基于同步辐射X射线荧光光谱和X射线吸收近边结构谱研究铅锌矿区浮萍中砷的耐受机制
2017-06-21储彬彬罗立强马艳红
储彬彬+罗立强+马艳红
摘 要 水生植物浮萍能够富集高浓度的砷,是植物过滤修复技术的代表,其耐受机理备受关注。本研究利用同步辐射X射线荧光光谱(Synchrotron radiation Xray fluorescence, SRXRF)和X射线吸收近边结构谱(Xray absorption near edge structure, XANES)技术,开展了铅锌矿区天然富砷浮萍样品中砷元素的微区分布和形态特征研究。微区SRXRF分析了两个单片浮萍样品FP1和FP2,单点扫描时间分别为5 s和2 s,光斑尺寸分别为70 μm×80 μm和100 μm×100 μm;对FP2样品选择了6个位置进行了微区XANES单点形态分析,扫描的能量范围为11.81~11.96 keV;整体XANES形态分析是针对压片的浮萍样品,扫描的能量范围为11.67~12.27 keV。结果表明,浮萍样品整体和微区XANES数据均表明砷形态为As;SRXRF微区分析发现浮萍中砷元素具有显著的叶脉分布特征,在一定浓度范围内,砷并不扩散到进行光合作用的叶肉中,有利于减轻砷对叶片的毒害作用,可能是浮萍耐受砷的一个保护机制。
关键词 浮萍; 砷; 微区分布; 形态
1 引 言
全球约有1.5亿人的饮用水受到砷污染[1], 我国也有多处水资源受砷污染的报道, 台湾嘉义南台[2]、新疆奎屯[3]、内蒙河套平原[4]、山西山阴县[5]等地先后出现了地方性饮水型砷中毒。植物过滤作为一种环境友好、低成本的植物修复技术,在过去20年逐渐发展起来。水生植物浮萍能富集高浓度的砷,是植物过滤修复技术的代表。如浮萍(Lemna minor)在64 μmol/L As和As溶液暴露6天,分别富集砷17408和8674 μg/g,富集系数可达3626和1807[6]。
因而,浮萍耐受As的机理也备受关注。Zhang等[7]通过一种特定的γ谷氨酰半胱氨酸合成酶抑制剂(LButhionine sulphoximine)对浮萍影响的对比实验发现,加入该抑制剂不仅会减少As还原成As,还会抑制植物螯合肽(PCs)的合成,降低了浮萍摄取和耐受As的能力,从而认为PCs在浮萍(Wolffia globosa)对砷的耐受性和解毒方面起着重要作用;Leo等[8]通过对比实验,发现浮萍(Lemna gibba)比魁叶萍(Salvinia minima)对As的耐性指数(Tolerance index)高20%,主要是由于浮萍面对As胁迫时,会增加硫酸盐的吸收和代谢,从而促进谷胱甘肽和非蛋白巯基的合成,参与细胞解毒。Leo等[9]认为花青素、非蛋白巯基和抗氧化物清除酶在浮萍(Lemna gibba)耐受As的毒性中起著一定作用。这些研究主要探讨的是浮萍中某种化合物在As耐受和解毒中的作用,但从元素微区分布特征和微区形态的角度,讨论浮萍对As的耐受性的研究还未见报道。另外,这些研究都是针对实验室培养的浮萍,天然情况下浮萍的这些特征是否有变化,也有待研究。
本研究针对铅锌矿区天然的富As浮萍(Lemna minor),通过SRXRF和XANES技术,研究浮萍中As的微区分布特征和微区形态,探讨其与As耐受性的关系。
2 实验部分
2.1 仪器与试剂
利用XSeries电感耦合等离子体质谱仪(ICPMS,美国Thermo Fisher公司)进行浮萍及所在水体中砷总量的测定。前处理试剂包括HNO3和H2O2(MOS级,北京化学试剂研究所的); 实验用水为去离子水(室温电阻率约18 MΩ·cm)。
用于形态分析的化合物标准为:三苯基砷(Triphenylarsine,(C6H5)3As,Alfa Aesar公司); 洛克沙肿(Roxarsone,C6H6AsNO6,Adamasbeta公司); 二甲基砷酸(Dimethylarsinic acid,(CH3)2AsO2H,Dr.Ehrenstorfer公司); Na2HAsO4·7H2O(Chem Service公司)。上述化合物均购自上海安谱科学仪器有限公司,纯度约为98%。
2.2 样品的采集和处理
采集了南京铅锌矿区附近菜园水沟中的浮萍(Lemna minor)及水样。浮萍样品用网捞出后,剔除杂物,用水清洗多次后,用去离子水冲洗3次,后续不同的分析采用不同的处理流程。(1)总砷测定的浮萍样品 洗净的浮萍用纱布包裹后,自然晾干,研磨粉碎后,称取0.5000g浮萍干样,进行ICPMS含量分析,其消解流程参照文献[10]。(2)微区SRXRF元素分析和微区XANES形态分析的浮萍样品 用密封盒采集含水的新鲜浮萍带至上海同步辐射实验现场,取单片浮萍样品用去离子水冲洗后吸干水分,将浮萍的根和叶分离,放入3M胶带,立即进行实验。(3)整体XANES形态分析的浮萍样品 洗净的浮萍样品用滤纸吸干水分后,进行冷冻干燥,干燥后样品研磨至颗粒直径小于74 μm,利用压片机制成直径为5 mm 的样片, 20℃保存, 待测。
水样分两部分处理:一部分是用0.22 μm滤膜过滤后加入HNO3;一部分加入HNO3后再经0.22 μm滤膜过滤。 二者HNO3的最终浓度均为2%。处理后的水样用ICPMS测定。
2.3 同步辐射SRXRF和XANES形态分析
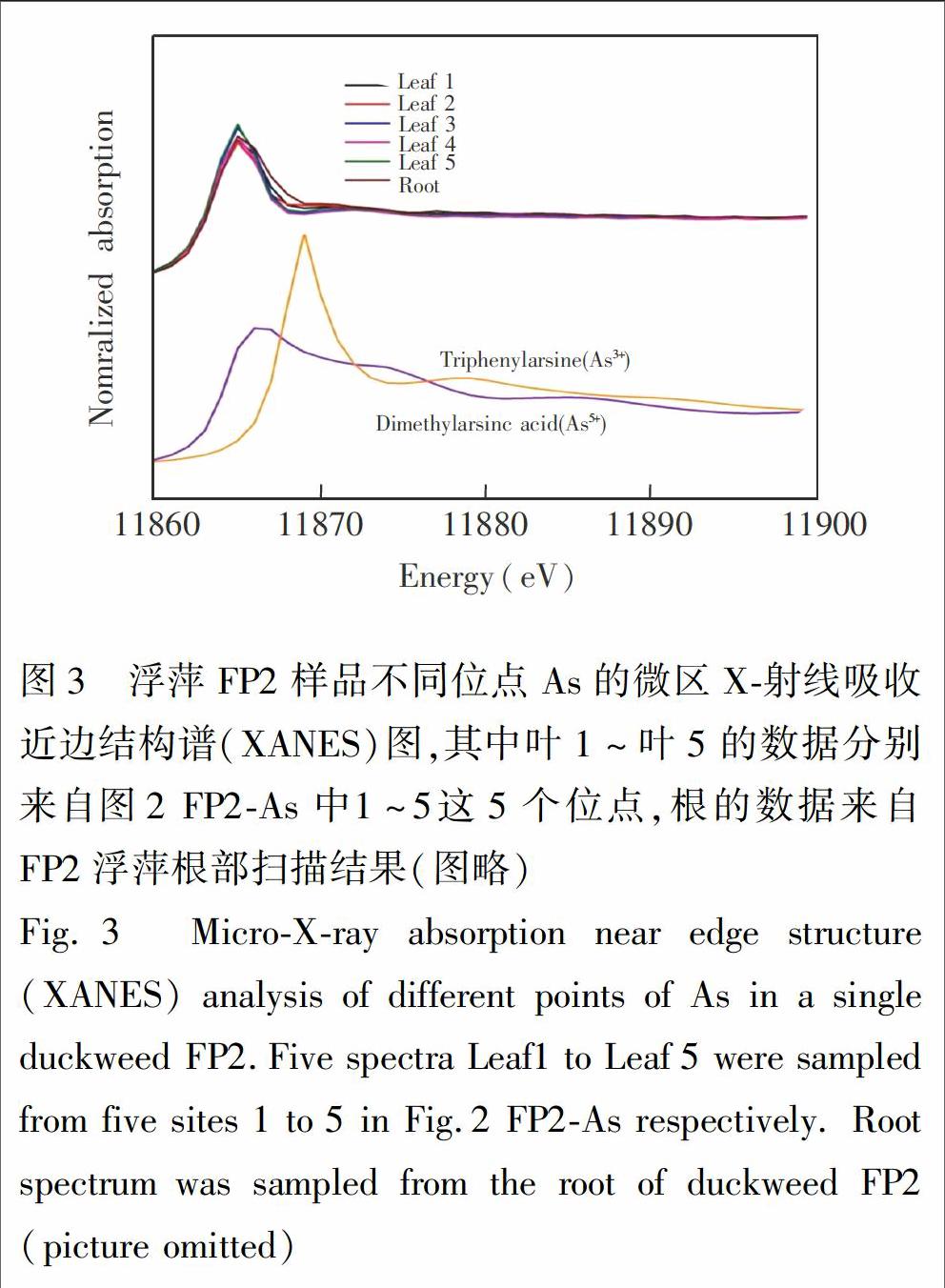
单片浮萍的微区SRXRF元素分析和微区XANES形态分析在上海同步辐射装置BL15U1光束线上的硬X射线微聚焦线站进行。SRXRF分析了两个单片浮萍样品,分别为FP1浮萍的叶和根以及FP2浮萍的叶,单点扫描时间分别为5 s和2 s,光斑尺寸分别为70 μm×80 μm和100 μm×100 μm。微区XANES分析了浮萍FP2,光斑尺寸约为200 μm×200 μm,扫描的能量范围为11.81~11.96 keV。
压片浮萍的整体XANES砷形态分析在上海同步辐射装置BLl4Wl光束线上的X射线吸收站谱进行。采用Si(111)双晶单色器,用固体探测器荧光模式测定样品,并在后电离室加滤波片锗(Ge)。由于自然界没有纯砷的标样,故利用靠近砷吸收边能量(11867 eV)的金片(11919 eV)进行能量校正。校准后开始样品的测定。采集样品的能量范围为11.67~12.27 keV。另外,砷的化合物标样,含砷量较高,将其均匀涂在3M胶带中,透射模式下测定。
利用PyMCA软件进行荧光数据解谱;利用Igor Pro软件进行面扫描数据的处理;利用Athena和Origin软件进行样品和标样的形态分析和对比。
3 结果与讨论
3.1 浮萍及水体中砷的含量
利用ICPMS分析了铅锌矿区浮萍及其所在水体中As的含量。浮萍样品中As的含量为(46.5±0.15)μg/g, 超过了该菜园中蔬菜As的含量(0.097~43.0 μg/g)[11],远高于食品中As的限量值0.05~1.5 μg/g[12]。然而,该浮萍所在水体中As的含量91.0 μg/L,并未超过地表水Ⅴ类水体中As的限值100 μg/L[13]。该地浮萍对水As的富集系数约为511倍,富集作用较显著。
此外,通过对比不同水样处理方式可知,加酸后过滤的水样中As的含量为(91.0±0.16) μg/L,是过滤后加酸的水样中As的含量((37.2±0.42) μg/L)的2.4倍,差异并不显著。然而该水体中Pb含量在上述两种处理方法后的水样中含量分别为450和0.469 μg/L,相差近1000倍[10]。这说明As和Pb在水中赋存位置不同,Pb主要存于水悬浮物中,而As主要存于水溶液中。
3.2 浮萍中元素的SRXRF微区分布特征
SRXRF微区分析是通过圈定元素感兴趣区,计算感兴趣区内电子计数之和进行元素在不同点的面扫描分析。因而感兴趣区的选择是SRXRF微区分析中的重要部分。在XRF中,第n个元素的kβ谱线与第n+1元素的kα谱线存在重叠干扰,因此需要针对样品中的元素特征,选择无重叠干扰的谱线作为元素的感兴趣区。从单片浮萍叶的60s SRXRF光谱图(图1)可见,浮萍中主要含Mn, Fe, Zn和As,并含有少量的Cu和Pb。图1中红色划线部分是圈定的各元素感兴趣区。考虑到Mnkβ对Fekα, Cukβ对Znkα的谱线重叠干扰,故选择Fe和Zn的kβ谱线作为感兴趣区。由于Mn含量高,且样品中无其它元素谱线重叠干扰Mnkα,故选择Mnkα谱线作为感兴趣区;同理,谱线中来见Ni的谱峰,故不存在Nikβ谱峰干扰Cu kα的现象,故选择Cukα为Cu的感兴趣区。谱图中,As和Pb的谱峰均出现,但是Askα(10543 eV)和Pb Lα (10551eV)谱线重叠严重,故分别选择Askβ和PbLβ为As和Pb的感兴趣区。浮萍中各元素的感兴趣区如下:Mn 5600~6150 eV,Fe 6900~7200 eV, Cu 7800~8240 eV, Zn 9370~9800 eV, As 11600~11850 eV, Pb 12450~12750 eV。 此外,圈定了Compton峰的感兴趣区(15400~15700 eV)用于后续的背景和基体校正。
浮萍样品的SRXRF元素微区分布如图2所示。每点的元素感兴趣区计数除以Compton感兴趣区的计数,以此强度比制图(图2)。采用Compton强度比有利于降低因电离室计数、死时间的波动等外界因素的影响,也可在一定程度上减小样品厚度、平整度及共存元素等的影响。
浮萍根部的微区分布显示了元素在根部的不均匀分布。从图2的FP1的根部扫描图可见,Pb, Zn和Cu高点在根冠部位,Mn在根尖部位,Fe在根部中间部位,而As在根部分布相对比较均匀。
浮萍叶片部分的元素微区分布指示了浮萍耐受砷的一种保护机制。该地浮萍中砷元素含量较高,砷元素的微区分布特征具有明显的规律性。从图2可见,砷元素主要沿浮萍的侧脉(Lateral vein)和中间叶脉(Middle of vein)分布,并在根和叶相交的节点(Node)处含量达到最高,而营养元素Fe, Mn, Cu, Zn等并无此分布特征,这些营养元素几乎充满了整个叶片。这说明浮萍中砷与营养元素的存储有所不同,砷通过浮萍根部传输并保存在叶脉中,在一定浓度范围内,砷并不扩散到叶片其它部位(如进行光合作用的叶肉中)。叶脉主要由维管束组成,为叶的支持结构,不含叶绿素,不进行光合作用。砷在叶脉维管束中聚集的特点在砷超富集植物蜈蚣草的研究中也有报道[14]。砷的这种分布特性有利于减轻砷对叶片的毒害作用,可能是浮萍耐受砷毒害产生的保护机制。而有害元素铅在此次实验中含量较低,为了避免砷的干扰,铅感兴趣区选定的是荧光产额相对较低的Lβ谱线,故铅的计数很低,在此次实验中Pb的分布特征并不明显,需要针对高铅含量的浮萍样品做进一步分析。
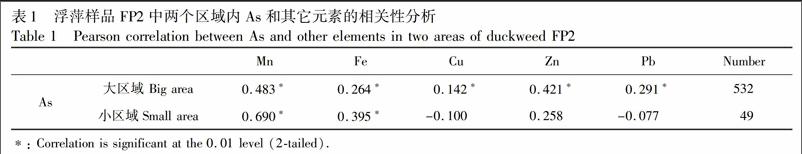
元素相关性分析有助于推測元素间的吸收和存储关系。针对图2中FP2样品,圈定了两个区域进行了元素相关性分析,见图2 FP2As 中两个红色方形区域。大区域涵盖了主要的叶片部分,含样品点532个;小区域主要针对根和叶相交的节点处,含样品点49个。相关性分析结果见表1。从整个叶片区域来看,分析点较多,As与Mn, Fe, Cu, Zn, Pb等元素均在0.01水平上显著正相关;从小的As富集区域来看,As与Mn和Fe具有显著正相关,As与Cu, Zn, Pb均无相关性。这些相关性表明,对于同一浮萍样本,元素之间的吸收可能存在相似性,但在局部位置元素的存储存在差异性。这在其它植物中也有相似发现,如,砷超富集植物大叶井口边草(Pteris nervosa)叶柄、中脉和羽叶中,As与K, Ca, Mn, Fe, Cu和Zn等元素相关性在0.01水平上均显示强正相关,而在根部As只与Fe有相关性[15];蜈蚣草的成熟叶片中,As与Mn是显著负相关(r=0.795),而年轻叶片中,Mn不受As影响[16];稻粒中,As与Fe无相关性,但稻叶中,As与Fe相关性显著[17]。
3.3 浮萍中As的吸收谱形态分析
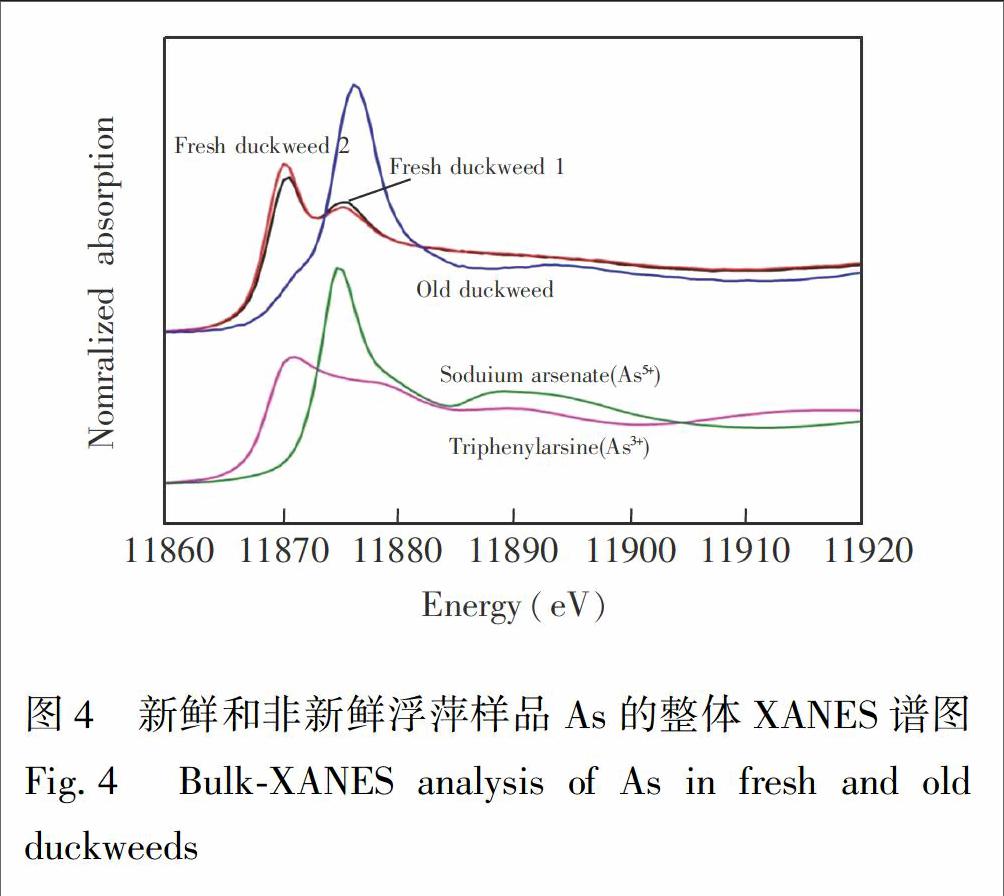
浮萍的单点微区XANES和整体XANES分析结果分别如图3和图4所示,砷在新鲜的浮萍样品以As形式存在;浮萍不同部位的单点微区XANES分析结果显示,各点之间As形态无明显差异。这与Zhang等[18]通过HPLCICPMS研究的无根浮萍(Wolffia globosa)90%为As的结果相似。已有多篇文献报道植物中砷以As形式存在[19,20],但部分植物中不同部位中As的形态却有差异。如蜈蚣草(Pteris vittata)孢子在As培养液中生长后进行X射线吸收谱分析,发现根部主要是As(90%±4%),叶片主要是As(95%±1%),而叶片主脉则含有24% As和76% As [21]。本实验中天然浮萍样品整体和微区XANES均显示砷形态为As。虽然As的毒性大于As,但As比As更容易排除细胞外,因此有学者认为, 将As还原成As是生物解毒的机制之一[22]。
另外,研究发现浮萍砷形态受实验条件的影响。从图4可見,新鲜的浮萍样品为As,而非新鲜的浮萍样品(X射线照射约115 min,之后冷冻保存2个多月)As形态已经变为As。 As的浮萍样品虽然一直冷冻保存,但曾做过Pb的XANES形态测试,接收了X射线照射。砷的形态易受多种因素影响,如Webb等[23]研究的蜈蚣草叶片鲜样砷为As,而烘干的样品砷却变成了As; Meirer等[20]研究发现As的营养液在48 h后也会有部分(<30%)被氧化成As。本实验中浮萍样品砷形态变为As, 可能是由于X射线照射引起。
4 结 论
铅锌矿区菜园水沟中浮萍对As具有明显富集作用。SRXRF微区分析发现, 浮萍中砷元素具有显著的叶脉分布特征,即砷元素沿着浮萍的侧脉和中间叶脉分布,并在根和叶相交的节点处含量达到最高。砷的这种分布特性有利于减轻砷对叶片的毒害作用,这可能是浮萍耐受砷的保护机制。另外,浮萍中砷的XANES分析表明其为As,但是样品经X照射并放置一段时间后,As被氧化为As。微区XANES分析表明,浮萍的不同部位中,砷的形态与浮萍整体的XANES形态分析结果相同,为As化合物,且各点之间As形态无明显差异。
References
1 Singh R, Singh S, Parihar P, Singh V P, Prasad S M. Ecotoxicol. Environ. Safe., 2015, 112: 247-270
2 LIN NianFeng, YANG Jie. Sci. Geographica Sin., 1999, 19(2): 135-139
林年丰, 汤 洁. 地理科学, 1999, 19(2): 135-139
3 ZHU YuLong, ZHEN YuJian, Chen XiaoXia, MA Yan, ZHANG Jie, WU ShunHua. J. Xinjiang Med. Univ., 2009, 32(3): 247-248
朱玉龙, 郑玉建, 陈晓霞, 马 艳, 张 杰, 吴顺华. 新疆医科大学学报, 2009, 32(3): 247-248
4 YANG Jie, LIN NianFeng. Hydrogeo. Eng. Geo., 1996, (1): 49-54
杨 洁, 林年丰. 水文地质工程地质, 1996, (1): 49-54
5 WANG ZhengHui, CHENG XiaoTian, LI Jun, SANG ZhiPing, WEN XingPING, WANG SanXiang,GAO JianGuo, HAN LingLing, DUAN HuShun, LIANG BinFeng. Chinese Journal of Control of Endemic Disenaces, 2003, 18(5): 293-295
王正辉, 程晓天, 李 军, 桑志萍, 温新平, 王三祥, 高建国, 韩凌凌, 段虎顺, 梁彬峰. 中国地方病防治杂志, 2003, 18(5): 293-295
6 Duman F, Ozturk F, Aydin Z. Ecotoxicology, 2010, 19(5): 983-993
7 Zhang X, Uroic M K, Xie W Y, Zhu Y G, Chen B D, Mcgrath S P, Feldmann J, Zhao F T. Environ. Pollut., 2012, 165(6): 18-24
8 Leo G A, Oliveira J A, Farnese F S, Gusman G S, Felipe R T A. Ecotoxicol. Environ. Safe., 2014, 105(1): 36-42
9 Leo G A, Oliveira J A D, Felipe R T A, Farnese F S, Gusman G S. J. Plant Interact., 2013, 9(1): 143-151
10 CHU BinBin, LUO LiQiang, XU Tao, YUAN Jing, SUN JianLing, ZENG Yuan, MA YanHong, YI Shan. Spectrosc. Spect. Anal., 2012, 32(7): 1975-1978
储彬彬, 罗立强, 许 涛, 袁 静, 孙建伶, 曾 远, 马艳红, 易 杉. 光谱学与光谱分析, 2012, 32(7): 1975-1978
11 WANG XiaoFang, LUO LiQiang. Ecol. Environ., 2012, 32(7): 1975-1978
王晓芳,罗立强. 生态环境学报, 2009, 18(1): 143-148
12 GB 27622005, Maximum levels of Contaminants in Foods. National Standards of the People′s Republic of China
食品中污染物限量. 中華人民共和国国家标准. GB 27622005
13 GB 38382002, Environmental Quality Standards for Surface Water. National Standards of the People′s Republic of China
地表水环境质量标准. 中华人民共和国国家标准. GB 38382002
14 Kitajima N, Kashiwabara T, Fukuda N, Endo S, Hokura A, Terada Y, Nakai I. Chem. Lett., 2008, 37(1): 32-33
15 Chen T B, Huang Z G, Huang Y Y, Xie H, Liao X Y. Chin.Sci.Bull., 2003, 48(15): 1586-1591
16 Tu C,Ma L Q. Environ. Pollut., 2005, 135(2): 333-340
17 Hossain M B, Jahiruddin M, Panaullah G M, Loeppert R H , Islam M R, Duxbury J M. Environ. Pollut. 2008, 156(3): 739-744
18 Zhang X, Zhao F, Huang Q, Williams P N, Sun G, Zhu Y. New Phytol., 2009, 182(2): 421-428
19 CastilloMichel H, HernandezViezcas J, Dokken K M, Marcus M A, PeraltaVidea J R, GardeaTorresdey J L. Environ. Sci. Technol., 2011, 45(18): 7848-7854
20 Meirer F, Pepponi G, Streli C, Wobrauschek P, Mihucz V, Záray G, Czech V, Broekaert J, Fittschen U, Falkenberg G. XRay Spectrom., 2007, 36(6): 408-412
21 Pickering I J, Gumaelius L, Harris H H, Prince R C, Hirsch G, Banks J A, Salt D E, George G N. Environ. Sci. Technol., 2006, 40(16): 5010-4
22 Rahman M A, Hassler C. Aquatic Toxicol., 2014, 146(1): 212-219
23 Webb S M, Gaillard J F, Ma L Q, Tu C. Ecotoxicol. Environ. Safe., 2003, 37(4): 754-760
