大豆苷元与氨基修饰β—环糊精包合物的制备、表征及水溶性
2017-06-21邓颖慧苏丽娜庞艳华郭亚飞王芬廖
邓颖慧+苏丽娜+庞艳华+郭亚飞+王芬+廖霞俐+杨波
摘 要 采用饱和水溶液法制备了大豆苷元分别与两种氨基修饰β环糊精(ACD) 即单6氨基β环糊精(NCD) 和单6乙二胺基β环糊精(ENCD) 的固体包合物,并获得最佳包合条件:大豆苷元与环糊精投料比为3∶1(n/n) ,搅拌时间为72 h,分别获得83%和67%的产率。利用X射线粉末衍射和热重分析对其进行了表征,证实了两种包合物的形成。利用Job′s曲线法确定了主客体的包合比为1∶1,并利用荧光光谱滴定分析测得其包合稳定常数KS分别为899.2和203.8 L/mol。水溶性实验表明,通过与NCD和ENCD形成包合物,25℃下大豆苷元在水中的溶解度由原来的8.31 μg/mL增至15.2和13.2 mg/mL,分別提高了约1800和1500倍。
关键词 大豆苷元;氨基修饰β环糊精;固体包合物;包合行为;水溶性
1 引 言
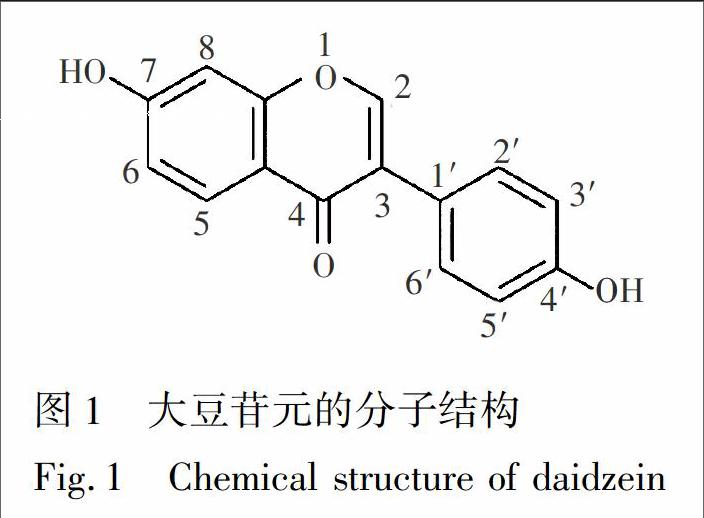
大豆苷元,即7,4′二羟基异黄酮(Daidzein,图1) ,又名黄豆苷元、大豆黄酮、大豆素等,是一种重要的异黄酮类化合物,主要存在于豆科类植物如大豆和葛根中。研究表明,大豆苷元具有多种重要的药理作用,主要包括抗血栓和动脉粥样硬化的形成[1]、抗糖尿病[2,3]、抗氧化[4,5]、骨骼保护[6,7]及抗肿瘤等作用[8,9],同时,大豆苷元还通过在肠道中代谢为Sequol而具有雌激素样的作用[10,11]。但是,大豆苷元溶解性差,稳定性低,口服吸收差,致使其生物利用度低,体内吸收量少,大大阻碍了其药理作用的有效发挥[12,13]。化学修饰手段,如成酸[14,15]、成盐[16,17]和糖苷化[18,19]等,是近年来报道的提高大豆苷元的水溶性最为常见的途径。但是,这些方法常存在制备困难、水溶性提高程度有限及大豆苷元活性受到影响等不利因素。因此,改善大豆苷元的水溶性,对提高其生物利用度、开发其药用价值等均具有重要意义。
环糊精(Cyclodextrin, CD) 是直链淀粉在环糊精糖基转移酶作用下生成的一系列环状寡糖的总称,通常含有6~8个D(+)吡喃葡萄糖单元,分别称为α, β和γ环糊精。环糊精具有“内疏水、外亲水”的截锥状分子结构,能与众多有机/无机分子通过多种非共价相互作用,如范德华力、氢键作用、疏水作用等形成水溶性的主客体包合物或组装成复杂的超分子体系。当将环糊精作为超分子主体应用于难溶药物或生物活性分子时,可大大提升其水溶性、稳定性和生物利用度等性质[20~22]。
本实验室近年致力于以环糊精为主体的天然药物超分子体系研究[23~27],发现用氨基等基团修饰β环糊精后,可极大地提升其水溶性。本研究以两种氨基修饰的β环糊精衍生物(ACD) ,即单6氨基β环糊精(NCD) 和单6乙二胺基β环糊精(ENCD) 为主体,采用饱和水溶液法分别制备了它们与大豆苷元的固体包合物,优化了包合条件,通过X射线粉末衍射(XRD) 和热重(TG) 分析等手段对它们进行了表征,采用荧光光谱法确定了包合平衡常数和包合比,同时对包合物的水溶性进行测试。
2 实验部分
2.1 仪器与试剂
Shimadzu RF5301PC荧光分光光度计(日本岛津公司); D/Max3B X射线衍射仪(日本理光公司); NETZSCH STA449F3同步热分析仪(德国耐驰公司) 。
大豆苷元(纯度>98%,阿拉丁试剂) 、β环糊精(食品级,98%,孟州华兴) 为直接购买使用,NCD和ENCD为参考本实验室已有方法[28,29]自制。其它试剂均为分析纯,实验用水为二次蒸馏水。
2.2 实验方法
2.2.1 大豆苷元与氨基修饰β环糊精固体包合物的制备 在室温(25℃) 及避光条件下,取大豆苷元76 mg(0.3 mmol) 溶于5 mL无水乙醇中,同时按一定比例取氨基修饰β环糊精溶于20 mL蒸馏水(pH≈7.0) 中,混合两种溶液。室温避光搅拌一定时间之后,减压蒸去体系中的溶剂,再加少量水溶解。过滤除去其中的不溶固体,并用0.45 μm微孔滤膜过滤,得到澄清滤液。减压蒸干后, 于40℃真空干燥24 h,即得到固体包合物。通过对大豆苷元与氨基修饰β环糊精的投料比及搅拌时间的优化,以固体包合物的产率为指标获取两种固体包合物形成的最佳条件。
2.2.2 XRD分析 分别取大豆苷元、NCD、ENCD及它们的固体包合物作X射线粉末衍射分析。测试条件为:Cu靶,Kα辐射源(k=1.5460 ) ,电压为40 kV,电流为100 mA,扫描速率为5°/min。
2.2.3 热力学性能测试 对大豆苷元、NCD、ENCD及它们的包合物进行了热性质研究。热分析条件为:氮气流速为70 mL/min,升温速率为10℃/min,并由室温升到400℃。
2.2.4 荧光光谱滴定 采用荧光光谱滴定法测定大豆苷元与β环糊精衍生物的包合稳定常数KS。首先,配制Na2CO3NaHCO3缓冲溶液(pH 10.5) ,并用其配制0.01 mol/L氨基修饰β环糊精溶液及3.0×105 mol/L大豆苷元溶液。取8支10 mL比色管,分别加入大豆苷元溶液1.0 mL,然后依次加入氨基修饰β环糊精溶液0, 0.2, 0.4, 0.6, 0.8, 1.0, 1.2, 1.5和2.0 mL。所有待测比色管均用缓冲溶液定容至10 mL,室温下超声30 min后,在λex/λem = 385/468 nm波长下测定。
2.2.5 水溶性测试 采用饱和水溶液称重法来进行包合物的水溶性测试。分别在2 mL蒸馏水(pH≈7.0) 中加入过量固体包合物,25℃避光剧烈搅拌1 h。滤纸过滤除去不溶固体后,再用0.45 μm微孔滤膜过滤,滤液减压蒸干,称重,以此计算包合物在水中的溶解度。
3 结果与讨论
3.1 大豆苷元/NCD固体包合物的制备
在大豆苷元/NCD固体包合物的制备过程中,大豆苷元与NCD的投料比(大豆苷元∶NCD,摩尔比) 及包合搅拌时间对生成包合物的收率有一定的影响。 实验结果表明:随着搅拌时间延长,收率随之提高,且至72 h时基本达到平衡,此时继续延长搅拌时间对提高收率不再起作用,这时包合脱包的可逆过程基本达到平衡。此外,随着投料比的增加,收率也随之增加。当大豆苷元与NCD的投料比为3∶1时,收率基本趋于平衡,此时继续提高投料比也不会导致收率的明显变化。因此,经筛选确定该包合物制备的最佳条件为:大豆苷元与NCD的投料比为3∶1,包合时间为72 h,此时收率为83%。具体的投料比和搅拌时间对包合物回收率所产生的影响如表1所示。
3.2 大豆苷元/ENCD固体包合物的制备
与大豆苷元/NCD固体包合物的制备过程相似,包合搅拌时间和投料比这两个因素同样对大豆苷元/ENCD固体包合物的收率产生明显影响。实验结果表明,随着搅拌时间的延长,产率随之提高,且当搅拌时间为72 h时,收率达到最大;随着投料比的增加,收率也随之增大。当大豆苷元与ENCD的投料比为3∶1(n/n) 时,收率达到最大。因此确定包合物制备的最佳条件为:大豆苷元与环糊精投料比为3∶1(n/n) ,包合时间为72 h时,产率为67%。具体的条件筛选过程如表2所示。
3.3 XRD分析
采用XRD分析对大豆苷元在形成包合物前后的晶体/非晶体形态进行了表征。图2为大豆苷元、NCD、ENCD及它们之间的两种固体包合物的XRD图谱。从图2可见,大豆苷元本身呈现典型的晶体形态(a) ,而两种氨基修饰β环糊精NCD和ENCD均为无定形态粉末(b和d) 。而在形成包合后,两种包合物均不再表现出大豆苷元的晶体形态特征,而是更多地呈现与其主体(NCD和ENCD) 相似的无定形态特征。通常,环糊精如与另一组分只形成简单的物理混合物时,其XRD分析结果将呈现两者图谱的简单加合。因此,该变化可初步证明大豆苷元与氨基修饰β环糊精之间形成了主客体包合物,而非物理混合物。
3.4 包合物的热力学性能
通过热重(TG) 分析对大豆苷元形成包合物前后的热力学性质的改变进行了探讨。图3记录了大豆苷元、NCD、ENCD及两种固体包合物的TG曲线,大豆苷元在308.82℃开始分解(曲线a) ,NCD在303.25℃开始分解(曲线b) ,而大豆苷元/NCD包合物在296.83℃开始分解(曲线c) ,即形成包合物后分解温度较大豆苷元和NCD均有所降低。另一方面,ENCD的分解温度为272.91℃(曲线d) (其中向上的尖峰应为仪器误差) ,而与大豆苷元形成包合后,包合物的分解温度降至245.04℃(曲线e) 。从包合前后主、客体及包合物之间热重曲线的明显区别可进一步证实大豆苷元与两种氨基修饰β环糊精均形成了包合物。
3.5 包合比的确定
以Na2CO3NaHCO3缓冲溶液(pH 10.5) 配制大豆苷元分别与NCD和ENCD的混合溶液。保持大豆苷元与氨基修饰β环糊精的总浓度不变(3.0 × 105 mol/L) ,使大豆苷元在其中的物质的量的比率在0.1~0.9变化。通过测定它们的荧光强度变化获得Job′s曲线(图4) ,进而得到大豆苷元的两种包合物的包合比。由图4可见,从曲线中最高点所对应的横坐标(0.5) 可知,大豆苷元与两种氨基修饰β环糊精的包合化学计量比均为1∶1,此结果与本研究组之前的研究结果[30]一致。
3.6 包合稳定常数的测定
NCD和ENCD与大豆苷元的混合溶液的荧光光谱曲线如图5所示。荧光光谱曲线均是以Na2CO3NaHCO3缓冲溶液(pH 10.5) 为介质而测得,检测波长为:λex/λem=385/468 nm。
由于大豆苷元与NCD和ENCD的包合比均为1∶1,所以其包合稳定常数Ks满足公式(1) :
KS: 包合稳定常数(L/mol);[CD]0和[CD]分别为环糊精的初始浓度及环糊精浓度(mol/L); [Daidzein]0和[Daidzein]分别为大豆苷元的初始浓度及大豆苷元浓度(mol/L); [CD·daidzein]:环糊精/大豆苷元包合物的浓度(mol/L);ΔF: 大豆苷元荧光强度的变化;Δε: 有无环糊精时大豆苷元的摩尔消光系数差值。
由此可推出公式(2) :
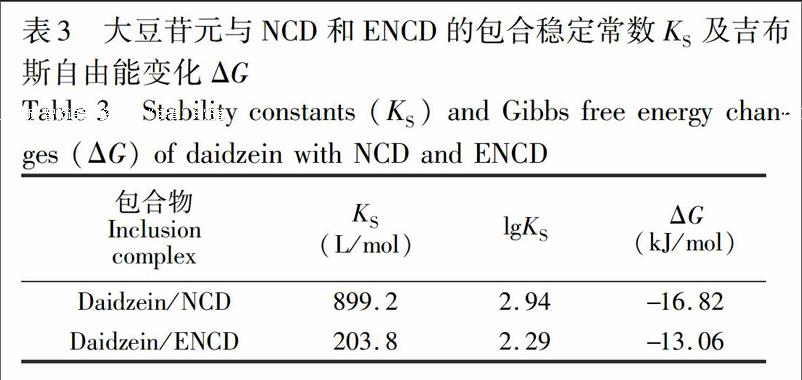
其中,ΔF可以根据实验中环糊精浓度改变测得的荧光强度差值计算得到,然后根据非线性最小二乘法计算得到包合物的KS值。表3给出了两种包合物包合稳定常数KS及吉布斯自由能变化ΔG,两种氨基修饰β环糊精对大豆苷元的包结能力NCD>ENCD,这与两者在同一条件下的包合收率大小一致(83%和67%) ,表明包合能力的强弱可能影响氨基修饰β环糊精与同一客体形成包合物的收率。
3.7 包合物的水溶性
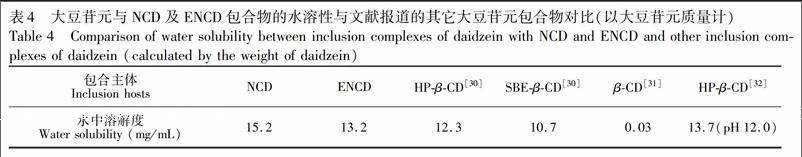
通过饱和水溶液法测试表明,大豆苷元与NCD及ENCD形成包合物后,在水中的溶解度分别提高至15.2和13.2 mg/mL(以大豆苷元的质量计算) ,相对于同样条件下大豆苷元本身的溶解度(8.31 μg/mL) 分别提高了约1800和1500倍。与此同时,与文献报道的β环糊精常见衍生物如2羟丙基β环糊精(HPβCD) [30,32]、磺丁基醚β环糊精(SBEβCD) [31]以及β环糊精[32]等相比,本研究所使用的两种氨基修饰β环糊精对大豆苷元具有更强的增溶能力(见表4) 。
实验结果表明,利用饱和水溶液法制备的大豆苷元与两种氨基修饰β环糊精NCD和ENCD的固体包合物,均可明显提高大豆苷元的水溶性,形成包合物后,大豆苷元在水中的溶解度分別提高了约1800和1500倍,对大豆苷元的增溶能力强于已报道的环糊精及其衍生物。这些实验结果可为设计和开发新的大豆苷元的水溶性制剂提供新的研究思路。
References
1 Gottstein N,Ewins B A, Eccleston G P, Hubbard G P, Kavanagh I C, Minihane A M, Weinberg P D, Rimbach G. Brit. J. Nutr., 2003, 89: 607-615
2 Park M H,Ju J W, Park M J, Han J S. Eur. J. Pharmacol., 2013, 712: 48-52
3 Cheong S H,Furuhashi K, Ito K, Nagaoka M, Yonezawa T, Miura Y, Yagasaki K. J. Nutr. Biochem., 2014, 25: 136-143
4 Fritz K L,Seppanen C M, Kurzer M S, Csallany A S. Nutr. Res., 2003, 23: 479-487
5 Dwiecki K, Neunert G, Polewski P, Polewski K. J. Photochem. Photobiol. B, Biol., 2009, 96: 242-248
6 Fonseca D, Ward W E. Bone, 2004, 35: 489-497
7 Somjen D, Katzburg S, Kohen F, Gayer B, Livne E. J. Cell. Biochem., 2008, 103: 1826-1832
8 de Lemos M L. Ann. Pharmacother., 2001, 35: 1118-1121
9 Liu X, Suzuki N,Laxmi Y R S, Okamoto Y, Shibutani S. Life Sci., 2012, 91: 415-419
10 Lu Z, Zhou R, Kong Y, Wang J, Xia W,Guo J, Liu J, Sun H, Liu K, Yang J, Mi M, Xu H. Curr. Cancer Drug Targets, 2016, 16: 455-465
11 Kang N J, Lee K W,Rogozin E A, Cho Y Y, Heo Y S, Bode A M, Lee H J, Dong Z. J. Biol. Chem., 2007, 282: 32856-32866
12 King R A,Bursill D B. Am. J. Clin. Nutr., 1998, 67: 867-872
13 Setchell K D R, Brown N M, Desai P, ZimmerNechemias L, Wolfe B E, Brashear W T, Kirschner A S, Cassidy A, Heubi J E. J. Nutr., 2001, 131: 13625-13755
14 Kanakubo A, Koga K, Isobe M, Fushimi T, Saitoh T, Ohshima Y, Tsukamoto Y. Tetrahedron, 2001, 57: 8801-8805
15 Chen X L, Shi X N,Qu L B, Yuan J W, Lu J S, Lu Y F. Chin. J. Chem., 2007, 25: 1008-1013
16 Fairley B,Botting N P, Cassidy A. Tetrahedron, 2003, 59: 5407-5410
17 Soidinsalo O, Whl K. Steroids, 2004, 69: 613-616
18 Needs P W, Williamson G. Carbohydr. Res., 2001, 330: 511-515
19 Shimoda K, Sato N, Kobayashi T, Hamada H, Hamada H. Phytochemistry, 2008, 69: 2303-2306
20 Loftsson T, Brewster M E. J. Pharm. Sci., 1996, 85: 1017-1025
21 Rajewski R A, Stella V J. J. Pharm. Sci., 1996, 85: 1142-1169
22 Loftsson T, Duchêne D. Int. J. Pharm., 2007, 329: 1-11
23 Han B, Yang B, Yang X, Zhao Y, Liao X, Gao C, Wang F, Jiang R. J. Biosci. Bioeng., 2014, 117: 775-779
24 Wang F, Yang B, Zhao Y, Liao X, Gao C, Jiang R, Han B, Yang J, Liu M, Zhou R. J. Biomater. Sci. Polym. Ed., 2014, 25: 594-607
25 Xiao D, Yang B, Zhao Y, Liao X, Yang X, Wang F, Chen Y, Zhou R. J. Incl. Phenom. Macrocycl. Chem., 2014, 79: 349-356
26 Ren Y, Liu Y, Niu R, Liao X, Zhang J, Yang B. J. Mol. Struct., 2016, 1117: 1-7
27 Ren Y, Liu Y, Yang Z, Niu R, Gao K, Yang B, Liao X, Zhang J. Mater. Sci. Eng. C Mater. Biol. Appl., 2016, 69: 68-76
28 Ren Y, Yang B, Liao X. RSC Adv., 2016, 6: 22034-22042
29 Ren Y, Yang B, Liao X. Catal. Sci. Technol., 2016, 6: 4283-4293
30 Deng Y, Pang Y,Guo Y, Ren Y, Wang F, Liao X, Yang B. J. Mol. Struct., 2016, 1118: 307-315
31 LEI YingJie, YU Mei, ZHAO Kang. Food Sci., 2005, 26(10): 134-137
雷英杰, 俞 玫, 趙 康. 食品科学, 2005, 26(10): 134-137
32 GE YueBin, CHEN DaWei, XIE LiPing, WANG HongZhong, ZHENG GuiLan, ZHANG RongQing. Chin. J. Chin. Mater. Med., 2006, 31(24): 2039-2041
葛月宾, 陈大为, 谢莉萍, 王洪钟, 郑桂兰, 张荣庆. 中国中药杂志, 2006, 31(24): 2039-2041
