解淀粉芽孢杆菌固态发酵黄芪中有效成分的变化
2017-06-21侯美如尹珺伊陈楠楠周庆民秦平伟史同瑞杨淑萍
侯美如 , 刘 宇 , 王 岩 , 尹珺伊 , 陈楠楠 , 周庆民 , 秦平伟 , 史同瑞 , 杨淑萍
(黑龙江省兽医科学研究所 , 黑龙江齐齐哈尔161006)
解淀粉芽孢杆菌固态发酵黄芪中有效成分的变化
侯美如 , 刘 宇 , 王 岩 , 尹珺伊 , 陈楠楠 , 周庆民 , 秦平伟 , 史同瑞 , 杨淑萍
(黑龙江省兽医科学研究所 , 黑龙江齐齐哈尔161006)
运用解淀粉芽孢杆菌发酵黄芪, 研究发酵对黄芪有效成分含量的影响。 将黄芪中添加解淀粉芽孢杆菌在37 ℃条件下发酵72 h培养, 对照组为同等条件下黄芪固体培养基单独培养, 利用紫外分光光度法测定两组黄芪多糖、总黄酮和总皂苷含量。 结果表明, 发酵组较不添加解淀粉芽孢杆菌对照组多糖、 总黄酮和总皂苷含量分别提高了39.59%、 41.59%、 22.63%。因此, 利用解淀粉芽孢杆菌在一定条件下发酵黄芪, 可促进其有效成分释放。
黄芪 ; 解淀粉芽孢杆菌 ; 固体发酵 ; 黄芪多糖 ; 总黄酮 ; 总皂苷
黄芪是我国传统中药材,始载于汉代《神农本草经》,为豆科多年生草本植物,为豆科植物蒙古黄芪或膜荚黄芪的干燥根[1],具有补气固表、利尿托毒、排脓、敛疮生肌之功效,主要成分有黄芪多糖、黄酮类和皂苷类[2]。随着黄芪用量和用途的逐年增加,黄芪的传统使用方式已不能满足社会的需求。许多新技术的出现,为黄芪的使用提供了更多的可能。其中,微生物发酵技术不仅可以提高中药活性成分含量、提高药效、降低毒副作用,同时中药中的成分可促进或抑制其次生代谢产物的产生,生产出包含多种活性成分的制剂或新药[3]。本试验利用益生菌—解淀粉芽孢杆菌对中药黄芪进行固体发酵,探究发酵对黄芪中有效成分含量的影响,为黄芪固体发酵技术的进一步研究提供理论依据。
1 材料与方法
1.1 试剂与仪器 黄芪购自河北凯达药业有限公司;黄芪甲苷对照品(批号:20151213);D(+)-无水葡萄糖对照品(批号:20160302);芦丁对照品(批号:20150702),均购自上海金穗生物科技有限公司;其他试剂均为分析纯。黄芪固态发酵培养基:黄芪粉(过40目筛)30 g、黄豆粉10 g、CaCO30.2 g、水59.8 mL。解淀粉芽孢杆菌SSYB菌株,由本研究室分离鉴定并保存。
UV-1900PC双束紫外可见分光光度计为上海佑科仪器仪表有限公司出产。
1.2 黄芪发酵 取解淀粉芽孢杆菌SSYB菌株普通肉汤培养种子液,按2%接种量接种黄芪固态发酵培养基,共9份,为发酵组(SSYB组),另外取无菌肉汤,按2%接种量接种黄芪固态发酵培养基,共9份,为对照组(C组),置于37 ℃恒温培养箱中培养72 h。
1.3 固体发酵黄芪中有效成分的提取
1.3.1 固体发酵黄芪中多糖的提取 取发酵组及对照组样品各3份,参照参考文献[4]分别加入100 mL超纯水稀释,振荡摇匀1 h,离心,取上清,加乙醇至终浓度为75%,室温静置过夜,离心,收集沉淀,加水定容至500 mL。
1.3.2 固体发酵黄芪中总皂苷的提取 取发酵组及对照组样品各3份,分别加入500 mL超纯水,混匀容至100 mL,离心,取上清液,定容至500 mL。取上清提取液50 mL,参照文献方法[5],置于分液漏斗中,加入50 mL正丁醇,进行萃取。弃液再次用正丁醇萃取,合并萃取液,加入1% NaOH溶液100 mL,洗涤3次,除色素后用超纯水洗至中性,收集正丁醇溶液, 70 ℃水浴挥干溶剂,加甲醇溶解,定容至25 mL。
1.3.3 固体发酵黄芪中总黄酮的提取 取发酵组及对照组样品各3份,参照文献方法[6-7]分别加入80%乙醇150 mL,混匀,浸泡过夜,70 ℃水浴超声破碎40 min,冷却,以5 000 r/min离心10 min,取上清液,定容至250 mL。
1.4 发酵黄芪主要成分含量的测定
1.4.1 发酵黄芪多糖含量测定
1.4.1.1 标准曲线的制备 选用苯酚-硫酸法,精密称取105 ℃干燥至恒重的无水葡萄糖对照品0.10 g,加水定容至100 mL,即得对照品溶液。精密称取对照品溶液0.25、0.5、1.0、2.0、3.0、4.0、5.0 mL,加水定容至50 mL,摇匀,精密吸取2 mL,加入5%苯酚溶液1 mL,混匀,迅速加入浓硫酸5 mL,振荡5 min,置沸水浴加热15 min,取出,迅速置于冰浴中,冷却30 min,取出,以蒸馏水为空白,在400~700 nm处的全波长扫描,最大吸收峰位置位于491 nm处,故选择491 nm为黄芪多糖的检测波长,以吸光度值(A)对质量浓度(C)进行回归分析,绘制标准曲线。
1.4.1.2 样品溶液及其显色后溶液稳定性试验 取发酵黄芪多糖提取液,置室温分别放置0、1、2、3、4 h,取提取液2.0 mL,按苯酚-硫酸显色法进行操作,测定吸光度值;另取多糖提取液溶液2.0 mL,依法显色后,于室温分别放置0、1、2、3、4 h,测定吸光度值,计算样品中每克黄芪的多糖含量。
1.4.1.3 重复性试验 取同批发酵法黄芪多糖提取液样品6份,分别进行苯酚-硫酸显色试验,测定吸光度值,计算样品中每克黄芪的多糖含量。
1.4.1.4 回收率试验 精密称取已知含量的黄芪发酵固体培养基6份,精密添加不同量的无水葡萄糖对照品,依黄芪多糖提取方法制备样品溶液,分别进行苯酚-硫酸显色试验,测定吸光度值,计算样品中的多糖质量,并对回收率进行计算。
1.4.1.5 多糖提取量的测定 取7支具塞试管,以蒸馏水为空白对照,其余6管各取样品多糖提取液2.0 mL,分别进行苯酚-硫酸显色试验,测定其吸光度值,计算样品中每克黄芪的多糖含量。
1.4.2 黄芪总皂苷含量
1.4.2.1 标准曲线的制备 按香草醛-高氯酸法显色试验,精密称取黄芪甲苷对照品15.0 mg,加入甲醇定容至25 mL。准确吸取0、0.01、0.02、0.03、0.04、0.05、0.06 mL于试管中, 70 ℃水浴挥干溶剂,加入新鲜配制的5%香草醛冰醋酸溶液0.2 mL,高氯酸0.8 mL, 70 ℃水浴中作用15 min后,冰水浴冷却,加入冰醋酸5 mL,摇匀后以试剂作空白对照,于双束紫外可见分光光度计上,在400~700 nm波长范围内扫描,筛选测定波长为543 nm,绘制标准曲线。
1.4.2.2 样品溶液及其显色后溶液稳定性试验 取发酵组黄芪皂苷提取液,置室温分别放置0、1、2、3、4 h,取提取液25 μL,按香草醛-高氯酸法显色试验进行显色后测定吸光度值。另取黄芪皂苷提取液25 μL,依法进行显色,在室温分别放置0、1、2、3、4 h,测定吸光度值,计算样品中每克黄芪的总皂苷含量。
1.4.2.3 重复性试验 取同批发酵法黄芪皂苷提取液样品6份,按香草醛-高氯酸法显色试验,测定吸光度值,计算样品中每克黄芪的总皂苷含量。
1.4.2.4 回收率试验 精密称取已知含量的黄芪固体发酵培养基6份,加入一定量的甲苷对照品溶液,依黄芪皂苷制备方法制备样品溶液,运用香草醛-高氯酸法测定样品总皂苷质量,并对回收率进行计算。
1.4.2.5 总皂苷提取量的测定 吸取样品提取液25 μL,分别放入干燥试管中,水浴挥干溶剂,按香草醛-高氯酸法进行显色,在543 nm波长处测定吸光度值,代入标准曲线及计算公式,得黄芪总皂苷提取量。
1.4.3 黄芪总黄酮含量 黄芪总黄酮含量测定方法的标准曲线制备、稳定性试验、重复性试验及回收率试验等数据的文章已在投。
总黄酮质量分数的测定:取黄芪黄酮提取物0.75 mL,加入10 mL容量瓶内,加入1.25 mL的30%乙醇溶液;再加入5%亚硝酸钠溶液0.5 mL,室温作用6 min;加入10%硝酸铝溶液0.5 mL,室温作用6 min;加入4%氢氧化钠溶液4.0 mL,以蒸馏水定容至刻度,室温作用15 min;随行试剂为空白,于波长510 nm测定吸光度值,计算黄芪黄酮含量。
标准曲线:A=13.413C-0.0055 R2=0.9998
1.5 统计学方法 使用SPSS中的独立样本t检验对数据进行差异性分析。
2 结果
2.1 发酵黄芪总多糖含量变化
2.1.1 无水葡萄糖标准曲线 以491 nm为检测波长,测定浓度为1.25、2.5、5、10、15、20、25 μg/mL溶液的吸光度值,结果分别为0.089、0.157、0.285、0.545、0.820、1.083、1.386。回归方程为:A=0.0541C+0.0149 R2=0.9995。试验结果表明,在1.25~25 μg/mL 浓度范围内,吸收度与浓度呈良好的线性关系,见图1。

图1 D(+)-无水葡萄糖标准曲线
2.1.2 样品溶液及其显色后溶液稳定性 样品溶液及其显色后溶液稳定性试验结果显示,其RSD分别为0.5070%和1.3631%,结果表明,样品溶液及其显色后溶液4 h内稳定,见表1。
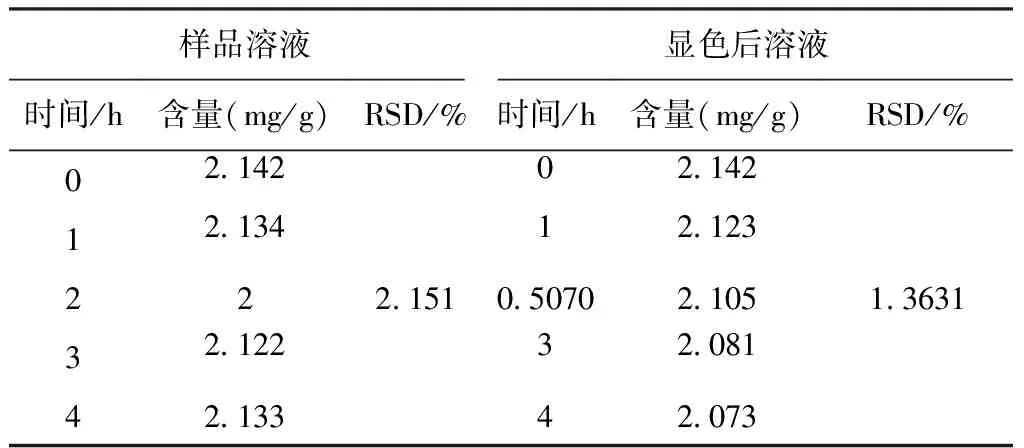
表1 稳定性试验结果
2.1.3 重复性试验结果 由表2可知,黄芪多糖平均含量为2.136±0.0103 mg/g,RSD为0.4816%,方法重复性良好。

表2 重现性试验测定结果
2.1.4 回收率试验结果 由表3可知,其平均回收率为100.22±1.3670%,RSD为1.3636%,结果表明,本法具有良好的回收率。
2.1.5 发酵液中多糖提取结果 由表4,可知经37 ℃恒温培养72 h,发酵组与对照组黄芪多糖质量分别为2.105±0.005 mg/g和1.508±0.042 mg/g,发酵组黄芪多糖含量高于对照组,较对照组高39.59%。

表3 回收试验测定结果

表4 发酵黄芪中多糖含量的变化 (n=3)
注:P> 0.05为两组试验数据差异不显著,P<0.05为两组试验数据差显著,下表同
2.2 发酵黄芪中总皂苷含量变化
2.2.1 黄芪总皂苷标准曲线 以543 nm为检测波长,测定浓度为1.0、2.0、3.0、4.0、5.0、6.0 μg/mL溶液的吸光度值,结果分别为0.043、0.069、0.091、0.116、0.139、0.165。回归方程为:A=0.0241C+0.0193,R2=0.9996。试验结果表明,在1.0~6.0 μg/mL浓度范围内,吸收度值与浓度呈良好的线性关系,见图2。
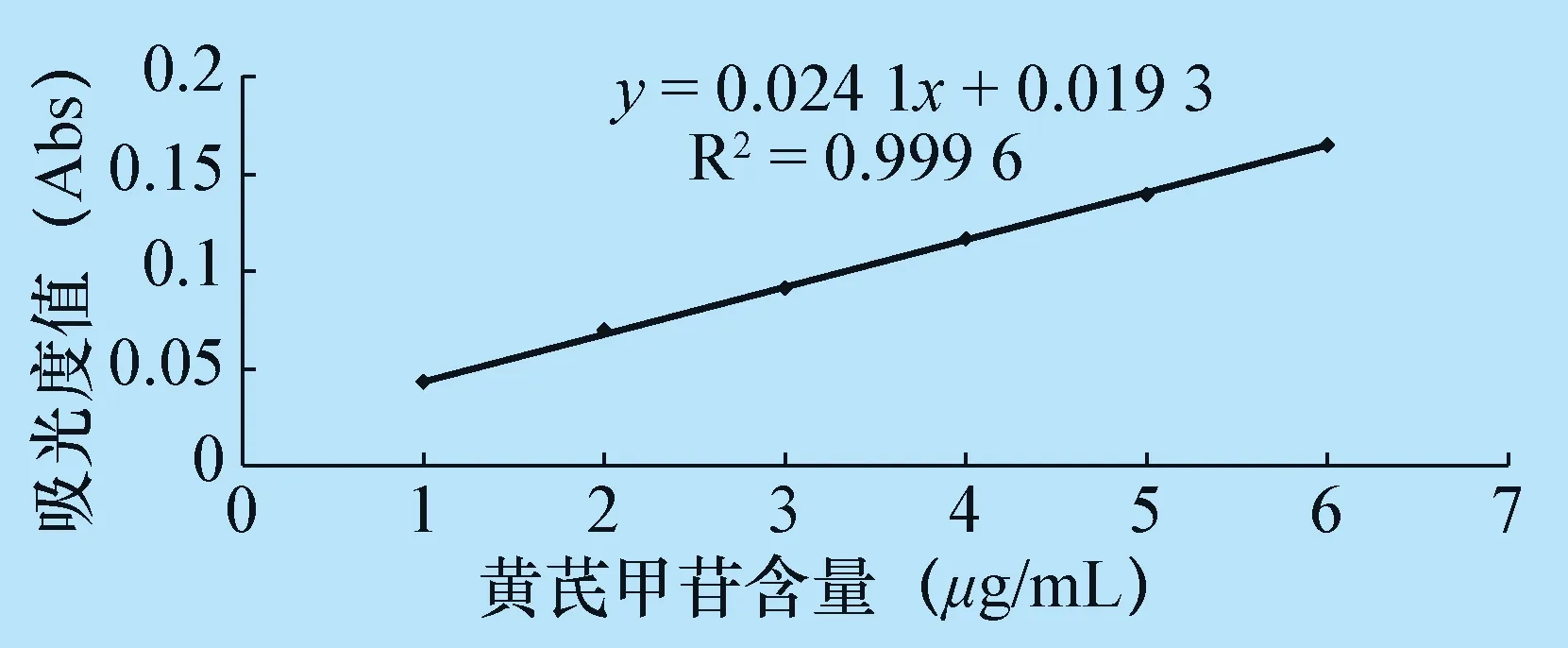
图2 黄芪甲苷标准曲线
2.2.2 样品溶液及其显色后溶液稳定性试验 样品溶液及其显色后稳定性试验结果显示,其RSD分别为0.0693%和0.1473%,结果表明,样品溶液及其显色后溶液4 h内稳定,见表5。

表5 稳定性试验测定结果
2.2.3 重复性试验结果 由表6可知,黄芪总皂苷平均含量为6.561±0.0044 mg/g,RSD为0.0678%,方法重复性良好。
2.2.4 回收率试验结果 由表7可知,其平均回收率为100.12±0.2558%,RSD为0.2543%,结果表明,本法具有良好的回收率。
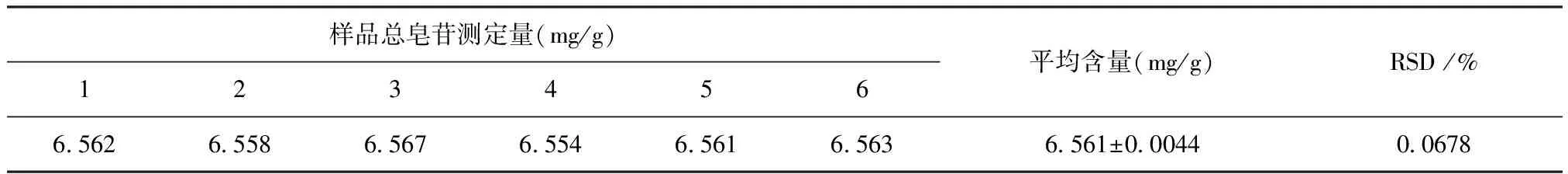
表6 重现性试验测定结果

表7 回收试验测定结果
2.2.5 发酵液中总皂苷提取结果 由表8,可知经37 ℃恒温培养72 h,发酵组与不接菌对照组黄芪总皂苷质量分别为6.568±0.0087 mg/g和5.356±0.0057 mg/g,发酵组黄芪总皂苷含量高于对照组,较对照组高22.63%。
2.3 发酵黄芪总黄酮提取结果 由表9,可知经37 ℃培养72 h,发酵组与对照组黄芪总黄酮质量分数分别为3.183±0.0567 mg/g和2.248±0.0046 mg/g,发酵组黄芪总黄酮含量高于对照组,较对照组高41.59%。

表8 发酵黄芪中总皂苷含量的变化 (n=3)

表9 发酵黄芪中总黄酮含量的变化 (n=3)
3 讨论
经比色法对黄芪中的主要活性成分—黄芪多糖、总黄酮、总皂苷进行提取量测定,经解淀粉芽孢杆菌37 ℃发酵72 h的黄芪较不添加菌黄芪培养基对照组其三种成分的含量均有提高,分别提高了39.59%、41.59%、22.63%。其原因可能是解淀粉芽孢杆菌其生产过程中能产生抑菌活性物质和多种酶类,其中分泌的纤维素酶可裂解细胞壁纤维,有利于中药中有效成分释放,使黄芪多糖、总黄酮和总皂苷质量分数升高。有报道指出纤维素酶可提高黄芪有效成分[5],同时本课题组对该分离株纤维素酶活性进行了测定,证实该株解淀粉芽孢杆菌具有产纤维素酶的能力,但为证明这种推测仍需进一步的试验和数据加以支持。
本试验与一些运用其他菌种进行发酵黄芪的结果稍有差异,马伟[8]运用保加利亚乳杆菌对黄芪进行发酵处理,经发酵后黄芪总皂苷质量分数增加了22%,总黄酮分数增加13.6%,但总多糖含量分数有所下降,其原因可能是保加利亚乳杆菌在发酵过程中分解了黄芪中的大分子物质,使总黄酮和总皂苷质量分数升高,同时却消耗了黄芪中的多糖而使多糖质量分数呈现下降的趋势。而经朱新术[9]筛选得到一株优良乳酸菌菌株FGM1,对黄芪发酵后其粗多糖提取率比黄芪提取物中高131%。推测为GM菌发酵过程中产生大量有机酸以及GM菌驯化后分泌新的胞外酶对黄芪细胞壁的水解作用,促使黄芪多糖从细胞壁或蛋白复合体中游离出来。这些结果的差异可能与菌种种类,菌种与中药之间的相互作用,菌种生长对营养来源的需求,培养基组成成分,中药有效成分释放原理等方面的不同有关。
解淀粉芽孢杆菌发酵黄芪过程中,由于菌种-解淀粉芽孢杆菌在代谢过程中发生的化学反应复杂多样,同时中药黄芪本身含有的活性成分比较复杂,经学者研究黄芪其主要药效成分是黄酮、皂苷和黄芪多糖,且目前从黄芪及其同属近缘植物中已分离出的皂苷类成分达40多种,黄酮类成分也多达30种[10],这使整个发酵过程变得更为复杂,那么整个发酵过程中的活性成分发生了怎么的变化?如药性的改变、药效的增减,物质的生成和转化,这些问题都尚不清楚,本实验仅对经解淀粉芽孢杆菌发酵的黄芪三种有效成分的质量分数进行了对比,其经发酵前、后物质的组成成分及各物质间的转化的问题仍有待进一步的研究。
[1] 徐丽莉, 袁久林. 黄芪炮制历史沿革及现代研究思路[J]. 中华中医药学刊, 2011, 9(29): 2071-2073.
[2] 仝欣. 黄芪主要活性成分的药理作用[J]. 时珍国医国药, 2011, 22(5): 1246.
[3] 刘亚明. 发酵技术在中医药中的应用[M]. 北京: 中国中医药出版社, 2010.
[4] 郁帅陆, 何旬, 陆利霞, 等. 黄芪固态发酵中有效成分的变化[J]. 食品与药品, 2007, 9(3): 8-10.
[5] 郑立颖, 魏彦明, 陈龙. 纤维素酶在黄芪有效成分提取中的应用[J]. 甘肃农业大学学报, 2005, 40(1): 94-96.
[6] 李春红, 田吉, 何兵, 等. 紫外分光光度法测定黄芪总黄酮的含量[J]. 重庆医科大学学报, 2011, 36(8): 954-956.
[7] 梁欣格, 吕卓红, 王盼盼, 等. 紫外分光光度法测定黄芪总黄酮含量[J]. 亚太传统医药, 2016, 12(5): 35-36.
[8] 马伟, 贾艳姝, 刘秀波. 药用植物黄芪乳酸发酵成[J]. 东北林业大学学报, 2013, 41(1): 129-132.
[9] 朱新术, 杨志强, 李建喜. 发酵黄芪的乳酸菌的驯化及其与黄芪相互作用研究[J]. 中国微生态学杂志, 2005, 20(5): 450-451.
[10] 张亚莉. 黄芪中主要化学成分的研究现状[J]. 临床合理用药, 2011, 4(2B): 151-152.
Changes of effective components of Astragalus in the solid fermentation ofBacillusamyloliquefaciens
HOU Mei-ru , LIU Yu , WANG Yan , YIN Jun-yi , CHEN Nan-nan , ZHOU Qing-min ,QIN Ping-wei , SHI Tong-rui , YANG Shu-ping
(Heilongjiang Institute of Veterinary Medicine Science , Qiqihaer 161006 , China)
To determine the influence ofBacillusamyloliquefaciensfermentation on the effective components of astragalus, astragalus fermentation byBacillusamyloliquefacienswas performed at 37 ℃ for 72 h, and the control group for astragalus culture excludingBacillusamyloliquefacienswas performed under the same condition. Then, the total contents of saponins, total polysaccharide and total flavone were determined by UV spectrophotometry in the two groups. The results showed the contents of polysaccharide, total flavonoids and total saponins in astragalus fermentation group were increased 39.59%, 41.59%, and 22.63% compared control group, respectively. Our findings indicate that, astragalus fermentation byBacillusamyloliquefacienscan promote the release of its effective components under certain condition.
Radix astragalus ;Bacillusamyloliquefaciens; Fermentation of Chinese herbal medicine ; Astragalus polysaccharide ; Flavonoids ; Total saponins
SHI Tong-rui
2016-10-14
黑龙江科技计划项目(GC13B404)
侯美如(1985-),女,助理研究员,硕士,研究方向为动物疾病防控,E-mail:houmeiru168@126.com
史同瑞,E-mail:systr@sina.com
S853.72
A
0529-6005(2017)05-0064-05
