结缕草肉桂醇脱氢酶基因家族全基因组序列鉴定和表达分析
2017-06-19史经昂张兵肖晓琳马晶晶杨向阳刘建秀
史经昂,张兵,肖晓琳,马晶晶,杨向阳,刘建秀
(江苏省中国科学院植物研究所,江苏 南京 210014)
结缕草肉桂醇脱氢酶基因家族全基因组序列鉴定和表达分析
史经昂,张兵*,肖晓琳,马晶晶,杨向阳,刘建秀
(江苏省中国科学院植物研究所,江苏 南京 210014)
肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD,EC 1.1.1.195)是植物木质素合成途径的关键酶,通过消耗NADPH,将松柏醛等复杂醛转化成相应的醇单体,在植物生长发育过程和逆境应答中起到重要作用。本研究从结缕草基因组中鉴定获得了16个肉桂醇脱氢酶(ZjCAD)基因,对其进行了系统进化与基因结构的生物信息学分析。半定量PCR分析显示5个ZjCAD基因在叶片中特异表达,木质素染色结合不同种源材料ZjCAD基因的表达分析进一步表明ZjCAD6的表达与叶片木质素含量正相关,提示ZjCAD6可能为控制结缕草叶片木质素合成的关键基因。ZjCAD6基因全长2736 bp,有3个内含子和4个外显子,开放阅读框为1074 bp,编码357个氨基酸。ZjCAD6蛋白含有两个Zn2+结合位点与一个NADP(H)结合结构域,与已报道的其他植物具催化活性的CAD蛋白特征一致。上述结果为进一步研究结缕草叶片木质素含量及其机械强度等性状形成的分子机理提供了重要的参考。
结缕草;木质素;肉桂醇脱氢酶;生物信息学分析;基因表达
结缕草(Zoysiajaponica)是一种优良的多年生暖季型草坪草,具有发达的根状茎和匍匐茎,被广泛应用于庭院草坪、运动场草坪、保土草坪等各种草坪的建植中。在几种暖季型草坪草中,结缕草具有优良的耐践踏能力,叶片近革质,其木质素含量显著高于杂交狗牙根(Cynodondactylonvar.dactylon×C.transvaalensiscv.)和海雀稗(Paspalumvaginatum)[1]。
木质素是高等植物细胞壁的重要组成成分,主要存在于次生细胞壁中,可以提高细胞壁的强度,为植物组织提供机械支撑。木质素还和植物长距离的运输营养和水分、抵御病虫害等生理功能密切相关。在被子植物中,木质素主要由松柏醇衍化的愈创木基(G)型单体、芥子醇衍化的紫丁香基(S)单体以及对香豆醇衍化的对羟基苯基(H)单体构成,3种单体通过β-O-4醚键、C-C键、联苯醚键聚合成复杂的高分子聚合物[2-4]。
苯丙氨酸途径是植物木质素生物合成的主要途径,这个过程中涉及多种酶:苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)[5]、肉桂酸-4-羟基化酶(cinnamic acid 4-hydroxylase,C4H)[6]、4-香豆酸辅酶A连接酶(4-coumarate:coenzyme A ligase,4CL)[7]、3-羟基肉桂酰转移酶(p-coumarate 3-hydroxylase,C3H)[8]、咖啡酸-O-甲基转移酶(caffeic acid O-methyltransferase,COMT)[9]、阿魏酸-5-羟基化酶(ferulate-5-hydroxylase,F5H)[10]、肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)[11-12]等。CAD是木质素生物合成途径的关键限速酶之一,在单体合成反应的最后一步将不同醛单体催化成相应的醇单体[13]。CAD基因以多基因家族形式存在植物体中,自第一个CAD基因从烟草(Nicotianatabacum)茎段中获得以来[14],多种植物的CAD基因均被广泛研究。在拟南芥(Arabidopsisthaliana)中发现的9个CAD基因中,CAD4、CAD5被发现是控制木质素生物合成的主要基因[15-16],AtCAD1则与拟南芥茎延伸过程中的木质化相关[17]。水稻(Oryzasativa) 12个CAD基因中,OsCAD2在木质素合成途径中起最主要的作用,表达谱分析发现其在节间、叶鞘、根中高表达[14]。玉米(Zeamays) bm1突变体中木质素含量和结构都发生了改变,并使叶脉与茎的厚壁组织变成红褐色,这一突变最终被定位在CAD基因上[18]。CAD-RNAi导致玉米植株总木质素减少,但并未影响植株的生长发育[19]。其他多种植物如柳枝稷(Panicumvirgatum)[11]、烟草[2,14]、白杨(Populustomentosa)[20]、高粱(Sorghumbicolor)[21]等的CAD基因和木质素合成的关系也得到了初步的研究。然而,结缕草等暖季型草坪草的CAD基因的研究却鲜有报道。
在本研究中,我们首次对结缕草CAD基因家族16个ZjCAD基因的系统进化关系、基因结构和组织表达特异性进行了比较分析,发现5个ZjCAD基因在结缕草叶片中优势表达。在不同种源材料中,ZjCAD6基因的表达丰度和木质素含量呈正相关,提示ZjCAD6是决定结缕草叶片木质素含量的关键基因。这一研究结果为解析结缕草叶片机械强度和耐践踏性状形成的分子机理提供了重要线索。
1 材料与方法
1.1 植物材料
结缕草品种(Zenith,Meyer),野生种源材料(Z103、Z112)种植于南京中山植物园试验地(32°02′ N,118°28′ E;海拔30 m)。采用标准的施肥、灌溉、修剪、除虫等养护措施。取直立枝展开叶第二叶位的叶片用于RNA提取和木质素染色,材料来源见表1。
1.2CAD基因的序列获取与生物信息学分析
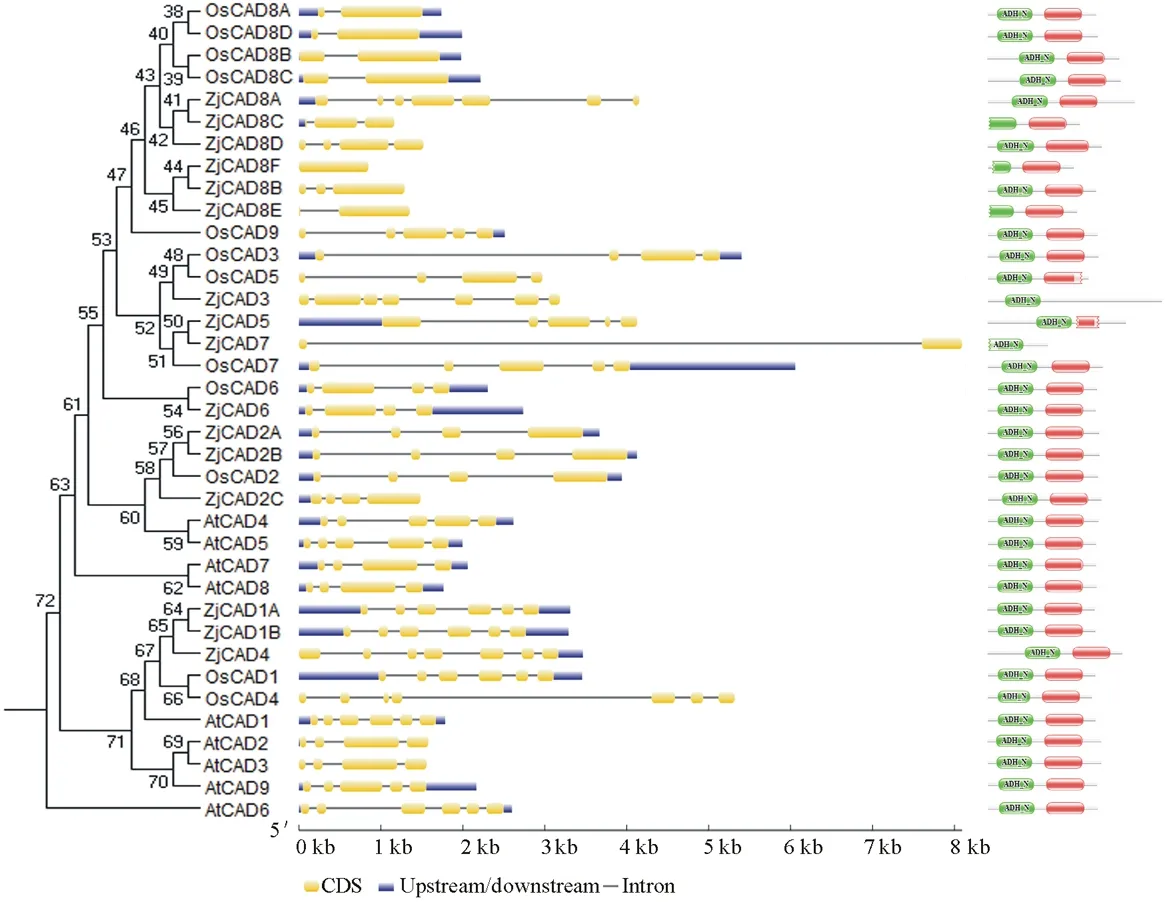
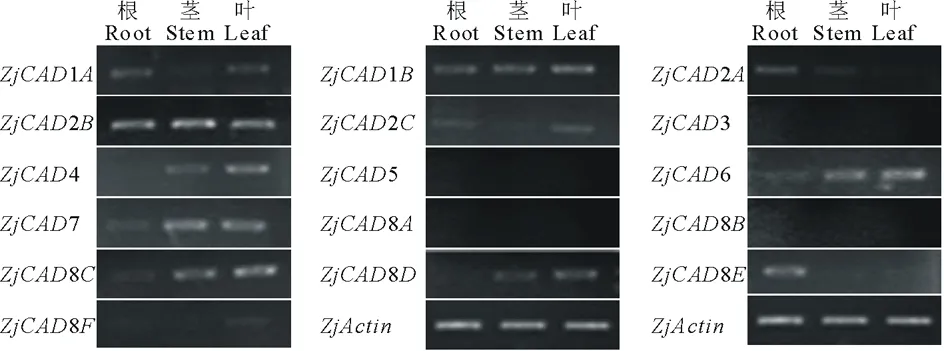
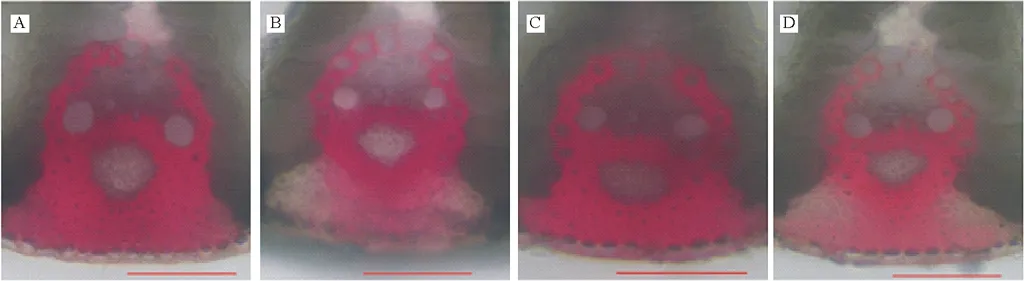
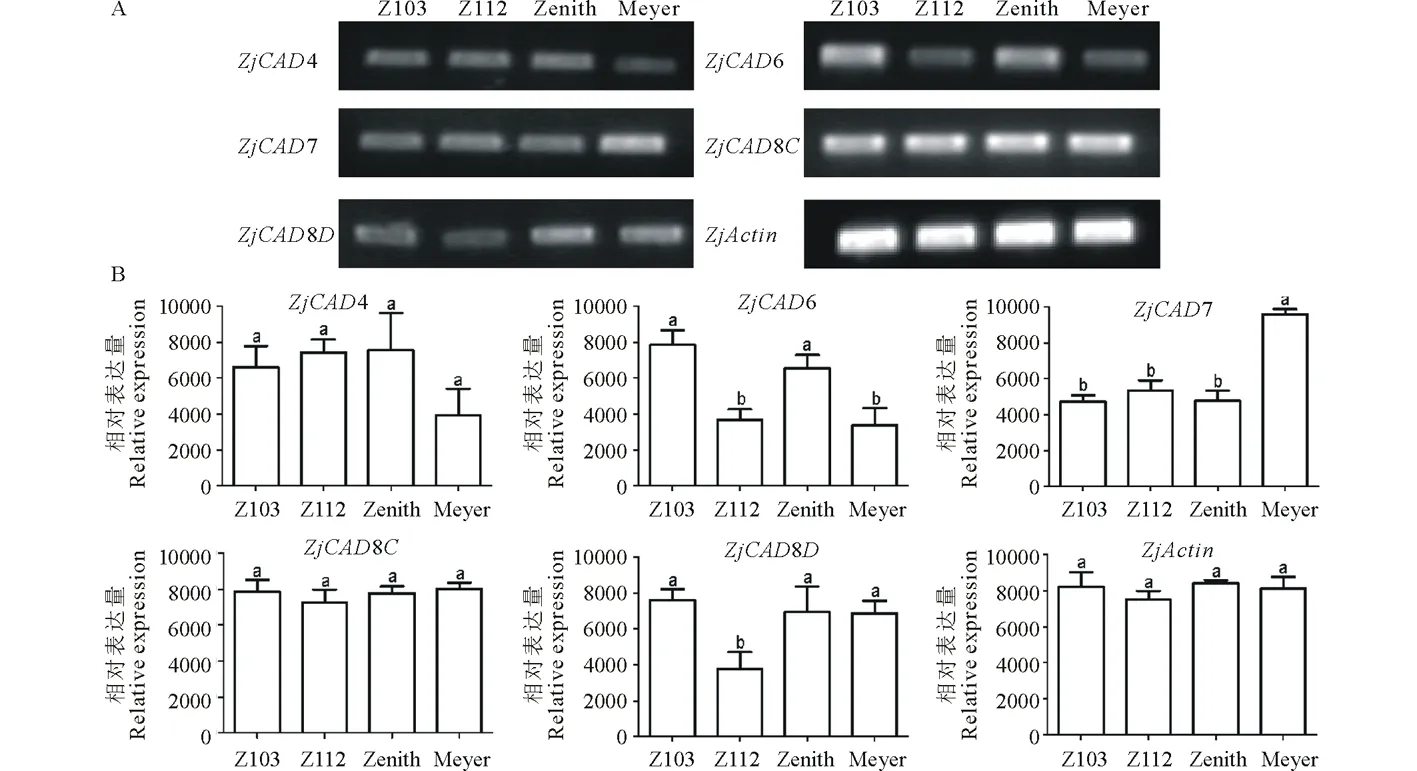
以已报道的拟南芥和水稻CAD基因为探针[18],通过本地同源BLAST搜索[22]结缕草基因组数据库(http://zoysia.kazusa.or.jp/)[23],E值设定为 将获取的结缕草ZjCAD基因与拟南芥AtCAD基因、水稻OsCAD基因进行生物信息学分析比较。系统进化树采用Megalign软件进行、蛋白结构域通过Pfam分析获得、内含子外显子分析通过GSDS2.0(http://gsds.cbi.pku.edu.cn/)进行。 1.3 RNA提取与cDNA合成 使用植物RNA提取试剂盒(Omega,USA)提取结缕草不同组织RNA,提取方法参照试剂盒说明书进行。使用RNase-Free DNase Set(BBI,China)消化基因组DNA。使用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(Takara,Japan)逆转录合成cDNA。 1.4ZjCAD基因在结缕草不同组织和不同种源材料的表达分析 以cDNA为模板,用特异性引物进行PCR扩增(引物设计见表2),以结缕草肌动蛋白actin基因为内参,分析不同ZjCAD基因在不同组织和不同种源材料的表达情况。 表2 ZjCAD基因表达引物Table 2 Set of primers for ZjCAD genes expression 1.5 木质素组织化学染色 取展开叶第二叶位叶片,于叶基部1 cm处用双面刀片切取厚度约100 μm的薄片。染色方法采用Wiesner染色法,将超薄切片置于2%间苯三酚(无水乙醇溶解)中染色2 min,置于载玻片上滴加1滴25%盐酸,立即封片镜检。 2.1ZjCAD基因家族生物信息学分析 如表3所示,通过本地blast分析和Pfam结构域确认,我们总共在结缕草基因组中发现了16个CAD基因,其编码蛋白氨基酸残基数范围为196~576个,与玉米ZmCAD2基因相似度在42%~92%之间。为了更好地了解结缕草CAD基因家族的序列变异情况,我们将16个ZjCAD基因与12个水稻OsCAD基因和9个拟南芥AtCAD基因进行了进化树的分析。如图1所示,系统进化树分析结果表明结缕草CAD基因存在高度的重复扩增现象,如AtCAD1基因在水稻中有OsCAD1和OsCAD4两个同源基因,而在结缕草中其同源基因数量进一步增加至3个。基因结构分析显示结缕草CAD基因家族不同成员内含子数量差异巨大,所含内含子数量从0到6均有分布。蛋白结构域分析则进一步表明,除ZjCAD3和ZjCAD7外所有ZjCAD基因编码蛋白均含有1个醇脱氢酶结构域和1个辅分子伴侣结构。 表3 结缕草CAD基因家族信息Table 3 The information of CAD gene family in Z.japonica 2.2ZjCAD基因在不同结缕草种质不同组织中的表达特征 利用RT-PCR方法,我们进一步对结缕草CAD基因家族不同成员的组织表达模式进行了分析,结果如图2所示。在16个ZjCAD基因中,除ZjCAD3、ZjCAD5、ZjCAD8A和ZjCAD8B 4个基因外,其他12个基因均在一个或多个组织中表达。12个基因中,ZjCAD1B、ZjCAD2B为持家基因,在根、茎、叶中均高表达。ZjCAD8E在根中特异性表达,ZjCAD2A在根和茎中优势表达,而ZjCAD4、ZjCAD6、ZjCAD7、ZjCAD8C、ZjCAD8D则均在叶中有着较高表达。 2.3 不同结缕草种源材料叶片木质素含量与CAD基因表达相关性 使用 winser 染色法,我们对4份结缕草种源材料的叶片进行了木质素的组织化学染色分析,如图3所示,4份种源材料中,Z103与Zenith染色较深,Z112与Meyer染色较浅,且染色面积较小,说明Z103与Zenith木质素含量高于Z112与Meyer。如图4所示,对上述分析发现的5个叶片中高表达的CAD基因进行RT-PCR分析发现,仅ZjCAD6的表达模式和木质素染色结果一致,即Z103与Zenith两份种源材料的表达量高于Z112与Meyer,而其余4个CAD基因的表达则无这种相关性。这一结果提示ZjCAD6基因可能是决定不同结缕草种源材料叶片木质素含量的关键基因。 图1 结缕草ZjCAD基因家族进化树,基因结构和保守结构域分析Fig.1 Phylogenetic tree,gene structure and conserved motif analysis of ZjCAD genes 图2 ZjCAD基因在不同组织中的表达情况Fig.2 The expression pattern of ZjCAD genes in different tissues 图3 木质素组织化学染色Fig.3 Histochemical analysis of ligninA:Z103;B:Z112;C:Zenith;D:Meyer.Scale bar=50 μm. 图4 5个ZjCAD基因在4份材料中的差异表达Fig.4 Expression analysis of 5 ZjCAD genes in 4 zoysiagrassesA:代表性半定量RT-PCR电泳结果Representative electrophoresis result of RT-PCR;B:3次重复实验统计学分析Statistical analysis of 3 replicate experiments. 图5 ZjCAD6基因与其他物种CAD基因氨基酸序列一致性比对Fig.5 Alignment of amino acid sequence of ZjCAD6 with CADs from other plant species 2.4 ZjCAD6蛋白序列保守性分析 ZjCAD6基因编码蛋白ZjCAD6为有催化活性的功能蛋白。为了进一步确定ZjCAD6基因与结缕草叶片木质素合成的相关性,我们将ZjCAD6蛋白与其他植物具催化活性的CAD蛋白进行了氨基酸序列比对分析。如图5所示,所有具催化活性的CAD蛋白均含一个与Zn2+催化相关的GHE(X)2G(X)5G(X)2V结构域,一个与Zn2+结合的GD(X)10C(X)2C(X)2C(X)7C结构域和一个与NADP(H)结合相关的富含甘氨酸的GLGGV(L)G保守结构域[25]。这3个结构域在ZjCAD6蛋白中均同样存在,提示ZjCAD6基因编码蛋白ZjCAD6为有催化活性的功能蛋白。 肉桂醇脱氢酶以基因家族的形式存在于多个植物中,在拟南芥中有9个CAD基因,水稻中有12个CAD基因,二穗短柄草(Brachypodiumdistachyum)和杨树(Populustrichocarpa)中则分别有7和15个CAD基因[20,26]。在结缕草中,我们共发现了16个CAD基因。这16个CAD基因具有非常大的序列和基因结构差异,最短的ZjCAD8F仅849 bp,最长的ZjCAD7则长达8093 bp,ZjCAD8F无内含子,而ZjCAD3、ZjCAD4、ZjCAD8A则拥有多达6个的内含子。这一结果和拟南芥、水稻中CAD基因家族不同成员的序列差异度是不同的[27],说明结缕草CAD基因家族的不同成员具有较大的基因序列差异性[26]。拟南芥中,AtCAD4(AtCAD-D)、AtCAD5(AtCAD-C)为控制木质素合成的主效基因,AtCAD4在花和根中高表达。AtCAD5在木质的根中高表达[28]。在二穗短柄草中,BdCAD5则在根和茎中高表达。本研究同样发现不同结缕草CAD基因具有不同的组织表达特异性,值得一提的是ZjCAD4、ZjCAD6、ZjCAD7、ZjCAD8C、ZjCAD8D5个基因在叶片中均高表达,提示这5个CAD基因参与了结缕草叶片木质素的合成。然而,在拟南芥中,AtCAD1、AtCAD7、AtCAD8等基因也被证明与木质素的合成相关[17,20,28],说明CAD基因家族不同成员可能存在功能冗余的现象。因此,叶片中高表达的5个ZjCAD基因的具体功能作用尚需进一步探究和验证。 Wiesner反应利用间苯三酚在酸性条件下与肉桂醛基团发生显色反应获得红色或粉色的化合物,是检测植物木质素含量的最直观、高效的方法[29]。本研究中,Z103与Zenith两份结缕草种源材料Wiesner染色强度高于Z112与Meyer,说明Z103与Zenith叶片木质素含量和木质化程度较高,提示不同种源材料机械强度和耐践踏能力差异可能与其木质化程度密切相关。 不同结缕草种源材料中ZjCAD6基因的表达和叶片木质素含量正相关,提示其为决定结缕草叶片木质素含量的关键CAD基因。在几种模式植物中,AtCAD4、AtCAD5[16]、ZmCAD2[18]、OsCAD2[13]基因分别为控制拟南芥、玉米、水稻木质素合成的主效基因,序列分析发现ZjCAD6基因与这些具催化活性的CAD基因具有46%~47%的序列相似性,尤其是与催化活性相关的酶结构域高度保守,说明ZjCAD6蛋白是具有CAD酶活性的活性蛋白。在进化树的比对中,ZjCAD6与OsCAD6相似度最高,尽管OsCAD6未被证明直接参与木质素的合成过程,但其特有的过氧化物酶结合位点揭示其可能参与了其他代谢途径。而且,OsCAD6与杨树中芥子醇脱氢酶(sinapyl alcohol dehydrogenase,SAD)有59.4%的相似度,SAD表现出对底物芥子醛特异的亲和性[27]。因此,在今后的研究中,可进一步对ZjCAD6基因进行表达、纯化与活性测定,分析其催化特征和调控机制,从而可以更深入的解析结缕草叶片木质素合成的分子机理。 本研究首次获得了结缕草16个CAD基因家族成员。16个结缕草CAD基因中,有12个基因在根、茎、叶不同组织中表达,5个基因在叶片中优势表达。5个基因中,仅ZjCAD6基因的表达与不同结缕草种源材料木质素含量正相关,提示ZjCAD6基因是控制结缕草叶片木质素合成的关键基因。本研究结果为解析结缕草机械强度和耐践踏的分子机理提供了重要信息。 References: [1] Lulli F,Guglielminetti L,Grossi N,etal.Physiological and morphological factors influencing leaf,rhizome and stolon tensile strength in C4turfgrass species.Functional Plant Biology,2011,38(11):919-926. [2] Ralph J,Lapierre C,Marita J M,etal.Elucidation of new structures in lignins of CAD- and COMT-deficient plants by NMR.Phytochemistry,2001,57(6):993-1003. [3] Barrière Y,Riboulet C,Méchin V,etal.Genetics and genomics of lignification in grass cell walls based on maize as model species.Genes Genomes Genomics,2007,1(2):133-156. [4] Harrington M J,Mutwil M,Barrière Y,etal.Molecular biology of lignification in grasses.Advances in Botanical Research,2012,61:77-112. [5] Huang J,Gu M,Lai Z,etal.Functional analysis of theArabidopsisfunctional analysis of theArabidopsisPAL gene family in plant growth,development,and response to environmental stress.Plant Physiology,2010,153(4):1526-1538. [6] Schilmiller A L,Stout J,Weng J K,etal.Mutations in the cinnamate 4-hydroxylase gene impact metabolism,growth and development inArabidopsis.The Plant Journal,2009,60(5):771-782. [7] Xu B,Escamilla-Trevio L L,Sathitsuksanoh N,etal.Silencing of 4-coumarate:coenzyme A ligase in switchgrass leads to reduced lignin content and improved fermentable sugar yields for biofuel production.New Phytologist,2011,192(3):611-625. [8] Franke R,Hemm M R,Denault J W,etal.Changes in secondary metabolism and deposition of an unusual lignin in the ref8 mutant ofArabidopsis.The Plant Journal,2002,30(1):47-59. [9] Pichon M,Deswartes C,Gerentes D,etal.Variation in lignin and cell wall digestibility in caffeic acid O-methyltransferase down-regulated maize half-sib progenies in field experiments.Molecular Breeding,2006,18(3):253-261. [10] Ruegger M,Meyer K,Cusumano J C,etal.Regulation of ferulate-5-hydroxylase expression inArabidopsisin the context of sinapate ester biosynthesis.Plant Physiology,1999,119(1):101-110. [11] Saathoff A J,Sarath G,Chow E K,etal.Downregulation of cinnamyl-alcohol dehydrogenase in switchgrass by RNA silencing results in enhanced glucose release after cellulase treatment.PloS one,2011,6(1):e16416. [12] Ookawa T,Inoue K,Matsuoka M,etal.Increased lodging resistance in long-culm,low-lignin gh2 rice for improved feed and bioenergy production.Scientific Reports,2014,4:6567. [13] Hirano K,Aya K,Kondo M,etal.OsCAD2 is the majorCADgene responsible for monolignol biosynthesis in rice culm.Plant Cell Reports,2012,31(1):91-101. [14] Knight M E,Halpin C,Schuch W.Identification and characterization of cDNA clones encoding cinnamyl alcohol dehydrogenase from tobacco.Plant Molecular Biology,1992,19(5):793-801. [15] Sibout R,Eudes A,Pollet B,etal.Expression pattern of two paralogs encoding cinnamyl alcohol dehydrogenases inArabidopsis.Isolation and characterization of the corresponding mutants.Plant Physiology,2003,132(2):848-860. [16] Sibout R,Eudes A,Mouille G,etal.Cinnamyl alcohol dehydrogenase-C and-D are the primary genes involved in lignin biosynthesis in the floral stem ofArabidopsis.The Plant Cell,2005,17(7):2059-2076. [17] Eudes A,Pollet B,Sibout R,etal.Evidence for a role of AtCAD 1 in lignification of elongating stems ofArabidopsisthaliana.Planta,2006,225(1):23-39. [18] Halpin C,Holt K,Chojecki J,etal.Brown-midrib maize (bm1)-a mutation affecting the cinnamyl alcohol dehydrogenase gene.The Plant Journal,1998,14(5):545-553. [19] Fornalé S,Capellades M,Encina A,etal.Altered lignin biosynthesis improves cellulosic bioethanol production in transgenic maize plants down-regulated for cinnamyl alcohol dehydrogenase.Molecular Plant,2012,5(4):817-830. [20] Barakat A,Bagniewska-Zadworna A,Choi A,etal.The cinnamyl alcohol dehydrogenase gene family inPopulus:phylogeny,organization,and expression.BMC Plant Biology,2009,9(1):26. [21] Sattler S E,Saathoff A J,Haas E J,etal.A nonsense mutation in a cinnamyl alcohol dehydrogenase gene is responsible for the sorghum brown midrib6 phenotype.Plant Physiology,2009,150(2):584-595. [22] Altschul S F,Gish W,Miller W,etal.Basic local aligment search tool.Journal of Molecular Biology,1990,215(3):403-410. [23] Tanaka H,Hirakawa H,Kosugi S,etal.Sequencing and comparative analyses of the genomes of zoysiagrasses.DNA Research,2016,23(2):171-180. [24] Xie Q,Niu J,Xu X,etal.Corrigendum:De novo assembly of the Japanese lawngrass (ZoysiajaponicaSteud.) root transcriptome and identification of candidate unigenes related to early responses under salt stress.Frontiers in Plant Science,2015,6:610. [25] Chao N,Liu S X,Liu B M,etal.Molecular cloning and functional analysis of nine cinnamyl alcohol dehydrogenase family members inPopulustomentosa.Planta,2014,240(5):1097-1112. [26] Bukh C,Nord-Larsen P H,Rasmussen S K.Phylogeny and structure of the cinnamyl alcohol dehydrogenase gene family inBrachypodiumdistachyon.Journal of Experimental Botany,2012,63(17):6223-6236. [27] Tobias C M,Chow E K.Structure of the cinnamyl-alcohol dehydrogenase gene family in rice and promoter activity of a member associated with lignification.Planta,2005,220(5):678-688. [28] Tronchet M,Balagué C,Kroj T,etal.Cinnamyl alcohol dehydrogenases-C and D,key enzymes in lignin biosynthesis,play an essential role in disease resistance inArabidopsis.Molecular Plant Pathology,2010,11(1):83-92. [29] Vallet C,Chabbert B,Czaninski Y,etal.Histochemistry of lignin deposition during sclerenchyma differentiation in alfalfa stems.Annals of Botany,1996,78(5):625-632. Genome-wide identification and characterization of the cinnamyl alcohol dehydrogenase gene family inZoysiajaponica SHI Jing-Ang,ZHANG Bing*,XIAO Xiao-Lin,MA Jing-Jing,YANG Xiang-Yang,LIU Jian-Xiu InstituteofBotany,JiangsuProvinceandChineseAcademyofSciences,Nanjing210014,China Cinnamyl alcohol dehydrogenase (CAD,EC1.1.1.195) is a key enzyme in the lignin biosynthesis pathway.By using NADPH as a cofactor,CAD catalyzes cinnamyl aldehydes to alcohols and plays an important role in plant development and stress responses.This study identified 16 CAD genes inZoysiajaponica.Phylogenetic and structural analyses of these genes were conducted.Semi-quantitative RT-PCR indicated that 5ZjCADgenes were specifically expressed in leaves.Lignin histochemical staining and expression analyses ofZjCADgenes in different cultivars and a wild accession further showed that the expression pattern ofZjCAD6 was positively correlated with leaf lignin contents.These results indicate thatZjCAD6 may be the key gene that regulates lignin biosynthesis in the leaves ofZ.japonica.The full length of theZjCAD6 gene is 2736 bp,and is comprised of three introns and four exons.The 1074 bp open reading frame ofZjCAD6 encodes 357 amino acids.ZjCAD6 protein contains two Zn2+-binding motifs and a NADP(H)-binding motif,which is vital for its catalytic activity.Our results provide an important reference for further study of both lignin content's molecular mechanisms and the tensile strength ofZ.japonicaleaves. Zoysiajaponica;lignin;cinnamyl alcohol dehydrogenase;bioinformatics analysis;gene expression 10.11686/cyxb2016442 http://cyxb.lzu.edu.cn 史经昂,张兵,肖晓琳,马晶晶,杨向阳,刘建秀.结缕草肉桂醇脱氢酶基因家族全基因组序列鉴定和表达分析.草业学报,2017,26(6):111-119. SHI Jing-Ang,ZHANG Bing,XIAO Xiao-Lin,MA Jing-Jing,YANG Xiang-Yang,LIU Jian-Xiu.Genome-wide identification and characterization of the cinnamyl alcohol dehydrogenase gene family inZoysiajaponica.Acta Prataculturae Sinica,2017,26(6):111-119. 2016-11-19;改回日期:2017-02-14 江苏省公益院所能力提升项目-草坪种质创新(BM2015019-1),江苏省体育产业引导项目“江苏省运动草坪研究中心建设暨运动草坪标准化项目”和江苏省体育产业引导项目“天然草坪耐践踏性关键技术体系研发与集成示范”资助。 史经昂(1992-),男,江苏徐州人,在读硕士。E-mail:shion1992@outlook.com *通信作者Corresponding author.E-mail:bingkeith@gmail.com
2 结果与分析

3 讨论
4 结论
