高精料日粮对山羊瘤胃和盲肠发酵及生物胺生成与吸收的影响研究
2017-06-19李弘伟刘军花霍文捷朱伟云毛胜勇
李弘伟,刘军花,霍文捷,朱伟云,毛胜勇
高精料日粮对山羊瘤胃和盲肠发酵及生物胺生成与吸收的影响研究
李弘伟,刘军花,霍文捷,朱伟云,毛胜勇*
(江苏省消化道营养与动物健康重点实验室,南京农业大学消化道微生物实验室,江苏 南京 210095)
本实验旨在探究饲喂高精料日粮对山羊瘤胃和盲肠发酵、生物胺生成与吸收的影响研究。试验选用6头装有永久性瘤胃瘘管的雄性波杂山羊,随机分成低精料组与高精料组,实验期24 d。结果显示,与低精料组相比,饲喂高精料日粮的山羊瘤胃液中总挥发性脂肪酸、乙酸、丙酸、丁酸、戊酸、总支链脂肪酸、酪胺、腐胺、组胺、甲胺和色胺浓度显著性增加(P<0.05),而瘤胃pH和乙丙比显著降低(P<0.05);饲喂高精料日粮的山羊盲肠内容物中的乙酸、丙酸、总挥发性脂肪酸浓度和上述5种生物胺浓度显著增加(P<0.05);同时,瘤胃和盲肠静脉血中的上述5种生物胺的浓度显著提高(P<0.05)。相关性分析结果表明,瘤胃液中酪胺、腐胺、甲胺和色胺浓度与瘤胃静脉血所对应的生物胺浓度呈显著正相关(P<0.05),且盲肠内容物中酪胺、腐胺、甲胺和色胺与盲肠静脉血中对应的生物胺的浓度呈显著正相关(P<0.05)。结果说明,饲喂高精料日粮促进了山羊瘤胃和盲肠发酵,提高了瘤胃与盲肠内容物中生物胺浓度,暗示高精料日粮可能提高消化道上皮的通透性,促进消化道上皮对生物胺的吸收。
高精料日粮;山羊;生物胺;瘤胃;盲肠
现代集约化养殖中,为提高肉羊生长速度和养殖效益,生产者常在日粮中使用大量精饲料,但使用高精料日粮常导致瘤胃代谢异常,引发营养代谢病如瘤胃酸中毒[1-2]、蹄叶炎[3]和脂肪肝[4]。生物胺是一类广泛存在于动植物体内,是一类含氮的具有生物活性的低分子量有机化合物的总称,由相应的氨基酸经脱羧反应生成[5]。研究表明,体内低浓度的生物胺对动物机体免疫、神经系统和血压调节有重要作用[6-8]。但生物胺浓度过高会诱发蹄叶炎,进而对肉羊健康及福利带来严重负面影响[9]。在反刍动物消化道系统中,瘤胃和后肠是生物胺如组胺等的主要产生场所,但目前的研究主要集中于瘤胃生物胺的生成与传送。在马属动物上的研究表明,饲喂高精料日粮可导致马后肠微生物发酵异常,组胺浓度显著增高,诱发马蹄叶炎[10-12]。但高精料日粮对山羊后肠生物胺生成的影响并不清楚[13-14]。此外,高精料日粮是否可促进羊胃肠道内生物胺的吸收也尚无报道。由此,为充分了解饲喂高精料日粮对肉羊瘤胃及盲肠内生物胺生成及吸收的影响,研究了饲喂高精料日粮对山羊瘤胃及盲肠微生物发酵,以及对瘤胃及盲肠内生物胺生成与吸收的影响,拟进一步了解高精料日粮对肉羊健康的影响。
1 材料与方法
1.1 试验动物、日粮配方及试验设计
于2015年3月,选用6头体重相近、安装有永久性瘤胃瘘管的健康山羊,统一驱虫,单栏饲养。采用随机区组实验设计,将6头山羊分为两组,即低精料组(10%精料+90%粗饲料,LC)和高精料组(60%精料+40%粗饲料,HC),每组3头,实验期为24 d。每天饲喂2次(08:00和17:00),每次等量饲喂,自由饮水。参照NRC标准设计日粮配方,2种日粮的组成及营养水平见表1。
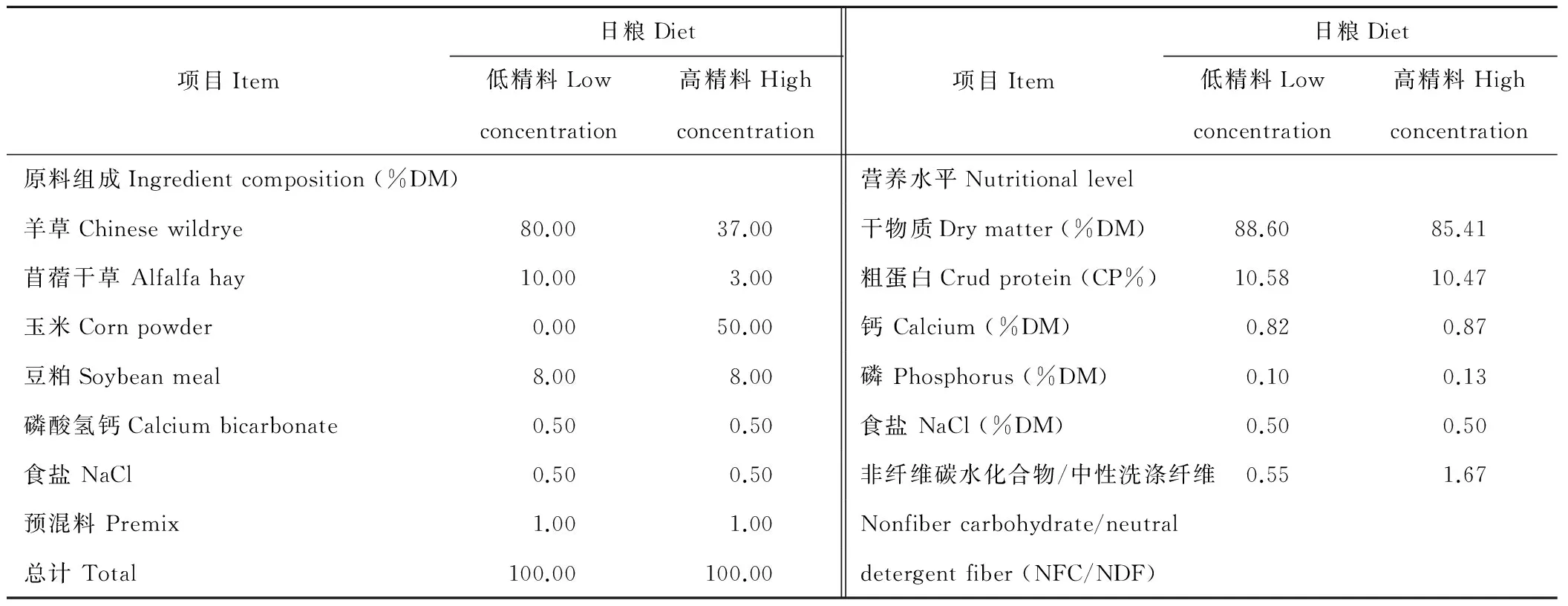
表1 日粮组成及营养水平Table 1 Dietary ingredients and nutritional level
1)预混料为每kg饲粮提供包含The premix provided the following per kg of diets:MnSO4153 mg,ZnSO4186 mg,FeSO4125 mg,CoCl28.25 mg,KIO325 mg,CuSO433 mg,NaSeO34 mg,VA15.28 mg,VE0.47 mg。
2)营养水平参考文献[15]的方法计算。Nutrient levels were calculated according to the method in reference[15].
1.2 瘤胃液及瘤胃静脉血液的采集及分析
分别于试验期第22和23天,饲喂前(0 h)和饲喂后2、4、6、8、10和12 h连续采集瘤胃液,用于测定瘤胃pH、挥发性脂肪酸(volatile fatty acid,VFA)和生物胺的含量。于实验期第24天晨饲后6 h,将动物麻醉,采用真空采血管采集瘤胃和盲肠静脉血,采集血液后,立即屠宰动物,采集瘤胃和盲肠内容物。血液经4 ℃冰箱过夜,3000 r/min离心20 min,取血清-20 ℃保存备测生物胺。瘤胃内容物充分混匀后,经4层纱布过滤后,所得瘤胃液部分用于测定pH,部分保存于-20 ℃条件下,用于生物胺与挥发性脂肪酸测定。盲肠内容物经充分混匀后,取匀质盲肠内容物与去离子水1∶1比例充分混合,4 ℃条件下,13000 r/min离心20 min,取上清液保存于-20 ℃冰箱,用于挥发性脂肪酸及生物胺浓度的测定。
1.3 指标测定
采用pH计(HI-9125;HANNA Instruments)测定瘤胃pH;参照Wang等[5]的方法,采用气相色谱法(GC-14B气象色谱仪,日本,柱温130 ℃,气化室温度180 ℃,检测器温度180 ℃)测定挥发性脂肪酸浓度;参照王东升等[16],采用反相高效液相色潽法(岛津液相色谱系统LC-ATVP,Agilent ZORBAX 80A Extend-C18,流速1 mL/min,检测器波长254 nm,柱温30 ℃)测定瘤胃和盲肠内容物及其静脉血中生物胺含量。
1.4 数据统计
经Microsoft Office Excel 2010初步整理数据后,瘤胃pH、挥发性脂肪酸和生物胺浓度数据采用SPSS(17.0)的GLM模型进行分析;盲肠内容物pH、挥发性脂肪酸和生物胺浓度采用Independent-t-test方法分析。瘤胃内容物与瘤胃静脉血、盲肠内容物与盲肠静脉血中生物胺含量的相关性采用XLSTAT 2010软件分析。显著性水平为P<0.05。
2 结果与分析
2.1 瘤胃pH和VFA含量
如图1所示,晨饲后山羊瘤胃液pH值呈先下降后上升的趋势,HC组和LC组变化规律一致。LC组瘤胃平均pH值始终在6.0以上。HC组瘤胃pH值基本在5.6以下,采食后2 h达到最低点5.4。HC组山羊瘤胃pH显著低于对照组(P<0.001)。晨饲后12 h内,山羊瘤胃液中总VFA、乙酸、丁酸、戊酸浓度均呈先上升后逐步下降的趋势,饲喂后2 h前后到达最大值;HC组上述各酸浓度皆显著高于LC组(P<0.05),且受采样时间点的显著影响(P<0.05),但日粮和采样时间点之间无显著影响(P>0.05)。HC组和LC组丙酸浓度无显著性差异(P>0.05);LC组乙丙比呈先下降后上升的趋势,HC组呈逐渐下降的趋势,两组间差异显著(P<0.05)。LC组总支链脂肪酸含量变化平稳,HC组在晨饲10 h后升高;HC组与LC组差异显著(P=0.010)。
2.2 连续采样时瘤胃中生物胺含量
由图2可知,饲喂HC日粮的山羊瘤胃液中的酪胺、腐胺、组胺、甲胺和色胺的浓度皆显著高于LC组(P<0.05)。此外,HC组山羊瘤胃液内腐胺、甲胺和色胺含量皆在饲喂后6 h时达到最大值;而酪胺和组胺含量在饲喂后10和8 h时达到最高值。
2.3 屠宰时山羊瘤胃液及盲肠内容物中的挥发性脂肪酸含量
由表2可知,与LC组相比,HC组山羊瘤胃液中的TVFA、丙酸、丁酸和戊酸浓度皆显著高于LC组(P<0.05),但两组间总支链VFA和乙酸浓度差异不显著(P>0.05)。HC组山羊盲肠内容物中乙酸、丙酸、总支链VFA含量亦显著高于低精料组(P<0.05),但两组间总VFA、丁酸和戊酸含量差异不显著(P>0.05)。
2.4 屠宰山羊瘤胃液和盲肠内容物中的生物胺含量
由表3可知,与LC组相比,HC组山羊瘤胃液及盲肠内容物中的酪胺、腐胺、组胺、甲胺、色胺均显著性升高(P<0.05)。
2.5 屠宰山羊瘤胃和盲肠静脉血中的生物胺含量
由表4可知,与LC日粮相比,HC组山羊瘤胃及盲肠静脉血中的酪胺、腐胺、组胺、甲胺和色胺显著高于LC组(P<0.05)。其中,HC组山羊瘤胃静脉血中酪胺浓度是LC组的3倍,而HC组山羊盲肠静脉血中酪胺浓度是对照组的6倍左右。
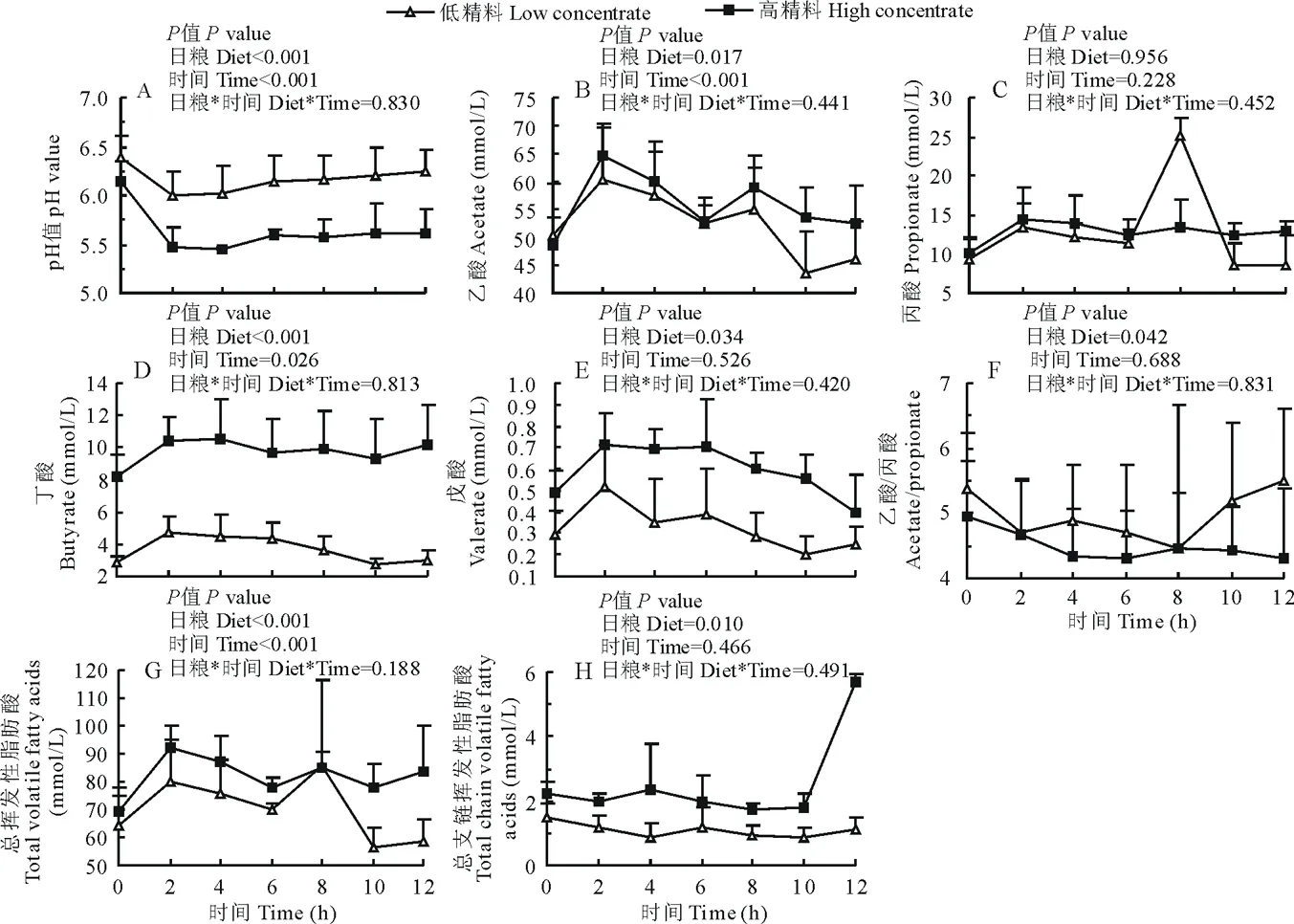
图1 瘤胃pH和VFA含量的变化Fig.1 Dynamic changes in ruminal pH and the concentration of volatile fatty acid in rumen
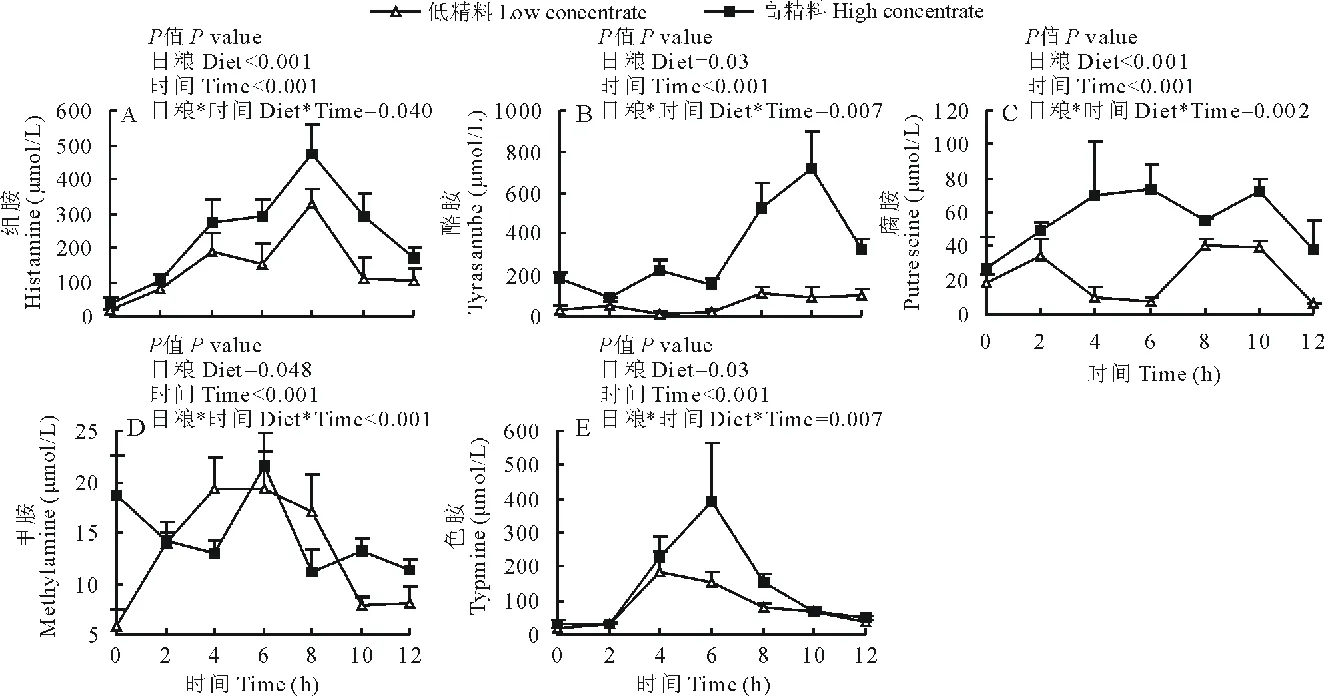
图2 瘤胃生物胺含量的变化Fig.2 Changes in the level of five types of biogenic amine in ruminal fluid
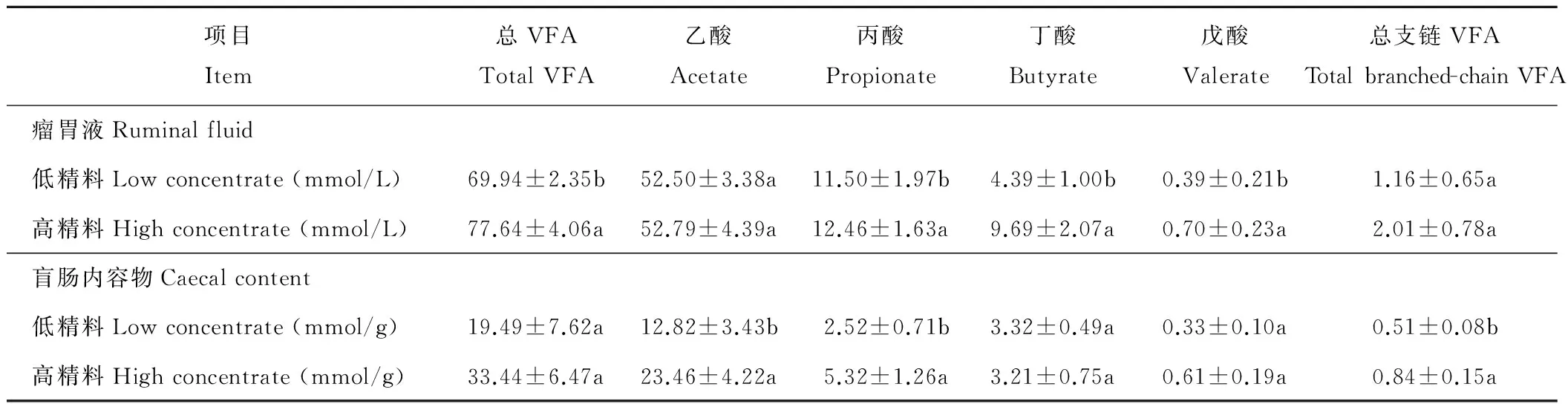
表2 瘤胃液及盲肠内容物中挥发性脂肪酸浓度Table 2 The concentration of VFA in the ruminal fluid and cecum content
注:同列相同字母表示差异不显著(P>0.05),标有不同小写字母表示差异显著(P<0.05)。下同。
Note:The same letter within treatments means no significant difference (P>0.05),however,different letter within treatments means significant difference (P<0.05).The same below.
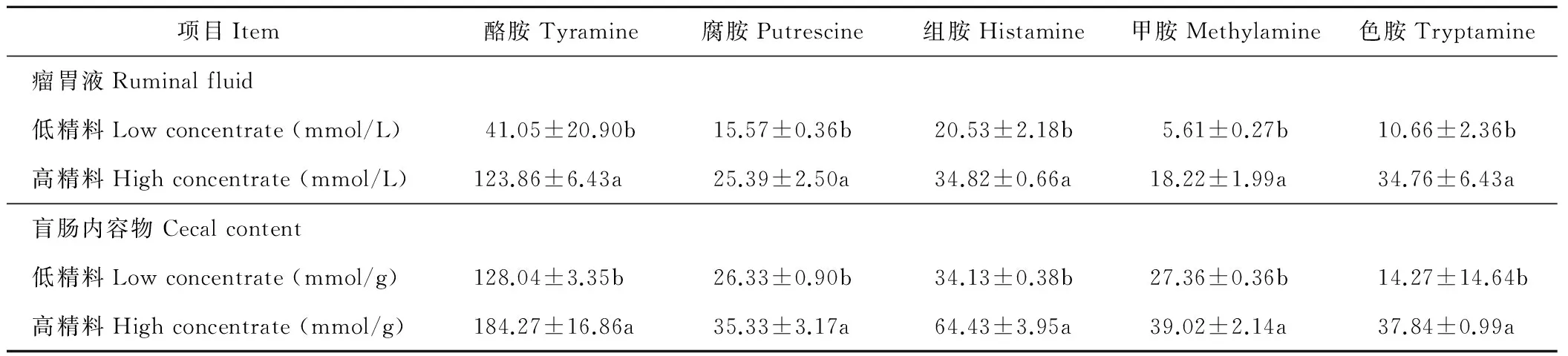
表3 瘤胃液和盲肠内容物中生物胺浓度Table 3 The concentration of biogenic amine in rumen fluid and cecal digesta
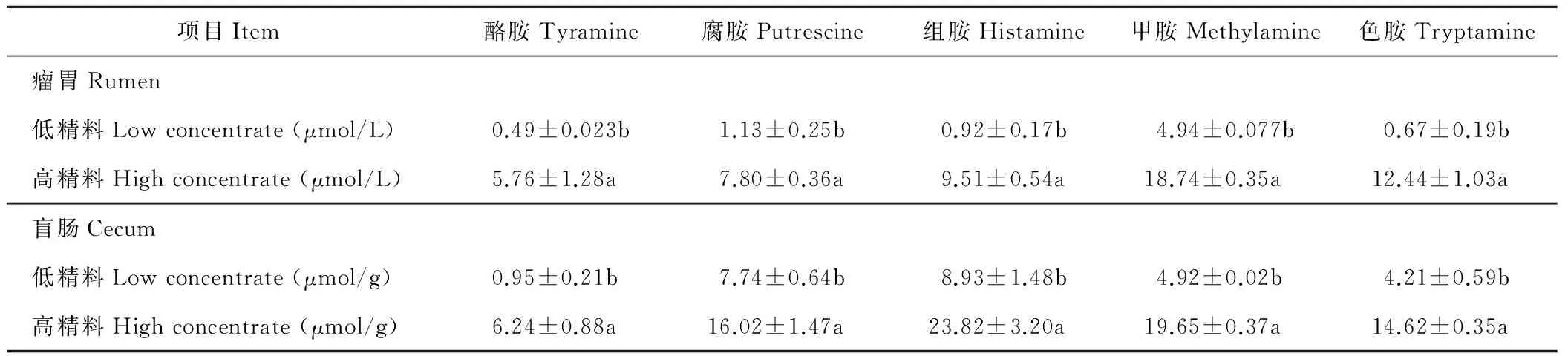
表4 瘤胃静脉血及盲肠静脉血中生物胺浓度Table 4 The concentration of biogenic amine in vein blood of rumen and cecum vein
2.6 屠宰山羊瘤胃液及盲肠内容物中生物胺与其静脉血中生物胺含量的相关性
由表5可知,瘤胃液中生物胺含量与瘤胃静脉血中生物胺含量均呈显著(P<0.05)正相关。盲肠中除盲肠内容物中的腐胺含量与盲肠静脉血中的组胺含量的相关性不显著外(P>0.05),盲肠内容物中的其他生物胺含量与盲肠静脉血中的生物胺含量呈显著正相关(P<0.05)。
3 讨论
生物胺是一类分子量相对较小的有机物,由相应的氨基酸通过脱羧反应生成,常见的生物胺包括酪胺、组胺、甲胺、色胺和尸胺等。如前言所述,正常条件下,动物体内生物胺含量较低,而低浓度的生物胺有益于细胞生长和机体发育[17],但生物胺浓度过高会危害人和畜禽的身体健康[18-20]。本研究发现,与对照组相比,饲喂高精料日粮组的山羊瘤胃液及瘤胃静脉血中生物胺含量显著升高。 本研究中,两组山羊日粮蛋白水平一致,因此,两组山羊瘤胃液中生物胺浓度存在差异的原因可能与瘤胃内环境参数如pH值不同有关。实际上,本研究发现,高精料日粮导致HC组山羊瘤胃内VFA浓度升高,pH值显著下降。而有体外研究报道,低pH可提高瘤胃微生物分泌的生物胺生成酶的酶活性,进而加快氨基酸的脱羧反应,促进了瘤胃内生物胺的生成[21-23]。因此,饲喂HC日粮的山羊瘤胃内生物胺浓度的升高可能与瘤胃低pH有关。此外,本研究同时发现,饲喂HC日粮的山羊瘤胃静脉血中生物胺浓度显著高于LC组,其原因可能与HC日粮导致瘤胃上皮屏障受损有关。以前的研究发现,饲喂高精料日粮导致山羊瘤胃上皮屏障受损[24],而瘤胃上皮屏障损伤可使进入瘤胃静脉中的生物胺数量增多。
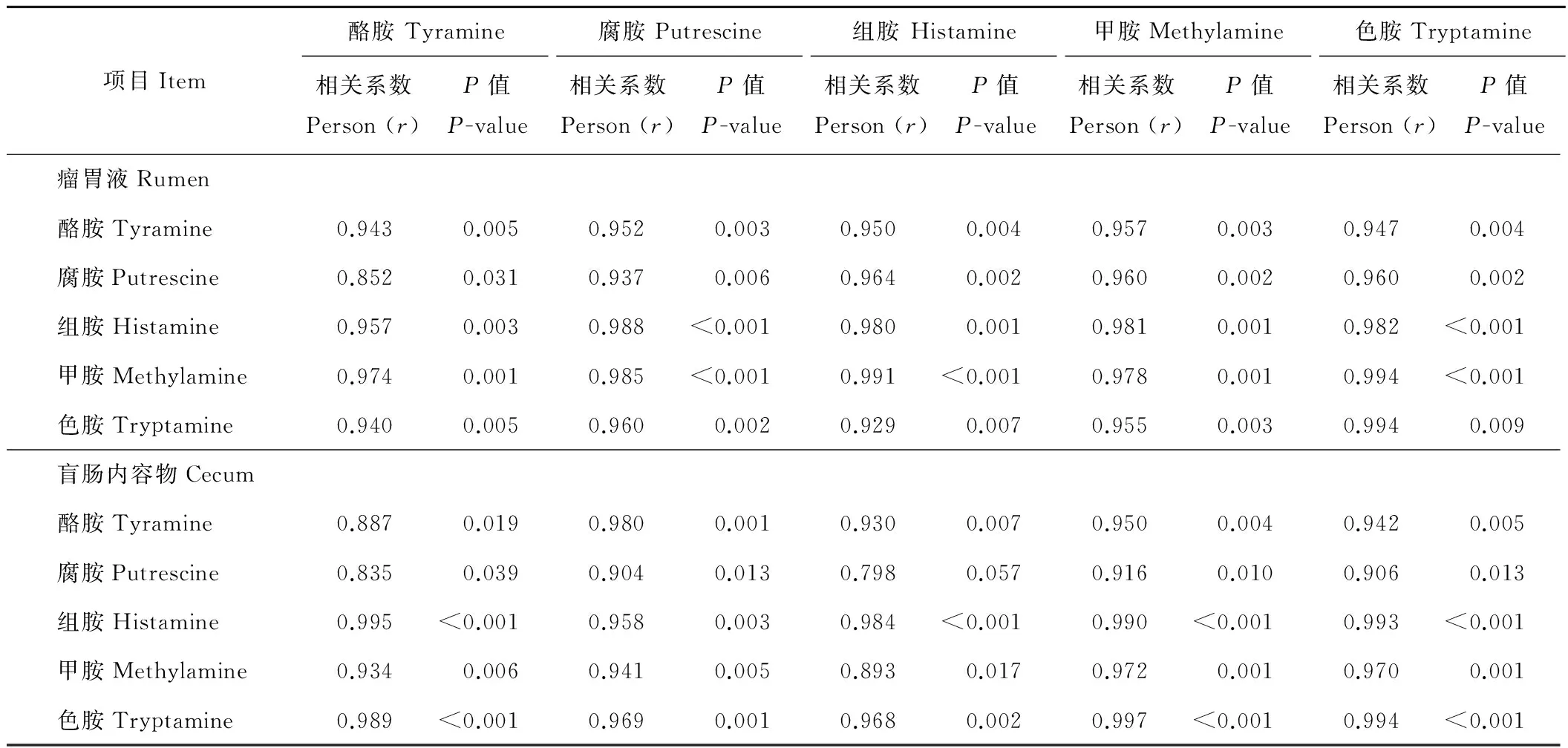
表5 瘤胃液及盲肠内容物中生物胺含量与其静脉血中生物胺含量的相关性Table 5 The relationship between biogenic amine in rumen fluid and cecum content and the vein blood of rumen and cecum
后肠是反刍动物另一微生物消化场所。据报道,羊盲肠与结肠发酵所产VFA占消化道总VFA产量的8.6%~16.8%[25]。当饲喂高精料日粮时,山羊后肠发酵类型和VFA的产生速率也同时发生改变。DeGregorio等[26]研究表明,比较采食含0%,40%和80%玉米日粮的羔羊盲肠中VFA时,发现饲喂80%玉米日粮的羊盲肠内总VFA含量最高,且饲喂80%玉米日粮的山羊盲肠内丁酸比例、乳酸浓度、乙酸与丙酸比及pH均显著降低。与DeGregorio等[26]报道一致,本研究也发现,饲喂HC日粮的山羊后肠内容物中TVFA浓度显著增加,使后肠pH显著降低。pH下降可能进一步改变盲肠微生物区系,使发酵氨基酸产生生物胺的微生物的数量及其脱羧能力增加[27],进而提高了盲肠内容物中生物胺的含量。
综上,饲喂高精料日粮导致瘤胃pH值显著下降,瘤胃液及盲肠内容物中的TVFA和生物胺含量显著升高;饲喂高精料日粮可能导致动物消化道上皮屏障受损,使进入瘤胃静脉和盲肠静脉血液中的生物胺含量增加。但有关生物胺的生成及吸收机制仍不清楚,需进一步研究。
References:
[1] Nagaraja T G,Titgemeyer E C.Ruminal acidosis in beef cattle:The current microbiological and nutritional outlook.Journal of Dairy Science,2007,90:17-38.
[2] Krause K M,Oetzel G R.Understanding and preventing subacute ruminal acidosis in dairy herds:A review.Animal Feed Science &Technology,2006,126(3):215-236.
[3] Nocek J E.Bovine acidosis:Implications on laminitis.Journal of Dairy Science,1997,80(5):1005-1028.
[4] Ametaj B N,Zebeli Q,Iqbal S.Nutrition,microbiota,and endotoxin-related diseases in dairy cows.Revista Brasileira de Zootecnia,2010,39:433-444.
[5] Wang D S,Zhang R Y,Zhu W Y,etal.Effects of subacute ruminal acidosis challenges on fermentation and biogenic amines in the rumen of dairy cows.Livestock Science,2013,155(2):262-272.
[6] Sjaastad O.Determination and occur-rence of histamine in rumen liquor of sheep.Acta Venterinria Scandinavica,1967,8:50-70.
[7] Mah J H,Han H K,Oh Y J,etal.Biogenic amines in jeotkals,korean salted and fermented fish products.Food Chemistry,2002,79(2):239-243.
[8] Ladero V,Calles-Enríquez M,Fernández M,etal.Toxicological effects of dietary biogenic amines.Current Nutrition &Food Science,2010,6(2):145-156.
[9] Shalaby A R.Significance of biogenic amines to food safety and human health.Food Research International,1996,29(7):675-690.
[10] Colles C,Jeffcott L.Laminitis in the horse.The Veterinary Record,1977,100(13):262-264.
[11] Al Jassim R A,Andrews F M.The bacterial community of the horse gastrointestinal tract and its relation to fermentative acidosis,laminitis,colic,and stomach ulcers.Veterinary Clinics of North America:Equine Practice,2009,25(2):199-215.
[12] Johnson P J,Messer N T,Slight S H,etal.Endocrinopathic laminitis in the horse.Clinical Techniques in Equine Practice,2004,3(1):45-56.
[13] Dain J A,Neal A,Dougherty R.The occurrence of histamine and tyramine in rumen ingesta of experimentally over-fed sheep.Journal of Animal Science,1955,14(4):930-935.
[14] Golder H,Celi P,Rabiee A,etal.Effects of grain,fructose,and histidine on ruminal pH and fermentation products during an induced subacute acidosis protocol.Journal of Dairy Science,2012,95(4):1971-1982.
[15] Xiong B H,Pang Z H,Zhao F,etal.Tables of feed composition and nutrition values in China (2014 twenty-fifth edition).China Feed,2014,21:29-39.熊本海,庞之洪,赵峰,等.中国饲料成分及营养价值表(2014年第25版)制订说明.中国饲料,2014,21:29-39.
[16] Wand D S,Huo W J,Zhu W Y,etal.Determination of biogenic amines in rumen fluid by reverse phase-high erhormance liquid chromatography.Chinese Journal of Nutrition,2011,23(12):2165-2169.王东升,霍文婕,朱伟云,等.反相高效液相色谱法测定瘤胃液中的生物胺.动物营养学报,2011,23(12):2165-2169.
[17] Santos M S.Biogenic amines:Their importance in foods.International Journal of Food Microbiology,1996,29(2):213-231.
[18] Glorioso J M,Mao S A,Rodysill B,etal.Pivotal preclinical trial of the spheroid reservoir bioartificial liver.Journal of Hepatol,2015,63(2):388-398.
[19] Fusi E,Rossi L,Rebucci R,etal.Administration of biogenic amines to saanen kids:Effects on growth performance,meat quality and gut histology.Small Ruminant Research,2004,53(1):1-7.
[20] Toivola P,Gale C.Effect on temperature of biogenic amine infusion into hypothalamus of baboon.Journal of Neuroendocrinology,1970,6(4):210-219.
[21] Bailey S,Baillon M L,Rycroft A,etal.Identification of equine cecal bacteria producing amines in aninvitromodel of carbohydrate overload.Applied and Environmental Microbiology,2003,69(4):2087-2093.
[22] Garner M R,Flint J F,Russell J B.Allisonella histaminiformans gen.Nov.,sp.Nov.:A novel bacterium that produces histamine,utilizes histidine as its sole energy source,and could play a role in bovine and equine laminitis.Systematic and Applied Microbiology,2002,25(4):498-506.
[23] Al Jassim R A,Scott P T,Trebbin A L,etal.The genetic diversity of lactic acid producing bacteria in the equine gastrointestinal tract.FEMS Microbiology Letters,2005,248(1):75-81.
[24] Liu J,Xu T,Liu Y,etal.A high-grain diet causes massive disruption of ruminal epithelial tight junctions in goats.American Journal of Physiology-regulatory Integrative and Comparative Physiology,2013,305(3):232-241.
[25] Kong X H.Study on Digestion of Dietary Nutrients in Hindgut of Sheep[D].Beijing:China Agricultural University,2005.孔祥浩.绵羊后肠道对日粮养分消化的研究[D].北京:中国农业大学,2005.
[26] DeGregorio R,Tucker R,Mitchell G,etal.Carbohydrate fermentation in the large intestine of lambs.Journal of Animal Science,1982,54(4):855-862.
[27] Li S,Khafipour E,Krause D,etal.Effects of subacute ruminal acidosis challenges on fermentation and endotoxins in the rumen and hindgut of dairy cows.Journal of Dairy Science,2012,95(1):294-303.
Effects of high concentrate diet on microbial fermentation and biogenic amine formation and absorption in the rumen and cecum of goats
LI Hong-Wei,LIU Jun-Hua,HUO Wen-Jie,ZHU Wei-Yun,MAO Sheng-Yong*
JiangsuKeyLaboratoryofGastrointestinalNutritionandAnimalHealth,LaboratoryofGastrointestinalMicrobiology,NanjingAgriculturalUniversity,Nanjing210095,China
This study was conducted to evaluate the effect of high concentrate diets on ruminal and cecal fermentation and biogenic amines production and absorption in the gastrointestinal tract of goats.Six goats fitted with permanent rumen fistula were randomly divided into low concentrate group and high concentrate groups for an experiment that lasted 24 days.The results showed that,compared with the low concentrate group,high concentrate diets increased the concentrations of total volatile fatty acid,acetate,propionate,butyrate,total branched chain fatty acid,tyramine,putrescine,histamine,methylamine and tryptamine (P<0.05).Ruminal pH and the ratio of acetate to propionate decreased (P<0.05).A high concentrate diet also improved the levels of acetate,propionate,total volatile fatty acid and the five biogenic amines in cecal digesta (P<0.05).Compared with the control group,the concentrations of biogenic amines contents were higher in the high concentrate group in rumen and cecal vein blood (P<0.05).Correlation analysis revealed that the biogenic amines contents of tyramine,putrescine,methylamine and tryptamine in rumen fluid and rumen vein blood were significantly positively correlated (P<0.05).In addition,significant correlations of the five amines contents were observed between cecal digesta and cecal vein blood (P<0.05).These results show that high concentrate diets significantly affect ruminal and cecal fermentation,indicating that high concentrate feeding might increase ruminal and cecal epithelial permeability and thus stimulate the absorption of biogenic amines from rumen and cecum.
high concentrate diet;goats;biogenic amine;rumen;cecum
10.11686/cyxb2016305 http://cyxb.lzu.edu.cn
李弘伟,刘军花,霍文捷,朱伟云,毛胜勇.高精料日粮对山羊瘤胃和盲肠发酵及生物胺生成与吸收的影响研究.草业学报,2017,26(6):210-216.
LI Hong-Wei,LIU Jun-Hua,HUO Wen-Jie,ZHU Wei-Yun,MAO Sheng-Yong.Effects of high concentrate diet on microbial fermentation and biogenic amine formation and absorption in the rumen and cecum of goats.Acta Prataculturae Sinica,2017,26(6):210-216.
2016-08-18;改回日期:2016-12-26
国家自然科学基金项目(31372339)资助。
李弘伟(1991-),男,河南周口人,在读硕士。E-mail:2015105041@njau.edu.cn
*通信作者Corresponding author.E-mail:maoshengyong@163.com
