棉酚对反刍动物的危害性及其瘤胃微生物学脱毒机理探讨
2017-06-10王炜康杨红建邢亚亮杨开伦李胜利
王炜康,杨红建*,邢亚亮,杨开伦,李胜利
(1. 中国农业大学动物科技学院,动物营养学国家重点实验室,北京 100193;2. 山西省牧草工作站,山西太原 030001;3. 新疆农业大学动物科学学院,新疆乌鲁木齐 830052)
棉酚对反刍动物的危害性及其瘤胃微生物学脱毒机理探讨
王炜康1,杨红建1*,邢亚亮2,杨开伦3,李胜利1
(1. 中国农业大学动物科技学院,动物营养学国家重点实验室,北京 100193;2. 山西省牧草工作站,山西太原 030001;3. 新疆农业大学动物科学学院,新疆乌鲁木齐 830052)
棉花在加工过程中所产生的棉籽、棉花壳、棉仁粉、棉粕等副产品是畜禽养殖业重要的饲料资源。与单胃动物相比,反刍家畜对棉副产品中棉酚毒性具有一定耐受性,但目前与棉酚相关的瘤胃微生物学脱毒机制尚不清楚。本文针对棉酚的危害性,重点综述了棉酚脱毒相关的化学与微生物学机理研究进展,以期为今后开展瘤胃微生物棉酚脱毒机制研究提供参考依据。
反刍动物;棉酚毒性;微生物脱毒
我国是棉花生产大国,棉籽加工所产生的大量棉副产品中含有丰富的氨基酸和蛋白质,但棉酚(Gossypol)限制了棉副产品在畜禽养殖中的大量使用。与单胃动物相比,成年反刍家畜拥有庞大的瘤胃微生物系统,因此可通过瘤胃微生物发酵作用来降低采食棉副产品中游离棉酚的含量,继而对棉酚毒性具有一定的耐受性。随着消费者对畜产品质量安全要求的不断提高,棉酚的危害性及其相关的微生物学脱毒机制仍备受畜牧养殖从业者高度关注。
1 棉酚结构、毒性及其在反刍动物上的摄入限量规定
棉酚又称棉毒素,通常存在于锦葵科棉属植物的根、茎、叶和籽实中,是一种由色素腺体分泌生成的多酚二萘衍生物,主要以游离棉酚(Free gossypol,FG)和结合棉酚(Bound gossypol,BG)2种形式存在。BG是指与蛋白质、氨基酸或其他物质结合的棉酚,而FG则指具有活性羟基和活性醛基的棉酚[1-3](图1)。全棉籽中棉酚的含量因棉花品种不同,存在很大差异(0.02%~6.64%),并主要以FG形式存在[1-3]。除一些高棉酚棉花品种的花蕾和叶片中的棉酚含量较高外,通常情况下棉籽仁和棉花根皮中棉酚含量最高,且不同棉花品种或同一品种在不同生长时期棉植株各部位的棉酚含量都存在很大差异[4]。
活性羟基和活性醛基是FG造成动物棉酚中毒的主要原因(图1),但相关的中毒机制仍不完全清楚。有研究发现,棉酚可与膜蛋白和膜基质结合进而破坏细胞膜结构,并通过负离子自由基方式影响细胞内电子传递系统,影响细胞内诸如Ca2+依赖性蛋白激酶参与的相关代谢活动,继而对细胞、血管、神经系统产生危害性[5]。棉籽经过加热发生美拉德反应,动物摄入棉籽后,FG分子结构中的活性基团与饲料蛋白质分子中的赖氨酸、精氨酸等氨基酸胺基残基结合,形成大分子的BG,从而减少赖氨酸的吸收量,继而对动物机体健康产生危害[6]。FG与日粮中的铁和钙离子结合,通过对蛋白质和膜基质的结合,破坏矿物质离子的转运机制,进而降低动物的矿物质吸收量,影响其生产性能和血红蛋白的形成[5]。FG能破坏雄性动物睾丸生精上皮的正常结构和功能,导致生成的精子合格率下降,甚至无精,降低动物繁殖力[7]。线粒体是棉酚发挥毒性最主要的靶细胞器,在体内棉酚能选择性地破坏睾丸生精细胞中线粒体的正常机能,从而影响动物的正常生殖机能[8]。FG被动物机体吸收后在肝脏中分布含量最高,胆汁、血清和肾的含量次之,而在淋巴结、脾、心以及肺中含量则相对较低。FG在动物机体内主要经肝脏由胆汁排入粪便,其余部分以尿液和乳汁形式排出体外[9]。
根据棉酚的毒性,联合国粮农组织蛋白质机构规定脱毒棉籽粕中的棉酚含量必须少于0.065%,世界卫生组织规定脱毒棉籽粕中棉酚含量必须少于0.04%,我国规定配合饲料中棉酚含量不允许超过0.02%[2]。虽然与单胃动物相比,反刍动物瘤胃解毒作用可使FG毒性减少很多,但在饲喂过程中若使用过量的棉副产品仍然会导致反刍动物中毒。欧盟对反刍动物日粮中FG的使用限量做出了规定,即成年牛、山羊、绵羊日粮中的游离棉酚含量应低于500 mg/kg,犊牛应低于100 mg/kg。美国规定反刍动物日粮中FG最大含量0~3 周龄时为100 mg/kg,3~24 周龄时为200 mg/kg,大于24 周龄时母畜为600 mg/kg,育种公畜为200 mg/kg[10]。目前,我国对反刍动物日粮中FG限量和棉籽粕等副产品的安全使用量尚无明确规定。
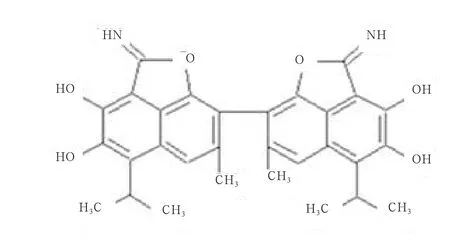
图1 FG的分子结构[3]
2 棉酚对反刍家畜的危害性
2.1 反刍动物常见棉酚中毒症状 牛棉酚中毒表现前期以肠胃炎为主,食欲大幅度下降、腹泻,神经兴奋,后肢软弱无力;胸腔内有大量红色渗出液;肝淤血肿大,颜色紫黄不均;肺淤血、水肿或气肿;心脏扩张,心肌松软;排褐粪、伴有粘液,严重时有尿血现象;怀孕母牛早产、流产或产畸形胎[11]。羊中毒后呼吸困难,食欲下降,全身有脱毛现象;胸、腹腔内累积大量液体,呈淡红色透明状;肺脏水肿、充血,气管和支气管内有泡沫样液体;心腔扩大,心肌色淡、松软;肝脏肿大,质脆呈黄色;肾脏充血肿大,膀胱黏膜有明显出血现象;胃肠道出血、炎症明显[12]。
2.2 游离棉酚对反刍动物畜产品质量的影响 饲料中的FG不仅会在动物体内残留,也会通过畜产品转移到人体内。《国家卫生标准》(GB2716-88)规定,长时间食用FG含量不超过0.02%的食用油时,不会影响人类健康,目前我国没有对肉制品和奶制品中棉酚含量的标准作出明确规定[11]。畜产品中残留的游离棉酚对人体健康的影响主要表现为对男性正常生殖功能的抑制作用。有研究发现,连续3个月每天服用12.5 mg棉酚才会影响正常的生殖功能[13]。
Ewing[14]按饲料卫生标准FG最大量1 200 mg/kg为依据,对牛羊不同生长阶段推荐了10%~20%不等的棉籽粕安全限量。研究发现,日粮中全棉籽添加量为30%时奶牛会出现死亡[15],当奶牛日粮中全棉籽含量不超过13.5%,FG日采食量不超过18.34 g时,奶牛健康不会受影响,产奶量和各项常规血液指标均正常[16]。当奶牛日粮中FG浓度达945 mg/kg时,牛奶中FG残留量可达到0.3252 mg/kg,因此,全棉籽含量在奶牛日粮中所占比例不超过15%时,牛奶中的FG残留量不会超过上述人类 对棉酚摄入的安全限量[11]。
有研究发现,当日粮中全棉籽添加量由7%升高至22%时,育肥牛胴体重、净肉率和肉骨比等屠宰性能降低越多,且优质牛肉产量也出现明显下降[17];而且22%全棉籽组日粮中FG含量可达到920.27 mg/kg,屠宰后肝脏中残留量高达79.13 mg/kg,肌肉中残留量为1.22 mg/kg,均远低于国家标准对食用油中棉酚安全含量的规定[17]。笔者据此测算,假设成年人连续3个月每天食用上述生鲜肝脏160 g或上述生鲜牛肉10.25 kg,才可能会影响生殖功能,但事实上这些畜产品在烹饪加工过程中,FG本身可与其他蛋白质结合转化为BG,并不一定能真正影响人体生殖功能。
2.3 游离棉酚对瘤胃微生物区系的影响 瘤胃是反刍动物最主要的消化器官,细菌、原虫、厌氧真菌等是瘤胃微生物的主要种类。在正常饲养条件下,其数量分别可达109~1010、105~106、103~105CFU/mL[18],瘤胃微生物通过自身分泌的各种消化酶对日粮进行发酵,并合成一定数量的微生物蛋白、维生素等,。影响瘤胃微生物组成区系最直接的作用因素是饲料,它是瘤胃微生物最主要的营养物质来源。反刍动物日粮中棉粕的使用量远高于单胃动物,这与瘤胃微生物对FG的解毒功能可能存在很大关系,但目前关于瘤胃微生物对棉酚的具体降解机制仍然需要进一步研究;棉酚是否对某些特定种类的瘤胃微生物生长繁殖存在促进或抑制作用,这些问题有待进一步深入研究。
有研究发现,在绵羊日粮中按0.1 g/kg的剂量添加棉酚后,瘤胃液pH无明显变化,瘤胃中纤维分解菌、总细菌和原虫的数量显著增加,氨态氮的浓度也显著提高,但真菌数量显著下降,同时挥发性脂肪酸的产量明显下降。瘤胃细菌种类繁多,仅纤维分解菌的类别就可达几十种,瘤胃细菌总量和纤维分解菌的增加说明棉酚对瘤胃纤维分解菌可能存在促生长作用。瘤胃真菌对棉酚较为敏感,低浓度的棉酚就能抑制真菌的生长[19]。以上试验结果说明,纤维分解菌和原虫对棉酚有一定的耐受性,可能对棉酚脱毒有十分重要的作用。
3 瘤胃微生物对游离棉酚的脱毒机制探讨
微生物消化是反刍动物最主要的消化方式,因此反刍动物对棉酚的脱毒主要依靠瘤胃微生物,其原理可能是通过FG与微生物所分泌的酶、氨基酸或活性蛋白中的游离氨基结合从而将FG转化为BG,或者利用微生物生长繁殖和新陈代谢活动所产生的一些酶,对棉酚结构进行降解或转化,从而达到脱毒效果[20]。
3.1 尿素与游离棉酚脱毒 反刍动物瘤胃微生物能利用尿素氮作为自身生长氮源,并合成微生物蛋白,因此日粮中添加尿素可以补充氮源来满足机体部分蛋白质营养需要。在一定温度和湿度的条件下,尿素作为酞氨化合物可以与FG结合生成西佛碱类化合物,再经过脱水生成西佛碱,从而将FG转化为BG,达到脱毒效果[21]。有研究表明,用8%的尿素溶液喷洒在含水量为60%的棉花秸秆上,在密闭容器中室温静置2 d再取出,自然风干,FG的脱毒效果可达71%[22],这可能是尿素与FG发生反应的结果。
3.2 糖基化与游离棉酚脱毒 棉酚的部分活性羟基经过糖基化修饰可以合成4种糖苷棉酚。根据结构表征,糖苷棉酚1和2是以缩醛式异构体存在,糖苷棉酚3和4以醛式异构体存在(图2)。醛式异构体棉酚的醛基与蛋白质分子作用,降低了其活性;缩醛式异构体抑制其与蛋白质作用,增加了活性[23]。棉铃虫是棉花蕾铃期重要的钻蛀性害虫,主要蛀食蕾、花、铃,也取食嫩叶。 用含FG的饲料饲喂棉铃虫幼虫后,在其粪便中检测到单糖基化和双糖基化的棉酚同分异构体,经过糖基化修饰,使亲脂性配基转化为亲水性配基,水溶性增强,失去穿透细胞膜的能力,减少活性基团对细胞的损伤,更容易随体液从体内排出。通过对葡萄糖苷转移酶的特异性标记发现,只有葡萄糖苷转移酶UGT41B3和UGT40B1参与了FG的糖基化过程[24]。 因此,糖基化过程可能是棉铃虫体内一种重要的FG脱毒机制,目前仍然缺乏关于反刍动物瘤胃微生物中是否存在能分泌葡萄糖苷转移酶的微生物的相关研究。
3.3 细胞色素氧化酶P450与游离棉酚脱毒 细胞色素氧化酶P450是一类参与机体内源性和外源性化合物代谢的酶,在生物体的内质网中含量较高,属于混合功能氧化酶系统中的一种,同时也是药物代谢酶系中最重要的酶,含铁离子的P450与底物结合,一个电子经NADPH—P450还原酶传递后与Fe结合,使其被还原为Fe2+;一分子氧、一个质子、第二个电子再与Fe2+结合后进一步形成铁氧复合物,它与另一个质子结合,产生水和铁氧复合物。铁氧复合物与氢原子(来自底物)分离,形成一对短暂的自由基,氧化型底物从复合物中释放,P450酶再生[25]。细胞色素氧化酶P450催化的反应主要包括:①单加氧反应:芳香族或脂肪族的烃基化反应、N-羟基化反应、S-氧化反应等。②非单加氧型氧化反应:脱氢反应、脱氧反应等。③去氧化反应:脱水反应等[26]。细胞色素氧化酶P450在氧化反应过程中主要起末端氧化的作用,它与底物总的反应原理化学式:
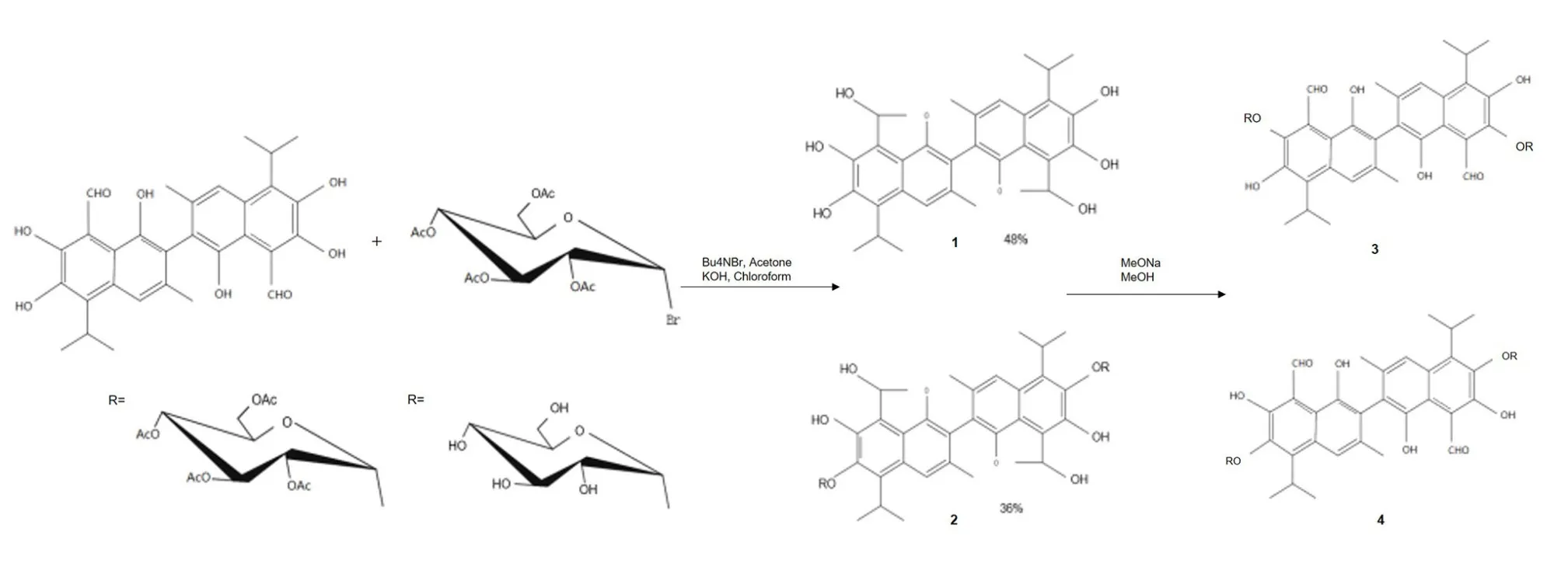
图2 棉酚的羟基部分糖基化[22]

其中,RH代表反应底物,分子氧经过反应形成水,底物经过氧化形成羟基化代谢产物(ROH)[27]。
昆虫体内的细胞色素氧化酶主要有两种功能:一种是催化体内活性物质的合成,例如激素、酶;另一种是催化外源性物质的代谢,例如植物毒素[28]。有研究发现,棉铃虫体内细胞色素氧化酶P450的表达水平与其生长速度呈正相关关系,用RNA干扰技术抑制棉铃虫细胞色素氧化酶P450的CYP6AE14基因表达以后,用含一定浓度棉酚的日粮饲喂棉铃虫幼虫,发现其生长速度明显减慢,并且在其粪便中能检测到FG[29]。该试验说明细胞色素氧化酶P450在棉铃虫对FG的脱毒过程中发挥着重要作用。因此,细胞色素氧化酶P450介导的氧化反应可能是FG微生物脱毒的重要机制之一,但是瘤胃微生物是否具有上述类似的棉酚脱毒机制尚不清楚。
3.4 谷胱甘肽转移酶与棉酚脱毒 谷胱甘肽转移酶(Glutathione transferase,GTase)是催化谷胱甘肽的亲核硫原子与底物的亲电子基团反应的酶。 它能在细胞内对其他生理毒性化学物质起到解毒作用。谷胱甘肽(GSH)主要存在于需氧生物中,它是一种结构为γ一谷氨酰一半胱氨酰一甘氨酸的三肽,常作为某些酶的辅酶,其功能主要利用自身的活性基团保护其他重要的酶和蛋白质的巯基的一种抗氧化剂[30]。有研究发现,用不同棉酚含量的棉花品种饲喂棉铃虫后,发现取食棉酚含量低的棉花品种的棉铃虫体内GTase的活性明显低于取食棉酚含量高的棉花品种的棉铃虫,并且GTase的活性随着棉酚浓度的增加而增加[31]。因此,GTase可能与棉酚脱毒有一定关系,目前,关于GTase是否能够具体参与到棉酚脱毒的过程以及其作用机制仍然有待进一步探讨。
4 小结与展望
综上所述,棉副产品中FG的毒性主要由活性醛基和活性羟基引起的,但关于瘤胃微生物棉酚脱毒作用的研究解释大多基于FG转化为BG,诸多已有研究主要将FG减少程度高低作为物理、化学、微生物脱毒作用效果的判定依据。针对棉副产品在反刍家畜养殖中的应用而言,FG是否会改变瘤胃微生物区系,FG是否会影响瘤胃微生物消化代谢,针对FG致毒活性基团,瘤胃微生物是否具有去氧化、糖基化、细胞色素氧化酶P450、GTase相关的脱毒机制,这些均尚无相关报道并值得深入研究。系统阐释FG的微生物学脱毒机制对今后更好地开发利用棉副产品饲料资源具有重要科学与应用指导意义。
[1] Alexander J, Benford D, Cockburn A, et al. Gossypol as undesirable substance in animal feed[J]. EFSA J, 2008, 908: 1-55.
[2] Randel R D, Chase Jr C C, Wyse S J. Effects of gossypol and cottonseed products on reproduction of mammals[J]. J Anim Sci, 1992, 70(5): 1628-1638.
[3] Price W D, Lovell R A, Mcchesney D G. Naturally occurring toxins in feedstuffs: center for veterinary medicine perspective[J]. J Anim Sci, 1993, 71(9): 2556-2562.
[4] 唐爱民, 万长寿. 棉株不同部位棉酚含量及其与表型的相关分析[J]. 中国棉花, 1985, (6):20-22 .
[5] 胡承阅, 蒋婵华. 已知棉酚的生物学活性及作用机理[J].国际生殖健康/计划生育杂志, 1997, (2):68-72.
[6] Blauwiekel R, Xu S, Harrison J H, et al. Effect of whole cottonseed, gossypol, and ruminally protected Lysine supplementation on milk yield and composition[J]. J Dairy Sci, 1997, 80: 1358-1365.
[7] 吐尔逊帕夏. 棉籽壳对雄性新疆细毛羊繁殖机能的影响[D]. 杭州: 浙江大学, 2010.
[8] 潘晓亮. 棉粕和棉籽壳诱发雄性新疆细毛羊尿石症的研究[D]. 杭州: 浙江大学, 2010.
[9] Albrecht J E, Clawson A J, Smith F H. Rate of depletion and route of elimination of intravenously injected gossypol in swine[J]. J Anim Sci, 1972, 35(5):941-946.
[10] 卢智文. 日粮中棉酚含量计算方法及安全限量[J]. 中国饲料, 1996, (24):33-34.
[11] 孙延鸣, 张高轩, 周林. 反刍家畜棉酚中毒的诊治[J]. 黑龙江畜牧兽医, 2004, (4): 40-40.
[12] 钟荣珍. 日粮添加全棉籽对泌乳早期奶牛生产性能及乳脂组成的影响[D]. 保定: 河北农业大学, 2007.
[13] 顾芝萍, 章仁安, 王益鑫. 低剂量棉酚男性避孕效果和副作用的临床观察[J]. 生殖与避孕, 1994, 14(1):13-18.
[14] Ewing W N. The Feeds Directory: Commodity Products Guide[M]. Ashby de la Zouch U K: Context Publications, 1998: 118.
[15] Colinnegrete J, Kiesling H E, Ross T T, et al. Effect of whole cottonseed on serum constituents, fragility of erythrocyte cells, and reproduction of growing Holstein heifers[J]. J Dairy Sci, 1996, 79(11):2016-2023.
[16] 冯仰廉, 王燕兵. 棉籽对反刍动物的营养价值和代谢(续) [J]. 饲料研究, 2011, (5):12-14.
[17] 李坤, 赵红波, 宋恩亮, 等. 全棉籽对阉牛育肥性能、胴体性状及肉质的影响[J]. 畜牧兽医学报, 2012, 43(10):1582-1588.
[18] Hungate R E, Macy J. The roll-tube method for cultivation of strict anaerobes[J]. Methods Microbiol, 1969, 3B: 117-132.
[19] 候彩云. 棉酚对绵羊瘤胃微生物种群及纤维物质降解的影响[D]. 呼和浩特: 内蒙古农业大学, 2012.
[20] Yin J, Jin L, Chen F, et al. Novel O-glycosidic gossypolisomers and their bioactivities[J]. Carbohydrate Res, 2011, 346(14): 2070-2074.
[21] Dao V T, Dowd M K, Martin M T, et al. Cytotoxicity of enantiomers of gossypol Schif f’s bases and optical stability of gossypolone[J]. Eur J Med Chem, 2004, 39(7): 619-624.
[22] 斯热吉古丽·阿山, 艾尼瓦尔·艾山, 崔卫东, 等. 七种脱毒法对棉副产品的脱毒效果比较——根据游离棉酚含量分析[J]. 黑龙江畜牧兽医, 2016, (1): 132-134.
[23] 李玲, 刘玉秀, 汪清民. 棉酚的结构衍生及构效关系研究进展[J]. 中国科技论文, 2015, (12):1351-1357.
[24] Radominskapandya A, Bratton S M, Redinbo M R, et al. The crystal structure of human UDP-glucuronosyltransferase 2B7 C-terminal end is the first mammalian UGT target to be revealed: the significance for human UGTs from both the 1A and 2B families[J]. Drug Metab Rev, 2010, 42(1): 133-144.
[25] 刘移民, 王翔朴. 细胞色素氧化酶P450研究新进展[J].毒理学杂志, 2000, 14(4): 243-246.
[26] Krempl C, Sporer T, Reichelt M, et al. Potential detoxification of gossypol by UDP-glycosyltransferases in the two Heliothine moth species Helicoverpa armigera and Heliothis virescens[J]. Insect Biochem Mol Biol, 2016, 71: 49-57.
[27] Gonzalez F J. The molecular biology of cytochrome P450s[J]. Pharmacol Rev, 1988, 40(4):243-288.
[28] 郑明奇. 棉铃虫细胞色素P450的诱导、纯化及其性质研究[D]. 北京: 中国农业大学, 2003.
[29] Celoriomancera M D L P, Ahn S J, Vogel H, et al. Transcriptional responses underlying the hormetic and detrimental effects of the plant secondary metabolite gossypol on the generalist herbivore Helicoverpa armigera[J]. BMC Genomics, 2011, 12(1): 84-87.
[30] 张辉, 蔡顺养. 谷胱甘肽转移酶[J]. 国外医药抗生素分册, 1993, (1): 54-59.
[31] 祝水金, 季道藩, 刘胜安, 等. 棉花色素腺体和棉酚对棉铃虫生长发育和抗药性的影响[J]. 中国农业科学, 2001, 34(2): 157-162.
Gossypol’s Toxicity and Its Microbial Detoxification Mode in Ruminants: A Review
WANG Wei-kang1, YANG Hong-jian1*, XING Ya-Liang2, YANG Kai-lun3, LI Sheng-li1
(1. State Key Laboratory of Animal Nutrition, College of Animal Science & Technology, China Agricultural University, Beijing 100193, China; 2. Grass and Forage Station of Shanxi Provine, Shanxi Taiyuan 030001, China; 3.College of Animal Science & Technology, Xinjiang Agricultural University, Xinjiang Urumuqi 830052, China)
Cotton by-products, including whole cottonseeds, cottonseed hulls, cottonseed meal, etc. have been extensively used as important feed resources for livestock and poultry in China. Although ruminants in comparison with monogastric animals are believed to be relatively tolerant to gossypol toxicity of cottonseed by-products, so far it is not quite clear about microbial gossypol detoxification mode in the rumen. Regarding the harm of gossypol, its possible chemical and microbial detoxification modes were reviewed and discussed with aim to provide references for better understanding gossypol detoxification in ruminant animals.
Ruminant animal; Gossypol toxicity; Microbial detoxification
S816
A
10.19556/j.0258-7033.2017-06-015
2016-12-02;
2017-01-05
中国农业大学-新疆农业大学科研合作基金
王炜康(1994-),男,四川巴中人,在读硕士,主要从事反刍动物营养研究,E-mail: 18292092306@163.com
* 通讯作者:杨红建,E-mail:yang_hongjian@sina.com
