GPR30在三阴性乳腺癌内分泌治疗中的意义
2017-06-06范国宇
范国宇
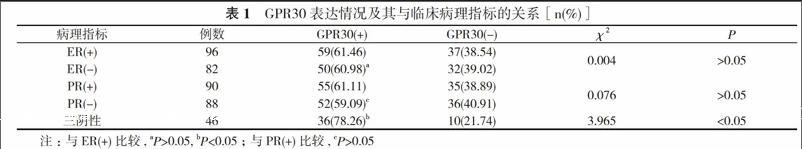
【摘要】 目的 研究G蛋白耦联受体30(GPR30)在三阴性乳腺癌中的表达及意义。方法 收集178例病理诊断为乳腺癌患者的病理标本, 进行免疫组化染色, 分析GPR30表达情况及其与临床病理指标的关系。结果 雌激素受体(ER)(+)患者GPR30表达率61.46%与ER(-)患者表达率60.98%比较, 差异无统计学意义(P>0.05);孕激素受体(PR)(+)患者GPR30表达率61.11%与PR(-)患者表达率59.09%比较, 差异无统计学意义(P>0.05);GPR30与ER、PR在乳腺癌患者中的表达是相互独立的, 作为独立因素存在。三阴性乳腺癌患者GPR30表达率78.26%与ER(+)患者比较, 差异具有统计学意义 (P<0.05)。结论 GPR30是预测三阴性乳腺癌患者预后的生物学标志物, GPR30在三阴性乳腺癌内分泌治疗中具有重要作用。
【关键词】 G蛋白耦联受体30;内分泌治疗;三阴性乳腺癌
DOI:10.14163/j.cnki.11-5547/r.2017.12.014
【Abstract】 Objective To study the expression and significance of G protein-coupled receptor 30 (GPR30) in triple-negative breast cancer. Methods Pathological specimen of 178 breast cancer patients confirmed by pathological diagnosis were collected for immumohistochemical staining, and analysis were made on GPR30 expression situation and its relation to clinical indicators. Results Estrogen receptor (ER)(+) patients had no statistically significant difference in GPR30 expression rate as 61.46% comparing with 60.98% in ER(-) patients (P>0.05). Progestrone receptor (PR)(+) patients had no statistically significant difference in GPR30 expression rate as 61.11% comparing with 59.09% in PR(-) patients (P>0.05). GPR30 and ER, PR were mutually independent in expression of breast cancer, and they existed as independent factors. Triple-negative breast cancer patients had statistically significant difference in GPR30 expression rate as 78.26% comparing with ER(+) patients (P<0.05). Conclusion GPR30 is a biology marker in predicting prognosis of triple-negative breast cancer, and it plays an important role in endocrinotherapy of triple-negative breast cancer.
【Key words】 G protein-coupled receptor 30; Endocrinotherapy; Triple-negative breast cancer
三陰性乳腺癌(triple-negative breast cancer, TNBC)占乳腺癌的15%~20%, 病死率是ER阳性患者的2倍, 三阴性乳腺癌不表达ER、PR以及人表皮生长因子受体-2(HER-2), 缺乏内分泌治疗、靶向治疗的指征, 术后以化疗为主要治疗手段, 与非三阴性类型的乳腺癌比较, 复发转移率高, 总体生存率低[1]。G蛋白耦联受体30(G protein-coupled receptor 30, GPR30)属于G蛋白耦联受体家族, 是一种膜性结合性雌激素受体, 参与乳腺癌细胞增殖、侵袭和转移等行为。2013年有报道GPR30和三阴性乳腺癌高度相关, 与高复发率有关[2]。
1 资料与方法
1. 1 一般资料 本研究收集本院2005~2015年病理诊断为乳腺癌的178例患者病理标本, 平均随访时间48个月, 其中ER(+)患者96例、 ER(-)患者82例, PR(+)90例、PR(-)88例, 其中三阴性患者46例。
1. 2 实验方法 取178例患者病理标本石蜡切片进行常规脱蜡、水洗后抗原修复, 用3%的H2O2封闭15 min, PBS漂洗后用正常山羊血清封闭30 min, 室温孵育1 h, PBS漂洗, 用硫酸镍铵显色5 min, 酒精脱水、二甲苯透明、中性树胶封片, 空白对照用PBS取代一抗。在解剖镜下选取免疫阳性区域, 放入2.5%戊二醛于4℃固定2 h, PBS漂洗, 1%锇酸后固定, 捞于有支持膜的200目镍网上, 醋酸双氧铀-枸橼酸铅染色, 每组免疫组化染色切片选取15张, 显微镜观察。
1. 3 评分标准 参照ER免疫组化评分系统, 每张切片选取5个高倍视野进行记数, 阳性细胞的百分率(A):<1%为1分;1%~10% 为2分;11%~33% 为3分;34%~66% 为4分;67%~100%为 5分。染色程度(B):全部细胞阴性为0分;染色细胞弱阳性为1分;中等阳性为2分;强阳性为3分;(A)+(B)总和5~8分, 为抗原表达阳性, 否则为阴性。
1. 4 统计学方法 采用SPSS18.0统计学软件进行统计分析。计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
ER(+)患者GPR30表达率61.46%与ER(-)患者表达率60.98%比较, 差异无统计学意义(P>0.05);PR(+)患者GPR30表达率61.11%与PR(-)患者表达率59.09%比较, 差异无统计学意义(P>0.05);GPR30与ER、PR在乳腺癌患者中的表达是相互独立的, 作为独立因素存在。三阴性乳腺癌患者GPR30表达率78.26%与ER(+)患者比较, 差异具有统计学意义 (P<0.05)。见表1。
3 讨论
三阴性乳腺癌是高度异质性乳腺癌亚型, 复发转移率高, 目前欠缺有效的辅助治疗手段, 仅有的全身细胞毒性化疗难以取得满意的效果, 治疗手段有限[3]。本研究中GPR30在三阴性乳腺癌表达异常升高, 是乳腺癌预后不佳的生物指标, 也提示这种独立作用的雌激素受体很有可能在三阴性乳腺癌患者的不良预后中扮演重要角色[4]。
研究表明雌激素和抗雌激素药物[三苯氧胺(TAM)等] 可活化GPR30信号发挥效应, 与激活EGFR/ERK转导通路有关[5-8]。有临床试验应用雌激素处理细胞周期中位于S期的DNA量明显高于对照组, 增殖能力明显提高, 其促生长效应被GPR30特异性拮抗剂G15阻断, 说明雌激素可活化GPR30促进三阴性乳腺癌细胞系的增殖[9-13]。研究证明EGFR特异性抑制剂AG1478、GPR30特异性抑制剂G15, ERK特异性抑制剂U0126靶向抑制GPER/EGFR/ERK信号通路, 可以降低三阴性乳腺癌转移、侵袭能力[5, 14], 已有肿瘤相关成纤维细胞中结缔组织生长因子及 MMPs 等分子的药物进入Ⅲ期临床试验, 有待于进一步临床研究。
综上所述, GPR30是预测三阴性乳腺癌患者预后的生物学标志物, GPR30在三阴性乳腺癌内分泌治疗中具有重要作用。
参考文献
[1] Girgert R, Emons G, Griindker C. Inactivation of GPR 30 reduces growth of triple-negative breast cancer cells: possible application in targeted therapy. Breast Cancer Res Treat, 2012, 134(1):199-205.
[2] Steiman J, Peralta EA, Louis S, et al. Biology of the estrogen receptor, GPR30, in triple negative breast cancer. Am J Surg, 2013, 206(5):698-703.
[3] Wei W, Chen ZJ, Zhang KS, et al. The activation of protein-coupled receptor 30 (GPR30) inhibits proliferation of estrogen receptor-negative breast cancet cells in vitro and in vivo. Cell Death Dis, 2014, 2(5):e1428.
[4] Catalano S, Giordano C, Panza S, et al. Tamoxifen through GPER upregulates aromatase expression: a novel mechanism sustaining tamoxifen-resistant breast cancer cell growth. Breast Cancer Res Treat, 2014, 146(2):273-285.
[5] Elbaz M, Nasser MW, Ravi J, et al. Modulation of the tumor microenvironment and inhibition of EGF/EGFR pathway: novel anti-tumor mechanisms of Cannabidiol in breast cancer. Mol Oncol, 2015, 9(4):906-919.
[6] 余騰骅, 罗浩军, 严玉钊, 等. GPR30介导雌激素对三阴性乳腺癌MDA-MB-468细胞系增殖的影响. 第三军医大学学报, 2014, 36(14):1467-1471.
[7] 余腾骅, 王智亮, 赵晨晖, 等. 雌激素激活GPR30/ERK通路促进三阴性乳腺癌MDA-MB-468细胞迁移及侵袭. 第三军医大学学报, 2014, 36(20):2077-2082.
[8] 赵晨晖, 余腾骅, 涂刚. 雌激素受体GPER在乳腺癌中的研究现状. 肿瘤防治研究, 2015, 42(12):1248-1252.
[9] 朱克鹏, 杨光伦, 涂刚. GPR30在乳腺癌内分泌治疗耐受中的作用研究. 中国癌症杂志, 2011, 21(8):648-653.
[10] 朱克鹏. GPR30在原发及复发性乳腺癌中的表达和意义. 重庆医科大学, 2012.
[11] 杨玉华, 娄丹, 吕小梅. 乳腺癌中雌激素受体GPR30与ER、PR及HER2的相关性. 实用医学杂志, 2015(17):2854-2856.
[12] 罗浩军. GPR30、CTGF及FN在乳腺癌中的表达与意义. 重庆医科大学, 2010.
[13] 阮姝琴. 重组人Heregulin-β1上调GPR30表达及对乳腺癌生物学行为影响的研究. 浙江大学, 2012.
[14] 陈花, 马海蓉. 乳腺癌治疗新靶点GPER1研究进展. 中华肿瘤防治杂志, 2014, 21(12):959-964.
[收稿日期:2017-02-15]
