猕猴骨盆性差研究
2017-06-05王凤产胡海洋赵晓进
王凤产, 胡海洋, 赵晓进
(河南师范大学 水产学院, 河南 新乡 453007)
猕猴骨盆性差研究
王凤产, 胡海洋, 赵晓进*
(河南师范大学 水产学院, 河南 新乡 453007)
探讨太行山猕猴骨盆性差特征.材料方法:成年猕猴骨盆标本41例(雄19例,雌22例),选择骨盆变量11个,同时测量颅长和股骨长;数据处理采用SPSS 22.0统计软件,统计处理采用ANOVA、ANCOVA、POWER、PCA和Logistic回归分析.结果:成年猕猴骨盆有明显的性差,单因素方差分析结果显示颅长、股骨长和坐骨长雄性明显大于雌性;但是耻骨长、骨盆入口变量和骶骨宽等雌性明显大于雄性.骨盆变量PCA提取2个因子,解释了总变异的72.55%.结果显示骨盆提取的2个因子都有一定的性别识别能力.二元逻辑回归检验2个因子的性别正确判别率是92.7%,F1和F2分别是82.9%和73.2%.猕猴骨盆性差结果提示雌性骨盆性差主要与分娩选择压力有关,尤其是考虑到猕猴具有相对较大的新生儿头颅时.
猕猴; 骨盆; 性差; ANCOVA; PCA
研究现生非人灵长类生长发育和功能形态学时,骨盆的形态特征,包括性差、变异性和不对称性等,一直受到国内外学者的广泛关注[1-3].雌性哺乳动物的骨盆除了支撑身体、传递动力、保护脏器和行走运动的功能以外,骨盆还作为生殖的通道参与繁殖后代,这些功能会明显的影响到雌性动物骨盆的形态结构[4-6].
S.Karen[7]研究发现几乎所有灵长类的耻骨长与整个骨盆大小有密切和特殊的关系;F.Marchal[8]研究发现南方古猿与现代人行走姿态不同从而导致它们的骨盆形态有显著差异;R.G.Tague[2]报道了12个灵长类种群的骨盆和股骨性差的相互关系,指出大部分灵长类的骨盆初始发育趋势是朝着雌性骨盆形态结构的特征发育,在青春期发育过程中,由于雄激素的作用使雄性动物的骨盆改变了原来的发育方向,形成了雄性骨盆的特有形态结构[9];但是,P.D.Gingerich[9]报道成年雌性松鼠猴(Saimirisciureus)骨盆的特有结构是在青春期以后获得的,未成年松鼠猴的骨盆是没有性差的,未成年雌雄骨盆的形态与成年雄性骨盆结构相似;胡凤霞等[6]最近报道了太行山猕猴(Macacamulatta)耻骨、坐骨与髂骨的异速生长.
太行山猕猴分布在豫、晋两省交界太行山南段,目前为我国野生猕猴自然分布最北界种群之一,具有特殊的地理分布[10].
本文主要通过协方差分析探讨骨盆不同变量性差特征.通过PCA降维处理,将原始数据简化为少数因子进行命名和解释;通过Logistic回归探讨各因子的性别正确判别率,为非人灵长类基础理论研究与资源保护利用积累更多资料.
1 材料和方法
1.1 材料 骨骼材料来自河南省北部太行山猕猴自然保护区.标本获得在1990—2016年.现保存在河南师范大学生命科学学院.成年骨盆、颅骨和股骨标本41例(雄19,雌22).标本干燥、对称、生长发育健康和完整无缺.标本的性别已知,根据骨骺愈合情况推测标本都是成年.
1.2 选择变量和测量 依据有关资料选择骨盆变量[5-6].测量变量13个(骨盆变量11个,颅长和股骨长),测量位点见图1,颅长和股骨长见文献[2].测量所用工具为电子数显卡尺,分辨力:0.01 mm.数据测量由本文第一作者独立完成.
图1 骨盆变量测量(雌性, No.609)
Fig. 1 Measurements of pelvis (female, No: 609)
1.3 数据处理 数据处理采用SPSS 22.0统计软件.为消除各变量绝对值大小的影响,所有测量数据经过自然对数转换[11].性差检验采用单因素方差分析(ANOVA)和单因素协方差分析(ANCOVA).SPSS协方差分析通过一般线性模式来完成.协方差分析时颅长为协变量,性别为固定因子,其他12个变量为因变量.因变量中股骨长作为非骨盆变量,用于比较其他骨盆变量.采用的协方差分析目的是排除协变量(颅长或身体大小)的影响,再研究性别因素对各个因变量的影响[12-13].异速生长模型选择幂函数表达式:y=axb.a为异速生长常数,b为异速生长指数.当a=1时为等速生长,当a>1和a<1 时分别为正异速生长和负异速生长[11].采用PCA可以从众多的原始变量中提取少数几个综合变量,使其包含原始变量提供的大部分信息,使数据降维[12].性别判别分析采用二元Logistic 回归模型,计算出各个因子性别的正确判别率.
2 结果
2.1 形态特征的性差 雌雄之间的单因素方差分析和协方差分析结果见表1.

表1 对数转换后颅长为协变量的雌雄之间的协方差分析
注:*:P<0.05; **:P<0.01; ***:P<0.001; ns:P>0.05.
结果表明:1) 颅长为协变量,其他为因变量,性别为固定因子,回归斜率(b)差异性检验表明不同性别的2条回归线是否存在交互作用;2) 单因素方差分析(ANOVA)结果显示性差主要表现在颅长、股骨长和坐骨高上(P<0.01),太行山猕猴骨盆整体上是雄性大于雌性;3) 协方差分析(ANCOVA)性差较大的变量表现在耻骨长、入口矢径、出口横径和骶骨宽,这些变量明显与雌性猕猴繁殖行为有关;4)不同的统计学方法骨盆变量性差结果截然不同,包括性差的大小、分布和方向.
2.2 骨盆变量异速生长
根据ANCOVA结果,选择出6个性差较大的骨盆变量进行异速生长分析(表2).异速生长回归结果显示:1) 总体上异速生长拟合效果并不是很好.雄性组异速生长模型的决定系数R2=0.458,范围:0.213~0.620;雌性组异速生长模型R2=0.367,范围:0.156~0.604.2) 不同性别异速生长的拟合结果不同.雄性组的6个变量中,3个是正异速生长,3个是负异速生长;雌性组的6个变量都是正异速生长,例如:骨盆入口矢径(EG)雄性是负异速生长(b=0.562),雌性是正异速生长(b=1.212).3) 不同变量异速生长的拟合结果也不同.例如:耻骨长(GJ)是正异速生长,但是,异速生长的速率是不同的(雄:b=1.154,雌:b=2.092).

表 2 性差显著的骨盆变量与颅长异速生长模型汇总、参数估计和F检验
注:*:P<0.05; **:P<0.01; ***:P<0.001.
2.3 PCA结果 原始数据进行对数转换,PCA提取2个因子,解释了总变异的72.55%(表3).PCA的KMO检验为0.786.Bartlett的球形度检验,卡方值=520.33,P=0.000.结果显示该数据适合进一步做因子分析.因子载荷选用临界值>0.600,将13个原始变量提取2个因子(表4).因子F1包含7个变量(CL、FL、HI、JI、CC、HJ和EF),这些变量在F1轴上取值较大.因子F2包含6个变量,即AA、BB、DD、GJ、EG和FG,这些变量在F2轴上取值较大.2个因子得分值散点图分布见图2.考虑到F1和F2因子都可能与性别有关,分别对F1和F2因子得分值进行单因素方差分析.结果表明:F1和F2因子得分值性差有统计学意义.
2.4 性别判别分析 采用F1与F2因子得分值进行二元Logistic回归分析(表5).结果显示:F1和F2因子逻辑回归性别检验的正确判别率分别是82.9%和73.2%.2个因子合并后逻辑回归性别检验的正确判别率是92.7%,说明2个因子都有一定的性别识别能力.

表 3 PCA结果
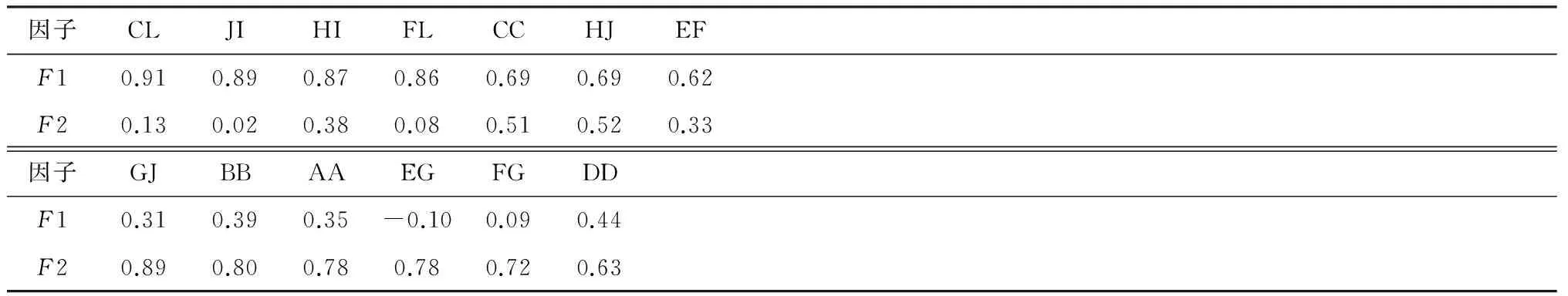
表 4 PCA旋转成份矩阵


图 2 经最大方差法旋转后各因子分析载荷图
3 讨论
舒尔茨提出一些灵长类动物骨盆的性差发育是一种特殊的发育机制,无论是绝对量度还是相对量度雌性骨盆的某些变量都大于雄性[1].雌性拥有较大的骨盆是因为她们要繁殖后代.为了保证新生胎儿的顺利分娩,通过自然选择或定向选择,可以部分解释雌性骨盆明显大于雄性骨盆的原因[15-18].进一步研究发现并不是所有骨盆的性差都与分娩功能的选择压力有关.许多雌性灵长类动物的骨盆容量与新生胎儿的大小并没有严格的对应关系[1].胡凤霞等报道了太行山猕猴髋骨性差和异速生长,结果表明骨盆大部分变量是雄性大于雌性,少部分变量是雌性大于雄性[6].
ANCOVA结果显示,猕猴骨盆一些变量显示出明显的性差.这些变量性差方向与颅长性差方向相反.这里用颅长(协变量)代替动物身体大小[6,19],例如:当颅长=125.64 mm时,因变量耻骨长均值:雄=52.14 mm,雌=61.01 mm(ANCOVA:F=33.61,P<0.001).
PCA个数的确定是根据特征根的大小.这里提取了2个因子,解释的累积方差达72.55%(表3).可以看出累积方差并不是很高,因为这里研究的目的主要是雌雄骨盆的性差比较,PCA提取的少数因子总是有一些原始信息会损失掉.这些可以由其他一些影响因素来解释,例如,种群差异、营养差异或个体差异等.这一点与以前的研究资料报道是一致的[6,20].PCA选择了Kaiser标准化最大方差法进行因子选择.旋转后每个因子上的载荷分配更加清晰,更容易解释各个因子的含义(表4).因子1包含的主要变量有4个,分别是颅骨长、股骨长、坐骨高和骨盆最大高,结果提示这4个变量可以代表猕猴个体的大小,可以命名为骨盆体型因子.这些因子性差大小与猕猴体重性差大小一致.推测主要受基因、异速生长和性别选择因素的影响[21].因子2中包含的主要变量有4个,分别是耻骨长、骨盆入口横径、骶骨宽和骨盆入口矢径(图1).很明显这些变量都与猕猴生殖功能关系密切,是雌性大于雄性,可以命名为骨盆繁殖因子.
R.G.Tague[2]解释了灵长类骨盆正常发育的趋势是具有成年雌性骨盆的形态特征,青春期发育过程中,由于雄激素促进和抑制骨盆的某些结构异速生长,雄性的骨盆生长改变了原来生长发育的方向或轨迹,从而发育为雄性骨盆,当然雄激素也会影响颅骨和股骨的性差发育[2].
观察表4和图2,发现有几个骨盆变量的因子载荷比较特殊.这些变量是骨盆最大宽、髂骨高和骨盆中段矢径.它们位于因子1和因子2之间.这些变量既与个体体型大小有关又与骨盆繁殖结构有关.推测这些变量受到动物个体体型大小和骨盆繁殖定向选择的交互作用,处于一种“折中”或“妥协”的交互作用[15].这些变量也可以单列一类,作为交互因子.
这里采用二元Logistic回归来探讨各因子的性差.目的是1) 比较2个因子性差的大小;2) 探讨二元Logistic判别函数的判别效果.Logistic回归分析表明2个因子都存在性差.F1和F2的性别正确判别率分别是82.9%和73.2%.2个因子合并后性别正确判别率是92.7%,具有较高的判别率.通过二元逐步Logistic回归分析,结果显示F1和F2都被选择进入模型,首先选择进入模型的变量是F1.说明总体上F1仍然是性别识别的有效指标.采用多元回归判别分析结果与二元Logistic回归结果基本一致.回代检验和交互检验结果表明该判别函数比较稳定.
目前普遍认为,非人灵长类骨盆性差很可能与个体性差大小和头盆比例有关,首先与分娩选择压力有关,尤其是猕猴具有相对较大的新生儿头颅,就像松鼠猴和长鼻猴那样的骨盆大小.松鼠猴和长鼻猴的共同特征是骨盆性差显著,同时头盆比例指数较高.猕猴、松鼠猴和长鼻猴头盆比例分别是0.98、1.33和0.95[16],所对应的体重性差指数分别是:0.74、0.85和0.57,猕猴体重性差指数位于两者之间.结果说明头盆比例至少是限制雌性骨盆大小的因素之一.因为胎儿不可能无限生长,骨盆也不可能无限扩张;体重性差大小一般与骨盆性差大小无关[21].另外,还有一种可能是雄性选择理论.当雌性面临着分娩困境时,雄性选择较窄的骨盆,使其运动起来更省力、快捷.既有利于获取食物,又有利于逃避天敌,躲避灾害[6,15].
本研究是太行山猕猴骨盆性差系列研究之一,与以前骨盆相关研究是不同的:1) 本研究通过ANCOVA和PCA来探讨骨盆性差,包括与颅长和股骨长的关系,以及骨盆内不同变量之间的关系,这一点在以前的研究中不曾提到;2) 研究方法的改进,通过因子分析和逻辑回归分析进一步讨论了各个因子的性差特征;3) 标本数量和测量工具精度增加,有效地提高了研究结果的精确性和准确性.例如:雄性骨盆标本从原来的9例增加到现在的19例.另外,对变量的选择和结果的分析讨论中,又查阅了近些年有关灵长类骨盆研究资料,信息和方法的改进使得该项研究更加系统和深入.
这里选择的变量还有一定的局限性,骨盆变量的类型除了量度变量以外,还有骨盆非测量性状-耻骨下角形状[9]、坐骨-耻骨指数等[18];这里用颅长代表体型大小也会出现一些误差,R.G.Tague[2]曾指出灵长类股骨长度和股骨头直径不能代替体重,因为有一些灵长类的股骨长度存在性差,而所对应的体重却没有性差;异速生长模型这里选择的是幂函数,实际上描述动物生长的非线性模型有许多种,并非是一个标准的生长模型.
致谢 河南师范大学博士科研启动课题资助(5102109179103)对本文给予了资助,谨致谢意.
[1] SCHULTZ A H. Sex differences in the pelves of primates[J]. Am J Physical Anthropology,1949,7(3):401-424.
[2] TAGUE R G. Big-bodied bales help us recognize that females have big pelves[J]. Am J Physical Anthropology,2005,127(4):392-405.
[3] TAGUE R G. Variation in pelvic size between males and females[J]. Am J Physical Anthropology,1989,80(1):59-71.
[4] TAGUER G. Variation in pelvic size between males and females in nonhuman anthropoids[J]. Am J Physical Anthropology,1995,97(3):213-233.
[5] 赵晓进. 太行山猕猴髋骨变量研究初报[J]. 人类学学报,2003,22(1):69-74.
[6] 胡凤霞,赵晓进,赵哲,等. 太行山猕猴髋骨异速生长和性别判定研究[J]. 人类学学报,2015,34(3):417-424.
[7] KAREN S. Sexual dimorphism and allometry in primate ossa coxae[J]. Am J Physical Anthropology,1981,55(2):209-215.
[8] MARCHAL F. A new morphometric analysis of the hominid pelvic bone[J]. J Human Evolution,2000,38(3):347-365.
[9] GINGERICH P D. The development of sexual dimorphism in the bony pelvis of the squirrel monkey[J]. Anatomical Record,1972,172(3):589-595.
[10] 赵晓进,多甜,田华香,等. 太行山猕猴腕骨形态与性差[J]. 河南师范大学学报(自然科学版),2016,44(3):110-113.
[11] MOBB G E, WOOD B A. Allometry and sexual dimorphism in the primate innominate bone[J]. Am J Anatomy,1977,150(4):531-537.
[12] 李昕,张明明. SPSS 22.0统计分析从入门到精通[M]. 北京:电子工业出版社,2015.
[13] LEUTENEGGER W. Functional aspects of pelvic morphology in simian primates[J]. J Human Evolution,1974,3(3):207-222.
[14] RUSK K M, OUSLEY S D. An evaluation of sex-and ancestry-specific variation in sacral size and shape using geometric morphometrics[J]. Am J of Physical Anthropology,2016,159(4):646-654.
[15] MOFFETT E A, MADDUX S D, WARD C V. Sexual dimorphism in relative sacral breadth among catarrhine primates[J]. Am J Physical Anthropology,2013,152(4):435-446.
[16] TOJIMA S. Tail length estimation from sacrocaudal skeletal morphology in catarrhines[J]. Anthropological Science,2013,121(1):13-24.
[17] BENAZZI S, MAESTRI C, PARISINI S, et al. Sex assessment from the sacral base by means of image processing[J]. J Forensic Sciences,2009,54(2):249-255.
[18] BLACK E S. Sexual dimorphism in the ischium and pubis of three species of South American Monkeys[J]. J Mammalogy,1970,51(4):794-796.
[19] WOOD B A, CHAMBERLAIN A T. The primate pelvis:allometry or sexual dimorphism?[J]. J Human Evolution,1986,15(4):257-263.
[20] TAGUE R G. Costal process of the first sacral vertebra:sexual dimorphism and obstetrical adaptation[J]. Am J Physical Anthropology,2007,132(3):395-405.
[21] STEUDEL K. Sexual dimorphism and allometry in primate ossa coxae[J]. Am J Physical Anthropology,1981,55(2):209-215.
(编辑 郑月蓉)
Sexual Dimorphism of the Pelvis inMacacamulatta
WANG Fengchan, HU Haiyang, ZHAO Xiaojin
(CollegeofFisheries,HenanNormalUniversity,Xinxiang453007,Henan)
Aim of this study is to explore sexual dimorphism of the pelvis inMacacamulattafrom the Taihang Mountains. Skeletal pelves of 41Macacamulatta(19 males and 22 females) were examined and eleven measurements of the pelvis, together with the measure of cranial and femoral lengths, were selected. All the statistics were computed with SPSS for Windows (v. 22.0). Data were subjected to ANOVA, ANCOVA, Power, PCA and Binary logistic regression analysis. Results showed that the sex differences were very pronounced in the pelvis of adultMacacamulatta, as had been amply demonstrated. The means of the cranial, femoral, ischial lengths, etc., were significantly greater in males than females using analysis of variance (ANOVA); but the means of pubis lengths, parameters of the pelvic inlet, sacral breadth, etc., were significantly greater in females than in males using analysis of covariance (ANCOVA). PCA for these pelvis measurements extracted two factors that explained 72.55% of the variance. The results of this study indicated that both factors of pelvis were useful for sex assessment. UsingF1 andF2 scores by Binary logistic regression analysis, the overall combined accuracy was 92.7%, versus 82.9% and 73.2% forF1 andF2 scores respectively. The presence of sexual dimorphism in the pelvis ofMacacamulattamainly attributed to obstetric selection, particularly when considered with the relatively large neonatal skull.
Macacamulatta; pelvis; sexual dimorphism; ANCOVA; PCA
2016-09-06
河南省重点科技攻关项目(172102310721)
Q954
A
1001-8395(2017)03-0361-06
10.3969/j.issn.1001-8395.2017.03.016
*通信作者简介:赵晓进(1957—),男,教授,主要从事进化生物学的研究,E-mail: zxj_6119@163.com
