中国对虾虾壳制备几丁质工艺研究
2017-06-05郭雪松张冬阳
柏 韵,李 然,张 振,郭雪松,张冬阳
(锦州医科大学食品科学与工程学院,辽宁锦州 121000)
中国对虾虾壳制备几丁质工艺研究
柏 韵,李 然,张 振*,郭雪松*,张冬阳
(锦州医科大学食品科学与工程学院,辽宁锦州 121000)
本实验以中国对虾虾壳为原料制备几丁质,利用柠檬酸脱钙、蛋白酶脱除蛋白质,通过对蛋白酶活力测定,本实验选用Alcalase碱性蛋白酶进行实验。通过单因素实验和Box-behnken响应面设计优化几丁质的最佳制备条件,以灰分含量为脱钙指标,得到柠檬酸脱钙最佳工艺条件为:固液比1∶12,反应时间2.5 h,柠檬酸浓度为8%,灰分含量为0.42%。以蛋白质含量为指标,测得碱性蛋白酶脱蛋白的最佳工艺条件为:加酶量2200 U/g,反应时间5 h,反应温度50 ℃,脱除的蛋白质浓度可达到31.42%。本实验条件温和、反应迅速、无环境污染,符合我国绿色无公害理念,为工业化生产几丁质提供基础。
几丁质,柠檬酸,蛋白酶,响应面,最佳工艺
几丁质,常用名甲壳素,作为天然的碱性多糖广泛地存在于自然界中。几丁质和其衍生物有着“第六大生命要素”的美名。几丁质自然生成量很大,每年约为10 亿t以上,仅次于纤维素。几丁质在虾、蟹甲壳中含量较高,约为10%~30%,是自然界中少见的带正电荷的可食性动物纤维素。几丁质可以抑制细菌生长,可降解,与生物有良好的相容性,因此在医学、药学、食品、化工等各个领域倍受青眯[1-2]。
几丁质主要从虾、蟹壳中提取,通过脱蛋白、脱钙、脱脂等过程制备,目前除钙、除蛋白质的方法主要是利用盐酸和NaOH溶液[3],此过程不仅耗时较长,在生产过程中会有大量废液的生成,对环境影响严重[4]。因此本实验选用柠檬酸代替盐酸,同时利用酶反应条件的温和性及高效性,在较短时间内脱除蛋白质,此方法保留几丁质原有的结构,同时保护环境。
因此,本实验以中国对虾虾壳为原料,对柠檬酸脱钙、蛋白酶脱蛋白质进行工艺优化,通过响应面设计得到制备几丁质的最佳工艺条件。
1 材料与方法
1.1 材料与仪器
中国对虾 锦州海鲜市场;Alcalase碱性蛋白酶、木瓜蛋白酶、Dispase分散酶、福林酚试剂、牛血清蛋白 BIOSHARP公司;柠檬酸、酪氨酸、碳酸钠、三氯乙酸、过氧化氢、乙醚等试剂 分析纯。
恒温水浴锅 天津市泰斯特仪器有限公司;UV-6300型紫外可见分光光度计 上海美谱达仪器有限公司;pHs-3B型精密pH计 上海雷磁仪器有限公司;分析天平 上海精密科学仪器有限公司;DHG-9140型电热恒温鼓风干燥箱 上海一恒科技有限公司;高速粉碎机 上海圣科仪器设备有限公司。
1.2 实验方法
1.2.1 工艺流程 酶法优化几丁质制备工艺流程:虾壳预处理→柠檬酸脱钙→水洗至中性→蛋白酶脱蛋白质→水洗至中性→乙醚脱脂→干燥→脱色→几丁质
1.2.2 原料预处理 将新鲜对虾洗净,去肉去杂质,45 ℃恒温水浴锅浸泡20 min,浸泡后的虾壳用清水洗至无内容物,晾干水分。将沥干水分的虾壳置于75 ℃的鼓风干燥箱中,干燥4 h。将充分干燥好的虾壳放入捣碎机内粉碎[5],虾壳粉备用。
1.2.3 灰分测定 参照国标GB 5009.4-2010《食品中灰分的测定》[6]。称取虾壳粉5 g,精确至0.0001 g,加入1 mL乙酸镁溶液(240 g/L)使试样完全润湿,放置10 min,在水浴锅上将水分蒸干。在电热板上以小火加热使试样充分炭化至无烟。置于马弗炉中550 ℃灼烧4 h,冷却至200 ℃左右。取出,放入干燥器中冷却30 min后称量,重复灼烧至前后两次称量相差不超过0.5 mg。做三组平行实验,取平均值。
1.2.4 水分测定 直接干燥法。准确称取5 g虾壳粉置于滤纸筒内,封好上口,在105 ℃烘箱中烘1 h,取出后放置于干燥器中备用。重复上述实验至称量前后两次称量相差不超过0.5 mg。参照GB 5009.3-2010食品中水分的测定[7]。
1.2.5 脂肪含量测定 索氏提取法。准确称取5 g虾壳粉置于滤纸筒内,封好上口,在105 ℃烘箱中烘1 h,以吸收滤纸包中的水分。取出后放置于干燥器中备用。具体测定方法参照国标GB/T 14772-2008食品中粗脂肪的测定[8]。做三组平行实验,取平均值。
1.2.6 蛋白质含量测定 在分析天平上准确称取5 g粉碎的虾壳,加入30 mL质量分数为4%的NaOH溶液,于温度95 ℃下水浴浸泡60 min,离心分离,滤渣重复上述实验,合并上清液,用凯氏定氮法测定上清液中的蛋白质含量。参照国标GB 5009.5-2010,食品中蛋白质的测定[9]。做三组平行实验,取平均值。
1.3 柠檬酸脱钙工艺优化
1.3.1 柠檬酸浓度对虾壳粉中灰分含量影响 选择固液比1∶10、反应时间3 h,分别加入浓度为 6、8、10、12、14 g/L 的柠檬酸对虾壳粉进行脱钙处理,测得灰分含量。
1.3.2 固液比对虾壳粉中灰分含量影响 反应时间为3 h、柠檬酸浓度10 g/L,测得固液比为1∶1、1∶5、1∶10、1∶15、1∶20 g/mL的灰分含量。
1.3.3 反应时间对虾壳粉中灰分含量影响 固液比1∶10,柠檬酸浓度10 g/L,分别测得反应2、2.5、3、3.5、4 h后的灰分含量。
1.3.4 响应面实验 为优化柠檬酸脱钙,在单因素的基础上,以柠檬酸浓度、固液比、反应时间为自变量,灰分含量为Y,运用响应面法设计实验。

表1 柠檬酸脱钙设计因素水平编码表
1.4 酶活力的测定
采用福林酚显色法[10-11],测得680 nm处的OD值并计算酶活力。酶活力定义为1 g固体酶粉,在一定温度和pH条件下,1 min水解酪素产生1 μg酪氨酸为1个活力单位,用U/g表示。
1.4.1 比色计常数K的测定 以酪氨酸溶液为标准,绘制标准曲线,其中以酪氨酸含量为横坐标,吸光度OD值为纵坐标。
1.4.2 样品测定 取1 mL酶稀释液,40 ℃下预热5 min,加入1 mL 2%酪蛋白溶液、2 mL 0.4 mol/L三氯乙酸,沉淀15 min,过滤,取滤液1 mL,加5 mL 0.4 mol/L碳酸钠、1 mL福林酚试剂,40 ℃恒温水浴显色20 min,680 nm处比色。同时做空白实验。
1.5 酶解法脱蛋白质工艺优化
1.5.1 福林酚法测蛋白质 取7支试管,分别加入0、0.1、0.2、0.4、0.6、0.8、1 mL标准蛋白质溶液(250 μg/mL牛血清蛋白),用水补足到1 mL,加入5 mL福林酚试剂甲,混匀,于25 ℃放置10 min,再加入试剂乙0.5 mL,立即摇匀,25 ℃保温30 min,于500 nm处比色。以蛋白质浓度为横坐标,光密度值为纵坐标[12],绘制标准曲线。
1.5.2 加酶量对蛋白质含量的影响 分别加入1000、1500、2000、2500、3000 U/g的Alcalase碱性蛋白酶,在50 ℃下反应5 h,取1 mL水解液于500 nm处比色,通过标准曲线计算水解液中蛋白质含量。做三组平行实验,取平均值,同时做空白实验。
1.5.3 反应时间对蛋白质含量的影响 反应温度50 ℃,加入2000 U/g Alcalase碱性蛋白酶,分别反应1、3、5、7、9 h,计算水解液中蛋白质含量。方法同上。
1.5.4 反应温度对蛋白质含量的影响 加入2000 U/g Alcalase碱性蛋白酶,恒温水浴的温度分别为30、40、50、60、70 ℃,反应时间5 h,测得水解液中蛋白质含量。方法同上。
1.5.5 响应面实验 为优化蛋白酶脱蛋白质工艺,在单因素实验的基础上,以反应温度、加酶量、反应时间为自变量,蛋白质浓度为Y值,运用响应面法设计实验[13],分析各研究自变量及其交互作用对蛋白质浓度的影响。

表2 蛋白酶脱蛋白质设计因素水平编码表
1.6 乙醚脱脂
将脱钙、脱蛋白后的虾壳粉用无水乙醚浸泡3 h,过滤、挥干乙醚。
1.7 脱色
将挥干乙醚后的虾壳粉经过30%过氧化氢溶液浸泡2 h。
1.8 数据讨论分析
利用Design-Expert8.0.6进行响应面设计。
2 结果与分析
2.1 虾壳常规指标测定结果
由表3可知,对虾壳中各成分含量进行测定,其中灰分17.88%、水分4.32%、脂肪14.26%、蛋白质41.65%,其余部分主要为甲壳素。

表3 虾壳常规指标测定结果
2.2 柠檬酸脱钙单因素实验结果
2.2.1 柠檬酸浓度对虾壳粉中灰分含量影响 柠檬酸浓度对虾壳中灰分影响见图1。
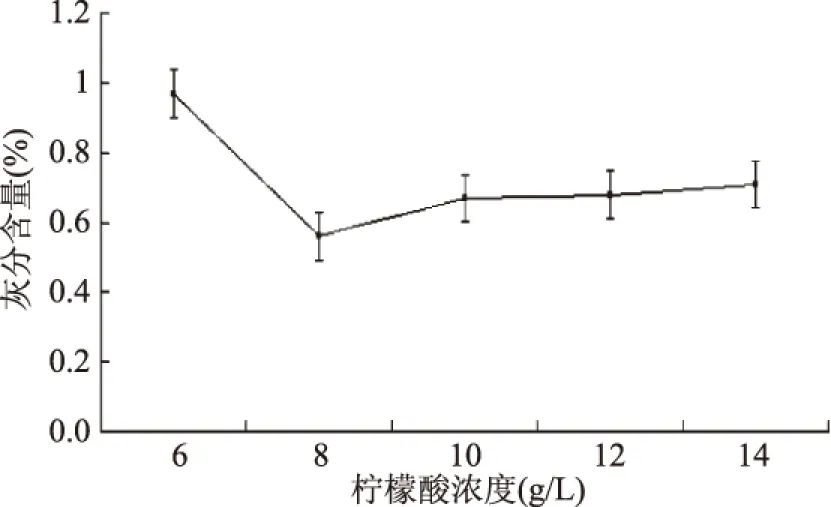
图1 柠檬酸浓度对虾壳中灰分影响Fig.1 Effect of citric acid concentration on ash content in shrimp shells
图1表明,当柠檬酸浓度为8 g/L时,灰分含量最低,浓度小于8 g/L时,随着浓度的增加,灰分含量逐渐降低,而当柠檬酸浓度大于8 g/L时,随柠檬酸浓度增加,灰分含量有小幅升高,但总体趋于稳定,因此选择最佳浓度为8 g/L。
2.2.2 固液比对虾壳粉中灰分含量影响 固液比对虾壳粉中灰分含量影响见图2。

图2 固液比对虾壳粉中灰分含量影响Fig.2 Effect of solid-liquid ratio on ash content in shrimp shells
图2表明,当固液比小于1∶10 时,随着固液比的增大,灰分含量有所下降,且下降明显。固液比的增加有助于虾壳中的无机盐与柠檬酸充分接触,有利于无机盐溶解[14]。当固液比在1∶10 以后,灰分含量降低缓慢。因此固液比1∶10为最佳。
2.2.3 反应时间对虾壳粉中灰分含量影响 反应时间对虾壳粉中灰分含量影响见图3。

图3 反应时间对虾壳中灰分影响Fig.3 Effect of reaction time on ash content in shrimp shell
图3表明,当反应时间为3 h时,灰分含量最低。2~3 h时,增加反应时间,柠檬酸与虾壳中的无机盐反应越来越完全,灰分含量呈逐渐减少的趋势。3 h后延长反应时间,灰分含量没有明显的变化,因此3 h为最佳反应时间。
2.2.4 响应面实验优化柠檬酸脱钙
2.2.4.1 响应面实验结果 利用Design-Expert8.0.6进行响应面设计,以灰分含量(Y)为响应值,响应面实验结果如表4,对表4进行回归分析,得到回归方程为Y=0.59+0.046A+0.23B-0.30C+0.097AB+0.11AC-0.10BC+0.18A2+0.086B2+0.37C2

表4 柠檬酸脱钙Box-Behnken实验设计结果

表5 柠檬酸脱钙Box-Behnken回归方程方差分析
注:差异不显著,p≥0.05,*差异显著,p≤0.05;**差异极显著,p≤0.01。


图4 反应时间和柠檬酸浓度相互作用对柠檬酸脱钙工艺影响的响应曲线面Fig.4 Response curve surface of citric acid decalcification process with interaction of reaction time and citric acid concentration

图5 反应时间和固液比相互作用对柠檬酸脱钙工艺影响的响应曲线面Fig.5 Response curve surface of citric acid decalcification process with interaction of reaction time and solid-liquid ratio
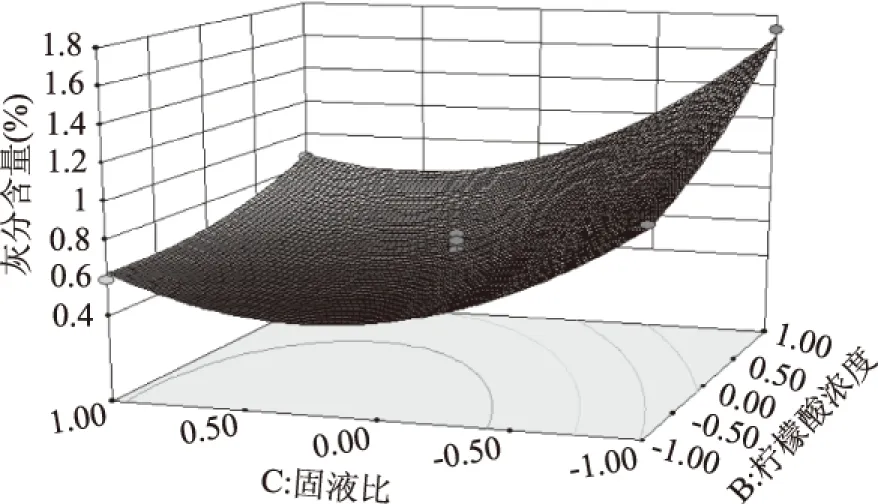
图6 柠檬酸浓度和固液比相互作用对柠檬酸脱钙工艺影响的响应曲线面Fig.6 Response curve surface of citric acid decalcification process with interaction of citric acid concentration and solid-liquid ratio
从图 4、图5、图6可见:柠檬酸浓度、反应时间和固液比之间的交互作用。从图4可见:根据响应面弯曲程度分析得出,柠檬酸浓度较低时,增加反应时间,灰分含量逐渐降低后趋于平稳。当提高柠檬酸浓度时,灰分含量随着反应时间的增加先降低后缓慢增加。随着柠檬酸浓度增加,与虾壳中的无机盐反应越完全,溶液一直呈现酸性,从而柠檬酸钙未出现沉淀,因此灰分含量随着时间逐渐减小[15]。从图5可见:随固液比的增加,灰分含量呈现降低趋势,反应时间增长,随着固液比的增加,灰分含量先降低后略有上升。当固液比较低时,溶液中的柠檬酸随着反应的进行而逐渐减少,最终导致溶液pH增大而使其中的柠檬酸钙沉淀吸附在几丁质上,从而使产品灰分含量较大,增加固液比后,溶液一直保持酸性,未出现沉淀,随反应时间增加,灰分含量开始减少,料液比与反应时间之间存在相互作用。从图6可见:随着固液比和柠檬酸浓度的增加,灰分含量同样先减少后略有上升,曲面较陡,表明柠檬酸浓度和固液比的相互作用对灰分含量的影响较大。
2.2.4.3 柠檬酸脱钙最佳工艺条件的确定 通过软件Design-ExpertV8.0.6求解方程,得到了最优提取工艺条件为:固液比为1∶12.4,反应时间2.5 h,柠檬酸浓度为8.14%,在上述条件下,由响应面模型预测的灰分含量0.420%。为了验证模型可行性,结合实际情况以固液比为1∶12,反应时间在2.5 h,柠檬酸浓度为8%,经过三次重复实验,灰分含量平均值为0.423%,与预测值0.420%结果比较接近,说明模型可以很好的反映柠檬酸脱钙的最佳工艺条件。
2.3 酶解法脱蛋白质单因素实验
2.3.1 福林酚法测蛋白质 以吸光度OD值为纵坐标,牛血清蛋白浓度为横坐标,绘制标准曲线,测定浓度为0~250μg/mL,结果如图7所示。

图7 牛血清蛋白浓度-吸光度标准曲线Fig.7 Bovine serum albumin concentration-absorbance standard curve
2.3.2 加酶量对蛋白质含量的影响 根据酶活力测定结果选择Alcalase碱性蛋白酶进行实验。加酶量对蛋白质含量的影响见图8。

图8 加酶量对蛋白质含量的影响Fig.8 The amount of enzyme on protein content
图8表明,蛋白质浓度随着加酶量增加而增加。当加酶量在2000 U/g以下时,蛋白质浓度增加明显,坡度较大,当加酶量>2000 U/g时,增加缓慢,总体趋势趋于平稳。因此最适加酶量为2000 U/g。
2.3.3 反应时间对蛋白质含量的影响 反应时间对蛋白质含量的影响见图9。
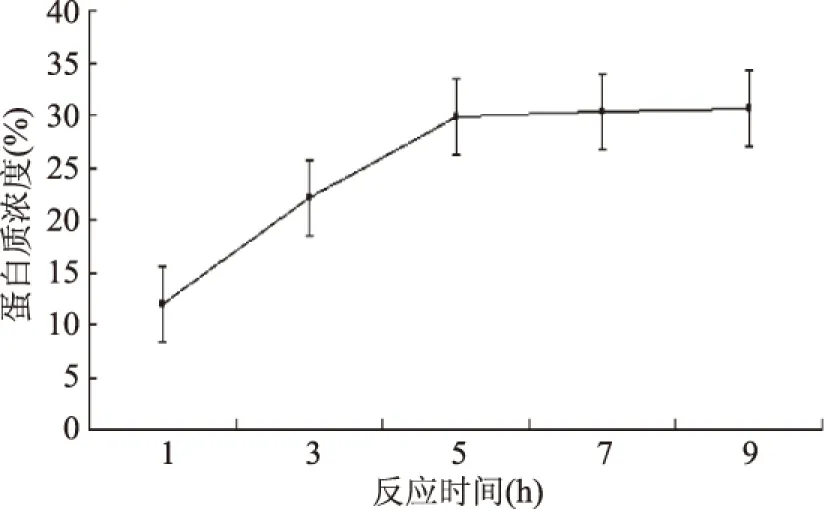
图9 反应时间对蛋白质含量的影响Fig.9 Effect of reaction time on protein content
图9表明,延长反应的时间,反应进行的越完全,蛋白质浓度也随之增加,反应时间在5 h之前,蛋白质浓度增加明显,当反应时间为5 h时,水解液中蛋白质浓度达到30%,之后增加反应时间,蛋白质浓度增加不明显,因此反应时间为5 h。
2.3.4 反应温度对蛋白质含量的影响 反应温度对蛋白质含量的影响见图10。

图10 反应温度对蛋白质含量的影响Fig.10 Effect of reaction temperature on protein content
图10表明,反应温度由30 ℃升至50 ℃的过程中,蛋白质浓度由21.9%升至44.5%,之后随着温度的上升,蛋白质浓度基本保持不变。在较高温度下,蛋白质在酶解液中溶解度较大,分子运动加剧,蛋白质分子从虾壳中分离的速率加快。当温度大于50 ℃,超出蛋白酶最适温度,酶活力降低,因此蛋白质浓度基本不增加。因此选用50 ℃作为最佳反应温度。
2.4 碱性蛋白酶脱蛋白质响应面优化
2.4.1 响应面实验结果 利用Design-Expert8.0.6进行响应面设计,以蛋白质浓度(Y)为响应值,响应面实验结果如表6,对表6进行回归分析,得到回归方程为Y=29.95+1.54A-0.68B+0.17C+0.34AB-0.61AC-0.87BC-2.09A2-6.39B2-2.57C2
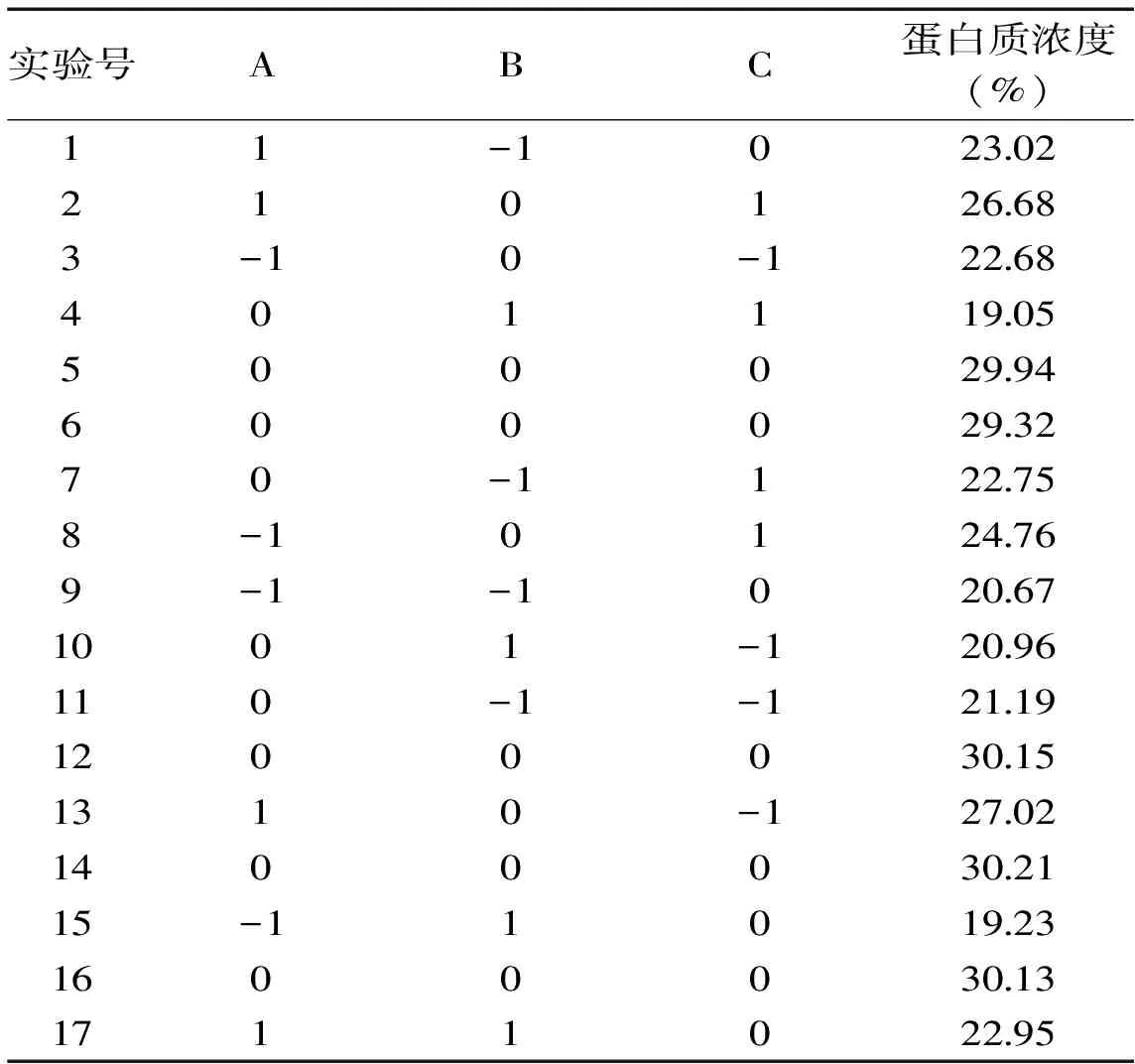
表6 蛋白酶法脱蛋白质的Box-Behnken实验设计结果

图11、图12、图13表明:反应温度、加酶量、反应时间三个因素间存在交互作用。从图11可知:蛋白质浓度随着加酶量和反应时间的增加先增加后降低,曲线弧度较大。增加反应时间,反应越完全,增加蛋白酶的添加量,脱除的蛋白质含量越高,说明反应时间和加酶量对蛋白质浓度的影响较大。从图12可见:温度较低时,蛋白质浓度随着加酶量的增加明显上升,提高反应温度,分子间运动加快,蛋白质浓度增加,温度超过酶最适温度后酶活力降低,蛋白质脱除率减少。从图13可见:随着反应温度和反应时间的增加,蛋白质浓度同样有先增加后减少的过程,曲面明显,有明显的峰值,两者之间存在相互作用。

表7 碱性蛋白酶脱蛋白质的Box-Behnken回归方程方差分析
注:**差异极显著,p≤0.01;*差异显著,p≤0.05;不显著,p≥0.05。

图11 反应时间和加酶量相互作用对碱性蛋白酶脱蛋白工艺影响的响应曲线面Fig.11 Response curve surface of alcalase protease deproteinization process with interaction of reaction time and protease dosage

图12 反应温度和加酶量相互作用对碱性蛋白酶脱蛋白工艺影响的响应曲线面Fig.12 Response curve surface of alcalase protease deproteinization process with interaction of reaction temperature and protease dosage

图13 反应温度和反应时间相互作用对碱性蛋白酶脱蛋白工艺影响的响应曲线面Fig.13 Response curve surface of alcalase protease deproteinization process with interaction of reaction temperature and reaction time
2.4.3 碱性蛋白酶脱蛋白质的最佳工艺条件确定 通过软件Design-ExpertV8.0.6求解方程,得到的碱性蛋白酶脱蛋白质最佳提取工艺条件为:加酶量2197.29 U/g,反应时间4.92 h,反应温度49.46 ℃,在上述条件下由响应面模型预测的蛋白质浓度为30.24%。为了检测模型可行性,结合具体自身实际情况,以反应温度50 ℃,加酶量2200 U/g,反应时间5 h,经过三次重复实验平均值为31.42%,与预测值30.24%结果比较接近,说明模型可靠,可以得出良好的提取工艺条件。
3 结论
通过单因素实验和Box-behnken响应面设计优化几丁质的最佳制备条件,以灰分含量为脱钙指标,得到柠檬酸脱钙最佳工艺条件为:固液比1∶12,反应时间2.5 h,柠檬酸浓度为8%,灰分含量为0.42%,符合食品级要求。以蛋白质含量为指标,测得碱性蛋白酶脱蛋白的最佳工艺条件为:加酶量2200 U/g,反应时间5 h,反应温度50 ℃,脱除的蛋白质浓度可达到31.42%。
几丁质的制备一直是人们研究的热点,但常用的制备方法多用到盐酸、浓碱[16-17]。此类试剂虽然易得,但反应时间长,同时在反应过程中会产生多种废液,对环境污染严重。本实验选用酶法脱蛋白,试剂的用量少,反应条件温和,反应时间与传统工艺相比较明显缩短。利用福林酚法测得的蛋白质含量,灵敏性高,显色效果明显,减少了不必要的偏差实验步骤,方便快捷。
[1]姜山,史源,朱启忠.壳聚糖文献分析[J].大学化学,2011(4):45-48.
[2]Ashish Dev,Jithin C,Sreeja V,et al. Novel carboxymethyl chitin nanoparticles for drug delivery applications[J]. Carbohy drate polymers,2010,79(4):1073-1079
[3]Knorr D. Recovery and utilization of chitin and chitosan in food processing waste management[J]. Food Technology,1991,34:114-120.
[4]Mahmoud N S,Ghaly A E,Arab F.Unconventional approach for demineralization of deproteinized crustacean shells for chitin production[J].Journal of Biochemistry and Biotechnology,2007,3(1):1-9
[5]刘锡红,赵灵希,张成杰,等.酶法从虾壳中提取甲壳素工艺优化的研究[J].食品工业科技,2013(22):209-212,216.
[6]GB 5009.4-2010,食品安全国家标准 食品中灰分的测定[S]. 2010.
[7]GB 5009.3-2010,食品安全国家标准 食品中水分的测定[S]. 2010.
[8]GB/T 5009.6-2003,食品中脂肪的测定[S]. 2003.
[9]GB 5009.5-2010,食品安全国家标准 食品中蛋白质的测定[S]. 2010.
[10]张剑,赵雷敏,康林霞.碱性蛋白酶活力分析方法研究[J].日用化学工业,2012(3):192-195.
[11]KarinaDM,VykundeshwariG,AnaMRP,et al.Effect of dynamic high-pressure treatment on the interfacial and foaming properties of soy protein isolate-hydroxypropyl methylcellulose ssystems[J].Food Hydrocolloids,2011,25(6):1640-1645.
[12]Lowry O H,Rosebrough N J,陈祥娥,等.福林酚试剂法测定蛋白质[J].食品与药品,2011(3):147-151.
[13]王馨云,耿丽晶,陈伟杰,等.响应面法优化五味子枯叶中木脂素的提取条件[J].饲料研究,2015,22:48-54.
[14]彭元怀,黄川,赵泽洁.超声波辅助提取虾壳甲壳素的工艺研究[J].食品工业科技,2012(9):304-308.
[15]唐义宝,谢晶.柠檬酸用于虾头、虾壳的脱钙处理[J].食品科学,2012(10):6-9.
[16]Karina D M,Vykundeshwari G,Ana M R P,et al. Effect of dynamic high-pressure treatment on the interfacial and foaming properties of soy protein isolate-hydroxypropylmethylcelluloses systems[J].Food Hydrocolloids,2011,25(6):1640-1645.
[17]梁玉佳.南极磷虾虾壳中甲壳素的制取与应用[D].大连:大连工业大学,2013.
Optimum technology of chitin preparation from penaeus chinensis
BAI Yun,LI Ran,ZHANG Zhen*,GUO Xue-song*,ZHANG Dong-yang
(College of Food Science and Engineering,Jinzhou Medical University,Jinzhou 121000,China)
In this study,chitin was extracted from Penaeus chinensis,and the protein was removed by protease and decalcified by citric acid. The protease activity was measured by Alcalase Alkaline protease. The optimal conditions of chitin preparation were determined by single factor experiment and Box-behnken response surface design. The optimal conditions of decalcification were obtained as follows:solid-liquid ratio 1∶12,reaction Time 2.5 h,citric acid concentration of 8%,ash content of 0.42%. The optimum conditions were as follows:adding 2200 U/g enzyme,reaction time 5 h,reaction temperature 50 ℃,and the protein concentration could reach 31.42% by taking the protein content as the index. The experimental conditions are mild,rapid response,no environmental pollution,in line with the concept of pollution-free green,and to provide the basis for industrial production of chitin.
chitin;citric acid;protease;response surface;optimal process
2016-11-17
柏韵(1992-),女,硕士,研究方向:农产品加工与贮藏工程,E-mail:m13188132062@163.com。
*通讯作者:张振(1983-),男,博士,讲师,研究方向:食品营养与安全,E-mail:zhangzhen8849@163.com。 郭雪松(1970-),男,硕士,副教授,研究方向:农产品精深加工及综合利用,E-mail:Jzguoxuesong@163.com。
辽宁医学院校长基金(XZJJ20140121);大学生创新训练项目(201610160057)。
TS254.1
B
1002-0306(2017)09-0174-07
10.13386/j.issn1002-0306.2017.09.025
