桃果实褐腐病拮抗菌的筛选、鉴定及其拮抗活性
2017-06-05殷晓慧王庆国石晶盈
殷晓慧,王庆国,张 畅,石晶盈
(山东农业大学食品科学与工程学院,山东泰安 271018)
桃果实褐腐病拮抗菌的筛选、鉴定及其拮抗活性
殷晓慧,王庆国,张 畅,石晶盈*
(山东农业大学食品科学与工程学院,山东泰安 271018)
以桃褐腐菌(Moniliniafructicola)为靶菌,采用稀释分离法和平板对峙法从桃园土壤中筛选出对病原菌有较强拮抗作用的菌株12a和14b。通过离体和活体实验对拮抗菌抑菌活性进行研究,经菌株形态、生理生化特性及16S rRNA基因序列分析进行菌株鉴定。结果表明:菌株12a和14b分别鉴定为死谷芽孢杆菌(Bacillusvallismortis)和高地芽孢杆菌(Bacillusaltitudinis),其无菌发酵滤液和挥发性代谢产物对桃褐腐菌的生长有显著的抑制作用,其中12a挥发性代谢产物对其菌丝生长的抑菌效果更为显著(p<0.05)。两株拮抗菌的菌液浸泡和熏蒸桃果实,延缓了桃褐腐病发病时间,有效地控制了病斑的扩展。
桃褐腐菌,拮抗菌,挥发性代谢产物,无菌发酵滤液,鉴定
桃果实肉质鲜美,富含蛋白质、糖、粗纤维、矿物质以及胡萝卜素、维生素B1、尼克酸等多种人体所必需的物质[1],被称为“天下第一果”[2]。但因其营养丰富,成熟期在高温季节,采后由微生物造成的腐烂非常严重[3]。其中,由褐腐菌(Moniliniafructicola)引起的褐腐病是桃果实采后的重要侵染性病害,环境适宜时,其在贮藏、运输、销售及消费过程中发生极为严重,使果实迅速丧失商品价值,造成巨大的经济损失[4]。目前桃果实采后褐腐病的控制主要依赖化学杀菌剂[5]。大量研究表明化学杀菌剂对桃果实采后褐腐病具有直接有效的杀菌作用。纪兆林等[6]测定了15种杀菌剂对桃褐腐病菌的毒力效果,咪鲜胺、戊唑醇和多菌灵等均对桃褐腐病菌有较强的毒力作用。Adaskaveg等[7]研究表明,环酰菌胺、啶酰菌胺、嘧霉胺和密菌环胺等能够有效地控制桃褐腐病的发生。但是长期使用化学杀菌剂会导致病原菌抗药性产生,药剂残留量增加和环境污染等问题[8]。
生物防治因其安全无毒、高效无残留等特点而受到广泛关注,并已有桃褐腐菌生防菌的筛选及对桃褐腐病防治的报道[9-11]。纪兆林等[12]在桃病果上分离筛选得到的地衣芽孢杆菌菌株W10菌液和抗菌蛋白能够明显地推迟褐腐病的发病时间,降低自然腐烂率。枯草芽孢杆菌CPA-8对桃果实褐腐病的体外实验表明,其无菌滤液对桃褐腐病菌有80%~90%的抑制活性[13]。气体熏蒸方式防治采后病害在生产中使用更为方便,而利用拮抗微生物产生的挥发性成分抑制病原菌生长和果实采后病害的研究报道比较少见。因此,有必要分离和筛选产挥发性拮抗成分的微生物用于防治采后病害,为生防菌的推广应用奠定良好的基础。
本研究从桃树根际土壤中筛选到两株对桃褐腐菌有拮抗作用的菌株12a和14b,并对其进行鉴定,在离体实验的基础上,通过浸泡和熏蒸的方法进一步探究其对桃果实活体的抑菌活性,初步评价拮抗菌无菌发酵滤液和挥发性代谢产物对桃果实褐腐病的防治效果,以期为桃褐腐病的防治提供新的拮抗菌株资源,为其实际应用奠定理论基础。
1 材料与方法
1.1 材料与仪器
桃褐腐菌(Moniliniafructicola)、拮抗菌12a(Bacillusvallismortis)及拮抗菌14b(Bacillusaltitudinis) 均由山东农业大学食品科学与工程学院果蔬采后贮藏保鲜实验室分离保存。
牛肉膏蛋白胨固体培养基(NA):牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂20 g,蒸馏水1000 mL,pH7.2,121 ℃高压灭菌20 min;牛肉膏蛋白胨液体培养基(NB):牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸馏水1000 mL,pH7.2,121 ℃高压灭菌20 min;马铃薯蔗糖琼脂培养基(PDA):马铃薯200 g,蔗糖20 g,琼脂20 g,蒸馏水1000 mL,121 ℃高压灭菌20 min。
SJ-CJ-1D超净工作台 苏州苏洁净化设备有限公司;ZQTY-70F恒温振荡培养箱 上海知楚仪器有限公司;AL204电子天平 梅特勒-托利多仪器(上海)有限公司;EPED-E2-20TF实验室级超纯水器 南京易普易达科技发展有限公司;HWS-500恒温培养箱 宁波江南仪器厂;YXQ-LS-50S历史压力蒸汽灭菌器 上海博迅实业有限公司;3730XL测序仪、2720 thermal cycler PCR仪 APPlied Biosystems;DYCP-31DN DNA电泳槽、DYY-5稳压电泳仪 北京六一仪器厂;DK-SD电热恒温水槽 上海一恒科学仪器有限公司;FR98O凝胶成像仪 上海复日科技仪器有限公司;HC-258R冷冻高速离心机 Bio Basic Inc;SP10-1000 Surf系列精密单道可调移液器、Ezup柱式细菌基因组DNA抽提试剂盒SK8255、SanPrep柱式DNAJ胶回收试剂盒SK8131 生工生物工程(上海)股份有限公司。
1.2 实验方法
1.2.1 拮抗菌的分离和筛选 在未施用化肥农药的桃园中采集桃树根际土壤,采用稀释分离法,取处理好的土壤0.5 g于10 mL无菌试管中,加入5 mL无菌水,振荡摇匀,静置3 min,吸取上层溶液0.5 mL加入到另一无菌试管内,加入4.5 mL无菌水,摇匀静置,依次进行稀释,获得10-1、10-2、10-3和10-4的土壤稀释液,分别吸取10-2、10-3和10-4的土壤稀释液100 μL加到NA平板上,用无菌涂布器涂匀,标明编号,放置1 h后将培养皿反转,于37 ℃中培养。2 d后,根据菌落形态等特点挑选细菌单菌落,分别移接到NA平板上,培养48 h后用于后续实验。经纯化的菌株于NA斜面培养基上,4 ℃保存。
采用平板对峙法[14]筛选拮抗菌。在PDA平板中央接种桃褐腐菌菌饼,以褐腐菌菌饼为中心,划十字,在十字交叉线的四端、距离平板1.5 cm处,接种分离出的同一种细菌,每个处理3皿。室温下培养96 h,以不接种细菌的培养皿为对照(Control),测定其抑菌率,选择抑菌率较高的两株拮抗菌进行后续实验。
抑菌率(%)=(对照菌落直径(mm)-处理菌落直径(mm))/对照菌落直径(mm)×100
式(1)
1.2.2 拮抗菌对病原菌抑制活性的测定
1.2.2.1 拮抗菌发酵滤液对桃褐腐菌菌丝生长的抑制作用 挑取NA平板上生长良好的拮抗菌分别接种到150 mL NB培养基中,在40 ℃ 180 r/min振荡培养48 h。将所得菌液在离心机中10000 r/min离心15 min,取上清液,用0.22 μm微孔滤膜进行过滤,即得无菌滤液。将无菌滤液与冷却至50 ℃左右的PDA培养基以体积比1∶9的比例混合后倒平板。对照组加入等体积的无菌水。在无菌操作台中,将事先培养好的桃褐腐菌用直径为6 mm的打孔器打孔,取菌饼接种到PDA平板中央,在温度为25 ℃,相对湿度为80%的条件下培养。培养24 h后,每12 h观察一次,测量菌落直径,计算抑菌率,计算方法同1.2.1。
1.2.2.2 拮抗菌挥发性代谢产物对桃褐腐菌菌丝生长的抑制作用 参照Gong等[15]的方法采用平板对扣法测定拮抗菌体外挥发性成分对褐腐菌菌丝的影响。制备NA和PDA平板,分别吸取过夜培养的两株拮抗菌菌液100 μL均匀涂布在NA平板上,取活化7 d的病原菌菌饼接种于另一PDA平板中央,与涂有拮抗菌菌液的平板对扣,密封,在温度为25 ℃,相对湿度为80%的条件下培养。每个处理3个重复,以只接种病菌菌饼的PDA平板和不做任何处理的NA平板对扣为对照。培养24 h后每12 h观察一次,测量菌落直径,计算菌丝生长抑制率,计算方法同1.2.1。
1.2.3 拮抗菌抑制桃果实褐腐病活性的测定
4)常规方案将饱和烟气加热至75 ℃,考虑系统温降后烟囱出口的排放烟气温度为70 ℃,高温烟气由100 ℃降温为75 ℃。
1.2.3.1 拮抗菌菌液浸泡对桃果实褐腐病病斑扩展的影响测定 挑取NA培养基上生长良好的两株拮抗菌分别接种到NB培养基中(各1000 mL),40 ℃ 180 r/min振荡培养48 h,将菌液用无菌水稀释一倍。取成熟度一致、大小均一、无病虫害和机械伤的肥城白里桃,分别用两种菌液稀释液浸泡15 min,以无菌水浸泡处理为对照,20 ℃下自然晾干,每个果在赤道一侧果面的中心处刺3 mm×3 mm×3 mm的伤口1个,接种参照Gu等[16]的方法制备的5×104个孢子囊/mL的桃褐腐菌孢子囊悬浮液20 μL。将上述处理的果实于(20±1) ℃保湿贮藏。每个处理重复三次,每次重复处理果实20个,该实验重复两次。贮藏36 h后,每12 h调查一次病斑直径,计算病斑扩展抑制率。
病斑扩展抑制率(%)=(对照病斑直径(cm)-处理病斑直径(cm))/对照病斑直径(cm)×100
1.2.3.2 拮抗菌菌液熏蒸对桃果实褐腐病病斑扩展的影响测定 将在NB培养基中振荡培养48 h的菌液1000 mL倒入密封罐的隔板下层(对照下层为相同体积的无菌水),上层放置成熟度一致、大小均一、无病虫害和机械伤的肥城白里桃,用凡士林密封罐盖,熏蒸1 h后将果实取出。每果刺3 mm×3 mm×3 mm的伤口1个,分别接种5×104个孢子囊/mL的桃褐腐菌孢子囊悬浮液20 μL,将上述处理的果实于(20±1) ℃保湿贮藏。每个处理重复三次,每次重复处理果实20个,该实验重复两次。贮藏36 h后,每12 h调查一次病斑直径,计算病斑扩展抑制率,计算方法同上。
1.2.4 拮抗菌的鉴定
1.2.4.1 分子生物学鉴定 采用SK8255(细菌)DNA 提取试剂盒分别提取菌株12a和14b的总DNA。PCR扩增采用细菌16S rRNA基因的通用引物对27F(5′-AGT TTG ATC MTG GCT CAG-3′)和1492R(5′-GGT TAC CTT GTT ACG ACT T-3′)进行PCR扩增,PCR扩增反应体系为25 μL,包括Template(基因组DNA 20~50 ng/μL)0.5 μL,10×Buffer(with Mg2+)2.5 μL,dNTP(各2.5 mmol/L)1 μL,酶0.5 μL,F(10 μmol/L)0.5 μL,R(10 μmol/L)0.5 μL,加双蒸H2O至25 μL。PCR反应条件为:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,循环30次;72 ℃修复延伸10 min,4 ℃终止反应。PCR产物经1%琼脂糖凝胶电泳,电泳条件为150 V、100 mA、20 min,EB染色后用凝胶成像系统观察电泳条带,切割所需DNA目的条带,纯化方式按照SK8131试剂盒说明书进行,PCR产物用PCR引物直接测序。测序完成后,将得到的序列在NCBI网站上进行BLAST分析,选取具有代表性的菌株,采用MEGA 6软件进行多序列同源性分析,并构建系统进化树。
1.2.4.2 菌株形态和生理生化鉴定 菌株形态和生理生化鉴定:参照《常见细菌系统鉴定手册》[17]中的方法对菌株12a和14b的形态和生理生化指标进行鉴定。
1.2.5 数据分析 采用IBM SPSS Statistics 20统计软件进行数据分析,用Duncan新复极差法进行显著性(p<0.05)水平检验。使用SigmaPlot 10.0进行作图。
2 结果与分析
采用平板稀释法从桃树根际土壤中分离出57株菌,利用平板对峙法筛选出4株对桃褐腐菌抑制效果较为明显的拮抗菌(表1),其中菌株12a和14b的抑菌活性较强,抑制率分别达70.6%和56.5%,结果见图1。

表1 四种拮抗菌对桃褐腐菌菌丝生长的抑制效果
注:同列中不同小写字母表示差异显著(p<0.05),表中数据为3次重复的平均值。
2.2 拮抗菌对病原菌菌丝的抑制效果
2.2.1 拮抗菌12a、14b发酵滤液对桃褐腐菌菌丝生长的抑制作用 如图2和图3所示,拮抗菌12a和14b的无菌发酵滤液均对桃褐腐菌具有较好的抑菌活性,经拮抗菌无菌发酵滤液处理的病原菌菌落边缘色素沉着、菌丝萎缩老化,其中拮抗菌12a的无菌发酵滤液对桃褐腐菌的菌丝生长具有较强的抑制作用,处理96 h后,其抑制率高达83.1%,拮抗菌14b的无菌发酵滤液对菌丝生长的抑制作用相对较弱,在40%左右。

图2 菌株12a及14b无菌发酵滤液对桃褐腐菌菌丝生长的影响Fig.2 Inhibition of sterile fermentation filtrate of strain 12a and 14b on mycelial growth of M. fructicola注:同一时间中不同小写字母表示差异显著(p<0.05),图4、图6、图7同。

图3 菌株12a及14b无菌发酵滤液对桃褐腐菌的抑制作用Fig.3 Inhibition of sterile fermentation filtrate of strain 12a and 14b on M. fructicola
2.2.2 拮抗菌株12a、14b挥发性代谢产物对桃褐腐菌菌丝的抑制作用 由图4、图5可以看出,拮抗菌12a、14b的挥发性代谢产物对桃褐腐菌具有强烈的抑制作用。和对照相比,桃褐腐菌在12a挥发性代谢产物的影响下菌丝褐变、生长受阻,在14b挥发性代谢产物的影响下菌丝扩展缓慢。处理96 h后,与菌株12a对扣的褐腐菌丝几乎无扩展,菌株14b的抑制率达67.7%,两者均具有较好的应用开发价值。

图4 菌株12a及14b挥发性代谢产物对桃褐腐菌的抑制作用Fig.4 Inhibition of volatile metabolites of strain 12a and 14b on mycelial growth of M. fructicola
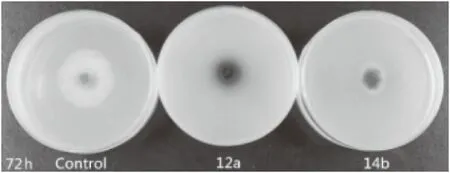
图5 菌株12a及14b挥发性代谢产物对桃褐腐菌的抑制作用Fig.5 Inhibition of volatile metabolites of strain 12a and 14b on M. fructicola
2.3 拮抗菌对桃果实褐腐病的抑制效果

图6 菌株12a及14b发酵液对桃果实病斑扩展的影响Fig.6 Effects of fermentation filtrate of strain 12a and 14b on development of lesion diameter of peach fruit inoculated with M. fructicola
2.3.1 拮抗菌菌液浸泡对桃果实褐腐病病斑扩展的影响 如图6所示,拮抗菌12a和14b发酵液浸泡处理,能明显延缓接种褐腐菌后桃果实病斑直径的扩展,但因其浸泡时桃毛脱落,蜡质层损伤,因此,桃果实自身抗性降低,防治效果随着时间的延长而逐渐降低。贮藏36 h时,对照组桃果实已出现褐腐病病斑,而处理组未出现。经拮抗菌12a发酵液浸泡处理的桃果实褐腐病病斑出现的时间晚于对照,且病斑直径显著(p<0.05)低于对照,防治效果较为明显,处理60 h后,病斑扩展的抑制率达74.2%;拮抗菌14b发酵液浸泡处理对桃果实病斑直径的抑制也有一定的效果,处理60 h后,病斑扩展的抑制率为24.7%。
2.3.2 拮抗菌菌液熏蒸对桃果实褐腐病病斑扩展的影响 如图7所示,经菌株12a和14b发酵液熏蒸处理的桃果实褐腐病病班出现的时间晚于对照组,且病斑直径显著(p<0.05)低于对照,处理后前期的防治效果较为明显。其中,拮抗菌12a发酵液熏蒸处理的桃果实对病斑的扩展有较强的抑制作用,处理60 h后,病斑扩展的抑制率达77.1%;拮抗菌14b发酵液熏蒸果实60 h后,病斑扩展的抑制率达50%。

图7 菌株12a及14b挥发性代谢产物对桃果实病斑扩展的影响Fig.7 Effects of volatile metabolites of strain 12a and 14b on lesion diameter of peach fruit inoculated with M. fructicola
2.4 拮抗菌的鉴定
2.4.1 分子生物学鉴定 以菌株12a和14b基因组DNA为模板,利用细菌通用引物进行PCR扩增,测得菌株12a和14b的16S rRNA基因序列长度分别为1509 bp和1508 bp(图8),将序列通过NCBI比对后,选取相似序列构建系统发育树(图9,图10)。结果表明,拮抗菌12a与BacillusvallismortisAB681417在同一分支上,遗传进化距离最近,拮抗菌14b与BacillusaltitudinisAJ831842在同一分支上,遗传进化距离最近。
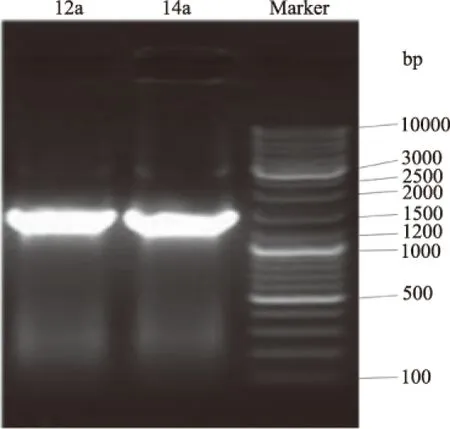
图8 PCR扩增产物的琼脂糖凝胶电泳图Fig.8 Agarose gel electrophoresis of PCR product from strain 12a and 14b

图9 基于菌株12a的16S rRNA基因序列构建的系统发育树Fig.9 Phylogenetic tree of strain 12a based on 16S rRNA gene sequence

图10 基于菌株14b的16S rRNA基因序列构建的系统发育树Fig.10 Phylogenetic tree of strain 14b based on 16S rRNA gene sequence
2.4.2 菌株形态和生理生化鉴定 菌株12a经革兰氏染色阳性,镜检呈杆状,具鞭毛,有芽孢,在NA平板上形成乳白色菌落,表面有褶皱,干燥不透明,边缘不整齐。菌株14b经革兰氏染色阳性,镜检呈杆状,具鞭毛,有芽孢,在NA平板上形成的菌落透明,表面光滑,边缘不整齐。拮抗菌12a和14b的生理生化鉴定结果见表2。结合菌株形态、生理生化特性及16S rRNA基因序列分析,鉴定拮抗菌12a为死谷芽孢杆菌(B.vallismortis),拮抗菌14b为高地芽孢杆菌(B.altitudinis)。两株拮抗菌已在中国微生物菌种保藏管理委员会普通微生物菌种保藏中心进行了保藏,12a的保藏号为CGMCC No.12179,14b的保藏号为CGMCC No.12180。

表2 菌株12a和14b的生理生化特性
注:“+”表示阳性,“-”表示阴性。
3 结论与讨论
采用平板稀释法从桃树根际土壤中分离得到57种菌株,经平板对峙筛选到两株对桃褐腐病原菌具有较强拮抗作用的菌株12a和14b。离体抗菌活性的测定中发现拮抗菌12a和14b的无菌发酵滤液和挥发性代谢产物对桃褐腐菌丝均有明显的抑制作用,说明两者中含有抑制桃褐腐病病原菌的成分,其活性物质有待进一步深入研究。张志斌等研究发现拮抗菌株FRo2发酵滤液对金黄色葡萄球菌等具有强抑制作用,并在滤液中分离得到抑菌活性化合物AW2[18]。Raza等研究发现多粘类芽孢杆菌WR-2产生的挥发性代谢产物具有良好的抗真菌作用,通过GC-MS分离鉴定出的苯并噻唑、苯甲醛、十六醛、2-十三烷酮和苯酚等能够抑制尖孢镰刀菌的生长[19]。在活体接种实验中,经两株拮抗菌发酵液浸泡和熏蒸处理的桃果实出现病斑的时间均晚于对照,同时期处理组的病斑直径明显小于对照,说明两株拮抗菌的次生代谢产物均能有效的延缓桃果实发病,控制病原菌在桃果实上的侵染,其中挥发性代谢产物对桃果实褐腐病的防治效果更为明显。桃果实经菌液浸泡后,表面起保护作用的桃毛脱落,易对桃果实造成物理性伤害,而采用熏蒸的方式处理桃果实,操作简单,成本较低,菌株与桃果实没有直接接触,造成交叉感染的风险小,且防治效果优于浸泡处理,因此采用熏蒸的方式对桃果处理具有较高的应用价值和广阔的市场前景。
结合菌株形态、生理生化特性及16S rRNA基因序列分析对两株拮抗菌进行菌种鉴定,菌株12a被鉴定为死谷芽孢杆菌,命名为Bacillusvallismortis12a;菌株14b被鉴定为高地芽孢杆菌,命名为Bacillusaltitudinis14b。死谷芽孢杆菌和高地芽孢杆菌在桃采后病害防治上的研究尚未见报道,但是死谷芽孢杆菌在抑制香菇培料中的木霉菌上的研究发现,此菌株生长繁殖所需的营养简单,繁殖速度快、抗逆性强[20],具有作为优势生防菌株的潜力,为防治桃果实褐腐病提供了新的资源和途径,对有效降低桃果实采后褐腐病的侵染和减少化学杀菌剂的使用提供了重要的参考价值,后续研究将对其抑菌活性物质进行分离纯化,以期开发出一种高效杀菌、环境友好型的微生物菌剂。
[1]马燕翔,车凤斌,肖雷,等. 桃及油桃贮藏保鲜技术[J]. 农村科技,2010(5):69-70.
[2]周翠英,张洪路. 桃果加工技术[J]. 农村新技术,2009(12):56-57.
[3]张晓宇,王春生,赵桂芳,等. 桃果实采后生理研究及贮藏保鲜技术应用进展[J]. 中国农学通报,2008,24(5):117-120.
[4]凡先芳,王宝刚,曾凯芳. 采后果实褐腐病防治技术研究进展[J]. 食品工业科技,2015,36(12):390-394.
[5]Pavanello EP,Brackmann A,Thewes FR,et al. Postharvest biological control of brown rot in peaches after cold storage preceded by preharvest chemical control[J]. Revista Ceres,2015,62(6):539-545.
[6]纪兆林,蒋长根,戴慧俊,等. 不同杀菌剂对桃褐腐病菌的毒力测定[J]. 中国南方果树,2013,42(5):95-97.
[7]Adaskaveg J,Forster H,Gubler W,et al. Reduced-risk fungicides help manage brown rot and other fungal diseases ofstone fruit[J]. California Agriculture,2005,5(2):109-114.
[8]Zheng M,Shi J,Shi J,et al. Antimicrobial effects of volatiles produced by two antagonistic Bacillus strains on the anthracnose pathogen in postharvest mangos[J]. Biological Control,2013,65(2):200-206.
[9]杨海清,刘正坪,刘素花,等. 桃褐腐病生防细菌的筛选及抑菌作用研究[J]. 北京农学院学报,2006,21(4):29-32.
[10]王兴华,马焕普,刘正坪,等. 桃褐腐病拮抗放线菌的分离筛选[J]. 北京农业,2007(15):28-30.
[11]胡海文,杨海清,王朋,等. 桃褐腐病菌拮抗细菌的分离筛选与鉴定[J]. 中国农学通报,2009,25(12):195-200.
[12]纪兆林,贺惠文,周慧娟,等. 地衣芽孢杆菌W10及其抗菌蛋白对桃褐腐病的抑制作用[J]. 园艺学报,2015,42(10):1879-1888.
[13]Yánez-Mendizábal V,Zeriouh H,Vias I,et al. Biological control of peach brown rot(Monilinia,spp.)byBacillussubtilis, CPA-8 is based on production of fengycin-like lipopeptides[J]. European Journal of Plant Pathology,2012,132(4):609-619.
[14]Ren X,Zhang N,Cao M,et al. Biological control of tobacco black shank and colonization of tobacco roots by aPaenibacilluspolymyxa,strain C5[J]. Biology & Fertility of Soils,2012,48(6):613-620.
[15]Gong AD,Li HP,Shen L,et al. TheShewanellaalgaestrain YM8 produces volatiles with strong inhibition activity againstAspergilluspathogensand aflatoxins.[J]. Frontiers in Microbiology,2015,6:1091.
[16]Gu R,Zhu S,Zhou J,et al. Inhibition on brown rot disease and induction of defence response in harvested peach fruit by nitric oxide solution[J]. European Journal of Plant Pathology,2014,139(2):369-378.
[17]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:349-388.
[18]张志斌,敖武,熊瑶瑶,等. 内生拮抗放线菌FRo2的鉴定及抑菌活性物质的分离[J]. 微生物学通报,2014,41(8):1574-1581.
[19]Raza W,Yuan J,Ling N,et al. Production of volatile organic compounds by an antagonistic strainPaenibacilluspolymyxa, WR-2 in the presence of root exudates and organic fertilizer and their antifungal activity againstFusariumoxysporum, f. sp. Niveum[J]. Biological Control,2014,80:89-95.
[20]郝捷,李杨,陈飞,等. 死谷芽孢杆菌对香菇栽培料中木霉菌的抑制研究[J]. 微生物学通报,2013,40(2):228-235.
Isolation and identification of antagonistic bacteria against peach brown rot and its antibacterial activity
YIN Xiao-hui,WANG Qing guo,ZHANG Chang,SHI Jing-ying*
(College of Food Science and Engineering,Shandong Agricultural University,Tai’an 271018,China)
Two antagonistic bacteria 12a and 14b were obtained from the peach rhizosphere soil againstMoniliniafructicolausing serial dilution method and dual-culture inhibition on agar plate. 12a and 14b were identified asBacillusvallismortisandBacillusaltitudinisrespectively by phenotypic,physiological,biochemical and 16S rRNA gene sequence analysis.Invitroevaluation of antagonistic activity,the sterile fermentation filtrate and volatile metabolites of strain 12a and 14b both showed a strong inhibition on the mycelia growth ofM.fructicola. Especially,the inhibitory effect of the volatile metabolites of strain 12a was more significant(p<0.05). For further study,invivotests indicated that fermentation broth and volatile metabolites of strain 12a and 14b also delayed the onset of brown rot significantly(p<0.05)inhibited the development of lesion diameter of peach brown rot.
Moniliniafructicola;antagonistic bacteria;sterile fermentation filtrate;volatile metabolites;identification
2016-12-02
殷晓慧(1992-),女,硕士,研究方向:食品加工与储藏技术,E-mail:18763896920@163.com。
*通讯作者:石晶盈(1980-),女,博士,副教授,主要从事果实采后病害的控制及其机理研究,E-mail:jyshi80@163.com。
山东省科技发展计划项目(2014GNC113009);“十二五”国家科技支撑计划项目(2015BAD16B03)。
TS201.3
A
1002-0306(2017)09-0128-06
10.13386/j.issn1002-0306.2017.09.016
