K-ras基因状态及ras蛋白表达在胃印戒细胞癌免疫表型分类中的意义*
2017-06-05熊秋迎胡秀华涂露霞熊振芳
熊秋迎,熊 欣,胡秀华,涂露霞,熊振芳△
(1.南昌大学第一附属医院病理科,南昌 330006;2.江西省南昌市洪都中医院急诊科 330038)
K-ras基因状态及ras蛋白表达在胃印戒细胞癌免疫表型分类中的意义*
熊秋迎1,熊 欣1,胡秀华2,涂露霞1,熊振芳1△
(1.南昌大学第一附属医院病理科,南昌 330006;2.江西省南昌市洪都中医院急诊科 330038)
目的 探讨K-ras基因状态及ras蛋白表达在胃印戒细胞癌免疫表型分类中的意义。方法 应用组织芯片免疫组织化学技术检测180例胃印戒细胞癌组织中ras蛋白的表达;PCR扩增和DNA直接测序法检测癌组织中K-ras基因12、13密码子的突变情况。结果 ras蛋白阳性50例(27.8%),ras蛋白阳性表达率在肠型印戒细胞癌中显著高于胃型和混合型印戒细胞癌(P<0.05)。在淋巴结转移阳性组织中, ras蛋白阳性表达率明显高于无淋巴结转移组织(P<0.05);随着肿瘤侵袭、演进及临床分期的升高,ras蛋白阳性表达率明显增高(P<0.05)。K-ras基因突变型22例(12.2%)。所有突变位点均位于12密码子,突变类型包括:GGT→AGT 1例,GGT→TGT 1例,GGT→GCT 2例,GGT→GTT 8例,GGT→GAT 10例。13密码子未发现突变。肠型印戒细胞癌K-ras基因突变率显著高于胃型和混合型印戒细胞癌(P<0.05)。K-ras基因突变型病例ras蛋白阳性表达率明显高于K-ras基因野生型病例(P<0.05)。Spearman等级相关分析显示, ras蛋白表达与K-ras基因突变呈正相关(r=0.61,P<0.05)。结论 ras蛋白的过表达可能与胃印戒细胞癌侵袭潜能、淋巴结转移相关,ras蛋白表达和K-ras基因突变与肿瘤的免疫表型变化存在相关性,它们在癌细胞表型转化过程中可能起到一定作用。
胃肿瘤;基因,ras;蛋白质;印戒细胞癌;K-ras基因;淋巴结转移;靶向治疗
胃印戒细胞癌是胃腺癌中特殊的组织学亚型,细胞含丰富黏液,该类型主要呈弥漫侵袭性生长,进展迅速,预后差。本研究前期资料显示胃印戒细胞癌的胃肠免疫标记表达模式可能反映肿瘤的演进潜能,说明可能存在不同的分子遗传学背景[1]。K-ras基因属于Ras基因超家族,是重要的癌基因,第12、13密码子点突变是其常见的突变位点,可导致细胞恶性转化。ras蛋白是表皮生长因子受体(EGFR)传导通路中关键的信号分子,当K-ras基因突变后,ras发生构象变化,从而失去细胞传导作用,刺激细胞分裂、增殖,导致细胞癌变[2]。目前,K-ras基因已成为结直肠癌分子靶向治疗靶点之一。因此,本研究对肠型印戒细胞癌是否存在K-ras基因突变,并对其生物学行为及个体化治疗有关的问题进行研究。本研究通过检测K-ras基因状态及ras蛋白在不同免疫表型胃印戒细胞癌中表达差异,探讨ras蛋白和K-ras基因与印戒细胞癌的胃、肠分型的关系及其作为分子治疗靶点在靶向治疗中的可能性,为制订个性化治疗方案和评估预后提供科学依据。
1 资料与方法
1.1 一般资料 收集南昌大学第一附属医院病理科2004年10月至2010年12月手术切除的180例胃印戒细胞癌组织,术前未行放、化疗。其中,男74例,女106例;年龄16~84岁,中位年龄47岁;黏膜内癌57例,早期黏膜下浸润癌 40 例,进展期癌 83 例;有淋巴结转移77例,无淋巴结转移103例;有脉管浸润74例,无脉管浸润106例;有神经浸润60例,无神经浸润120例;TNM分期中,Ⅰ期91例,Ⅱ期10例,Ⅲ期33例,Ⅳ期46例。胃印戒细胞癌免疫表型分型:本组前期研究[1]根据胃印戒细胞癌胃、肠免疫表型标记[胃免疫表型特异性标记物:黏液素(MUC)1、MUC5AC、MUC6;肠免疫表型特异性标记物:MUC2、果蝇相关同源异形框转录因子(CDX2)]表达差异,将其分为3型:胃型印戒细胞癌(只表达胃免疫表型标记物)67例,肠型印戒细胞癌(只表达肠免疫表型标记物)42例,混合型印戒细胞癌(胃、肠免疫表型标记物均表达)71例。
1.2 方法
1.2.1 ras蛋白检测 采用Envision-IHC法检测组织芯片中ras蛋白的表达情况,ras蛋白多克隆抗体购自Novocastra公司,即用型工作液。以细胞质或细胞膜出现棕黄色颗粒判定为阳性。
1.2.2 PCR扩增和DNA直接测序法检测K-ras基因突变 石蜡包埋肿瘤组织DNA提取、PCR扩增,PCR产物在测序仪(ABI PRISM310)上完成测序,测序试剂为Big Dye terminator v2.0,采用DNA Star软件进行序列分析。
1.3 统计学处理 采用SPSS19.0软件进行处理,计数资料用率表示,组间比较采用χ2检验、Fisher精确检验和 Spearman等级相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 ras蛋白表达与印戒细胞癌免疫表型分类及临床病理参数的关系 180例胃印戒细胞癌中,ras蛋白阳性50例,表达率为27.8%。肠型病例ras蛋白阳性表达率显著高于胃型和混合型病例,比较差异有统计学意义(P<0.05)。在有淋巴结转移病例中,ras蛋白阳性表达率明显高于无淋巴结转移病例,比较差异有统计学意义(P<0.05);随着肿瘤侵袭、演进及临床分期的升高,ras蛋白阳性表达率明显增高,比较差异有统计学意义(P<0.05),见表1、图1。
2.2 K-ras基因突变与印戒细胞癌免疫表型分类及临床病理参数的关系 180例癌组织中,K-ras基因突变22例,突变率为12.2%。所有突变位点均位于K-ras基因12密码子,突变类型包括:GGT→AGT 1例,GGT→TGT 1例,GGT→GCT 2例,GGT→GTT 8例,GGT→GAT 10例。13密码子未发现突变。肠型病例K-ras基因突变率显著高于胃型和混合型病例,比较差异有统计学意义(P<0.05)。而K-ras基因突变率与临床病理参数之间比较差异无统计学意义(P>0.05),见表1、图2。
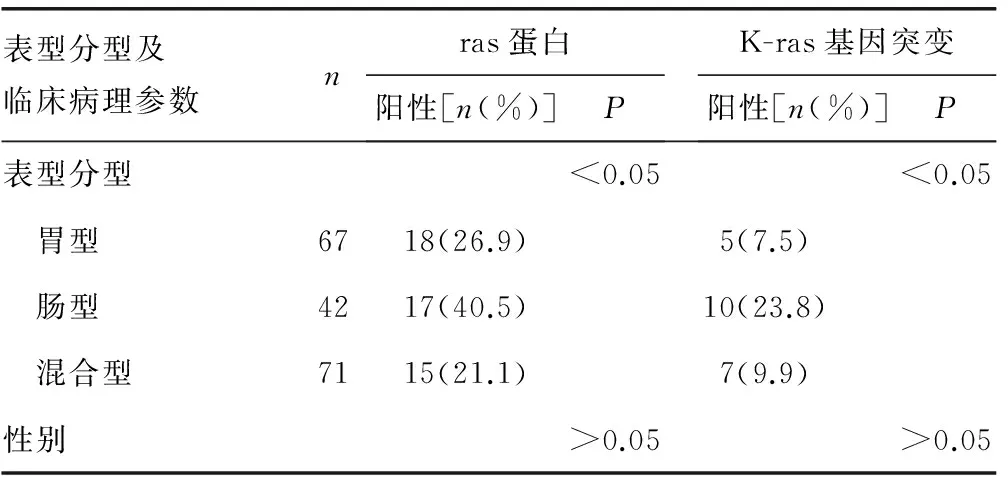
表1 不同免疫表型组K-ras基因状态及ras蛋白表达与临床病理参数的关系
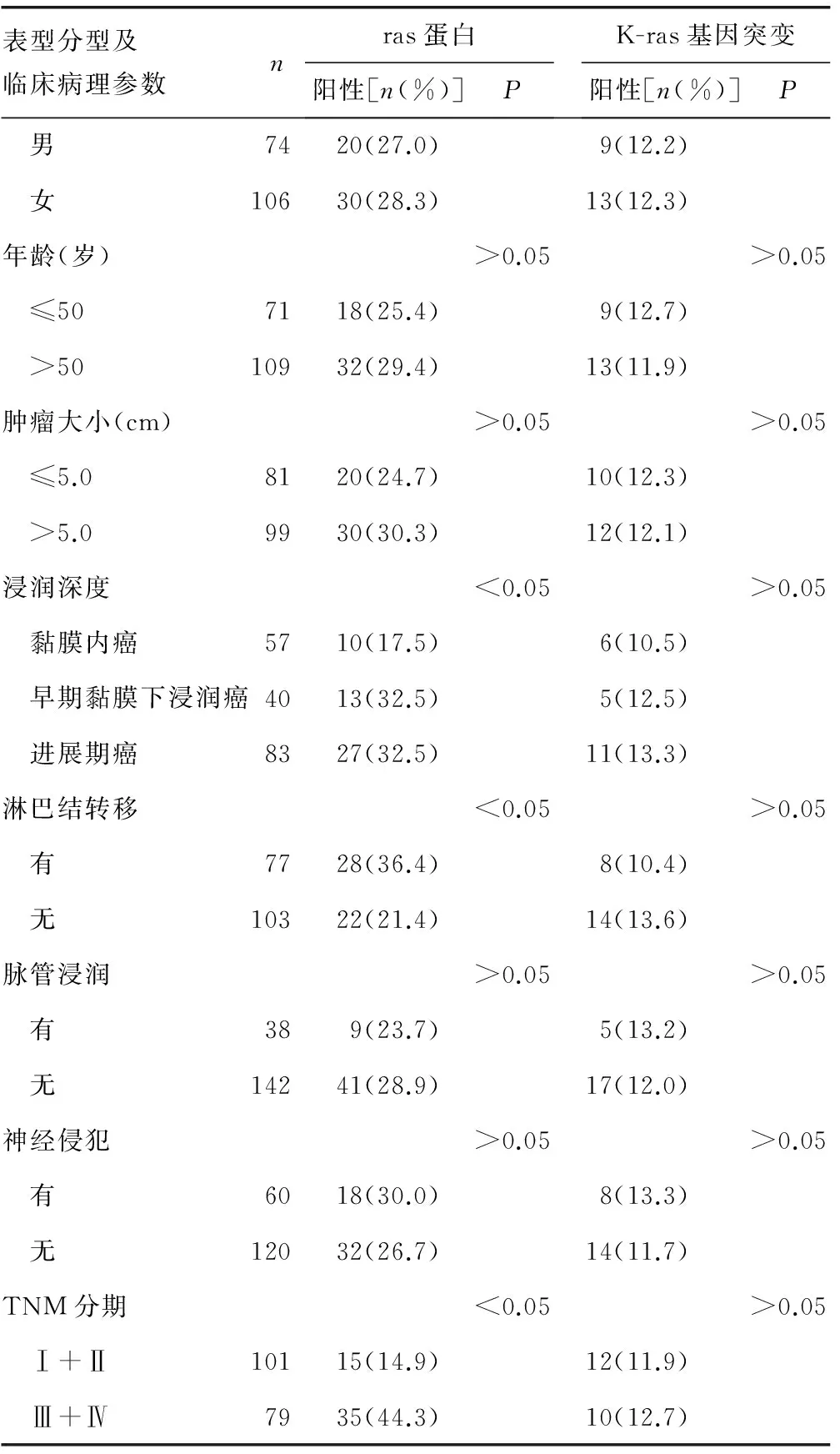
续表1 不同免疫表型组K-ras基因状态及ras蛋白表达与临床病理参数的关系
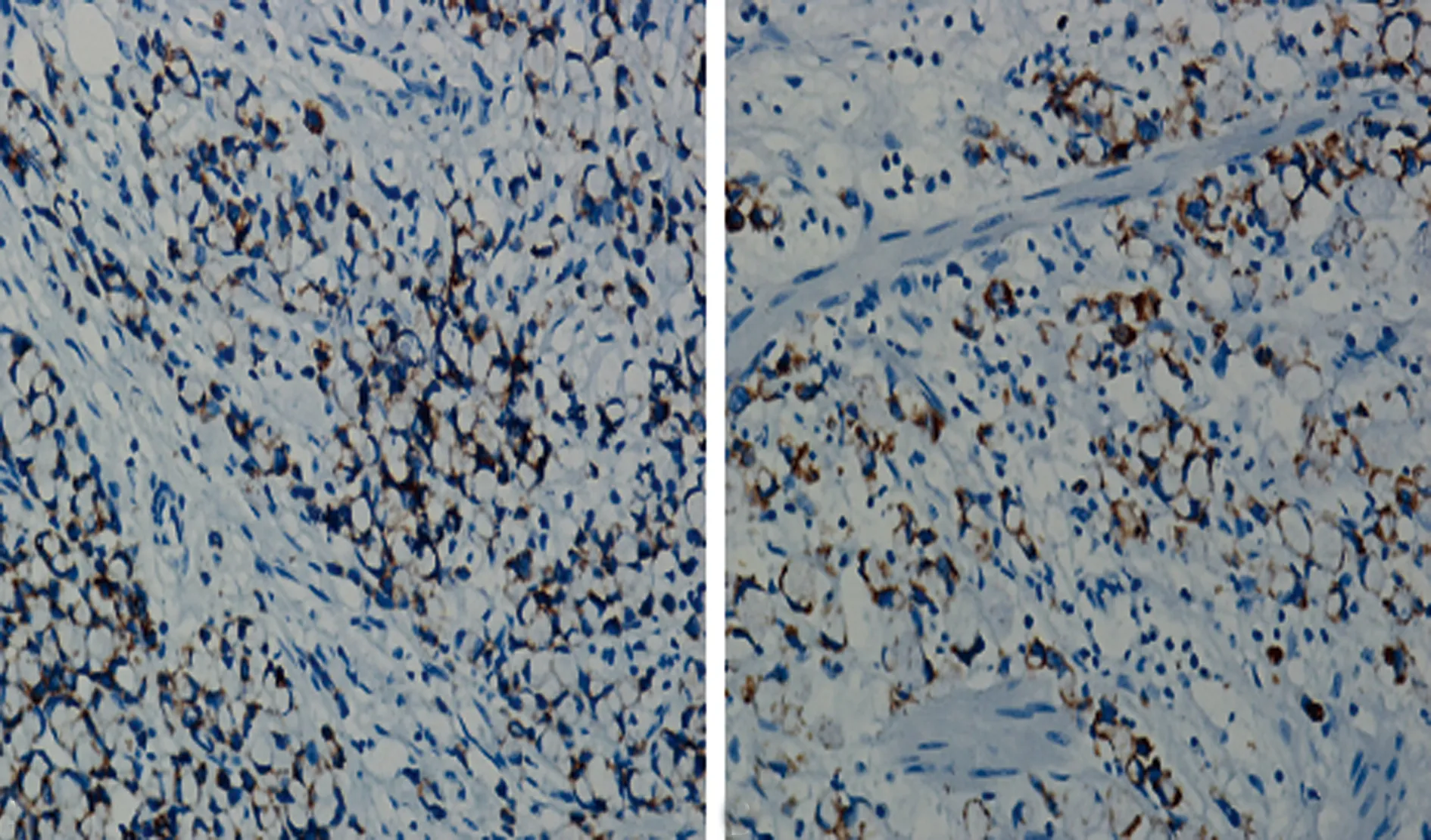
图1 肿瘤细胞ras蛋白阳性图(EnVision法,×200)
2.3 K-ras基因突变与ras蛋白表达的关系 22例K-ras基因突变型病例中,ras蛋白阳性表达13例,阳性率为59.1%。在158例K-ras基因野生型病例中, ras蛋白阳性表达37例,阳性率为23.4%。K-ras基因突变型病例ras蛋白阳性表达率明显高于K-ras基因野生型病例,比较差异有统计学意义(P<0.05)。Spearman等级相关分析显示,ras蛋白表达与K-ras基因突变呈正相关(r=0.61,P<0.05)。
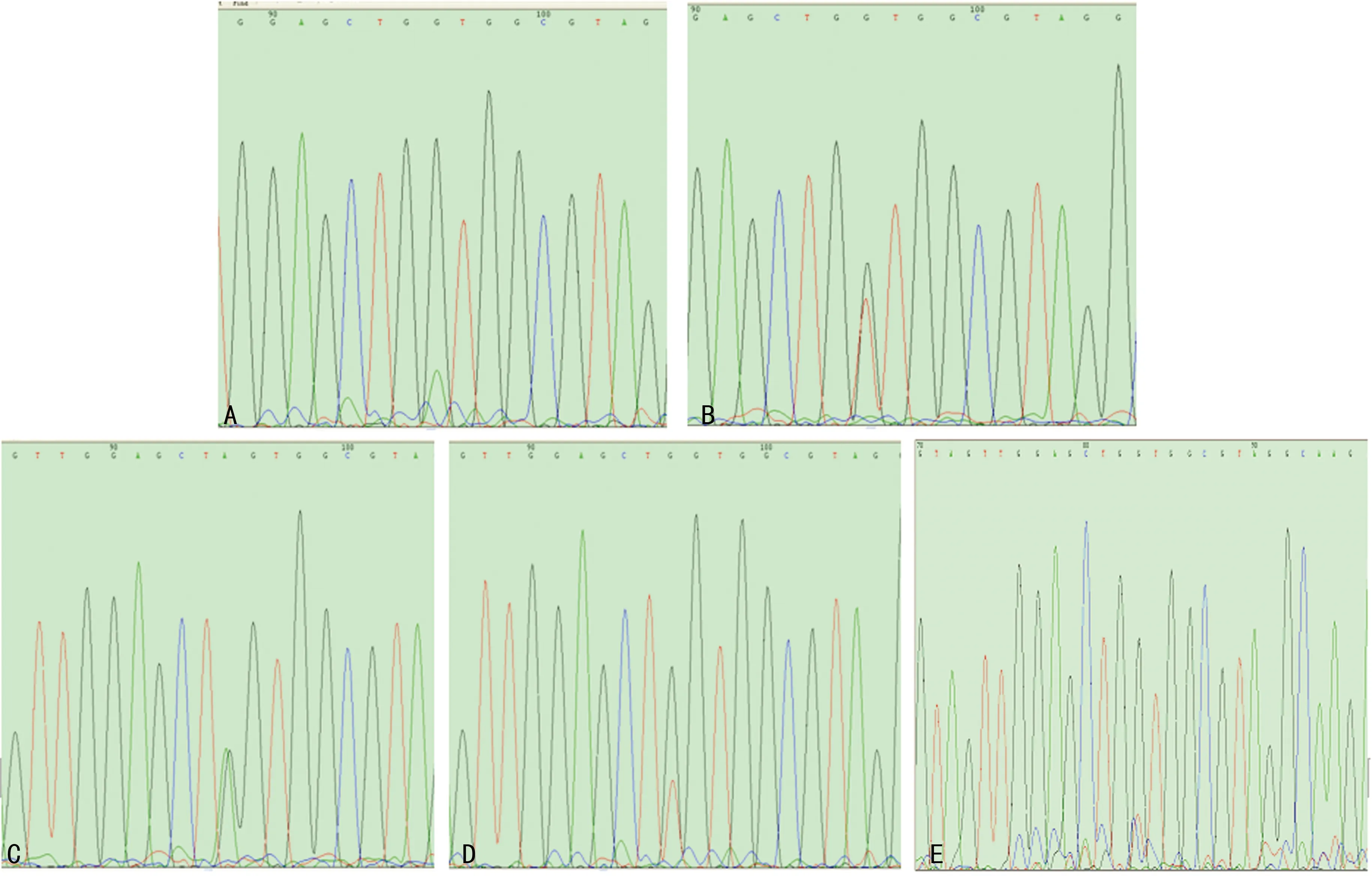
A:GGT→GAT;B:GGT→GTT;C:GGT→AGT;D:GGT→TGT;E:GGT→GCT。
图2 K-ras基因12密码子突变类型
3 讨 论
胃印戒细胞癌发病率在胃腺癌中占3.4%~39.0%[3-5]。它起源于黏膜固有层内腺颈部未分化的干细胞,细胞富含黏液[6]。与其他类型腺癌比较,印戒细胞癌具有分化差、侵袭性强、进展迅速、预后差等特点,是胃腺癌中最特殊的组织病理学类型。
K-ras基因是重要的原癌基因,编码相对分子质量为21×103的ras蛋白,而ras蛋白是EGFR传导通路中关键的信号分子,当K-ras基因突变后,ras蛋白构象发生变化,不受上游EGFR信号通路的控制,不断刺激细胞无休止地分裂、增殖[7-8]。
在实际工作中,K-ras基因已成为结直肠癌分子靶向治疗的标靶之一,随着对胃癌基因分子分型研究的不断深入,其治疗的分子标靶逐渐成为研究的热点。基于此,本课题组前期研究即根据胃印戒细胞癌胃、肠免疫表型标记表达差异,将其分为胃型、肠型和混合型3个不同类型,发现这3个类型预后存在差异[1]。而本研究结果显示,ras蛋白表达和K-ras基因突变状态于3组间亦存在差异。肠型病例中ras蛋白阳性表达率显著高于胃型和混合型病例,这说明ras蛋白可能与肿瘤的胃、肠免疫表型变化存在相关性,在癌细胞表型转化过程中可能起到一定作用。Gimori等[9]研究显示,ras蛋白表达与临床病理参数之间无相关性;Atkar等[10]资料表明, ras蛋白表达程度与肿瘤的分化程度有关;Okumura等[11]的结果则说明ras蛋白可能增强肿瘤的浸润进展、侵袭和转移能力。本研究结果显示,随着ras蛋白表达升高,瘤组织更易进展、浸润,且更易出现淋巴结转移,说明ras蛋白表达与差的肿瘤生物学行为及肿瘤演进有一定相关性, ras蛋白可能参与肿瘤细胞浸润和扩散,在一定程度上能够反映肿瘤的生物学行为。有文献报道ras蛋白的高表达可促进癌细胞溶解细胞外基质和胶原纤维,使细胞获得较强的浸润和转移潜能[12],这是否能促进癌细胞的血道、淋巴道及远处转移,尚待进一步研究。
近年来研究者发现,胃腺癌中也存在一定比例K-ras基因突变,与胃癌发生、发展密切相关,是胃癌发生的早期事件[13-15]。本研究显示在胃印戒细胞癌中,K-ras基因突变率仅为12.2%,突变率较其他胃腺癌类型偏低,且突变位点集中在12密码子,13密码子未发现突变,说明在印戒细胞癌的发生发展中,K-ras基因突变不起主导作用,突变位点较其他类型胃腺癌也存在差异。与胃型和混合型病例相比,肠型病例有较高的K-ras基因突变率,这表明K-ras基因突变对胃、肠表型变化有重要作用,证实了这种免疫表型分型存在不同的分子遗传学背景。本研究还显示,K-ras基因突变与淋巴结转移、浸润深度、临床分期等均无显著相关性,因此进一步研究参与胃印戒细胞癌侵袭、转移的信号传导通路,阐明肿瘤的发生、发展机制,寻找新的分子治疗靶点具有十分重要的意义。
由于肠型印戒细胞癌存在较高的ras蛋白表达和K-ras基因突变率,对其个体化治疗有无价值,需要对ras及相关信号通路进一步研究。
[1]熊振芳,肖海,谭云山.早期胃印戒细胞癌免疫表型的临床病理意义[J].中华病理学杂志,2010,39(7):442-446.
[2]Esteller M,Tovota M,Sanche Z,et al.Inactivation of the DNA repair gene with G to A mutations in K-ras in colorectal tumorigenesis[J].Cancer Res,2000,60(9):2368-2371.
[3] Kwon KJ,Shim KN,Song EM,et al. Clinicopathological characteristics and prognosis of signet ring cell carcinoma of the stomach[J].Gastric Cancer,2014,17(1):43-53.
[4]PhalanusitthephaC,GrimesKL,IkedaH,etal.Endoscopicfeaturesofearlystagesignetringcellcarcinomaofthestomach[J].WorldJGastrointestEndosc,2015,7(7):741-746.
[5]Cancer Genome Atlas Reseach Network.Comprehensive molecular characterization of gastric adenocarcinoma[J].Nature,2014,513(7517):202-209.
[6] Taghavi S,Jayarajan SN,Davey A,et al.Prognostic significance of signet ring gastric cancer[J].J Clin Oncol,2012,30(28):3493-3498.
[7]Pernot S,Voron T,Perkins G,et al.Signet-ring cell carcinoma of the stomach:impact on prognosis and specific therapeutic challenge[J].World J Gastroenterol,2015,21(40):11428-11438.
[8]Japanese Gastric Cancer A.Japanese gastric cancer treatment guidelines 2010[J].Gastric Cancer,2011,14(2):113-123.
[9]Gimori Y,Inokuchi M,Takagi Y,et al.Prognostic value of RKIP and p-ERK in gastric cancer[J].J Exp Clin Cancer Res,2012,31(1):30.
[10]Atkar SS,Durham A,Brice A,et al.Systemic activation of K-Ras rapidly induces gastric hyperplasia and metaplasia in mice[J].Am J Cancer Res,2011,1(4):432-445.
[11]Okumura T,Erichsen RE,Takaishi S,et al.K-Ras mutation targeted to gastric tissue progenitor cells results in chronic inflammation,an altered microenvironment,and progression to intraepithelial neoplasia[J].Cancer Res,2010,70(21):8435-8445.
[12]Thorgeirsson UP,Turpeenniemi T,Williams JE,et al.NIH/3H3 cells transfected with human tumor DNA containing activated ras oncogenes express the metastatic phenotype in nude-mice[J].Mol Cell Biol,1985,5(1):259-263.
[13]Takahashi N,Yamada Y,Taniguchi H,et al.Clinicopathological features and prognostic roles of KRAS,BRAF,PIK3CA and NRAS mutations in advanced gastric cancer[J].BMC Res Notes,2014,7(1):271.
[14]Zimmermann G,Papke B,Ismail S,et al.Small molecular inhibition of the KRAS-PDE interaction impairs oncogenic KRAS signaling[J].Nature,2013,497(7451):638-642.
[15]Ostrem JM,Peters U,Sos ML,et al.K-Ras (G12C) inhibitors allosterically control GTP affinity and effector interactions[J].Nature,2013,503(7477):548-551.
Significance of K-ras gene status and ras protein expression in immunophenotypic classification of gastric signet ring cell carcinoma*
XiongQiuying1,XiongXin1,HuXiuhua2,TuLuxia1,XiongZhenfang1△
(1.DepartmentofPathology,theFirstAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China; 2.DepartmentofEmergencyWard,HongduChineseMedicineHospital,Nanchang,Jiangxi330038,China)
Objective To investigate the significance of K-ras gene status and ras protein expression in immunophenotypic classification of gastric signet ring cell carcinoma.Methods The expression of ras protein in 180 cases of gastric signet-ring cell carcinoma was detected by tissue microarray immunohistochemistry.Meanwhile,the mutation in codon 12,13 of K-ras gene was determined by using PCR-based DNA direct sequencing analysis.Results The rate of ras protein expression was 27.8%.The rate of ras protein expression in intestinal phenotype was significantly higher than those in gastric and gastrointestinal phenotypes(P<0.05).The rate of ras protein expression in cases with lymph node metastasis was significantly higher than those in cases without nodal involvement(P<0.05).The rate of ras protein expression was significantly higher in cases with deeper invasion(P<0.05).The frequency of K-ras gene mutation was 22(12.2%).All of them were found in codon 12.The types of mutation included GGT→AGT(1 case),GGT→TGT(1 case),GGT→GCT (2 cases),GGT→GTT (8 cases) and GGT→GAT(10 cases).K-ras mutation was significantly associated with intestinal phenotype(P<0.05).The rates of ras protein expression in cases with mutational type of K-ras gene was higher than those in cases with wild type(P<0.05).The ras protein expression was positively associated with K-ras gene mutation(r=0.61,P<0.05).Conclusion The ras protein expression is correlated with nodal involvement and invasion.K-ras gene mutation and expression of ras protein is related to phenotypic classification,and they might influence the phenotypic transformation in gastric signet ring cell carcinoma.
stomach neoplasms;genes,ras;proteins;signet ring cell carcinoma;K-ras gene;lymph node metastasis;targeting therapy
10.3969/j.issn.1671-8348.2017.15.004
江西省卫生计生委科技计划项目(20155179)。 作者简介:熊秋迎(1976-),主管技师,本科,主要从事肿瘤分子病理学及病理技术方面研究。△
,E-mail:xiongzhenfang0408@126.com。
R735.2
A
1671-8348(2017)15-2027-03
2016-11-20
2017-01-08)
