阿糖胞苷通过自噬途径影响K562细胞增殖凋亡的实验研究
2017-06-05刘泽洪陈晓露
罗 昊,孟 赞,刘泽洪,陈晓露
(1.乐山职业技术学院人体解剖学与组织胚胎学教研室,四川乐山 614000;2.三峡医药高等专科学校病理学教研室,重庆万州 404120;3.乐山职业技术学院病理学教研室,四川乐山 614000)
论著·基础研究
阿糖胞苷通过自噬途径影响K562细胞增殖凋亡的实验研究
罗 昊1,孟 赞1,刘泽洪2,陈晓露3△
(1.乐山职业技术学院人体解剖学与组织胚胎学教研室,四川乐山 614000;2.三峡医药高等专科学校病理学教研室,重庆万州 404120;3.乐山职业技术学院病理学教研室,四川乐山 614000)
目的 探讨阿糖胞苷(Ara-C)通过自噬途径影响人红白血病K562细胞株增殖、凋亡的作用及可能的机制。方法 采用CCK-8法检测不同浓度的Ara-C作用24 h和48 h后细胞增殖抑制率;流式细胞术(FCM)检测凋亡率和周期;Hoechest染色观察细胞核染色质的形态,吖啶橙染色观察细胞酸性自噬小泡;Western blot检测p38和p-p38蛋白表达变化;RT-PCR和免疫荧光检测自噬凋亡相关基因和蛋白的表达水平。结果 CCK-8检测发现不同浓度的Ara-C均能抑制K562细胞增殖,并呈浓度和时间依赖性;FCM检测显示Ara-C能增加细胞的凋亡和将细胞周期阻滞在S期;Hoechest染色发现Ara-C处理K562细胞后呈凋亡形态改变;吖啶橙染色发现Ara-C组细胞绿色荧光增强,细胞出现大量的酸性自噬小泡;RT-PCR检测发现Ara-C上调自噬关键基因Beclin-1、LC3A和LC3B表达;Western blot检测发现Ara-C增加磷酸化p38表达;免疫荧光检测发现Ara-C增加LC3表达。结论 Ara-C能够激活p-p38介导的K562细胞发生自噬,进而抑制细胞增殖和促进细胞凋亡作用。
阿糖胞苷;白血病;自噬;细胞凋亡
[Abstract] Objective To investigate the effect of cytarabine (Ara-C) on proliferation and apoptosis of human erythroleukemia K562 cell line through autophagy pathway and its possible mechanism.Methods The cellular proliferation inhibiting rate after different concentrations of Ara-C acting for 24,48 h was detected by CCK-8;the cell cycle and apoptosis were detected by flow cytometry(FCM);the chromatin morphological changes in nucleus were observed by Hoechst staining;the cell acidic autophagy vesicles were detected by acridine orange staining;the expression changes of p38 and p-p38 proteins were detected by Western blot.The expressions of autophagy apoptosis related gene and protein were examined by RT-PCR and immunofluorescence.Results The CCK-8 results found that different concentrations of Ara-C could inhibit the proliferation of K562 cells with dose- and time-dependent manners.FCM detecting indicated that Ara-C could increase apoptosis and could arrest the cell cycle at S phase;Hoechest staining showed that K562cells had typical apoptotic morphological changes after Ara-C treating;the Acridine orange staining revealed that Ara-C caused the inclease of the green fluorescene in cells of the Ara-C group,and the cells appeared a great number of acidic autophagy vesicles;RT-PCR results showed that Ara-C up-regulated the expression of autophagy key genes Beclin-1,LC3A and LC3B;Western blot results showed that Ara-C increased the expression of phosphorylated p-p38.Immunofluorescence results showed the expression of LC3B was significantly enhanced.Conclusion Ara-C can activate p-p38 mediated K562 cells to generate autophagy,then inhibit the cell proliferation and promotes apoptosis.
红白血病是以红、白(主要是粒细胞)两系恶性增生的白血病,其发病机制为造血干细胞分化障碍,细胞周期调控紊乱,细胞凋亡受阻的恶性造血系统肿瘤[1]。阿糖胞苷(Ara-C)是白血病化疗的常见药物,其药理机制是抑制细胞内DNA合成,阻滞细胞增殖的嘧啶类代谢药物[2]。现临床运用的Ara-C 有3种剂量,分别为高、中、低剂量,其治疗的效果有差异,低剂量Ara-C能诱导白血病细胞分化,高剂量Ara-C能促进细胞凋亡作用和增强其他化疗药物的敏感性[3]。自噬受到自噬相关基因调控,具有调节细胞的生存及凋亡的功能,也参与了肿瘤发生、发展的过程[4]。自噬基因的大量激活可导致细胞自噬增加,最终引起自噬性细胞死亡(也称Ⅱ型程序性细胞死亡)[5]。因此,抗肿瘤药物可以通过自噬途径杀伤肿瘤细胞。
1 材料与方法
1.1 材料 人红白血病K562细胞株购自上海ATCC细胞库。每次取对数生长期的K562细胞以1×109个/L接种于10% 胎牛血清的RPMI 1640培养基中,在37 ℃,5% CO2饱和湿度下培养,每1~2 d传代和换液。
1.2 仪器与试剂 Ara-C购自美国Sigma公司,用PBS配制成0.1 mol/L的储存液,-20 ℃条件下避光保存,实验时用含血清的培养液稀释成工作液。胎牛血清、RPMI 1640培养基(美国Hyclone公司),CCK-8试剂盒(日本同仁化学研究所),Hoechest染液(江苏碧云天生物公司),吖啶橙(美国Sigma公司),p-38、p-p38、LC3B抗体(美国Cell Signaling Technology),荧光显微镜(日本Nikcon公司),酶标仪(550型)、Western blot电泳仪、PCR仪(美国Biorad公司),流式细胞仪(BD公司)。

表1 实时荧光定量PCR 相关基因引物序列
1.3 方法
1.3.1 CCK-8 法 培养对数生长期的K562细胞,以1×104个/孔接种于96孔板中。分别加入不同浓度的Ara-C(0~7.5 μmol/L),培养24、48 h后,每孔加入10 μL CCK-8检测液,轻轻摇匀,孵育2 h 后,用酶标仪(波长450 nm)检测每孔吸光度(A)值,并计算Ara-C的细胞增殖抑制率和半数抑制浓度(IC50)。
1.3.2 FCM检测周期 培养对数生长期的K562细胞,调整细胞浓度分别至5×108/L,接种于6孔细胞培养板中。分别加入不同浓度的Ara-C(0、2.5、5.0 μmol/L)作用48 h后,分别收集各组细胞,用预冷PBS洗涤1次,加入75%乙醇于4 ℃固定过夜,去除固定液后,加入0.5 mL含PI和RNAase A的DNA 染液,室温避光孵育30 min,流式细胞仪分析细胞DNA水平,根据DNA水平计算细胞周期,重复实验3次。
1.3.3 FCM检测凋亡 培养对数生长期的K562细胞,调整细胞浓度分别至5×108个/L,接种于6孔细胞培养板中。分别加入不同浓度的Ara-C(0、2.5、5.0 μmol/L)作用48 h后,分别收集各组细胞,用预冷PBS洗涤1次,4 ℃ 1 200×g离心5 min。检测前离心去除固定液,加入碘化丙啶(PI) 和Annexin V,置于冰上染色处理30 min,每组细胞1×105个,行流式细胞仪检测,此实验重复3次。
1.3.4 吖啶橙染色 K562细胞用Ara-C(5.0 μmol/L)作用24 h后,分别收集各组细胞,用预冷PBS洗涤1次。用新配制的吖啶橙(2 μ/mL),37 ℃避光孵育15 min,用PBS漂洗3次后,调整细胞浓度,取一滴细胞悬液滴到玻片上,待细胞沉积到玻片上时,吸去上层液体,封片置于荧光显微镜下观察酸性的自噬小泡,实验重复3次。
1.3.5 Hoechst染色 K562细胞用Ara-C(5.0 μmol/L)作用24 h后,分别收集各组细胞,加固定液室温固定20 min,用预冷PBS洗涤1次。直接加入Hoechst染色液避光、室温染色15 min,PBS洗涤3次,再加PBS制成细胞悬液,调整细胞浓度,滴在载玻片上,封片,观察,采图,实验重复3次。
1.3.6 RT-PCR 参照试剂盒说明书进行,Trizol提取细胞织总RNA。采用TaKaRa的反转录酶试剂和反转录cDNA。应用TaKaRa的SYBRⅡ试剂,PCR反应体系为10 μL。检测自噬重要基因的mRNA 水平。引物由上海生工生物公司提供,引物序列见表1。以GAPDH为内参基因,用目的基因与GAPDH 的起始拷贝数比值表示目的基因的相对表达量,实验重复3次。
1.3.7 Western blot K562细胞用Ara-C(5.0 μmol/L)作用24 h后,分别收集各组细胞,预冷PBS洗涤2次,用RIPA蛋白裂解液提取细胞总蛋白,4 ℃离心后取上清液。BCA法测得蛋白浓度,沸水中煮沸至蛋白完全变性后,保证每孔中有40 μg待测蛋白样品,行SDS-PAGE电泳,电转移至PVDF膜,5%脱脂奶粉室温封闭2 h后,分别加入抗体p38、p-p38和β-Actin按1∶1 000稀释抗体,4 ℃孵育过夜;以1∶2 000稀释的辣根过氧化物酶标记二抗,再用TBST漂洗3次,每次10 min置于脱色摇床上;最后在保鲜膜上滴入ECL化学发光液,在暗室进行X胶片曝光,洗片,胶片晾干后。扫描胶片,Quantity One软件定量分析,此实验重复3次。
1.3.8 免疫荧光 K562细胞用Ara-C(5.0 μmol/L)作用48 h后,收集细胞,用固定液在室温下固定细胞30 min后,用0.3% Triton X-100破膜处理10 min,PBS漂洗3次。在37 ℃湿盒内用5%山羊血清封闭30 min后,分别加入一抗LC3B(1∶200),4 ℃孵育过夜后,于37 ℃复温1 h,PBS漂洗3次,再加入1∶500稀释的红色荧光标记山羊抗兔IgG(H+L),室温避光孵育40 min;最后加入PI作用1 min后,PBS漂洗3次,封片,显微镜观察并采图,实验重复3次。

2 结 果
2.1 Ara-C抑制K562细胞增殖 CCK-8测细胞增殖抑制实验显示,不同浓度的Ara-C(0.625、1.25、2.5、5.0、7.5 μmol/L) 处理K562细胞24 h 和48 h 后,各组细胞的增殖明显受到抑制,并呈时间和浓度依赖性(见图1)。其中Ara-C(7.5 μmol/L)作用24 h 时,细胞增殖抑制率达45.93%±2.47%,作用48 h时达66.10%±4.50%,而Ara-C作用K562细胞48 h 时,半数抑制率为5 μmol/L左右。
2.2 Ara-C阻滞K562细胞周期在S期 不同浓度的Ara-C(2.5、5.0 μmol/L)处理K562细胞48 h 后,FCM检测结果显示,随药物浓度的增加,Ara-C(2.5、5.0 μmol/L)与空白对照组相比,G0/G1和G2/M期细胞比例降低,差异有统计学意义(P<0.05); Ara-C(2.5、5.0 μmol/L)与空白对照组相比,S期细胞比例增加,差异有统计学意义(P<0.05),见表2。

图1 Ara-C对K562细胞的增殖抑制作用

Ara-C(μmol/L)G0/G1G2/MS042.96±3.4613.02±3.4453.02±3.482.536.11±1.977.29±3.7156.60±2.305.031.16±2.303.36±3.2365.48±4.00
2.3 Ara-C诱导K562细胞凋亡 不同浓度的Ara-C(2.5、5.0 μmol/L) 处理K562细胞48 h 后,FCM检测结果显示随药物浓度的增加细胞早期和晚期凋亡数量明显增多,其早期凋亡率分别为5.09%±0.87%、11.00%±1.76%,且随着浓度的增高,早期凋亡率增高,分别与空白对照组(3.18%±0.52%)相比,差异有统计学意义(P<0.05);晚期凋亡率分别为5.78%±1.02%、18.32%±2.16%,且随着浓度的增高,晚期凋亡率增高,分别与空白对照组(1.19%±0.42%)相比,差异均有统计学意义(P<0.05),见表3。

表3 Ara-C对K562细胞凋亡的影响
2.4 Hoechst染色检测细胞凋亡 Ara-C(5.0 μmol/L)诱导K562细胞24 h后,用Hoechst染色显示,细胞核出现染色质浓缩、核碎裂、核边集的细胞凋亡现象,并且细胞发出蓝色荧光较空白对照组细胞强,说明Ara-C能诱导K562细胞凋亡(图2)。

图2 Hoechst染色检测细胞凋亡
2.5 Ara-C诱导 K562细胞自噬 Ara-C(5.0 μmol/L)诱导K562细胞24 h后,用吖啶橙染色后,观察细胞内的酸性自噬泡,细胞内绿色小泡代表酸性自噬小体。Ara-C诱导后,与对照组比较,细胞内酸性的自噬小泡明显增加,而对照组细胞绿色的自噬小泡基本看不见。

图3 吖啶橙染色检测细胞自噬
2.6 Ara-C影响自噬重要基因的表达 RT-PCR检测结果如图6显示,与对照组比较,K562细胞经Ara-C(5.0 μmol/L)作用24 h后,自噬重要基因(Atg3、Atg12)在细胞中变化不明显,而自噬最重要的基因Atg5、Atg7、Beclin-1、LC3A、LC3B表达上调,差异有统计学意义(P<0.05),其中自噬关键基因Beclin-1、LC3A、LC3B表达上调尤为明显。

*:P<0.05,与对照组比较。
图4 RT-PCR检测Ara-C影响自噬重要基因的表达

*:P<0.05,与空白对照组比较。
图5 Western blot检测Ara-C影响MAPK通路
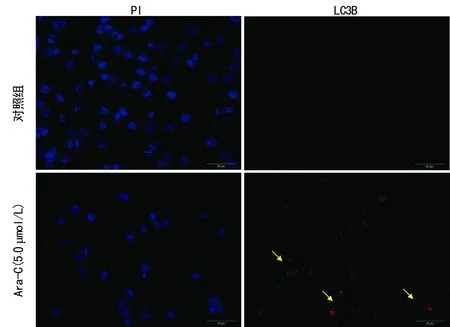
图6 免疫荧光检测LC3B的表达
2.7 Western blot检测Ara-C对MAPK通路的影响 Western blot结果如图6显示,与对照组比较,K562细胞经Ara-C(2.5、5.0 μmol/L)作用24 h后。与空白对照组相比,随浓度的升高,p38表达无明显差异,然而p-p38表达随Ara-C浓度增加其表达水平明显升高,差异有统计学意义(P<0.05),说明Ara-C能激活MAPK信号通路。
2.8 免疫荧光检测LC3B的表达 与对照组比较,K562细胞经Ara-C(5.0 μmol/L)作用24 h后,自噬重要蛋白LC3B表达主要在细胞质中,图中可见Ara-C作用后,细胞质中的LC3B表达增加,说明Ara-C能诱导细胞自噬(图6)。
3 讨 论
临床实践证明,Ara-C在高、中、低3种不同剂量治疗急性髓性白血病有不同的疗效,其中大剂量Ara-C的使用会对机体产生极大的伤害[3]。本实验采用了CCK-8法检测Ara-C对人红白血病K562细胞增殖的影响。结果表明Ara-C能有效抑制K562细胞增殖,但是高剂量是并没有极大改变Ara-C对白血病细胞的增殖,为临床上运用大剂量的Ara-C不能增加疗效提供体外实验依据。Ara-C是嘧啶类抗代谢药物,能阻滞细胞周期在S期,其药理机制是阻止细胞DNA合成,从而阻滞细胞增殖[2]。FCM结果显示,Ara-C可将K562细胞周期阻滞在S期,提示Ara-C可能通过细胞周期阻滞来抑制K562细胞增殖。
细胞自噬和凋亡密切相关,凋亡的早期,细胞出现应激反应,会出现自噬[5]。自噬异常与肿瘤的发生发展关系密切,可以从不同的生物学行为影响肿瘤的进程,其中有细胞周期、增殖、凋亡、耐药、血管生成及肿瘤的治疗等方面的调控[6]。文献[7]研究报道,自噬和细胞凋亡的关系存在两面性,维持细胞生存和促进细胞死亡。为了探讨Ara-C对白血病细胞自噬凋亡的关系,笔者运用了吖啶橙染色,发现加药组早期细胞出现酸性的自噬泡增多,RT-PCR结果显示自噬关键基因(Beclin-1、LC3A和LC3B)的表达均升高,证明了Ara-C能诱导白血病细胞发生自噬。Ara-C也能促进细胞的凋亡,FCM和Hoechst染色无论从数量上还是从形态上都说明了Ara-C能够促进K562细胞的凋亡。本实验结果显示了不同浓度的Ara-C可以诱导K562细胞自噬,也可以诱导细胞凋亡,证明Ara-C能够通过自噬途径抑制K562细胞增殖,促进细胞凋亡。
自噬的分子诱导机制复杂且具有高度保守性,MAPK参与调节自噬活性,从而在肿瘤的发生发展过程中发挥重要作用。在肿瘤药物中JNK、ERK和p38的磷酸化水平都发生改变,激活p38可以激活细胞自噬和凋亡[7-8]。本文将研究的重心转移到p38这个可以调节细胞死亡和自噬的关键因子,Western blot实验证明Ara-C能改变细胞中磷酸化p38的水平,这说明Ara-C能激活MAPK信号通路。
LC3B是自噬关键蛋白,其含量在一定程度上反映了自噬活性[9-10]。实验运用免疫荧光检测LC3B时,发现Ara-C能够增加LC3B的表达。还有FCM和Hoechst染色无论从数量上还是从形态上都说明了Ara-C能够促进K562细胞的凋亡,这说明Ara-C能够通过自噬途径诱导K562细凋亡。
综上所述,Ara-C在体外能够抑制白血病细胞增殖,阻滞细胞周期和诱导凋亡,其机制可能是通过激活MAPK信号通路,调控细胞自噬,从而抑制白血病细胞增殖和促进细胞凋亡。
[1]Musch T,Oz Y,Lyko F,et al.Nucleoside drugs induce cellular differentiation by caspase-dependent degradation of stem cell factors [J].PLoS One,2010,5(5):107-126.
[2]陈丽韵,贾培敏,童建华,等.阿糖胞苷诱导白血病细胞株U937自噬作用的实验观察[J].诊断学理论与实践,2013,12(2):185-188.
[3]陈姣,王晓冬,王春森.不同剂量阿糖胞苷对急性髓性白血病缓解后巩固治疗的疗效分析[J].临床血液学杂志,2016,19(3):219-223.
[4]Shintani T,Klionsky DJ.Autophagy in health and disease:a double-edged sword [J].Science,2004,306(5698):990-995.
[5]Klionsky DJ.Autophagy [J].Current Biol,2005,15(8):282-293.
[6] Meijer AJ,Codogno P.Signalling and autophagy regulation in health,aging and disease [J].Mol Aspects Med,2006,27(5):411-425.
[7]Ma Q,Chang Z,Wang W,et al.Rapamycin-mediated mTOR inhibition reverses drug resistance to adriamycin in colon cancer cells [J].Hepato-Gastroenterology,2015,62(140):880-886.
[8]郭晓,潘崚,侯兰芬,等.ERK和P38信号转导途径对慢性髓系白血病细胞周期的调控作用[J].中国实验血液学杂志,2007,15(2):242-247.
[9]Moscat J,Diaz-Meco MT.p62 at the crossroads of autophagy,apoptosis and cancer [J].Cell,2009,137(6):1001-1004.
[10]Colecchia D,Rossi M,Sasdelli F,et al.MAPK15 mediates BCR-ABL1-induced autophagy and regulates oncogene-dependent cell proliferation and tumor formation [J].Autophagy,2015,11(10):790-802.
《重庆医学》对临床研究论文医学伦理学要求
凡投本刊的涉及人的生物医学研究论文,作者应说明所在用的试验程序是否经过伦理审查委员会(单位性的、地区性的或国家性的)评估,注明批准号。涉及患者(受试者)的应签订知情同意书。
《重庆医学》编辑部
Experimental study on influence of cytarabine on K562 cells proliferation and apoptosis by autophagy pathway
Luo Hao1,Meng Zan1,Liu Zehong2,Chen Xiaolu3△
(1.Department of Human Anatomy,Histology and Embryology,Leshan Vocational and Technical College,Leshan,Sichuan 614000,China;2.Department of Pathology,Three Gorges Medical College,Chongqing 404120,China;3.Department of Pathology,Leshan Vocational and Technical College,Leshan,Sichuan 614000,China)
Ara-C;leukemia;autophagy;cell apoptosis
10.3969/j.issn.1671-8348.2017.13.003
罗昊(1979-),硕士,讲师,主要从事解剖组胚和白血病方面的研究。△
,E-mail:173290788@qq.com。
R733.7
A
1671-8348(2017)13-1736-04
2016-11-20
2017-01-08)
