长链非编码RNA TUG1在恶性肿瘤中的研究进展
2017-06-05刘安文
熊 乐,卢 婍,刘安文
·综 述·
长链非编码RNA TUG1在恶性肿瘤中的研究进展
熊 乐1,卢 婍2,刘安文1
长链非编码RNA(long chain non coding RNA, LncRNAs)近年来成为研究的热点。牛磺酸上调基因1(taurine upregulated gene 1, TUG1)是牛磺酸作用小鼠视网膜细胞后表达上调基因1,与肿瘤的发生、发展密切相关。TUG1在多种肿瘤中表达上调,其主要通过ceRNA模式与转录因子竞争性结合miRNA、调控细胞周期蛋白依赖性激酶抑制因子及影响肿瘤血管生成等途径参与肿瘤的发生、发展。进一步研究发现,TUG1还可作为肿瘤的预后标志物,在肿瘤的早期诊断、疗效判断及预后评估等方面具有重要的应用前景。
恶性肿瘤;长链非编码RNAs;TUG1;肿瘤标志物
长链非编码RNA(long chain non coding RNA, LncRNAs)是指转录本超过200个核苷酸的非编码RNAs,其本身不编码蛋白。牛磺酸上调基因1(taurine upregulated gene 1, TUG1)是长链非编码RNAs的一种,近年研究显示,TUG1在多种恶性肿瘤(肺癌除外)中高表达,与肿瘤的发生、发展密切相关,在恶性肿瘤的诊断、治疗中有着重要的潜在应用前景。本文主要从TUG1的结构功能及其与肿瘤的关系作一综述。
1 TUG1的结构及功能
TUG1全长7.1 kb,位于人22号常染色体长臂1区2号带2亚带(22q12.2)。它是2005年Young等[1]用牛磺酸对小鼠视网膜细胞处理后表达上调的基因之一,故因此命名。Khalil等[2]通过免疫共沉淀证实TUG1主要招募并结合多梳抑制复合体(polycomb repressive complex 2, PRC2),调控某些生长控制基因的表达;TUG1还可以通过ceRNA模式与转录因子竞争性结合miRNA,这两者是LncRNA调控肿瘤细胞生物学功能的共同机制。PRC2具有甲基化转移酶活性,由zeste同源基因增强子2(zeste homologue 2, EZH2)、zeste抑制因子12(suppressor of zeste 12, SUZ12)组成,从胚胎外胚层发育而来。PRC2催化组蛋白H3第27位赖氨酸的二甲基化和三甲基化(the di-and tri-methylation of lysine residue 27 of histone 3, H3K27me3),进而影响miRNA、细胞周期蛋白依赖性激酶抑制因子(如p15、p16、p21、p27、p57)及血管生成相关基因的表达,参与肿瘤的发生、发展。
2 TUG1与恶性肿瘤的关系
近年来随着LncRNAs的研究深入,TUG1也渐渐被熟知,被发现其在多种肿瘤中发挥功能,包括神经系统肿瘤、消化系统肿瘤、泌尿系统肿瘤、血液系统肿瘤、肺癌及子宫颈癌等(表1)。
2.1 TUG1与脑胶质瘤 Cai等[3]研究发现TUG1可以直接调节miR-144表达控制血肿瘤屏障,TUG1与miR-144结合后,引起下游基因热休克蛋白转录因子2(heat shock transcription factor 2, HSF2)激活,影响血管内皮细胞紧密连接蛋白ZO-1、occludin和claudin-5表达上调,从而使血肿瘤屏障增强,减少化疗药物进入肿瘤,降低化疗疗效。Cai等[4]进一步证实TUG1在胶质瘤组织和细胞株中均表达上调,其机制主要是抑制胶质瘤miR-299的表达,上调肿瘤细胞血管内皮生长因子A(vascular endothelial growth factor A, VEGFA)诱导的血管生成,促进胶质瘤的生长增殖。但是Li等[5-6]的研究结果却相反,TUG1在胶质母细胞瘤中低表达,且级别越高,表达越低,并发现主要通过激活Caspase 3和9介导的促凋亡,抑制BCL-2介导的抗凋亡,促进肿瘤细胞凋亡,抑制胶质母细胞瘤的生长。生存分析显示TUG1表达低的患者分期倾向更晚、肿瘤更大、生存时间更短。胶质母细胞瘤株中TUG1是通过下调miR-26a表达抑制细胞增殖的,且TUG1可以通过结合miR-26a靶基因PTEN的3′UTR端,抑制TUG1对miR-26a的负向调节作用。两者在实验方法上大致相同,但结果却大相径庭,鉴于目前尚无其他方面的实验研究,TUG1与脑胶质瘤的关系仍需验证。
2.2 TUG1与骨肉瘤 目前,现有研究均证实TUG1在骨肉瘤组织中高表达,其表达程度与肿瘤大小、术后化疗以及分期相关,还与预后、总生存期及疾病无进展生存时间相关,结果亦显示TUG1诊断预后价值高于血清碱性磷酸酶(alkaline phosphatase, ALP)[7-8]。最近一项研究发现TUG1是通过ceRNA的模式减少miR-9-5p表达,上调POU2F1(POU class 2 homeobox 1)表达,促进细胞增殖,减少细胞凋亡,促进肿瘤的生成[9]。但TUG1是否成为骨肉瘤的治疗靶点,其具体机制尚不清楚。
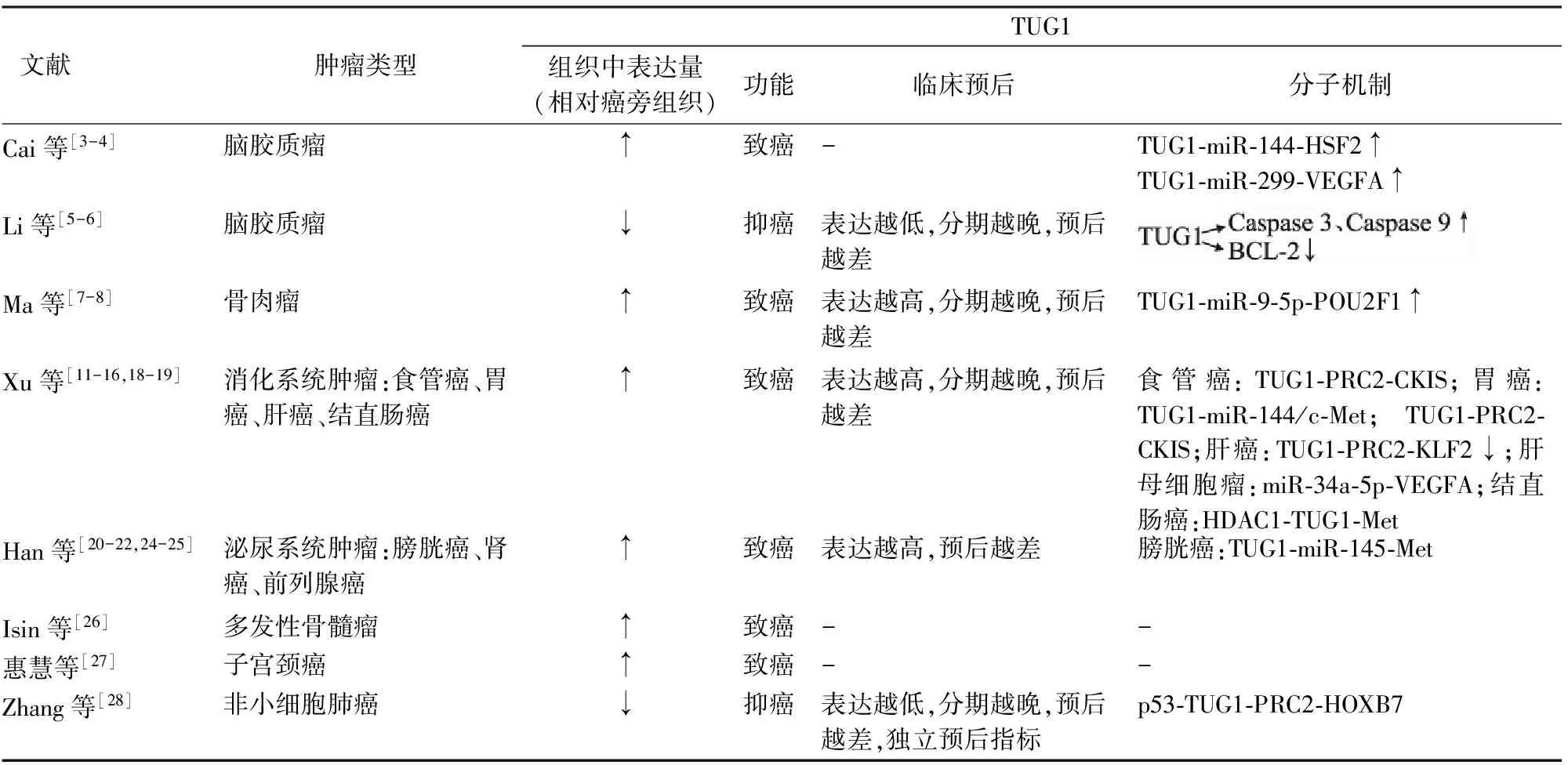
表1 TUG1与恶性肿瘤的关系
2.3 TUG1与消化系统肿瘤
2.3.1 TUG1与食管癌 我国的食管癌是最常见的恶性肿瘤之一[10]。研究表明,TUG1在食管鳞状细胞癌中呈高表达,且Xu等[11]发现其高表达程度与食管癌家族史以及食管上段肿瘤发生相关,与肿瘤大小、分化程度、浸润深度、淋巴结转移及TNM分期无关。Jiang等[12]亦证实了食管癌组织中TUG1高表达引起化疗耐药、导致患者治疗预后差。下调食管鳞状细胞癌细胞株中TUG1表达,抑制细胞的增殖和迁移,引起细胞周期阻滞,目前认为TUG1主要通过PRC2调节细胞周期蛋白依赖性激酶抑制因子在食管癌中发挥作用。
2.3.2 TUG1与胃癌 近来,文献报道亦表明TUG1在胃癌中高表达,其表达程度与胃癌淋巴结转移、分期、预后相关[13-14]。且其可以通过多种机制在胃癌发生、发展中产生调控作用:(1)TUG1抑制miR-144/c-Met轴促进胃癌细胞株的转移和侵袭能力[13];(2)TUG1可以调控细胞周期G0/G1的转变,主要是通过结合PRC2调节细胞周期蛋白依赖性激酶抑制因子的表达发挥作用,包括p15、p16、p21、p27和p57等[14]。以上研究表明TUG1可以作为胃癌治疗的新靶点,且可能成为胃癌诊断及预后的独立指标。
2.3.3 TUG1与肝癌 Huang等[15]已经证实了TUG1在肝癌组织和肝癌细胞株中高表达,且其表达程度与BCLC分期及肿瘤大小相关。下调TUG1表达后,生物学研究发现抑制了细胞的增殖,促进细胞凋亡,机制研究表明TUG1通过与PRC2结合下调抑癌基因KLF2表达,促进肝癌的发生。除了此通路外,Dong等[16]发现TUG1还可以通过miR-34a-5p-VEGFA轴影响肿瘤血管的形成,参与肝母细胞癌的生长。
2.3.4 TUG1与结直肠癌 多项研究均表明,上皮-间质转化(epithelial-mesenchymaltransition, EMT)是癌组织浸润转移的主要机制[17],Wang等[18]和Sun等[19]分别对临床88例和120例结直肠癌患者以及其细胞株进行Q-PCR检测,均发现TUG1高表达,其高表达主要由异常HDAC1(histone deacetylase 1)表达调控的。干扰癌细胞TUG1表达后,抑制了细胞的增殖和侵袭,且证实主要机制是通过激活EMT信号通路(E-钙黏蛋白、N-钙黏蛋白、vimentin、纤连蛋白)促进肿瘤的侵袭和转移的。
2.4 TUG1与泌尿系统肿瘤
2.4.1 TUG1与尿路上皮癌 通过比较膀胱癌组织及细胞株中TUG1表达,证实TUG1在癌组织和细胞株表达明显高于正常组,表达水平与肿瘤分级和分期密切相关,表明其在膀胱癌中发挥作用[20-21]。进一步干扰膀胱癌细胞株中TUG1表达后,细胞增殖受到抑制,并且促进了细胞凋亡,机制学研究发现TUG1通过抑制miR-145表达,促进EMT导致放疗抵抗,影响治疗疗效,生存分析亦表明TUG1表达更高的膀胱癌患者其总生存时间更短。
2.4.2 TUG1与肾细胞癌 肾细胞癌的发病率较低,占恶性肿瘤的3%[22],位居泌尿系统肿瘤的第2位,仅次于膀胱肿瘤[23]。TUG1与肾细胞癌的研究较少。Zhang等[24]通过相似的方法表明TUG1在肾细胞癌组织中高表达,且表达程度与Fuhrman分级和肿瘤大小相关,但其促进肾细胞癌发生、发展的具体机制不明,有待进行更多的研究。
2.4.3 TUG1与前列腺癌 Du等[25]通过微阵列和LncRNA基因表达谱数据分析,发现LncRNA中的TUG1影响了前列腺癌驱动基因的表达,表明TUG1与前列腺癌也存在联系,但目前相关的机制研究较少。
2.5 TUG1与其它恶性肿瘤 慢性淋巴细胞白血病和多发性骨髓瘤均属于B细胞恶性肿瘤。Isin等[26]通过检测这两种患者循环血中LncRNA的表达水平,发现慢性淋巴细胞白血病患者中TUG1表达无明显上调,而多发性骨髓瘤患者中呈高表达。在子宫颈癌的研究中,下调宫颈癌细胞Hela中TUG1的表达,发现抑制了Hela细胞的增殖和侵袭,促进Hela细胞的凋亡[27]。但TUG1在子宫颈癌发生、发展中的机制尚不明确。Zhang等[28]分析192例非小细胞肺癌组织和相应癌旁组织发现,TUG1在癌组织中呈低表达,其低表达与高TNM分期、肿瘤大小以及较差的总体存活率密切相关。TUG1由p53诱导表达,荧光素酶试验和染色质免疫沉淀分析证实TUG1是p53转录的直接靶标。进一步研究,下调TUG1表达能够促进HOXB7表达上调。甚至有学者提出,p53/TUG1/PRC2/HOXB7轴可以作为非小细胞肺癌的诊断和治疗的靶标,TUG1还可以作为非小细胞肺癌独立的总体生存率预测指标之一。
3 结语
虽然近年来有关LncRNAs的研究较多,但其生物学功能研究时间尚短,尚有众多不明确的地方。目前认为TUG1主要通过ceRNA模式与转录因子竞争性结合miRNA、调控细胞周期蛋白依赖性激酶抑制因子及影响肿瘤血管生成等途径参与肿瘤的发生、发展。TUG1在大多数肿瘤中高表达,但在非小细胞肺癌中低表达,表明其既可以发挥促癌作用,也能扮演抑癌角色。TUG1是否还有其他方式参与下游基因的表达调控,有待进一步探索。相信TUG1可以作为肿瘤的潜在治疗靶点,并有望成为新的肿瘤预后标志物,更好的服务于临床。
[1] Young T L, Matsuda T, Cepko C L. The noncoding RNA taurine upregulated gene 1 is required for differentiation of the murine retina[J]. Curr Biol, 2005,15(6):501-512.
[2] Khalil A M, Guttman M, Huarte M,etal. Many human large intergenic noncoding RNAs associate with chromatin-modifying complexes and affect gene expression[J]. Proc Natl Acad Sci USA, 2009,106(28):11667-11672.
[3] Cai H, Xue Y, Wang P,etal. The long noncoding RNA TUG1 regulates blood-tumor barrier permeability by targeting miR-144[J]. Oncotarget, 2015,6(23):19759-19779.
[4] Cai H, Liu X, Zheng J,etal. Long non-coding RNA taurine upregulated 1 enhances tumor-induced angiogenesis through inhibiting microRNA-299 in human glioblastoma[J]. Oncogene, 2016.doi: 10.1038/onc.2016.212.
[5] Li J, An G, Zhang M,etal. Long non-coding RNA TUG1 acts as a miR-26a sponge in human glioma cells[J]. Biochem Biophys Res Commun, 2016,477(4):743-748.
[6] Li J, Zhang M, An G, Ma Q. LncRNA TUG1 acts as a tumor suppressor in human glioma by promoting cell apoptosis[J]. Exp Biol Med(Maywood), 2016,241(6):644-649.
[7] Ma B, Li M, Zhang L,etal. Upregulation of long non-coding RNA TUG1 correlates with poor prognosis and disease status in osteosarcoma[J]. Tumor Biol, 2016,37(4):4445-4455.
[8] Zhang Q, Geng P, Yin P,etal. Down-regulation of long non-coding RNA TUG1 inhibits osteosarcoma cell proliferation and promotes apoptosis[J]. Asian Pac J Cancer Prev, 2013,14(4):2311-2315.
[9] Xie C H, Cao Y M, Huang Y,etal. Long non-coding RNA TUG1 contributes to tumorigenesis of human osteosarcoma by sponging miR-9-5p and regulating POU2F1 expression[J]. Tumour Biol, 2016,37(11):15031-15041.
[10] 刘雪姣, 岳 萌, 张玲玲, 等. Bufalin对食管癌ECA109细胞中FAK活化和上皮-间质转化的影响[J]. 临床与实验病理学杂志, 2016,32(8):846-850.
[11] Xu Y, Wang J, Qiu M,etal. Upregulation of the long noncoding RNA TUG1 promotes proliferation and migration of esophageal squamous cell carcinoma[J]. Tumor Biol, 2015,36(3):1643-1651.
[12] Jiang L, Wang W, Li G,etal. High TUG1 expression is associated with chemotherapy resistance and poor prognosis in esophageal squamous cell carcinoma[J]. Cancer Chemother Pharmacol, 2016,78(2):333-339.
[13] Ji T, Huang X, Jin J,etal. Inhibition of long non-coding RNA TUG1 on gastric cancer cell transference and invasion through regulating and controlling the expression of miR-144/c-Met axis[J]. Asian Pac J Trop Med, 2016,9(5):508-512.
[14] Zhang E, He X, Yin D,etal. Increased expression of long noncoding RNA TUG1 predicts a poor prognosis of gastric cancer and regulates cell proliferation by epigenetically silencing of p57[J]. Cell Death Dis, 2016,7(2):e2109.
[15] Huang M, Chen W, Qi F,etal. Long non-coding RNA TUG1 is up-regulated in hepatocellular carcinoma and promotes cell growth and apoptosis by epigenetically silencing of KLF2[J]. Mol Cancer, 2015,14(1):165.
[16] Dong R, Liu G, Liu B,etal. Targeting long non-coding RNA-TUG1 inhibits tumor growth and angiogenesis in hepatoblastoma[J]. Cell Death Dis, 2016,7(6):e2278.
[17] 姜晓玲, 乔 峰, 徐 维, 等. 上皮-间质转化及相关信号转导通路的研究进展[J]. 临床与实验病理学杂志, 2014,30(5):547-550.
[18] Wang L, Zhao Z, Feng W,etal. Long non-coding RNA TUG1 promotes colorectal cancer metastasis via EMT pathway[J]. Oncotarget, 2016,7(32):51713-51719.
[19] Sun J, Ding C, Yang Z,etal. The long non-coding RNA TUG1 indicates a poor prognosis for colorectal cancer and promotes metastasis by affecting epithelial-mesenchymal transition[J]. J Transl Med, 2016,14(1):42.
[20] Han Y, Liu Y, Gui Y,etal. Long intergenic non-coding RNA TUG1 is overexpressed in urothelial carcinoma of the bladder[J]. J Surg Oncol, 2013,107(5):555-559.
[21] Tan J, Qiu K, Li M,etal. Double-negative feedback loop between long non-coding RNA TUG1 and miR-145 promotes epithelial to mesenchymal transition and radioresistance in human bladder cancer cells[J]. FEBS Lett, 2015,589(20PartB):3175-3181.
[22] Yang Y, Valera V, Sourbier C,etal. A novel fumarate hydratase-deficient HLRCC kidney cancer cell line, UOK268: a model of the Warburg effect in cancer[J]. Cancer Genet, 2012,205(7-8):377-390.
[23] 蒋艳霞, 周 璇, 于文娟, 等. 肾细胞癌中CD147和VEGF的表达及其临床意义[J]. 临床与实验病理学杂志, 2016,32(7):757-760.
[24] Zhang M, Lu W, Huang Y,etal. Downregulation of the long noncoding RNA TUG1 inhibits the proliferation, migration, invasion and promotes apoptosis of renal cell carcinoma[J]. J Mol Histol, 2016,47(4):421-428.
[25] Du Z, Sun T, Hacisuleyman E,etal. Integrative analyses reveal a long noncoding RNA-mediated sponge regulatory network in prostate cancer[J]. Nat Commun, 2016,7:10982.
[26] Isin M, Ozgur E, Cetin G,etal. Investigation of circulating lncRNAs in B-cell neoplasms[J]. Clin Chim Acta, 2014,431:255-259.
[27] 惠 慧, 吴 磊, 周云松, 等. 沉默TUG1对宫颈癌Hela细胞增殖、凋亡、侵袭的影响[J]. 现代肿瘤医学, 2016,(12):1876-1878.
[28] Zhang E, Yin D, Sun M,etal. P53-regulated long non-coding RNA TUG1 affects cell proliferation in human non-small cell lung cancer, partly through epigenetically regulating HOXB7 expression[J]. Cell Death Dis, 2014,5(5):e1243.
国家自然科学基金(81560509)
1南昌大学第二附属医院肿瘤科,南昌 3300062南昌大学江西医学院公共卫生学院,南昌 330006
熊 乐,男,硕士研究生。E-mail: 834302799@qq.com 刘安文,女,博士,教授,通讯作者。E-mail: awliu666@163.com
时间:2017-4-17 18:19
http://kns.cnki.net/kcms/detail/34.1073.R.20170417.1819.016.html
R 730
A
1001-7399(2017)04-0425-04
10.13315/j.cnki.cjcep.2017.04.016
接受日期:2016-12-23
