食管鳞状细胞癌中PD-L1的表达及其预后意义
2017-06-05刘亚岚蒋冬先侯英勇徐一凡宿杰阿克苏曾海英张小垒
刘亚岚,蒋冬先,侯英勇,徐一凡,宿杰阿克苏,曾海英,高 峰,张小垒,徐 晨
·论 著·
食管鳞状细胞癌中PD-L1的表达及其预后意义
刘亚岚,蒋冬先,侯英勇,徐一凡,宿杰阿克苏,曾海英,高 峰,张小垒,徐 晨
目的 分析PD-L1表达与食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)临床病理因素的相关性和预后价值。方法 采用免疫组化法检测253例ESCC组织中PD-L1的表达,PD-L1阳性分别被定义为1%与5%的肿瘤细胞阳性。Kaplan-Meier 法构建生存曲线,单因素和多因素Cox回归模型分析独立的预后因素。结果 肿瘤表达PD-L1的患者有预后较好的趋势,但差异无统计学意义(P>0.05)。把患者分为Ⅰ+Ⅱ期(60.9%,154/253)和Ⅲ+Ⅳa期(39.1%,99/253)两个亚组,在Ⅰ+Ⅱ期患者中,PD-L1表达是独立的预后因子,提示患者预后较好(1%为分界值,P=0.046和0.021;5%为分界值,P=0.011和0.004);而在Ⅲ+Ⅳa期患者中,PD-L1表达与患者预后无明显相关性(1%为分界值,P=0.586和0.682;5%为分界值,P=0.807和0.620)。结论 不同分期的ESCC中,PD-L1表达的预后意义存在差异。在Ⅰ+Ⅱ期患者中,PD-L1表达是独立的预后因子,而在Ⅲ+Ⅳa期患者中无预后意义。
食管肿瘤;鳞状细胞癌;PD-L1;临床分期;预后标志物
食管癌是严重威胁人类健康的常见恶性肿瘤之一,2015年中国食管癌患者高达478 000例,其中375 000例死亡[1]。中国食管癌占全球的70%,其中95%为食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)。近年来尽管治疗水平明显提高,ESCC仍然是主要的致死癌症之一,5年的生存率低于20%。最近,针对免疫检查点药物引领了肿瘤治疗进入免疫治疗的新时期,也为ESCC的治疗提供新策略[2]。研究表明很多肿瘤PD-L1蛋白表达与临床病理因素存在相关性[3-4]。有研究发现PD-L1在恶性黑色素瘤、肺癌、乳腺癌、膀胱癌、卵巢癌和胃癌中表达并提示患者预后较差。但是,另外一些报道则表明PD-L1与预后缺乏相关性,或者其表达提示预后较好。在ESCC中,现有的少量关于PD-L1预后的研究结果却存在不一致现象[5-6]。因此,有必要进一步探讨PD-L1表达在ESCC中的预后意义。本实验利用组织芯片采用免疫组化法检测253例ESCC中PD-L1的表达,以分析其表达与临床病理特征的关系,探索其在ESCC中的预后意义。
1 材料与方法
1.1 材料 选取2007年~2010年复旦大学附属中山医院手术切除的ESCC组织253例。患者术前均未行放、化疗,诊断及临床分期参照AJCC指南。收集患者的临床和病理资料,包括性别、年龄、吸烟、肿瘤部位、肿瘤分化程度、脉管侵犯、神经侵犯、淋巴结转移等。
1.2 组织芯片 复习HE切片,选取代表性的区域,从供体蜡块中取出(2 mm宽,6 mm长)的组织垂直接种于受体蜡块中,制作组织芯片[6]。每个组织芯片包括70个位点,胃癌组织被用作起始标记点。
1.3 免疫组化 组织芯片制备4 μm厚切片,二甲苯脱蜡,pH 9.0缓冲液中加热10 min进行抗原修复。一抗为PD-L1兔单克隆抗体(稀释比1 ∶300,Origene公司),使用全自动免疫组化仪Ventana Benchmark XT进行免疫组化Polymer Conjugate法染色。
1.4 结果判读 PD-L1染色阳性为胞质和(或)胞膜中出现棕黄色或棕褐色颗粒。组织芯片中PD-L1的表达情况经两位病理医师独立评估。评估阳性细胞在肿瘤细胞中所占的百分比,参考相关文献及在食管癌中的相关研究,分别将1%阳性和5%阳性定义为肿瘤PD-L1阳性[7]。
1.5 统计学分析 利用χ2检验和Fisher确切概率法分析PD-L1表达和临床病理因素的相关性。患者随访至2015年8月15日。Kaplan-Meier和Log-rank法进行生存分析。Cox回归模型进行单因素和多因素生存分析。采用SPSS 19.0软件进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 临床特征 253例ESCC患者中位年龄62岁(37~83岁),其中男性212例,女性41例。110例有吸烟史。肿瘤部位:食管上段占4.7%,食管中段48.2%,食管下段42.7%。149例(58.9%)肿瘤分化高~中等,104例(41.1%)肿瘤分化较低。46例(18.2%)肿瘤存在脉管癌栓,68例(26.9%)肿瘤存在神经侵犯,120例(47.4%)出现淋巴结转移。依据第7版AJCC分期标准,154例(60.9%)患者为临床Ⅰ+Ⅱ期,99例(39.1%)患者为Ⅲ+Ⅳa期(表1)。
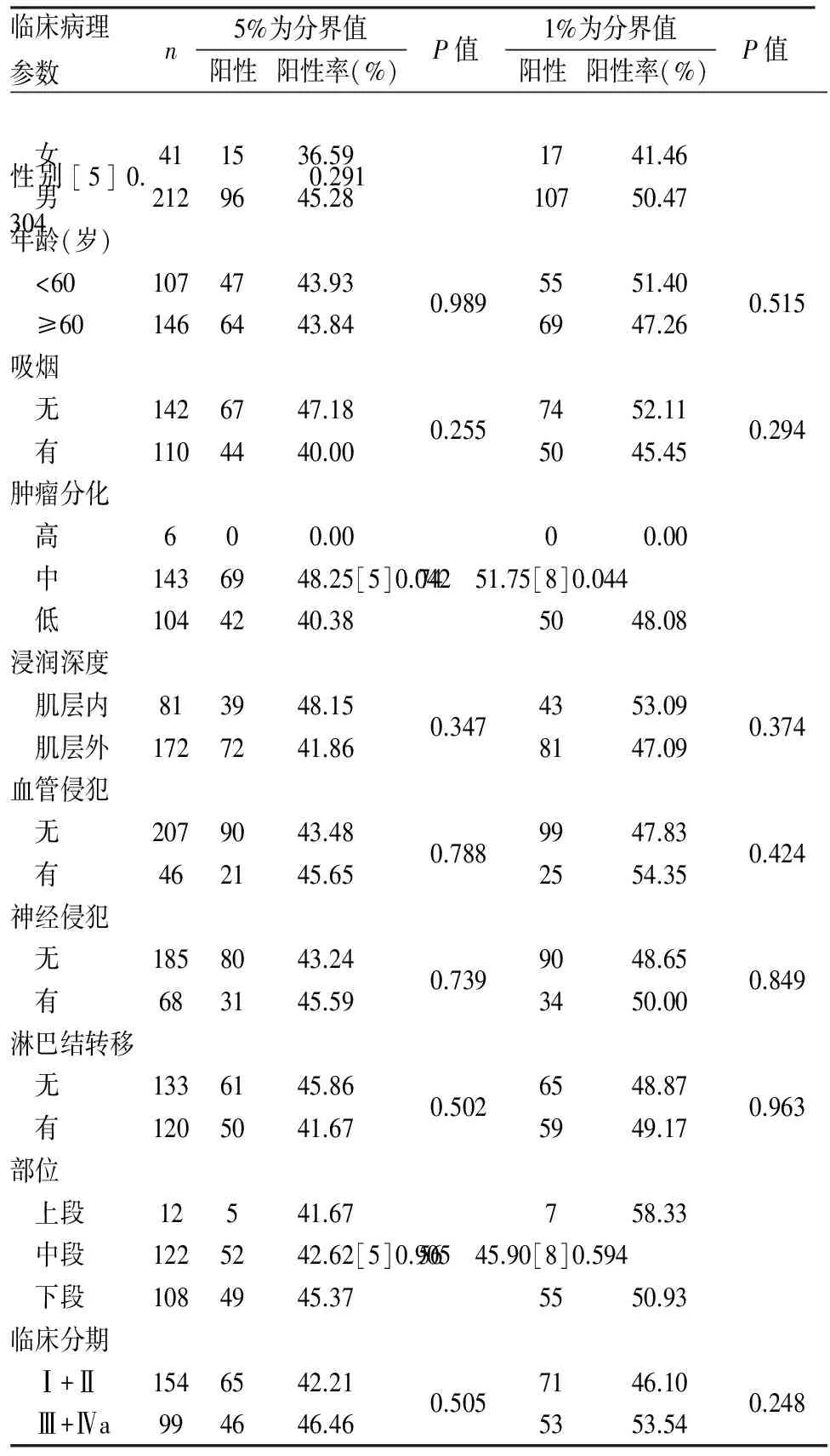
表1 食管鳞状细胞癌中PD-L1表达与临床病理特征的关系
253例肿瘤中,将1%定义为分界值时,49.0%的肿瘤PD-L1阳性;将5%定义为分界值时,43.9%的肿瘤PD-L1阳性(图1)。PD-L1表达与患者性别、年龄、吸烟、肿瘤部位、浸润深度、血管侵犯、神经侵犯、淋巴结转移及临床分期无明显相关性(P>0.05,表1)。
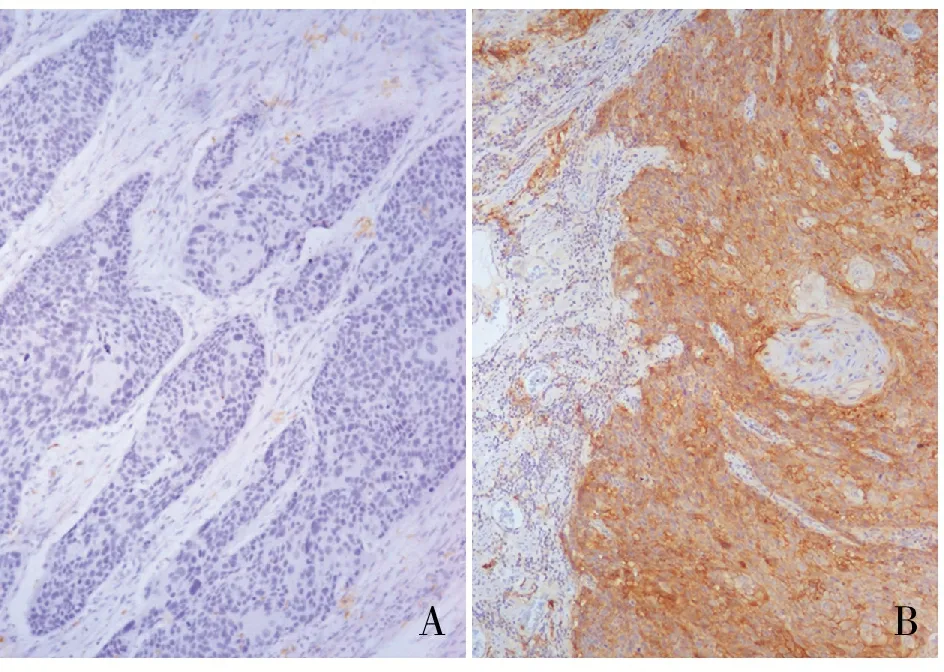
AB
图1 食管鳞状细胞癌中PD-L1的表达:A.PD-L1阴性;B.PD-L1阳性,Polymer Conjugate法
2.2 ESCC患者的生存分析 患者中位随访时间为33个月(4~102个月),148例患者出现疾病进展,149例死亡,其中144例死于ESCC。
PD-L1阳性患者的无瘤生存(disease free survival, DFS)和总生存期(overall survival, OS)比PD-L1阴性患者延长,但差异无统计学意义(1%作为分界值时,P=0.175和0.090;5%作为分界值时,P=0.099和0.057)。单因素生存分析发现肿瘤浸润深度、脉管侵犯和淋巴结转移与DFS和OS相关;多因素生存分析发现,浸润深度和淋巴结转移是患者独立预后因子。
在临床Ⅰ+Ⅱ期患者中,PD-L1阳性患者的DFS和OS比PD-L1阴性患者明显延长(1%为分界值,P=0.046 和0.021;5%为分界值,P=0.011和0.004)。单因素生存分析发现PD-L1阳性(5%为临界值)、肿瘤部位和淋巴结转移与DFS和OS相关;多因素生存分析发现,PD-L1阳性(5%为临界值)、肿瘤部位和淋巴结转移是患者独立预后因子。而在Ⅲ+Ⅳa期患者中,PD-L1阳性患者的DFS和OS与PD-L1阴性患者无明显差异(1%为分界值,P=0.586和0.682;5%为分界值,P=0.807和0.620)。单因素生存分析仅发现肿瘤浸润深度与DFS和OS潜在相关(P=0.047和0.051,图2,表2、3)。
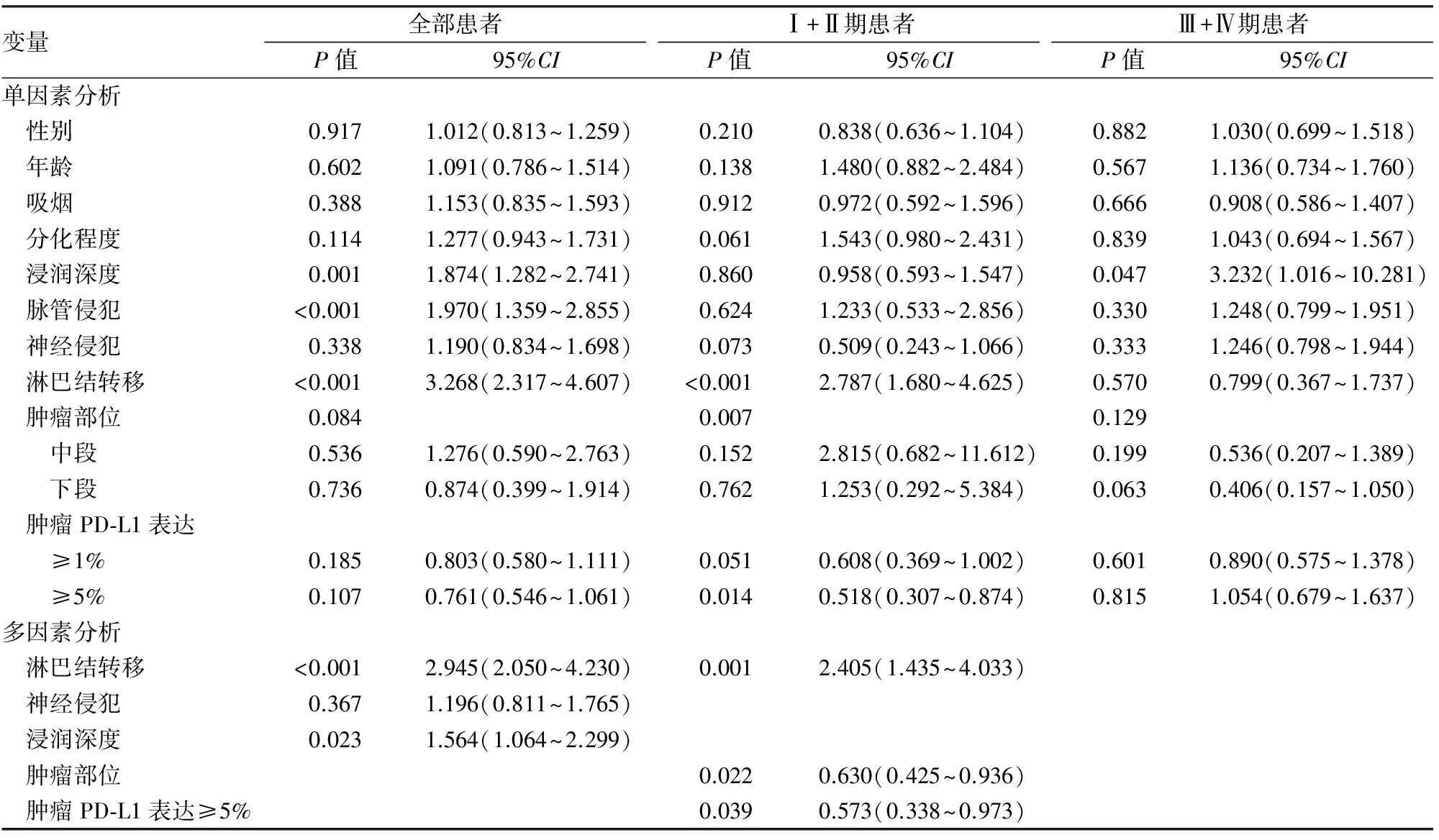
表2 单因素和多因素Cox回归模型分析与食管鳞状细胞癌患者DFS相关的危险因素
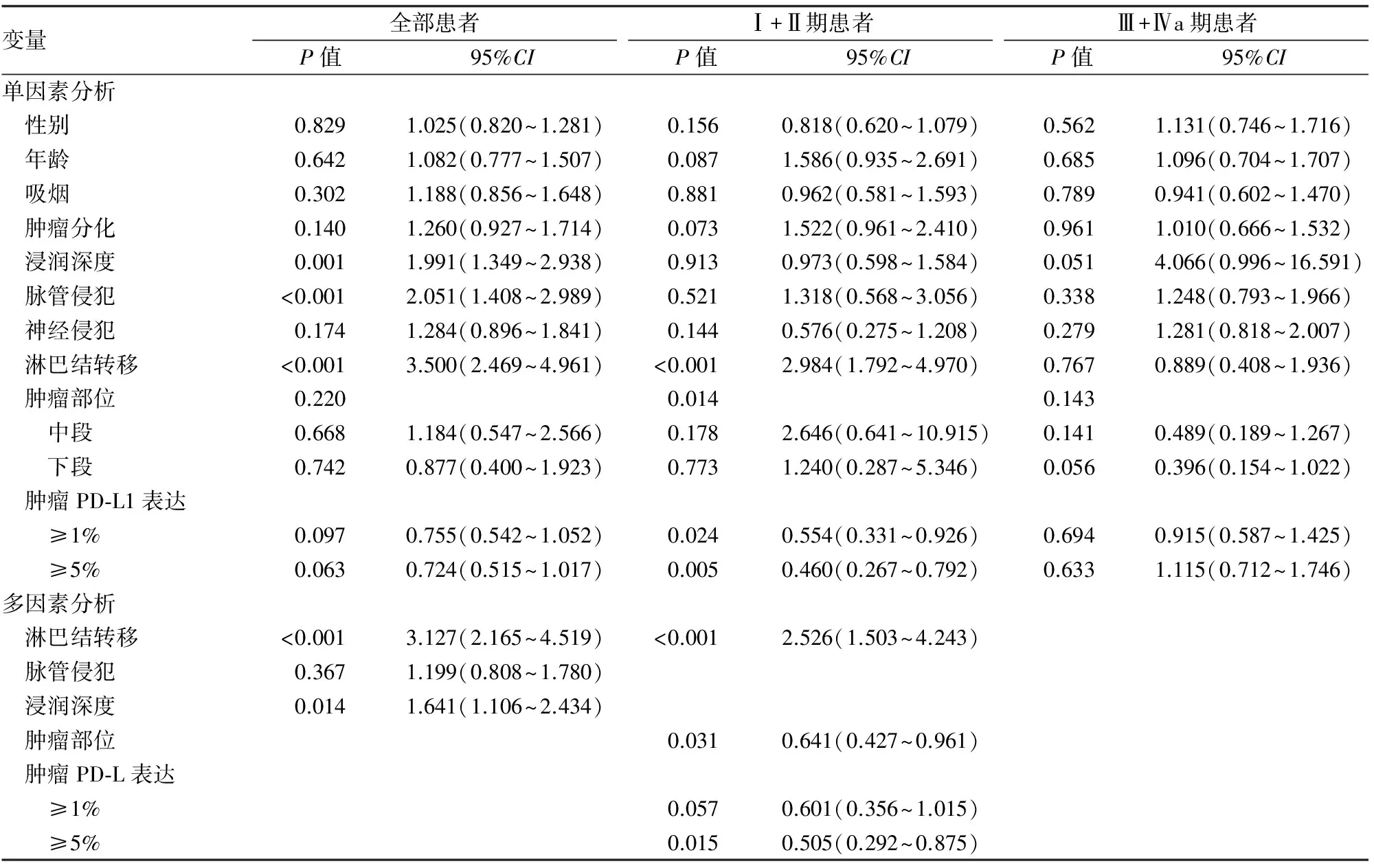
表3 单因素和多因素Cox回归模型分析与食管鳞状细胞癌患者OS相关的危险因素
3 讨论
PD1-PD-L1通路在肿瘤进展过程中发挥重要的作用。多种肿瘤中均存在PD-L1的表达,通过与肿瘤微环境的相互作用,PD-L1发挥免疫抑制作用。但是对于PD-L1表达的预后价值,目前的研究中存在相互冲突的结论。人群、检测方法以及临界值的差异,可能是潜在的原因。
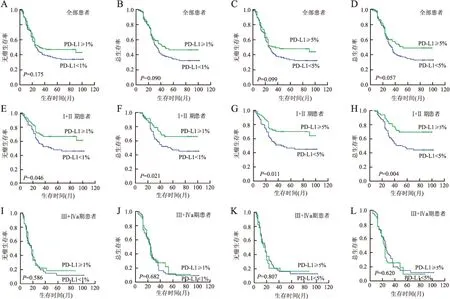
图2 生存分析 A~D.在全部食管鳞状细胞癌患者中,PD-L1阳性患者的无瘤生存和总生存期潜在好于阴性患者(1%为分界值,P=0.175和0.090;5%为分界值,P=0.099和0.057);E~H.Ⅰ+Ⅱ期PD-L1阳性患者的无瘤生存和总生存期明显好于阴性患者(1%为分界值,P=0.046和0.021;5%为分界值,P=0.011和0.004;I~L.Ⅲ+Ⅳa期PD-L1阳性患者与阴性患者的预后差异无统计学意义(1%为分界值,P=0.586和0.682;5%为分界值,P=0.807和0.620)
在以往研究中,大部分学者将所有患者当作一个整体,未考虑临床分期的差异。本实验分别在临床Ⅰ+Ⅱ期和Ⅲ+Ⅳa期中,评估PD-L1的表达情况。进而发现在临床Ⅰ+Ⅱ期患者中,PD-L1表达与患者预后好相关;在临床Ⅲ+Ⅳa期患者中,PD-L1表达与患者生存期无明显相关性。这表明PD-L1表达的预后意义是有条件的,仅局限于临床早期。在以前的研究中,也发现不同分期的患者中,分子标志物的预后意义不一致。如在结直肠癌中,与晚期患者相比,错配修复基因缺陷的预后意义在早期患者中更显著[8];在非小细胞肺癌中,PD-L1仅在早期患者中是预后好的因素[9]。因而在预后分析中,出现不一致的结论时,可以在不同分期的患者中分别进行分析,推测不一致结论的潜在原因。
在不同的水平(mRNA水平和蛋白水平)上评估PD-L1的表达,可能是以往研究中出现冲突结论的潜在原因。如在乳腺癌中,一些学者发现检测PD-L1 mRNA的表达提示延长的无复发生存期[10],而另外一些学者发现PD-L1蛋白表达提示较差的预后[11]。以mRNA为基础的方法,在检测时难免会同时检测肿瘤细胞和非肿瘤细胞的mRNA表达,导致结果出现偏差;而免疫组化的优点在于准确的定位,能够识别肿瘤细胞和非肿瘤细胞,减少结果的偏差。本实验利用组织芯片采用免疫组化法检测PD-L1的表达,避免了mRNA方法的缺陷。
PD-L1阳性分界值的选择差异,可能导致以往研究结论的差异。最近Borghaei等[12]研究发现,非小细胞肺癌中,当分界值为1%时,PD-L1表达与患者的总反应率和无进展生存期明显相关。在以往的研究中,5%也被用于临界值,进行预后分析。本实验分别以1%和5%为分界值,评估PD-L1表达在ESCC中的预后意义,发现PD-L1表达在较早期患者(I+Ⅱ期)中,是独立的预后因子。对比这两个分界值,本组实验结果显示分界值为5%时单因素和多因素分析显示差异均具有统计学意义,而1%为分界值时只在单因素分析显示差异有显著性,因此,对于食管癌,5%可能是一个更值得推荐的分界值。
在非小细胞肺癌、结直肠癌、乳腺癌和恶性黑色素瘤中,均有报道指出PD-L1表达提示患者预后较好,而其中的分子机制尚不清楚。可能的解释是局部紊乱的细胞免疫反应。一些学者认为PD-L1可能通过其它未知受体传递信号,造成T细胞增殖和细胞因子的释放(如IL-10和INFγ)。在不同程度上,机体的免疫环境会影响肿瘤的生长。需要进一步的研究来解释PD-L1作用的分子机制。
本组实验发现在较早期ESCC中,PD-L1表达(5%为临界值)是独立的预后因子,提示患者预后较好。而在较晚期ESCC患者中,PD-L1表达无预后意义。提示PD-L1表达的预后意义有一定的局限性。较晚期ESCC中复杂的分子机制,可能影响了PD-L1的生物学作用。这些数据也表明在临床实践中,应该在不同分期的肿瘤中,分别评价分子标志物的预后意义。
[1] Chen W, Zheng R, Baade P D,etal. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] Marta K. Cancer immunotherapy booster[J]. Cell, 2016,165:253-255.
[3] 沈吟芳, 穆传勇, 陈延斌, 等. 肺癌中PD-L1表达和调节性T细胞浸润的关系及意义[J]. 临床与实验病理学杂志, 2015,31(4):418-421,425.
[4] 吴 圣, 邵婧怡, 王 芳, 等. PD-L1和PD-1在胃癌组织中的表达及其临床意义[J]. 安徽医科大学学报, 2015,50(6):821-825.
[5] Chen K, Cheng G, Zhang F,etal. Prognostic significance of programmed death-1 and programmed death-ligand 1 expression in patients with esophageal squamous cell carcinoma[J]. Oncotarget, 2016,7(21):30272-30280.
[6] Leng C, Li Y, Qin J,etal. Relationship between expression of PD-L1 and PD-L2 on esophageal squamous cell carcinoma and the antitumor effects of CD8(+) T cells[J]. Oncol Rep, 2016,35(2):699-708.
[7] Hino R, Kabashima K, Kato Y,etal. Tumor cell expression of programmed cell death-1 ligand 1 is a prognostic factor for malignant melanoma[J]. Cancer, 2010,116(7):1757-1766.
[8] Kawakami H, Zaanan A, Sinicrope F A. Implications of mismatch repair-deficient status on management of early stage colorectal cancer[J]. J Gastrointest Oncol, 2015,6(6):676-684.
[9] Cooper W A, Tran T, Vilain R E,etal. PD-L1 expression is a favorable prognostic factor in early stage non-small cell carcinoma[J]. Lung Cancer, 2015,89(2):181-188.
[10] Schalper K A, Velcheti V, Carvajal D,etal. In situ tumor PD-L1 mRNA expression is associated with increased TILs and better outcome in breast carcinomas[J]. Clin Cancer Res, 2014,20(10):2773-2782.
[11] Muenst S, Schaerli A R, Gao F,etal. Expression of programmed death ligand 1 (PD-L1) is associated with poor prognosis in human breast cancer[J]. Breast Cancer Res Tr, 2014,146(1):15-24.
[12] Borghaei H, Paz-Ares L, Horn L,etal. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J]. New Engl J Med, 2015,373(17):1627-1639.
Expression of PD-L1 and its prognostic role in patients with esophageal squamous cell carcinoma
LIU Ya-lan, JIANG Dong-xian, HOU Ying-yong, XU Yi-fan, SU Jieakesu, ZENG Hai-ying, GAO Feng, ZHANG Xiao-lei, XU Chen
(DepartmentofPathology,ZhongshanHospital,FudanUniversity,Shanghai200032,China)
Purpose To analyze the correlations between PD-L1 expression and clinicopathological factors and their prognostic values in esophageal squamous cell carcinoma (ESCC) patients. Methods PD-L1 expression in the primary tumors from 253 patients with ESCC was evaluated using tissue microarray and immunohistochemistry (IHC). PD-L1 positivity was defined as positive staining of 1% and 5% tumor cells. Survival curves were constructed by using the Kaplan-Meier method. Univariate and multivariate Cox proportional hazard regression models were performed to identify associations with outcome variables. Results Overall, tumoral PD-L1 expression was potentially associated with favorable DFS and OS. When the patients were stratified into stage Ⅰ+Ⅱ (60.9%, 154/253) and stage Ⅲ+Ⅳa (39.1%, 99/253), the prognostic role was not consistent. In patients with stage Ⅰ+Ⅱ disease, tumoral PD-L1 expression was associated with better DFS and OS upon multivariate analysis (1% as the cutoff:P=0.046 and 0.021, 5% as the cutoff:P=0.011 and 0.004). However, PD-L1 expression was not correlated with prognosis in patients with stage Ⅲ+Ⅳa disease (1% as the cutoff:P=0.586 and 0.682, 5% as the cutoff:P=0.807 and 0.620). Conclusion The prognostic role of tumoral PDL expression is variable in different stages of ESCC, and tumoral PDL expression is an independent favorable predictor in ESCC patients with Stage Ⅰ-Ⅱ disease, but not in stage Ⅲ-Ⅳa or lymph node metastasis.
esophageal neoplasms; squamous cell carcinoma; PD-L1 expression; clinical stage; prognostic marker
上海市卫生计生系统重点薄弱学科建设基金(2015ZB 0201)
复旦大学附属中山医院病理科,上海 200032
刘亚岚,女,主治医师。E-mail: yalanliu@163.com 徐 晨,男,主治医师,通讯作者。E-mail: xuchenmail@126.com
时间:2017-4-17 18:19
http://kns.cnki.net/kcms/detail/34.1073.R.20170417.1819.001.html
R 735.1
A
1001-7399(2017)04-0355-05
10.13315/j.cnki.cjcep.2017.04.001
接受日期:2017-03-07
