DNA甲基转移酶参与调控斜纹夜蛾和家蚕幼虫的生长
2017-06-05徐关峰郑思春
徐关峰,郑思春
(广州市昆虫发育调控与应用研究重点实验室,华南师范大学生命科学学院,广州 510631)
DNA甲基转移酶参与调控斜纹夜蛾和家蚕幼虫的生长
徐关峰,郑思春*
(广州市昆虫发育调控与应用研究重点实验室,华南师范大学生命科学学院,广州 510631)
DNA甲基化是真核生物生长发育过程中基因表达的一种重要调控机制。本研究以鳞翅目农业害虫斜纹夜蛾Spodopteralitura和模式昆虫家蚕Bombyxmori为材料,研究了甲基化对幼虫生长的影响。研究结果表明,注射甲基化抑制剂5-Aza-dC后,不正常斜纹夜蛾比对照增加了36%,家蚕的增加了58.8%,不正常虫的生长发育缓慢、体型变小。斜纹夜蛾DNA甲基转移酶Sldnmt1 RNAi获得了相似的结果,不正常幼虫率比对照增加了35%。检测家蚕Bmdnmt1的mRNA水平,发现Bmdnmt1在5龄期的翅原基、脂肪体、表皮和中肠均有表达,其表达量在翅原基中的为最高;在翅原基和脂肪体中,Bmdnmt1的含量在5龄初期比在预蛹期的要高。初步分析了甲基化抑制剂处理后的家蚕脂肪代谢相关基因的表达,发现脂肪酶和乙酰辅酶A结合蛋白的mRNA水平在注射5-Aza-dC后48 h显著下调。研究结果初步表明了DNA甲基化参与调控了鳞翅目幼虫的生长发育,脂肪代谢可能是DNA甲基化调控的其中一个通路。
DNA甲基转移酶;功能;斜纹夜蛾;家蚕;幼虫
DNA甲基化是指DNA链上胞嘧啶第5位碳原子和甲基之间的共价结合。以S-腺苷甲硫氨酸(S-adenosyl-L-methionine, SAM)作为甲基供体, 在甲基转移酶的作用下,将甲基转移到胞嘧啶 5C位上,形成5-甲基胞嘧啶(Vanyushin, 2006)。DNA甲基化作为一种普遍存在于真核生物中重要的表观遗传调控,在调控基因表达和生物体生长发育过程中具有重要的作用,受到越来越广泛的关注。昆虫纲Insecta不仅是节肢动物门,也是整个动物界种类和数最多的一个纲;并且昆虫形态复杂以及具有变态发育等特有生理过程,因此研究昆虫 DNA甲基化的功能具有重要的意义(陈玮等,2015)。近年来发现昆虫DNA甲基化与高等哺乳动物有一定的相似性,但也具有其独特的特点和功能。目前的研究表明昆虫DNA甲基化涉及调节胚胎发育、参与基因印迹、调控级型和翅型分化、影响性别决定和介入抗药性形成等(梁士可等,2014)。较多的研究报道集中在蜜蜂Apismellifera分化为工蜂和蜂王过程中幼虫与成虫的DNA甲基化基因的分析(Kucharskietal., 2008; Shaoetal., 2014)。在东亚飞蝗Locustamiratoriamanilensis中也发现了类似的现象,通过不同喂养方式导致的独居和群居两种类型的蝗虫中,DNA甲基转移酶1(Dnmt1)、DNA甲基转移酶2和DNA甲基结合蛋白存在显著的表达差异(Robinsonetal.,2015)。在白背飞虱Sogatellafurcifera中,DNA甲基化的含量影响了翅的发育,短翅型的DNA甲基化含量(5.81%)高于长翅型(2.40%)(Zhouetal., 2013)。 DNA甲基化影响卵发育也有研究报道,沉默刚孵育的蜜蜂幼虫中的Amdnmt3基因,出现卵巢发育完全的蜂后(Kucharskietal., 2008);鳞翅目家蚕Bombyxmori卵注射BmdnmtdsRNA后,卵中基因甲基化率便发生变化(Xiangetal., 2013)。上述的研究报道显示DNA甲基化多发生于昆虫的形态变化中。昆虫的幼虫生长过程中是否存在DNA甲基化调控仍不清楚,特别是作为农业害虫主要所在的鳞翅目昆虫,一直被认为其DNA甲基化率较低,对生长发育的影响不是很重要。有报道金小蜂Nasoniavitripennis中被甲基化的基因主要为在整个发育过程都表达的组成型基因,侧面体现DNA甲基化的表观调控作用贯穿整个生长发育过程(Wangetal., 2013)。因此探讨农业害虫的幼虫生长过程的DNA甲基化调控作用,将对发现可用于害虫防治的新途径提供思路。
在哺乳动物中,从DNA甲基化的建立到维持需要3类DNA甲基转移酶的共同参与,即DNMT1、DNMT2和DNMT3(又分a和b两种类型)(Klose and Bird, 2006)。DNMT1称为维持型甲基化酶,其在DNA进行半保留复制时,促使新合成的DNA链进行甲基化(Bestor, 2000; Goll and Bestor, 2005);DNMT3能够催化DNA从头甲基化,这一过程主要发生在生物体发育的早期阶段(Okanoetal., 1999; Katoetal., 2007);DNMT2起初被认为也是一种DNA甲基化酶,但最近的研究表明DNMT2主要是使RNA甲基化(Golletal., 2006),因此其功能完全不同于DNMT1和DNMT3(柳莹等,2013;梁士可等,2014)。 在昆虫中,蜜蜂和环节动物等基因组中具有dnmt1、dnmt2和dnmt3基因,而在家蚕、沙漠蝗和赤拟谷盗等中只有dnmt1和dnmt2,缺乏dnmt3基因(Lykoetal., 2011)。Mitsudome等(2015)发现BmDNMT11不仅可以与半甲基化DNA,也可以与无甲基化DNA的结合,催化DNA甲基化,表明家蚕和沙漠蝗Schistocercagregaria的甲基化形成和维持的机制有可能不同于哺乳动物,推测家蚕等DNMT1综合了哺乳动物DNMT1和DNMT3的功能。敲除Bmdnmt1后导致家蚕的孵化率降低(Xiangetal., 2013)。在人类和小鼠的研究发现,DNMT1的N-末端参与细胞内定位及催化活性的调节,包括用于结合DNA甲基化相关蛋白(DMAP1)的带电结构域、核定位信号(Nuclear localization signal,NLS)、增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)结合位点、复制焦点靶向区域(Replication focus targeting sequence,RFTS)、锌离子结合域CXXC以及2个涉及运送DNMT1至复制叉的Polybromo结构域BAH(Fatemietal., 2001; Lee and Skalnik, 2005; Youngetal., 2006; Spadaetal., 2007; Songetal., 2012);C-末端为典型的催化结构。而在昆虫中,DNMT1的结构大致相近(陈玮等,2015)。
斜纹夜蛾Spodopteralitura为鳞翅目夜蛾科农业害虫,在中国除青海和新疆未明外,各省(自治区)都有发现。幼虫取食甘薯、棉花、芋、莲、田菁、大豆、烟草、甜菜和十字花科和茄科蔬菜等近300种植物的叶片,间歇性猖獗为害,本文选取其幼虫以及鳞翅目模式昆虫家蚕进行研究。本研究获得了3948 bp斜纹夜蛾Sldnmt1 cDNA,并进行了Sldnmt1功能研究:分别在斜纹夜蛾的Sldnmt1催化保守区域设计引物合成dsRNA,于幼虫期注射Sldnmt1 dsRNA干扰该基因,以及注射甲基化抑制剂,皆导致约40%幼虫的生长不正常。家蚕幼虫注射甲基化抑制剂获得了与斜纹夜蛾相似的结果。通过表达谱分析,确定了家蚕Bmdnmt1在幼虫期的翅原基和脂肪体中比在预蛹期具有相对较高的表达量。研究结果表明了在鳞翅目昆虫的幼虫存在DNA甲基化调控。
1 材料和方法
1.1 实验材料
斜纹夜蛾Spodopteralitura:中山大学昆虫研究所提供,虫源来源于广州的一块蔬菜田,在实验室中人工传代50代以上。卵孵化后于25℃用人工培养基进行饲养。
家蚕Bombyxmori品系P50:蚕卵由广东省农业科学院蚕业所提供。蚕卵在26℃±1℃,相对湿度70%±5%,光周期14 h ∶10 h(光 ∶暗)的恒温培养箱中孵化,孵化后幼虫在相同环境中用桑叶(采摘自广州宝桑园和华南农业大学蚕学桑园实习基地)进行饲养。
1.2 生物信息学分析
用软件Primer premier 5.0(PREMIER Biosoft International,美国)设计引物;用在线软件Primer-blast(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)分析引物的特异性。用在线软件Conserved Domain Architecture Retrieval Tool(http://www.ncbi.nlm.nih.gov/Structure/lexington/lexington.cgi?cmd=rps)分析蛋白结构域。
1.3 RNA干扰
Sldnmt1的互补双链RNA按T7 RiboMAXTMExpress RNAi System试剂盒(Promega, USA)提供方法进行合成。先用cDNA扩增合成双链RNA所需的模板DNA链,步骤如下:预热94℃ 3 min后,94℃ 30 s,55℃ 30 s,72℃ 30 s,35次循环,最后72℃ 10 min充分扩增。随后按照T7 RiboMAXTMExpress RNAi System试剂盒说明书合成和纯化所需的dsRNA。合成的dsRNA溶解在不含RNA酶的水中,gfp dsRNA作为对照并按相同方式进行合成。相关引物见表1。

表1 本研究中dsRNA合成所用引物表
RNA双链注射:选取斜纹夜蛾刚进入5龄幼虫注射已合成的dnmt1双链RNA。幼虫先在冰上放置30 min,从幼虫第2胸节将30 μg dsRNA注入到体腔,50-60头虫为一份样,共3个重复。留取20-25头用于形态观察,其余在注射后24 h和72 h收集整虫,提取RNA进行基因敲除分析。
1.4 RNA提取及cDNA制备
按照Trizol试剂盒(Invitrogen, California, USA)说明书提取总RNA。 对于所有的样品,取2 μg总RNA,通过反转录制备cDNA。合成步骤如下:取2 μg总RNA,混合5×M-MLV缓冲液、dNTP混合液、RNase抑制剂和DNAse I,于37℃ 30 min,然后75°C 10 min,随后加入RTase M-MLV(RNaseH-)和Oligo(dT)18引物,于37℃ 60 min,然后70℃ 15 min。
1.5 QPCR分析
按照2×SYBRPremix EXTaqTM(TaKaRa, Dalian, China)试剂盒说明书进行qPCR分析。在dnmt1的催化区域中的非dsRNA 设计区域,分别设计Sldnmt1和Bmdnmt1的qPCR引物。所有基因的相对表达量以RP49为内参。ABI7300 Real-time PCR系统程序如下:变性95°C 10 s后,95°C 10 s,60°C 31 s,循环40次(Applied Biosystems, Foster City, CA)。通过2-ΔΔCt的方式进行计算(Livak & Schmittgen, 2001),所有的数据为3次生物学重复。定量PCR引物见表2。
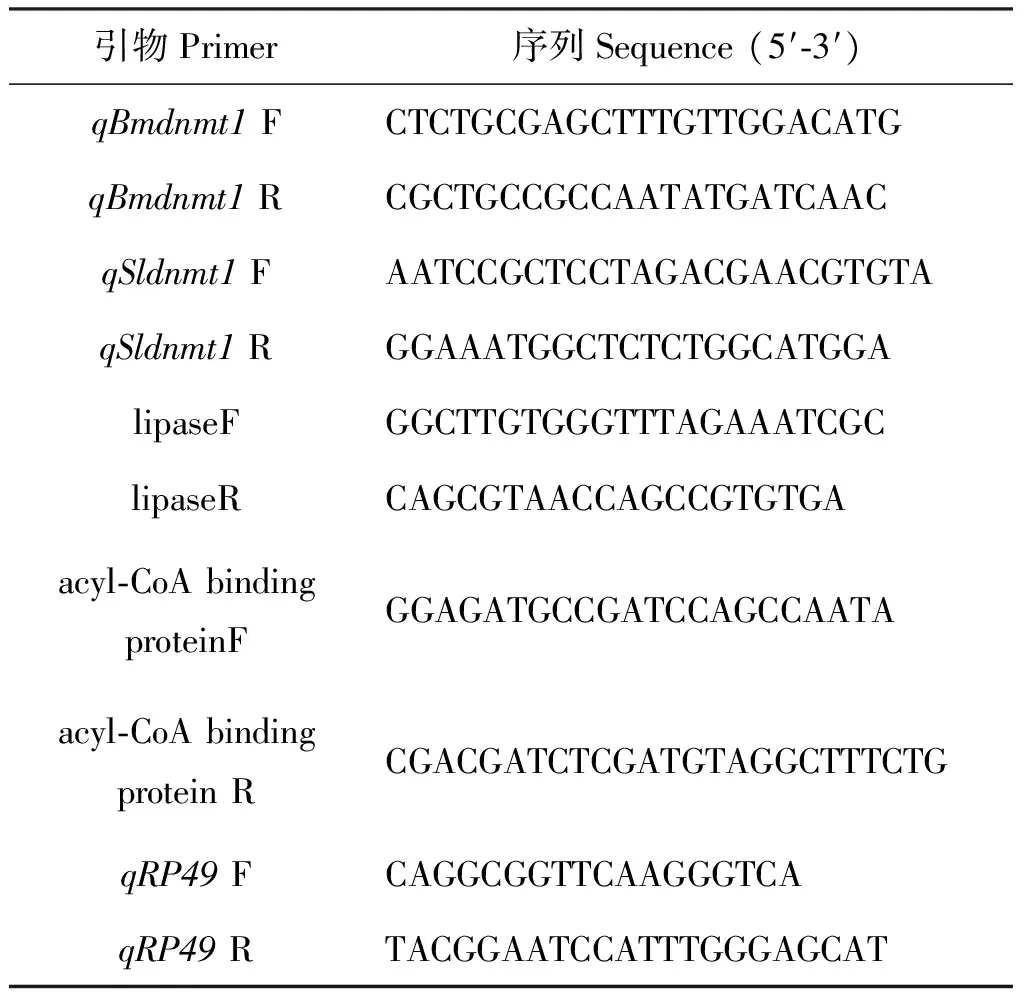
表2 本研究中qPCR所用引物表
1.6 DNA甲基化抑制剂注射
选取刚进入5龄的家蚕和斜纹夜蛾幼虫,分别注射水溶的DNA甲基化抑制剂5-aza-dC,(Sigma, USA)。幼虫先在冰上放置30 min,从幼虫第2胸节注入60 μg 抑制剂到体腔,60-80为一份样,共3个重复。对照则选取相同幼虫注射等量的ddH2O。除了留取20头用于形态观察,其余在注射后12 h、24 h和48 h收集整虫,提取RNA进行相关基因分析。
1.7 统计方法
所有的数据均为平均±标准差(SD),n=3。结果的意义由方差分析得出。*为P<0.05;**为P<0.01;***为P<0.001。
2 结果与分析
2.1 斜纹夜蛾Sldnmt1 cDNA的获得及其结构分析
本研究从NCBI网站上得到家蚕DNA甲基转移酶1序列(Bmdnmt1 GenBank编号:AB194008.1),继而根据家蚕Bmdnmt1序列比对斜纹夜蛾幼虫头部和中肠的转录组(未发表),发现在斜纹夜蛾幼虫头部及中肠都存在DNA甲基转移酶1。如图1所示,斜纹夜蛾SlDNMT1的ORF序列,由1311个氨基酸组成。
将家蚕和斜纹夜蛾与其他昆虫的DNMT1氨基酸序列进行比较表明,昆虫DNMT1的氨基酸为1300-1500个。如脐橙螟DanausplexippusDNMT1(GenBank 编号:EHJ76342.1)为1428个氨基酸,大红斑蝶PapiliomachaonDNMT1(GenBank编号:KPJ15240.1)为1363个氨基酸。各物种DNMT1氨基酸序列相似度高于70%(表3),表明了不同昆虫DNMT1可能具有相似功能。进一步用软件分析它们的蛋白结构,发现除了N-端略有差异外,氨基酸序列基本保守。N-端包含了与DNA相结合的锌离子结合域(zinc finger CXXC),以及2个与运送DNMT1至复制叉相关的Polybromo结构域(BAH);C-端为催化结构域(SAM_MT_C5)和具有6个保守的DNA结合活性基序(motif Ⅰ、motif Ⅳ、motif Ⅵ、motif Ⅷ、motif Ⅸ、motif Ⅹ)(图2)。Motif Ⅰ和motif Ⅹ折叠在一起,形成SAM的结合位点;motif Ⅳ中的脯氨酸和半胱氨酸,为 C-端催化结构提供甲醇基(陈玮等,2015)。
2.2 采用RNAi方法研究dnmt1对斜纹夜蛾幼虫生长的影响
由于昆虫DNMT1结构都由锌指结构、Polybromo结构域和催化结构域组成,因此选择重要功能区域(催化区域)合成dnmt1 dsRNA,进行dnmt1功能分析。结果表明:注射Sldnmt1 dsRNA 72-96 h后的斜纹夜蛾与对照相比,部分幼虫发育滞后,虫体体型偏小(图3)。斜纹夜蛾这类体型偏小幼虫增加了35%(表4)。定量PCR证明注射dsRNA的斜纹夜蛾中Sldnmt1表达量明显下降,表明斜纹夜蛾RNAi后幼虫发育不正常可能是Sldnmt1表达受到干扰的缘故。
MDEYIETKHLLDIEMDEYIETKHQLDIKMDENENNNVIAKTKPIVLDNEKCETCGQFLNNSDIIFYQGHPQNSVEEYIALTNEKLVLASG
EEGDIMERPQTNITSFCIFDEQGHLVPIDGGLVENDVCIYMSGYLKSICTDSPEIDDESVPVKDVGPIIEWFIHGFDGGEKNCITLSTEFGE
YNLLKPSEQYTPLMNNLYEKIWLSKIVIEYLEEYHYLQPTYEDLLELIRECTIPDLNDMRITEEMLHKHAQFVCDQVVSLEADEDDEPPL
ITLPCMRELIKLMGIKFGKRKFRTKIDYKKIDKKAWTKATTTPLVRKTFESFFTNQLDKTNHELVLRRKRCGVCEACQLPDCGECNACR
AMAKFGGHGRTKKACVRRFCPNMAVEQAEDSEPDDEDDYQQMAEKKHHDKIEDAVPVKLTGSNNRKIKWLGEPTKADTTKVYYEK
VEIDGSELCNGDFVMVETSQSNIPALVARVVYMWRETINSQSGYFHAEVFIRASDTVLGEVSDPREVFLGDRCCHGAPLSSILRKASVEK
GEIPADWFRLGGKEIDDKHFEDDGKTYFYNKYYERFTARFEDLPADPKCPNPLRQHRFCPSCERKTRRDAKNIPKVFGKLLEKSSVVTE
SNRTEWTHVTWQDYDYKKGCSVFLKPGTFKLKNSFNNNANNVKPKLDKVDEDIYPEYYRKSDNNLRGSNIDTGEPFCIGYIAAVTAIGE
GPLIVPQDIYLKVNVLYRPENTTSRFPQHEDLNVVYWSDEIRDVSFSAVVGVCQVFYEQNIPLHCSLTEWLEKDPCRFYFRMAFDKSSG
QFVDVPHNATTVGRTSDRSKDKGKGKGKSSKPVESNKNNVETSSVRPLRTLDVFAGCGGLSEGLHQAGVAECRWAIENVEAAAHAYG
LNNKNCIVFHEDCNALLKEAMSGATHSTNGLRLPMQGEVELLCGGPPCQGFSGMNRFNSREYSNFKNSLVASYLSYCDYYRPKYFILEN
VRNFVAFKKGMVLKLTLRALLDMGYQCTFGILQAGNYGVPQTRRRLIILAAAPGYKLPFYPEPTHVFSRRACSLTTTIDGKRFVTNINWD
ESAPRRTCTIRDAMSDLPRICNGANKIEIEYGSMPESHFQRLIRSKNENAKLRDHICKNMAPLIQARICRVPTTPGSDWRDLPNISVALSD
GTKCKVLQYRYDDKRNGRSSSGALRGVCACAAGGPCSPADKQENTLIPWCLPHTGNRHNNWAGLYGRVCWDGYFSTTVTDPEPMG
KQGRVLHPEQNRVVSVRECARSQGFPDTYIFAGSVQDKHRQVGNAVPPPLGAALGREIKRALASSI
图1 斜纹夜蛾DNA甲基转移酶 1全长氨基酸序列
Fig.1 The amino sequence ofSpodopteralituraDNA methyltransferase 1

图2 昆虫DNA甲基转移酶1(DNMT1)氨基酸和蛋白结构分析Fig.2 Analysis of amino acid and protein structure of insect DNA methyl transferase 1 (DNMT1)
2.3 利用DNA甲基化抑制剂研究Dnmt1对斜纹夜蛾和家蚕幼虫生长的影响
5-氮-2′脱氧胞苷(5-Aza-dC)是一种真核生物的DNA甲基化抑制剂,已被广泛应用于临床医疗和科研实验。 5-Aza-dC通过磷酸化后直接掺入DNA,抑制DNA甲基化转移酶,引起DNA低甲基化(Dastjerdietal., 2014; Zhouetal., 2015; Andersetal., 2016)。对鳞翅目农业害虫斜纹夜蛾和模式昆虫家蚕进行甲基化抑制剂处理,结果表明注射5-Aza-dC36 h后的部分家蚕和斜纹夜蛾出现了发育不良和幼虫体型较小的症状(图4)。其中斜纹夜蛾发育不良的幼虫比对照增加了36%(表4),结果与Sldnmt1 RNAi的结果相似(图3);不正常家蚕增加了58.8%(表4),表明DNA甲基化对家蚕幼虫生长的影响大于对斜纹夜蛾的,同时也证明了DNA甲基化在家蚕等鳞翅目昆虫中确实对幼虫的生长起到调控作用。

表3 不同昆虫物种DNMT1氨基酸序列一致性比较
注:不同物种DNA甲基转移酶1分别为:BmDNMT1,家蚕 ;AtDNMT1,脐橙螟; DpDNMT1,大红斑蝶; PmDNMT1,金凤蝶;PpDNMT1,玉带凤蝶;PxDNMT1,柑橘凤蝶;SlDNMT1,斜纹夜蛾。Note: Different species of Methyltransferase 1: BmDNMT1,Bombyxmori; AtDNMT1,Amyeloistransitella; DpDNMT1,Danausplexippus; PmDNMT1,Papiliomachaon; PpDNMT1,Papiliopolytes; PxDNMT1,Papilioxuthus; SlDNMT1,Spodopteralitura.

图3 Sldnmt1 RNAi后部分斜纹夜蛾性状图(左)和Sldnmt1表达分析(右)Fig.3 The phenotype (left) and Sldnmt1mRNA level (right) of Spodoptera litura after Sldnmt1 RNAi

实验Experiment注射物质Injectedmaterials斜纹夜蛾(%)Slitura家蚕(%)Bmoridnmt1RNAidsgfp(对照Control)4-dsSldnmt139-DNA甲基化抑制剂DNAmethylationinhibitor水Water(对照Control)11595⁃Aza⁃dC47647
注:每份样品虫数目为18-25条。Note: The number of per sample is 18-25.
2.4 家蚕Bmdnmt1表达谱分析
以上实验证实了dnmt1影响幼虫的生长发育,为了查明dnmt1如何发挥作用,本研究调查了家蚕5龄期Bmdnmt1表达的组织分布。采用定量PCR方法检测Bmdnmt1在不同组织的mRNA水平。实验结果表明:从组织而言,家蚕5龄期各个组织均有Bmdnmt1表达,以翅原基中的表达量为最高;从发育时间而言,在翅原基和脂肪体中以5龄初期含量较高,在表皮中以游走期较高,而中肠中则表达比较平稳。结果表明了鳞翅目昆虫dnmt1在幼虫期确有表达。

图4 DNA甲基化抑制剂处理36 h后斜纹夜蛾(上)和家蚕(下)表型分析Fig.4 The phenotypes of Spodoptera litura (above) and Bombxy mori (below) treated with DNA mehylation inhibitor for 36 h
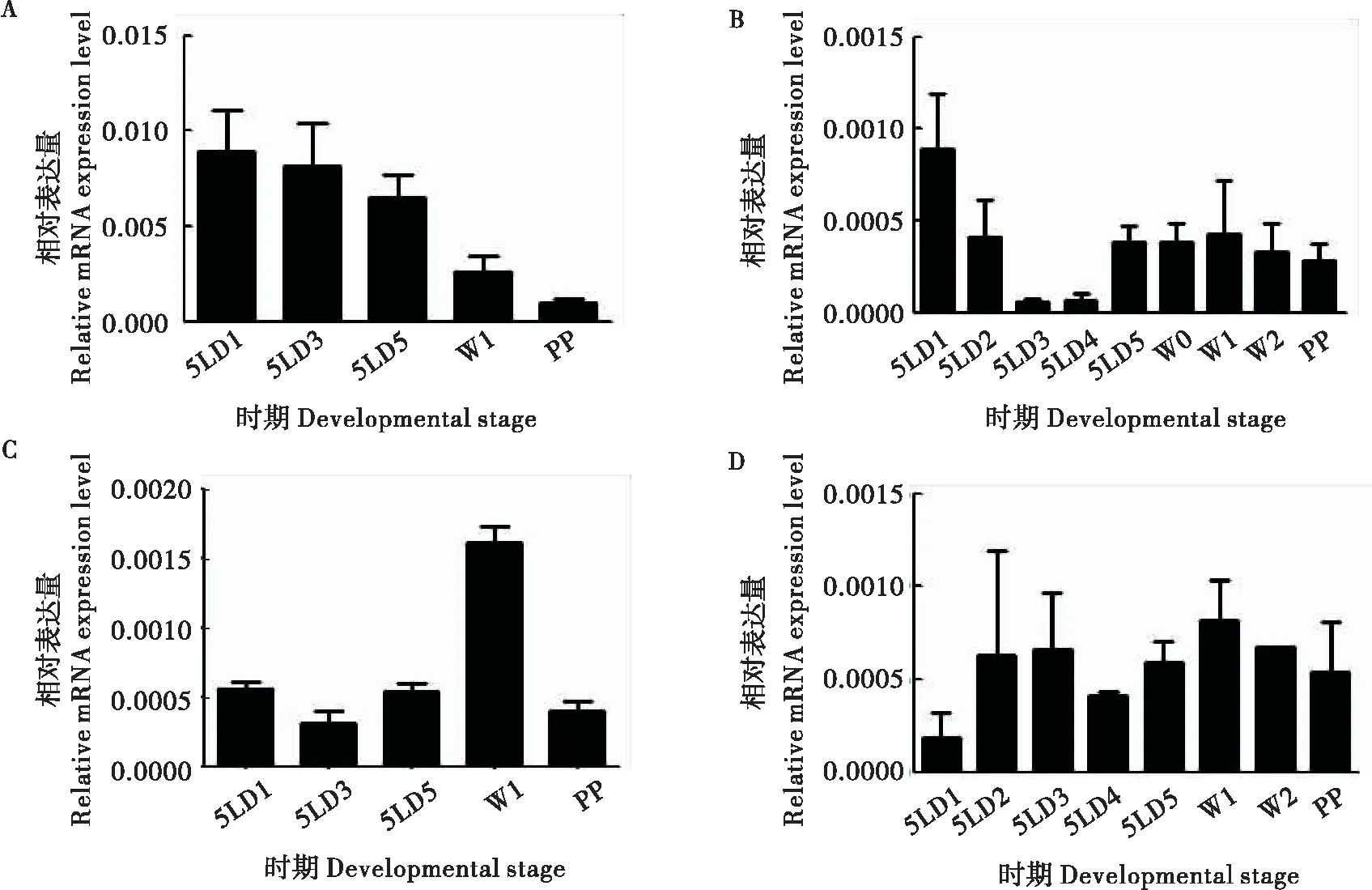
图5 Bmdnmt1在家蚕不同组织中的表达情况Fig.5 The expression of Bmdnmt1 in different tissues of Bombxy mori 注:A,翅原基;B,脂肪体;C,表皮;D,中肠。5L,5龄;W,游走期;PP,预蛹期;数字,天数。Note: A, Wing disc; B, Fat body;C, Epidermis; D, Midgut; 5L, Fifth instar larvae; W, Wandering stage; PP, Prepupal stage; Numbers, Days of development.
2.5 DNA甲基化调控家蚕幼虫脂肪代谢
由于DNA甲基化抑制剂和RNAi实验的结果皆表明,DNA甲基化可能通过调控营养代谢来影响幼虫的生长。为此,本研究初步分析了注射DNA甲基化抑制剂(5-Aza-dC)后的家蚕翅中与脂肪代谢有关的基因:脂肪酶(lipase)(GenBank 编号:XP_004931923.1)和乙酰辅酶A结合蛋白(acyl-CoA binding protein)(GenBank 编号:NM_001043557.1)。发现这两基因在注射了抑制剂48 h后的表达都呈现不同程度的下调。因此, DNA甲基化抑制剂处理导致的脂肪代谢受阻,可能是昆虫生长延缓的其中一个原因。
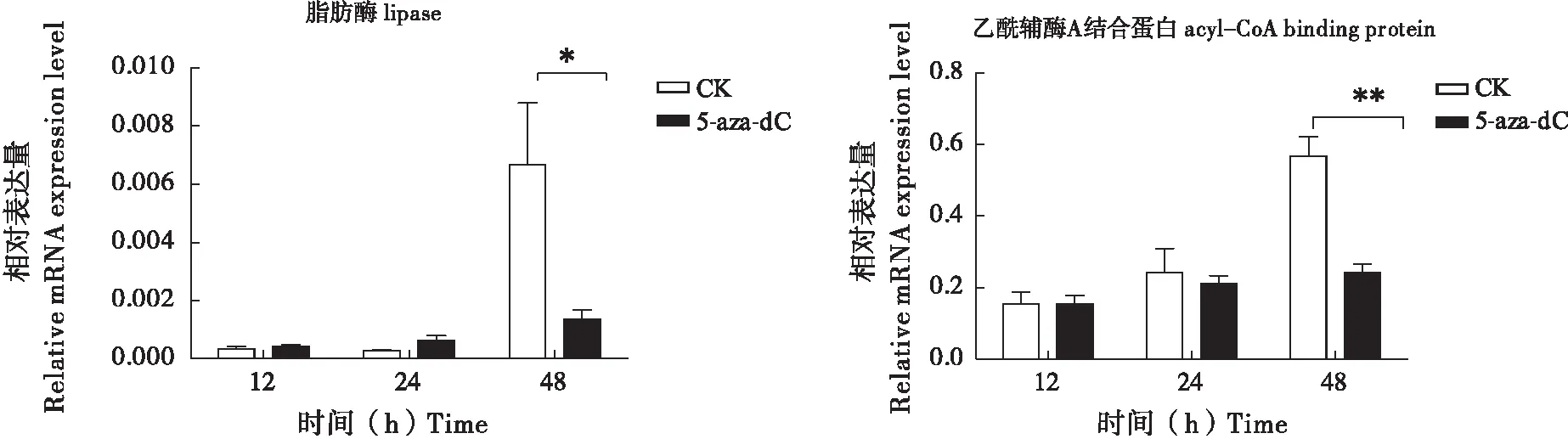
图6 DNA甲基化抑制剂注射5龄家蚕后脂肪酶和乙酰辅酶A结合蛋白mRNA水平分析Fig.6 The analysis of the mRNA levels of acyl-CoA binding protein and lipase in Bombxy mori larvae injected with DNA methylation inhibitor
3 结论与讨论
DNA甲基化是真核生物生长发育过程中基因表达的一种重要调控机制。它在昆虫中被证实参与了多种发育过程, 如蜜蜂卵期敲除Amdnmt3后,新孵出的蜜蜂多呈现出蜂王的特征(Kucharskietal.,2008);独居型蝗虫和群居型蝗虫的Lmdnmt1、Lmdnmt2和Lmmbd2/3等以及DNA甲基化相关基因的表达水平存在显著差异(Robinsonetal., 2015);家蚕卵期敲除Bmdnmt1基因后,家蚕孵化率明显下降(Xiangetal., 2013)。但是至今仍没有关于DNA甲基化对昆虫幼虫生长调控研究报道。本研究选取农业重要害虫斜纹夜蛾,针对鳞翅目昆虫中重要DNA甲基化酶基因dnmt1(柳莹等,2013),采用了RNAi方法,证明dnmt1参与调控幼虫期的生长(图3)。同时还采用甲基化专一抑制剂(5-aza-dC)进行了相似的实验。5-aza-dC在小鼠、大鼠和人体等哺乳动物体内和体外实验都证明可以显著抑制DNA基因组的甲基化含量(Fülleretal.,2015; Songetal.,2016; Wangetal.,2016)。5-aza-dC注射结果表明,抑制剂有效的抑制了斜纹夜蛾以及家蚕的DNA甲基化形成,导致幼虫出现不同比例的生长显著滞缓,个体变小等性状,进而验证了基因组甲基化调控家蚕和斜纹夜蛾等鳞翅目昆虫幼虫的生长。
但是,在本实验中,不论是RNAi还是甲基化抑制剂(5-aza-dC)的注射实验,都只得到35%-60%昆虫发生了性状变化,而非全部家蚕或斜纹夜蛾出现不正常的表型。分析其中一个原因可能是在幼虫时期表达量相对不高,因为不管在昆虫还是哺乳动物,dnmt1虽然在各时期的组织都有一定量的表达,但其主要的表达高峰期为受精卵、卵巢和睾丸等与生殖相关组织, 因而dnmt1对卵巢以及胚胎的早期发育起到至关重要的作用(Tayloretal., 2009; Fujiharaetal., 2012; Huanetal., 2015; Robinsonetal., 2015)。但本实验也证明了,虽然Bmdnmt1在幼虫时期表达量可能不高,但依然能调控幼虫的生长。
为了解dnmt1在幼虫期各组织的表达情况,本研究用Real-time PCR检测了家蚕5龄幼虫到化蛹前各组织中Bmdnmt1的表达情况。发现家蚕Bmdnmt1在其5龄到化蛹时期各个组织均有不同程度的表达,在翅原基和脂肪体中以5龄初期含量较高,在表皮游走期较高,而中肠中则表达比较平稳。因此,DNA甲基化并不是幼虫期最低,但有组织的差别。同时Bmdnmt1在各组织都有表达,表明BmDNMT1对幼虫期家蚕的各组织生长发育都有调控作用, 这与其他物种的报道相似。Robinson等人(2016)也验证了在蝗虫中卵、成虫头部、神经、卵巢和睾丸都存在Lmdnmt1、Lmdnmt2和Lmmbd2/3等基因的表达,其中卵巢和睾丸组织的表达量最高。这些实验结果从侧面反映了dnmt1在昆虫各组织及时期都存在表达,从而参与调控各时期各组织的生长发育。
鉴于斜纹夜蛾和家蚕在注射甲基化抑制剂后都出现发育不良等性状,推测甲基化可能调控了昆虫幼虫期生长发育所必须的营养和能量代谢。为此首先采用Real-time PCR检测了一些与能量代谢相关的基因,主要包括脂肪和甾醇类代谢相关基因,发现在脂肪代谢通路占重要地位的脂肪酶(lipase)和乙酰辅酶A结合蛋白(acyl-CoA binding protein)有不同程度的表达下调。脂肪酶广泛存在于动植物中,它在生物体中发挥水解、底物结合以及辅助因子等作用,对于脂类消化、吸收、运输及新陈代谢起着关键作用。在昆虫中,脂肪体是昆虫贮存能源的主要组织,脂肪酶广泛存在于动物脂肪体中,通过催化甘油三酯水解成游离脂肪酸和甘油,在经过进一步的生化反应为生物的其他生理活动提供能量(Brabcováetal.,2013; Wangetal.,2016)。虽然乙酰辅酶A结合蛋白(acyl-CoA binding protein)的研究比较少,但也在脂类代谢通路中起作用(Ohnishietal., 2005)。因此推测甲基化抑制剂处理后的家蚕发育受阻的其中一个原因,可能是家蚕体内脂质代谢通路受阻,导致能量供应不足,机体生理生化反应滞后或减弱所致。而甲基化抑制剂处理后,甲基化含量减少反而减少基因的表达已有不少报道(Xiangetal.,2010),但脂肪酶下调的具体机制仍还需要进一步的深入研究。同时,甲基化调控昆虫幼虫的除脂肪代谢外的其他途径也待进一步研究。
References)
Anders NM, Liu J, Wanjiku T,etal. Simultaneous quantitative determination of 5-aza-2-deoxycytidine genomic incorporation and DNA demethylation by liquid chromatography tandem mass spectrometry as exposure-response measures of nucleoside analog DNA methyltransferase inhibitors [J].JournalofChromatographyB, 2016, 1022: 38-45.
Bestor TH. The DNA methyltransferases of mammals [J].Hum.Mol.Genet, 2000, 9: 2395-2402.
Brabcová J, Prchalová D, Demianová Z,etal. Characterization of neutral lipase BT-1 isolated from the labial gland ofBombusterrestrismales [J].PLoSONE, 2013, 8 (11): e80066.
Chen W, Xu XJ, Chen NJ,etal. Review of research on insect DNA methylation [J].ChineseJournalofAppliedEntomology, 2015, 52 (5): 1082-1093. [陈玮, 徐雪娇, 陈楠菁, 等. 昆虫DNA甲基化的研究进展[J]. 应用昆虫学报, 2015, 52 (5): 1082-1093]
Dastjerdi MN, Babazadeh Z, Salehi M,etal. Comparison of the anti-cancer effect of disulfiram and 5-Aza-CdR on pancreatic cancer cell line PANC-1 [J].AdvancedBiomedicalResearch, 2014, 3: 156.
Fatemi M, Hermann A, Pradhan S,etal. The activity of the murine DNA methyltransferaseDnmt1 is controlled by interaction of the catalytic domain with the N-terminal part of the enzyme leading to an allosteric activation of the enzyme after binding to methylated DNA [J].JournalofMolecularBiology, 2001, 309 (5): 1189-1199.
Fujihara Y, Miyasako H, Kato K,etal. Molecular cloning, expression, and characterization ofstarfishDNA (Cytosine-5)-methyltransferases[J].Bioscience,Biotechnology,andBiochemistry, 2012, 76: 9, 1661-1671.
Füller M, Klein M, Schmidt E,etal. 5-Azacytidine enhances efficacy of multiple chemotherapy drugs in AML and lung cancer with modulation of CpG methylation [J].InternationalJournalofOncology, 2015, 46: 1192-1204.
Goll MG, Kirpekar F, Maggert KA,etal. Methylation of tRNA (AsP) by the DNA methyltransferase homologDnmt2 [J].Science, 2006, 311: 395-398.
Guo XX, Ye HY, Zhang M. DNA methylation inDrosophila, a review of recent studies [J].Hereditas, 2011, 33 (7): 713-719. [郭欣欣, 叶海燕, 张敏. 果蝇 DNA 甲基化研究进展[J]. 遗传, 2011, 33 (7): 713-719]
Huan Y, Xie B, Liu S,etal. A novel role for DNA methyltransferase 1 in regulating oocyte cytoplasmic maturation inPigs[J].PLoSONE, 2015, 10 (5): e0127512.
Kato Y, Kaneda M, Hata K,etal. Role of theDnmt3 family in de novo methylation of imprinted and repetitive seqences during male germ cell development in the mouse [J].HumanMolecularGenetics, 2007, 16 (19): 2272-2280.
Klose RJ, Bird AP. Genomic DNA methylation:The mark and its mediators [J].TrendsinBiochemicalSciences, 2006, 31: 89-97.
Kucharski R, Maleszka J, Foret S,etal. Nutritional control of reproductive status in honeybees via DNA methylation [J].Science, 2008, 319 (5871): 1827-1830.
Lee JH, Skalnik DG. CpG-binding protein (CXXC finger protein 1) is a component of the mammalian Set1 histone H3-Lys4 methyltransferase complex, the analogue of the yeast Set1/COMPASS complex [J].JournalofBiologigalChenmistry, 2005, 280 (50): 41725-41731.
Liang SK, Zhang M, Liang ZQ,etal. Characteristics and functions of DNA methylation in insects [J].ActaEntomologySinica, 2014, 57 (2): 1439-1442. [梁士可, 张梅, 梁梓强, 等. 昆虫DNA甲基化的特点和功能[J]. 昆虫学报, 2014, 57 (2): 1439-1442]
Liu Y, Tang YZ, Gao L. Research progress on invertebrates DNA methylation [J].BiotechnologyBulletin, 2015, 31 (8): 17-23. [柳莹, 唐永政, 高丽. 无脊椎动物DNA甲基化研究进展[J]. 生物技术通报, 2015, 31 (8): 17-23]
Lyko F, Foret S, Kucharski R,etal. The honeybee epigenomes: Differential methylation of brain DNA in queens and workers [J].PLoSBiology, 2010, 8: e1000506.
Mitsudome T, Mon H, Xu J,etal. Biochemical characterization of maintenance DNA methyltransferaseDNMT-1 from silkworm, Bombyx mori [J].InsectBiochemistry&MolecularBiology, 2015, 58: 55-65.
Ohnishi A, Koshino H, Takahashi S,etal. Isolation and characterization of a humoral factor that stimulates transcription of the acyl-CoA-binding protein in the pheromone gland of the silkmoth,Bombyxmori[J].TheJournalofBiological, 2005, 280 (6): 4111-41116
Okano M, Bell DW, Haber DA,etal. DNA methylteansferasesDnmt3aandDnmt3bare essential for de novo methylation and mammalian development [J].Cell, 1999, 99: 247-257.
Robinson KL, Tohidi-Esfahani D, Ponton F,etal. Alternative migratory locust phenotypes are associated with differences in the expression of genes encoding the methylation machinery [J].InsectMolecularBiology, 2016, 25 (2): 105-115.
Shao XL, He SY, Zhuang XY,etal. mRNA expression and DNA methylation in three key genes involved in caste differentiation in female honeybees (Apismellifera) [J].ZoologicalResearch, 2014, 35 (2): 92-98.
Song J, Teplova M, Ishibe-Murakami S,etal. Structure-based mechanistic insights intoDNMT1-mediated maintenance DNA methylation [J].Science, 2012, 335 (6069): 709-712.
Song N, Endo D, Song B,etal. 5-aza-2-deoxycytidine impairs mouse spermatogenesis at multiple stages through different usage of DNA methyltransferases [J].Toxicology, 2016, 361-362: 62-72.
Spada F, Haemmer A, Kuch D,etal.DNMT1 but not its interaction with the replication machinery is required for maintenance of DNA methylation in human cells [J].TheJournalofCellBiology, 2007, 176 (5): 565-571.
Taylor J, Moore H, Beaujean N,etal. Cloning and expression of sheep DNA methyltransferase 1 and its development-specific isoform [J].MolecularReproduction&Development, 2009, 76: 501-513.
Vanyushin BF. DNA methylation and epigenetics [J].RussianJournalofGenetics, 2006, 42 (9): 985-997.
Wang L, Li J, Zhao X,etal. Expression and characterization of a lipase-related protein in the malpighian tubules of the Chinese oak silkworm,Antheraeapernyi[J].BulletinofEntomologicalResearch, 2016, 14: 1-9.
Wang X, Wheeler D, Avery A,etal. Function and evolution of DNA methylation inNasoniavitripennis[J].PLoSGenet, 2013, 9 (10): e1003872.
Wang Y, Guo QL, Yan JQ,etal. Role of DNA methyltransferases in the pathogenesis of neuropathic pain in rats[J].JournalofCentralSouthUniversity(Medical Science), 2016, 41 (6): 578-585. [王英, 郭曲练,鄢建勤, 等. DNA甲基转移酶类在大鼠神经病理性疼痛发病机制中的作用[J]. 中南大学学报(医学版), 2016, 41 (6): 578-585]
Xiang H, Li X, Dai F,etal. Comparative methylomics between domesticated and wild silkworms implies possible epigenetic influences on silkworm domestication [J].BMCGenomics, 2013, 14: 646.
Xiang H, Wang W. Advances of DNA methylation studies in insects. In: Proceedings of the 2009 Annual Conference of the Insect Society of Yunnan Province [C]. 2009. [相辉, 王文. 昆虫DNA甲基化及其功能的研究进展. 见: 云南省昆虫学会2009年年会论文集[C]. 2009]
Xiang H, Zhu JD, Chen Q,etal. Single base-resolution methylome of the silkworm reveals a sparse epigenomic map [J].Nat.Biotechnol., 2010, 28: 516-520.
Young SR, Mumaw C, Marrs JA,etal. Antisense targeting of CXXC finger protein 1 inhibits genomic cytosine methylation and primitive hematopoiesis in zebrafish [J].JournalofBiologicalChemistry, 2006, 281 (48): 37034-37044.
Zhou X, Chen J, Liang MS,etal. Differential DNA methylation between two wing phenotypes adults ofSogatellafurcifera[J].Genesis, 2013, 51: 819-826.
Zhou Y, Hu Z. Genome-wide demethylation by 5-aza-2′-deoxycytidine alters the cell fate of stem/progenitor cells [J].StemCellReviewsandReports, 2015, 11 (1): 87-95.
Methyltransferase may involve in regulating the larval growth ofSpodopteralituraandBombxymori
XU Guan-Feng, ZHENG Si-Chun*
(Guangzhou Key Laboratory of Insect Development Regulation and Application Research, School of Life Sciences, South China Normal University, Guangzhou 510631, China)
DNA methylation plays a role in eukaryotes growth and development. In this study, the function of DNA methylation in larval growth of Lepidoptera pest,Spodopteralitura, and model insect,Bombxymori, was studied. The results showed that the abnormal larvae, which became smaller, of methylation inhibitor (5-Aza-dC)-treatedS.lituraandB.moriwere increased 36% and 58.8% comparing to un-treated larvae, respectively; the RNAi ofS.lituramethyltransferaseDnmt1 reveal the similar result as 5-Aza-dC treatment, the abnormal larvae was increased 35%. qRT-PCR analysis demonstrated the expression ofBmdnmt1 in wing disc, fat body, epidermis and midgut during larval stage, and the highest expression level was found in wing disc ; besides, in wing disc and fat body, theBmdnmt1 mRNA level in early fifth instar was higher than in prepupa. The mRNA levels of lipase and acyl-CoA binding protein, which belonged to lipid metabolism pathway, were analyzed in 5-Aza-dC-treatedB.morilarvae using qRT-PCR and showed that the expression of both genes were inhibited by 5-Aza-dC. All data together suggest that DNA methylation involves in the regulation of Lepidoptera larvae growth, lipid metabolism may be one of pathways regulated by DNA methylation.
DNA Methyltransferase; function;Spodopteralitura;Bombxymori; larvae
国家重点基础研究发展计划(2012CB114603)
徐关峰,男,1991年生,硕士研究生,研究方向为昆虫分子生物学,E-mail: 1473220308@qq.com
*通讯作者Author for correspondence, E-mail: sczheng62@126.com
Received: 2016-08-12; 接受日期Accepted: 2016-09-19
Q963;S433.4
A
1674-0858(2017)02-0372-10
徐关峰,郑思春.DNA甲基转移酶参与调控斜纹夜蛾和家蚕幼虫的生长[J].环境昆虫学报,2017,39(2):372-381.
