过敏性紫癜血清中某些细胞因子和IgA1含量变化的临床意义
2017-06-01邢静李文斌刘振奎石蔚
邢静++李文斌++刘振奎+++石蔚
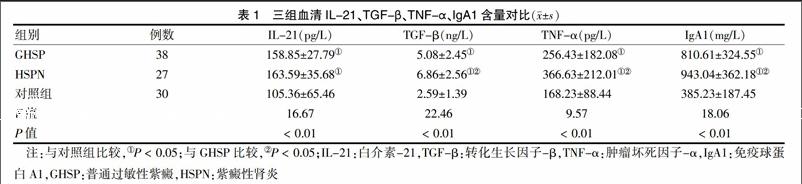
[摘要] 目的 观察普通过敏性紫癜(GHSP)及紫殿性肾炎(HSPN)患儿血清白细胞介素21(IL-21)、转化生长因子β(TGF-β)、肿瘤坏死因子α(TNF-α)和免疫球蛋白A1(IgA1)含量,进一步探讨过敏性紫癜(HSP)及HSPN的发病机制,为临床诊断和治疗HSP提供新思路。 方法 抽取2014年1月~2016年1月在河北北方学院附属第一医院儿科住院治疗的65例HSP(38例GHSP,27例HSPN)患儿和30例健康儿童(对照组)外周血,离心后分离血清,采用双抗夹心酶联免疫吸附法(ELISA)检测血清IL-21、TGF-β、TNF-α、IgA1含量,对结果进行统计学分析。 结果 HSP患儿IL-21、TGF-β、TNF-α、IgA1水平均高于对照组(P < 0.05),且HSPN患儿TGF-β、TNF-α、IgA1水平均明显高于GHSP患儿(P < 0.05),而IL-21水平在两组患儿之间差异无统计学意义(P > 0.05)。HSPN患儿血清TGF-β与IgA1呈正相关(r=0.346,P < 0.05),TNF-α与IgA1呈正相关(r=0.582,P < 0.05)。 结论 IL-21、TGF-β、TNF-α和IgA1参与GHSP及HSPN的发病及病情进展,血清IgA1含量可作为判断HSPN患儿预后的重要指标之一。
[关键词] 过敏性紫癜;普通过敏性紫癜;紫癫性肾炎;炎症介質;免疫球蛋白
[中图分类号] R692.34 [文献标识码] A [文章编号] 1673-7210(2017)04(b)-0111-04
[Abstract] Objective To observe the contents of IL-21, TGF-β, TNF-α and IgA1 in patients with general Henoch-Schnlein purpura (GHSP) and Henoch-Schnlein purpura nephritis (HSPN), and further explore the pathogenesis of HSP and HSPN, in order to provide new ideas for diagnosis and treatment of HSP in clinic. Methods 65 children with HSP (38 children with GHSP, 27 children with HSPN) hospitalized in Department of Pediatric Internal, the First Affiliated Hospital of Hebei North University from January 2014 to January 2016 were selected. At the same time 30 healthy children who did health examination in the same hospital were selected randomly as control group. Their serum were collected for test after centrifugation, the contents of serum IL-21, TGF-β, TNF-α and IgA1 were detected by double-antibody sandwich enzyme-linked immunosorbent assay method (ELISA). The results were analyzed statistically. Results The contents of serum IL-21, TGF-β, TNF-α and IgA1 in children with HSP were significantly higer than those of the control group (P < 0.05); and the contents of serum TGF-β, TNF-α, IgA1 in children with HSPN were higher than those of the children with GHSP (P < 0.05), but the content of serum IL-21 had no significant difference between the two groups (P > 0.05). The contents of serum TGF-β and IgA1 in children with HSPN was positively correlated (r=0.346, P < 0.05), while the contents of serum TNF-α and IgA1 in children with HSPN was also positively correlated (r=0.582, P < 0.05). Conclusion IL-21, TGF-β, TNF-α and IgA1 are all involved in the occurrence and development process of GHSP and HSPN, and serum IgA1 is help to judge the prognosis of patients with HSPN.
[Key words] Henoch-Schnlein purpura; Genral Henoch-Schnlein purpura; Henoch-Schnlein purpura nephritis; Inflammatory mediators; Immunoglobulins
过敏性紫癜又称亨舒综合征(Henoch-Schnlein purpura,HSP),好发于秋冬季节,发病年龄平均为(7.27±2.72)岁,是学龄期儿童常见疾病[1],临床表现除有皮肤紫癜、关节肿痛、腹痛、便血外,若累及肾脏还可以表现为血尿和/或蛋白尿,肾功能减退。HSP虽然大多预后良好,但少数患儿可发生终末期肾病[2],其中,未累及肾脏者称为普通过敏性紫癜(Genral Henoch-Schnlein purpura,GHSP),累及肾脏者称紫癜性肾炎(Henoch-Schnlein purpura nephritis,HSPN)。HSPN是儿童期继发性肾炎的重要原因之一。HSP的发病尚不明确,目前研究结果表明,患儿体内免疫细胞多克隆活化以致免疫球蛋白A1(Immunoglobulins,IgA1)为主的免疫球蛋白合成异常和循环免疫复合物的产生增多,导致机体发生系统性血管炎[3]。细胞因子白介素-21(interleukin-21,IL-21)、转化生长因子-β(transforming growth factor-β,TGF-β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和IgA1在人体免疫反应中具有重要作用,近年来被证实与HSP的发生及疾病进展有密切联系[4]。本研究通过观察HSP患儿急性期外周血IL-21、TGF-β、TNF-α、IgA1水平及其变化情况,进一步探讨儿童GHSP及HSPN的免疫学发病机制。
1 資料与方法
1.1 一般资料
本研究通过河北北方学院附属第一医院(以下简称“我院”)伦理委员会批准,所有测试者已签署知情同意书。选择2014年1月~2016年1月在我院儿科住院治疗的65例HSP患儿作为HSP组,其中,男41例,女24例;平均年龄(8.05±3.07)岁。纳入研究的患儿根据肾脏是否受累分为GHSP组(38例)和HSPN组(27例)。随机选择在我院体检中心进行体检的30例健康儿童作为对照组,其中男18例,女12例;平均年龄(8.15±3.16)岁。两组在性别构成比、年龄方面比较,差异无统计学意义(P > 0.05),具有可比性。
纳入标准为:①符合2005年欧洲风湿病防治委员会和美国风湿病协会共同制定的HSP诊断标准,临床表现为皮肤紫癜、急性关节炎或关节痛、弥散性腹痛以及肾脏受累,组织学检查示以IgA为主免疫复合物沉积。②处于HSP的急性期,具有典型皮疹,伴或不伴关节肿痛、腹痛及尿液改变。
排除标准:①2个月之内使用过糖皮质激素或其他免疫抑制剂。②既往患有系统性红斑狼疮、肾病综合征等免疫系统疾病或过敏性鼻炎、荨麻疹、支气管哮喘等过敏性疾病。
HSPN诊断标准为在HSP病程6个月内出现血尿和(或)蛋白尿。
1.2 方法
采用回顾性研究方法,所有受试儿童均于清晨空腹抽取静脉血2 mL,即刻置EDTA抗凝试管中混匀,4℃下2000 r/min离心15 min,收集血清置于-80℃冰箱待检;采用夹心法酶联免疫吸附试验(ELISA)检测血清IL-21、TGF-β、TNF-α、IgA1含量,操作步骤按试剂盒说明书进行。
1.3 统计学方法
采用SPSS 18.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;多组间比较采用单因素方差分析;计数资料用率表示,组间比较采用χ2检验;应用Pearson分析法对血清IL-21、TGF-β、TNF-α、IgA1含量进行相关性分析;以P < 0.05为差异有统计学意义。
2 结果
2.1 血清IL-21、TGF-β、TNF-α、IgA1变化情况
HSP患儿IL-21、TGF-β、TNF-α、IgA1水平均高于对照组(P < 0.05);且HSPN患儿TGF-β、TNF-α、IgA1水平均明显高于GHSP患儿(P < 0.05),而IL-21水平在两组患儿之间差异无统计学意义(P > 0.05)。见表1。
2.2 HSPN患儿血清IL-21、TGF-β、TNF-α、IgA1相关性
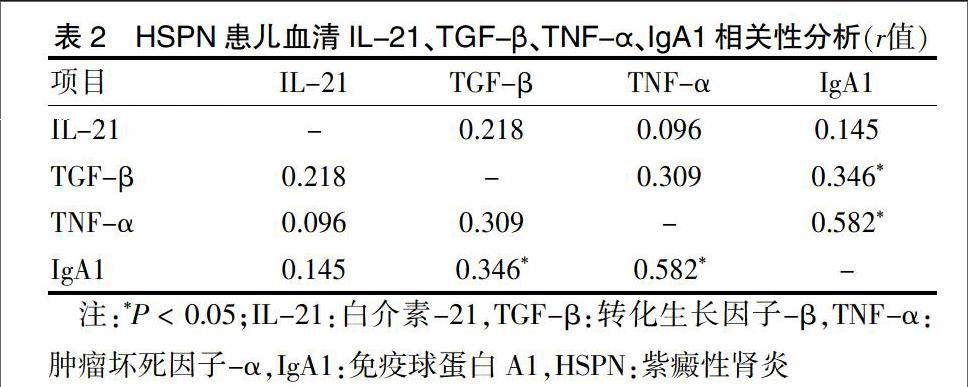
HSPN患儿血清TGF-β与IgA1呈正相关(r=0.346,P < 0.05),TNF-α与IgA1也呈正相关(r=0.582,P < 0.05)。见表2。
3 讨论
IL-21通常产生于活化的CD4+T细胞、滤泡辅助型T细胞以及NKT细胞,作用于表达有IL-21受体的B淋巴细胞,通过JAK/STAT通路激活e-Myc蛋白表达,促进B淋巴细胞的增殖和浆细胞分化,调节机体免疫力[5]。另外,IL-21和TGF-β协同作用还可使初始B细胞诱导Ig转换[6]。既往研究就认为,IL-21可能在系统性红斑狼疮、类风湿关节炎及过敏性紫癜等自身免疫性疾病中发挥重要作用[7]。刑静等[8]认为,体内合成IL-21可以调整HSP患者体内免疫功能紊乱的状态,但大量IL-21又往往增强免疫细胞的增殖与杀伤作用,加剧了自身免疫反应。本研究中,GHSP组及HSPN组患儿血清IL-21含量明显高于健康儿童(P < 0.05),但GHSP患儿及HSPN患儿之间差异无统计学意义(P > 0.05),表明IL-21在HSP发病机制中发挥重要作用,但IL-21对于HSP患儿是否会累及肾脏无提示意义。但王士杰等[9]认为HSP患儿急性期因T细胞分泌IL-21受到抑制,血浆IL-21含量会明显低于正常儿童,具体机制有待进一步探讨。
TGF-β可抑制B细胞分泌IgM而促进其分泌IgA和IgE,同时也可以抑制TH1和TH2细胞的功能,发挥保护性作用[10]。但TGF-β过度表达会促进肾脏系膜细胞增生,导致肾小球硬化,造成肾脏损伤[11]。本研究中,GHSP及HSPN患儿血清TGF-β水平均明显高于对照组,这是因为HSP 患儿急性期TH1/TH2细胞免疫应答失衡,TGF-β升高,体内出现保护性TH3细胞功能增强,以纠正TH1/TH2失衡[12]。本研究结果显示,HSPN组患儿血清TGF-β含量明显高于GHSP组,差异有统计学差异(P < 0.05)。结合上述讨论认为TGF-β可作为HSP患儿肾脏损伤的重要指标。
TNF-α主要由单核-巨噬细胞产生,可促进血管内皮细胞产生白细胞黏附分子,增强中性粒细胞的吞噬和黏附功能,并分泌大量炎性介质沉积于小血管内壁,增加血管通透性,因此不难看出TNF-α在HSP发病中起到重要作用[13]。Ha[14]认为,HSP发病过程中TNF-α水平甚至与肾损害程度及预后有关,在严重HSPN中可作为监测疾病活动的指标。Del Vecchio等[15]研究显示,TNF-α水平与HSP的腎损害程度相关,TNF-α水平越高,其尿红细胞计数越高,肾损害程度也越高。在本研究中,GHSP患儿和HSPN患儿血清TNF-α含量均明显高于对照组,且HSPN组明显更高,差异均有统计学意义(P < 0.05)。分析原因可能是TNF-α诱导产生的炎性介质和免疫复合物沉积于肾脏血管导致其通透性增加,出现血尿、蛋白尿等症状。另有研究阐明,TNF-α水平升高可促进内皮细胞特异性抗原产生,与IgA共同作用引起血管性炎症[16]。故研究TNF-α的同时,对IgA的研究不容忽视。
IgA1是免疫复合物形成的重要物质,当机体受感染、遗传、免疫等因素的影响时,IgA1易发生糖基化,糖基化的IgA1无法在肝脏中代谢[17],导致血清中IgA1增高并与IgG结合形成免疫复合物IgA1-IgG-IC,该免疫复合物最终沉积于肾脏并造成损伤[18-20]。早有研究证明,大量的免疫复合物使系膜细胞活化、增殖并释放多种细胞及炎性因子,导致肾小球系膜增生,细胞外基质分泌增多,新月体形成及肾小球纤维化形成等病理改变[21]。Saulsbury[22]研究也证明,异常糖基化的IgA1是HSPN的重要致病因素。本次研究发现,GHSP和HSPN患儿血清IgA1水平均明显高于对照组,且HSPN患儿明显更高,差异有统计学意义(P < 0.05)。与既往研究结果相似,说明在由GHSP发展为HSPN的过程中IgA1起着重要的促进作用。
本研究相关性研分析显示,HSPN患儿血清IgA1含量与TGF-β和TNF-α含量均呈正相关(P < 0.05),即TGF-β、TNF-α含量越高,IgA1含量越高。原因可能是TGF-β和TNF-α通过正反馈效应刺激机体产生IgA1并使其发生异常糖基化,后者形成循环免疫复合物沉积于小血管壁,造成皮肤及肾脏病变。目前临床上HSP远期预后主要取决于患儿肾脏病变。肖李艳等[23]研究认为,HSP肾损害的相关危险因素包括年龄、尿微量蛋白、白细胞数、血小板以及血总IgE。本研究结果提示,可通过检测TGF-β、TNF-α和IgA1含量来评估和预测HSP患儿预后。TGF-β和TNF-α之间未发现明显的相关性,有待扩大样本量进一步研究。
综上所述,HSP患儿血清IL-21、TGF-β、TNF-α和IgA1含量均高于对照组,且TGF-β、TNF-α和IgA1含量在HSPN患儿中进一步增高,另外,IgA1含量与TGF-β和TNF-α含量均呈正相关,血清IgA1含量可作为判断HSP患儿预后的重要指标之一。
[参考文献]
[1] 吴天慧,李志辉,段翠蓉,等.3482例小儿过敏性紫癜流行病学分析[J].实用预防医学,2014,21(8):978-980.
[2] Wiercinski,Zoch-Zwierz W,Wasilewska A,et al. Lymphocyte subpopulations of pefipheral bloodin children with Henoch-Schonlein purpura and IgA nephropathy [J]. PolMerkur Lekarski,2001,10(58):244-246.
[3] 陈小红,许飏,黎昌强,等.过敏性紫癜发病机制研究进展[J].西南军医,2012,14(2):298-300.
[4] 唐雪梅.过敏性紫癜病因及免疫发病机制[J].实用儿科临床杂志,2012,27(21):1634-1636.
[5] Xie J,Liu Y,Wang L,et al. Expansion of Circulating T Follicular Helper Cells in Children with Acute Henoch-Schnlein Purpura [J]. J Immunol Res,2015,2015:742535. doi: 10.1155/2015/742535.
[6] Avery DT,Bryant VL,Ma CS,et al IL-21-induced isotype switching to IgG and IgA by human naive B cells is differentially regulated by IL-4 [J]. J Immunol,2008,181(3):1767-1779.
[7] Leonard WJ,Spolski R. Interleukin-21:a modulator of lymphoid proliferation,apoptosisand differentiation [J]. Nat Rev Immunol,2005,5(9): 688-698.
[8] 邢静,张东风.儿童过敏性紫癜体液免疫、补体及血小板的变化及其临床意义[J].中国卫生标准管理,2014,5(1):11-12.
[9] 王士杰,鹿玲.过敏性紫癜患儿血IL-21、TGF-β、TNF-α、IgA1和免疫球蛋白变化及意义[J].临床儿科杂志,2011, 29(2):159-161.
[10] 丁娟娟,何庆南,张建江,等.儿童紫癜性肾炎体液免疫状态分析[J].临床心身疾病杂志,2012,12(2):84-86.
[11] 赵梅清,赵洪国.过敏性紫癜病人血清TGF-β1和HGF水平的变化[J].齐鲁医学杂志,2011,26(6):513-514.
[12] 于晓晴,高进,傅亮.紫癜性肾炎患儿血浆肿瘤坏死因子-α、转化生长因子-β1水平变化及相关性研究[J].实用儿科临床杂志,2008,23(5):360–361.
[13] 孙兴珍,田向阳,朱从龙.血、尿肿瘤坏死因子-α在过敏性紫癜患儿中的表达[J].河北医药,2012,34(24):3708-3709.
[14] Ha TS. The role of tumor necrosis factor-alpha in Henoch-Schonlein purpura [J]. Pediatr Nephrol,2005,20(2):149-153.
[15] Del Vecchio GC,Penza R,Altomare M,et al. Cytokine pattern and endothelium damage markers in Henoch-Schonlein purpura [J]. Immuno- pharmacol Immunotoxicol,2012,30(3):623-629.
[16] Kilis-Pstrusinska K. Paediatric Henoch-Schonlein purpura-immunolo-ical and clinical aspects for a family doctor [J]. Int Rew Clin immunol Family Med,2012,18(1):41-45.
[17] Novak J,VuHL,Novak L,et aI. Interactions ofhumanm gial cellswith IgA and lgA-containing immune complexes [J]. Kidney Int,2002,62(2):465-475.
[18] 鄧玉秀.综合护理干预在小儿过敏性紫癜护理中的效果观察[J].中国医药科学,2015,5(13):104-106.
[19] 邹书敏,余健.IgA肾病及过敏性紫癜肾炎患儿血清半乳糖缺乏的IgA1测定的临床意义[J].华南国防医学杂志,2012,26(6):542-556.
[20] 宫廷,任献青.儿童和成人过敏性紫癜伴发传染性单核细胞增多症各1例并文献回顾[J].中国医药科学,2015, 5(22):214-216.
[21] Novak J,Vu HL,Novak L,et aI. Interactions of humanm gial cellswith IgA and lgA-containing immune complexes [J]. Kidney Int,2002,62(2):465-475.
[22] Saulsbury FT. Henoch-Sehonlein purpura [J]. Curt Opin Rheumatol,2010,22(5):598-602.
[23] 肖李艳,潘险峰,陈勇.过敏性紫癜复发及肾损害的相关危险因素分析[J].海南医学,2016(4):626-628.
(收稿日期:2016-12-10 本文编辑:程 铭)
