酱香白酒酿造过程中产多元醇功能酵母的筛选
2017-06-01白小燕邱树毅雷安亮陈美竹黄魏王晓丹
白小燕,邱树毅,雷安亮,陈美竹,黄魏,王晓丹*
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳550025;2.贵州珍酒酿酒有限责任公司,贵州遵义563003;3.贵州大学酿酒与食品工程学院,贵州贵阳550025;4.贵州大学生命科学学院,贵州贵阳550025)
酱香白酒酿造过程中产多元醇功能酵母的筛选
白小燕1,4,邱树毅1,3,雷安亮2,陈美竹1,3,黄魏1,3,王晓丹1,3*
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳550025;2.贵州珍酒酿酒有限责任公司,贵州遵义563003;3.贵州大学酿酒与食品工程学院,贵州贵阳550025;4.贵州大学生命科学学院,贵州贵阳550025)
为了解酱香型白酒酿造过程中产多元醇酵母的种类和功能,以酱香型白酒大曲和酒醅中分离的酵母为研究对象,采用薄层层析法和高效液相色谱-蒸发光散射检测器法(HPLC-ELSD)对具有产多元醇功能的酵母进行筛选和多元醇定性、定量分析。实验结果显示,从142株酵母菌中筛选出5株具有产多元醇功能的酵母菌娄德酵母(Lodderomyces elongisporus)FBKL2.0073、库得毕赤酵母(Pichia kudriavzevii)FBKL2.0008、Trichosporon coremiiformeFBKL2.0310、Trichosporon coremiiformeFBKL2.0307和Trichosporonoidessp.FBKL2.0315,其中前4株菌都能产D-阿拉伯糖醇,L.elongisporusFBKL2.0073菌株产多元醇的总量最多,为(9.87±0.85)g/L。
酵母;薄层层析;高效液相色谱-蒸发光散射检测器法;多元醇;D-阿拉伯糖醇

BAI Xiaoyan1,4,QIU Shuyi1,3,LEI Anliang2,CHEN Meizhu1,3,HUANG Wei1,3,WANG Xiaodan1,3*
(1.Guizhou Provincial Key Laboratory of Fermentation Engineering and Biological Pharmacy,Guizhou University,Guiyang 550025,China; 2.Guizhou Jane Wine Brewing Co.,Ltd.,Zunyi 563003,China;3.School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China;4.School of Life Sciences,Guizhou University,Guiyang 550025,China)
酱香型是中国白酒的四大基本香型之一,具有酱香突出、幽雅细腻、饱满味长、空杯留香持久等特点。酱香型白酒的发酵窖池按出酒的风格特征分上、中、下三层,窖池上层酒醅主要产酱香酒,中层酒醅主要产醇甜型酒,下层酒醅主要产窖底香型酒[1]。甜味是一种让人感觉比较愉悦的口感,尤其在酒精度较高的白酒中,微甜味能使酒体显得绵柔醇厚,而目前白酒缺少醇甜的风格特征,一些生产企业为了改善白酒口感,降低成本获取经济利益,向其中违规添加甜味剂(糖精钠、甜蜜素、甜味素等)[2],有研究发现,糖精钠、甜蜜素等一些人工甜味剂具有潜在致癌、致畸、损害肾功能的副作用,这给消费者带来巨大的安全隐患[3]。同时,强制性国家标准GB 2760—2011《食品安全国家标准食品添加剂使用标准》中明确规定白酒中不允许添加任何甜味剂[4]。为满足市场的这一需求,有必要对醇甜型酒进行研究。
酵母是酿酒微生物家族的重要成员之一,从功能上主要分为两大类:一类是产酒酵母[5-6];另一类是产香酵母[7]。但是从相关文献可以看到[8-9],酵母除了具有产酒和产香的作用外,还具有产多元醇类物质的作用。SPENCER J F等[10]研究发现,耐高渗酵母在高渗条件下可产生多元醇,代谢葡萄糖产生的多元醇主要有甘油、D-阿拉伯糖醇、赤醉糖醇、山梨醇、麦芽糖醇等,其中五碳多元醇以D-阿拉伯糖醇为主[11-12]。范光先等[13]也发现在高糖环境中,高渗酵母产生的多元醇主要为D-阿拉伯醇或赤藓糖醇,而在高盐条件下产生的甘油居多。
多元醇是酒醅内的酵母菌在生成酒精的同时发酵糖所产生的,由于糖不能进入白酒中,因此多元醇是形成白酒中甜味的主要来源,其在酒内可起缓冲作用,使白酒更加丰满醇厚,甜度随羟基数增多而增强[14]。由于多元醇沸点高,属于不挥发醇类,不易随蒸馏进入酒中,因而在白酒中含量极低,定量分析的难度较大[15],目前,对白酒中多元醇的检测方法主要有薄层层析法(thinlayerchromatography,TLC)、高效液相色谱-蒸发光散射检测(high performance liquid chromatography-evaporative light-scattering detector,HPLC-ELSD)[16]、液质联用法[17]、毛细管气相色谱法[18]、离子色谱积分脉冲安培法[19-20]等。本实验以课题组前期从酱香型白酒酿造过程大曲和酒醅中分离的所有酵母为研究对象,通过建立薄层层析法和高效液相色谱-蒸发光散射法对酵母菌株产多元醇种类及含量进行初步分析,研究酱香型白酒酿造过程中酵母产多元醇类物质的能力。
1 材料与方法
1.1 材料与试剂
菌株:本实验室从酱香型白酒酒醅及大曲中筛选并保藏的142株酵母菌。
纸层析显色剂[21]:饱和硝酸银丙酮溶液-氢氧化钠酒精溶液;纸层析展开剂:正丁醇∶冰乙酸∶水=5∶1∶2;多元醇标样:取相同体积的质量浓度为0.01mg/mL的赤鲜糖醇、木糖醇、山梨糖醇、麦芽糖醇、丙三醇、阿拉伯糖醇标准溶液混合。
酵母膏胨葡萄糖琼脂培养基(yeast extract peptone dextrose,YEPD):酵母膏1g,蛋白胨2g,葡萄糖2g,琼脂2g,蒸馏水100 mL,121℃灭菌20 min。
高糖培养基:葡萄糖40 g,酵母粉1 g,蛋白胨2 g,琼脂1.5 g,蒸馏水100 mL,115℃灭菌20 min。
种子培养基:葡萄糖2 g,酵母粉1 g,蛋白胨2 g,蒸馏水100 mL,121℃灭菌20 min。
发酵培养基:葡萄糖20 g,酵母粉1 g,蛋白胨2 g,蒸馏水100 mL,115℃灭菌20 min。
实验所用试剂均来自上海博威生物科技有限公司。
1.2 仪器与设备
F254层析微晶纤维素板:武汉药科新技术开发有限公司;404146手持式折光仪:成都泰华光学有限公司;Milli-Q Academic密理博超纯水仪:密理博(上海)贸易有限公司;Agilent1260高效液相色谱仪、AgilentG4260B蒸发光检测器、AgilentHi-plexCa柱(300 mm×7.7 mm):美国Agilent公司。
1.3 方法
1.3.1 耐高渗酵母的筛选
酵母活化:将本实验室筛选并保藏的酵母在YEPD平板培养基上划线,30℃培养,活化8 h。
高糖培养:将活化酵母接入高糖培养基中,30℃培养,筛选出能在高糖培养基中良好生长的酵母菌株进行下一步实验。
1.3.2 摇瓶初筛
挑选在的高糖培养基中生长良好的耐高糖酵母,将其分别接种于含有50 mL发酵培养基的250 mL三角瓶中,30℃、160 r/min摇瓶培养3 d。用薄层层析法分析产物组成,选取产多元醇的菌株进行下一步复筛。
1.3.3 摇瓶复筛
将初筛所得菌株,进行活化,然后接入到种子培养液中在30℃、160 r/min扩培24 h,制得种子培养液,将各酵母种子液按5%的接种比例接种至含有50 mL发酵培养基的三角瓶中,30℃、160 r/min摇瓶培养5 d,每组做3个平行。分别测定发酵液中残糖量、可溶性固形物含量,选取具有稳定性状、多元醇产量较高的菌株作为研究对象。
1.3.4 测定方法
可溶性固形物与残糖量测定:酵母发酵液5000r/min离心后取上清,用阿贝折光仪测定其中的可溶性固形物含量。
残糖量测定:参见国标GB/T 5009.7—2008《食品中还原糖的测定》中的直接滴定法测定[22]。
多元醇产物进行初步定性和粗定量:根据测定单一标样和混合标样的展开效果,来确定一种适用于分析酵母产多元醇的薄层层析法,优化并确认的层析条件。样品处理方法如下:取不同菌株的发酵液各1 mL,10 000 r/min离心10 min,用毛细吸管将上清点样于微晶纤维素板上,层析时间为4 h,层析结束后自然晾干,层析图谱的显色采用饱和硝酸银丙酮溶液-氢氧化钠酒精溶液[21]。
HPLC-ELSD法测量条件:AgilentHi-plexCa柱(300mm× 7.7 mm),柱温为70℃,进样量为4 μL,以纯水水为流动相,蒸发光散射检测器(ELSD),雾化温度为60℃,蒸发温度为60℃,流速0.5 mL/min,载气为氮气。
准确配制葡萄糖、阿拉伯糖醇、麦芽糖醇、赤藓糖醇、木糖醇及山梨醇质量浓度为0.8 mg/mL的标准储备液,用0.22μm微孔滤膜过滤。准确配制5种糖醇混合储备液,使用蒸馏水稀释成质量浓度为0.8mg/mL、1.0mg/mL、1.5mg/mL、2.0 mg/mL、3.0 mg/mL、4.0 mg/mL的混合标准工作液。
测定前,准确吸取5mL发酵液于试管,65℃水浴10min,转移到离心管中10 000 r/min离心10 min,上清液经C18固相萃取小柱净化,收集滤液5 mL,用0.22 μm滤膜过滤。
2 结果与分析
2.1 耐高渗酵母的筛选
通过在高糖培养基上酵母生长的结果显示,142株酵母有131株能生长。这可能与酱香型白酒生产过程有关,因为这些酵母是从大曲和酒醅分离培养来的,而大曲和酒醅本身就是高温、高糖、高渗的环境,所以在这种环境下筛选出来的酵母在高糖培养基中能够存活[23]。
2.2 摇瓶发酵初筛
将在高糖培养基上生长的酵母菌株进行摇瓶培养初筛,再借助薄层层析法对发酵液中的多元醇含量进行初步分析。结果见表1及图1。
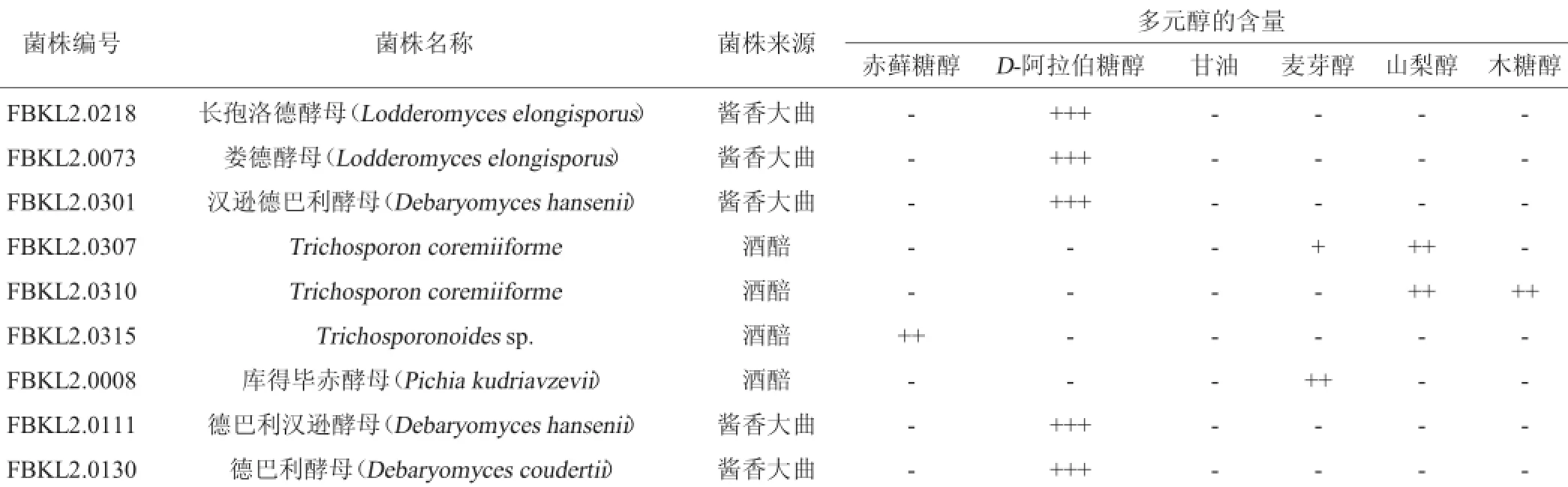
表1 产多元醇酵母的初筛结果Table 1 Preliminary screening results of polyhydric alcohol-producing yeasts

图1 发酵液中多元醇的薄层层析图Fig.1 TLC of polyhydric alcohols in fermentation broth
最终,选出了产D-阿拉伯醇量最多的菌株FBKL2.0218、FBKL2.0073、FBKL2.0301、FBKL2.0111、FBKL2.0130以及产山梨醇较多的菌株FBKL2.0307、产山梨醇和木糖醇的菌株FBKL2.0310、产赤藓糖醇的菌株FBKL2.0315、产麦芽糖醇的菌株FBKL2.0008酵母菌株共9株菌。由表1可知,许多酵母具有产多元醇的能力,其中以D-阿拉伯糖醇较为常见,有的发酵液还伴随少量的甘油生成[24]。从产多元醇酵母的来源上看,主要是来自于大曲,酒醅中较少,这可能与大曲和酒醅的环境差异有关,酱香型白酒是以小麦为原料的高温大曲,是白酒生产的糖化发酵剂,含糖量高且温度高,提供了高渗环境,在这种环境中筛选出来的酵母更能利用糖生成多元醇[25]。由图1可以看出,该实验条件下,各种糖醇能很好分开,分离效果及重现性良好,因而可以用于初步分析发酵液中的糖醇类物质,其中葡萄糖显色斑点,说明菌株FBKL2.0301和FBKL2.0307发酵液中残糖含量高;几种多元醇斑点中,D-阿拉伯醇显色斑点最大最黑,说明D-阿拉伯醇含量高。
2.3 摇瓶发酵复筛
将初筛中产多元醇含量较高的9株菌株分别接入液体发酵培养基进行摇瓶复筛。经多次重复实验,得复筛结果如表2。

表2 产多元醇酵母的复筛结果Table 2 Secondary screening results of polyhydric alcohol-producing yeasts
由表2可知,同其他酵母相比,相同条件下,菌株FBKL 2.0073、FBKL2.0008、FBKL2.0307、FBKL2.0310、FBKL2.0315的发酵液中残糖量更低,固形物含量与残糖量差值更大,且结合表1和图1可以看出,这些酵母发酵液对应的产物斑点更大,因而其多元醇产物的量可能更高。但还需要借助高效液相色谱方法来准确对酵母产多元醇的种类和产量做进一步分析。
2.4 高效液相色谱法对发酵液中多元醇产量测定
根据初筛和复筛结果,本实验筛选出5株葡萄糖残量低且多元醇产率相对较高的菌株FBKL2.0073、FBKL2.0008、FBKL2.0307、FBKL2.0310、FBKL2.0315作为发酵出发菌株,利用高效液相色谱法对发酵液中多元醇种类、含量进行分析。根据测得的峰面积与对应的糖醇浓度进行线性回归,可得到5种标准品的线性回归方程和相关系数R,结果见表3。
由表3可知,5种物质的相关系数R为0.996~0.999,在线性范围内各种糖醇的含量与峰面积有很好的线性关系,检出限在0.045~0.058 mg/mL范围内,经高效液相色谱法对发酵液中多元醇产量测定,得到色谱图(见图2)。

表35 种标准品的回归方程、线性范围及检出限Table 3 Regression equations,correlation coefficients and limit of detection of five standards
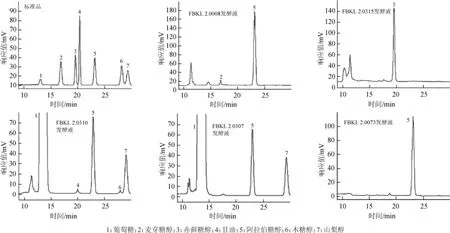
图2 标准品和部分发酵液样品的高效液相色谱图Fig.2 HPLC chromatograms of standard substance and part fermention broth samples
由图2可知,发酵液FBKL2.0008产麦芽糖醇和D-阿拉伯糖醇;发酵液FBKL2.0315产赤藓糖醇;发酵液FBKL2.0310产甘油、D-阿拉伯糖醇、木糖醇和山梨醇,且由于残糖量过高,葡萄糖已经超出检测线,出现平头峰;发酵液FBKL2.0073产D-阿拉伯糖醇;发酵液FBKL2.0307产D-阿拉伯糖醇和山梨醇,总之,酵母所产多元醇主要为D-阿拉伯糖醇。
利用高效液相色谱法对发酵液中多元醇含量进行测定,将峰面积带入相应回归方程可得到各多元醇的产量,结果见表4。
由表4可知,菌株FBKL2.0073产D-阿拉伯糖醇的含量相对最高,为(9.870±0.85)g/L。且其产多元醇的种类及总量最多,同时产三种糖醇。但总的来说,从酱香型白酒酿造过程中筛选出的酵母产多元醇的能力都是较低的[26-28]。这可能与菌株的来源有关,高产多元醇的酵母菌株多是从含糖量丰富的样品(蜂蜜、花粉)中筛选[9],本次实验菌株来源于大曲和酒醅,相比之下,可利用的糖类物质较少。
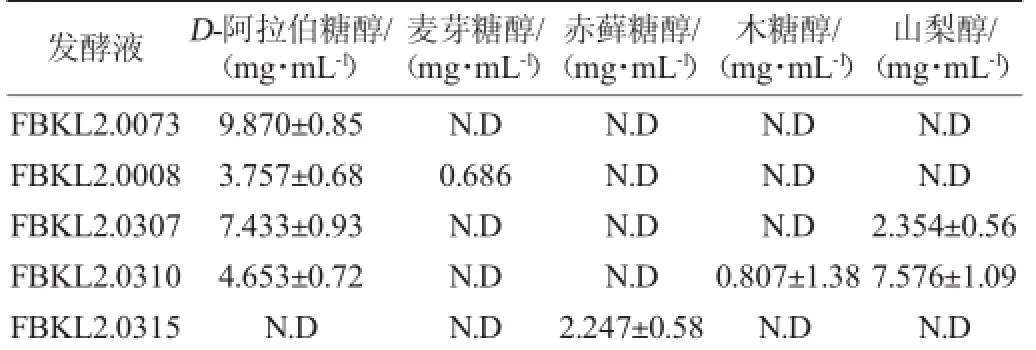
表4 不同酵母发酵液中多元醇含量Table 4 Polyhydric alcohol contents in different yeast fermentation broth
3 结论
本研究筛选出5株产多元醇酵母菌株娄德酵母(Lodderomyceselongisporus)FBKL2.0073、库得毕赤酵母(Pichia kudriavzevii)FBKL2.0008、TrichosporoncoremiiformeFBKL 2.0310、Trichosporon coremiiformeFBKL2.0307和Trichosporonoidessp.FBKL2.0315,其中Lodderomyces elongisporus FBKL2.0073菌株产多元醇的总量最多,为(9.870±0.85)g/L。从酱香型白酒酿造过程中大曲和酒醅里分离的大部分酵母均有产生多元醇类物质的能力,分别为D-阿拉伯糖醇、麦芽糖醇、赤藓糖醇、甘油、木糖醇、山梨醇,其中以产D-阿拉伯糖醇较为常见且产量也最高。
[1]崔利.形成酱香型酒风格质量的关键工艺是“四高两长,一大一多”[J].酿酒,2007,34(3):24-35.
[2]王景.白酒中违禁添加剂及特征成分的多种质谱检测技术研究[D].北京:北京化工大学,2015.
[3]牛之瑞,王秀君,于毅涛,等.液相色谱-质谱联用同时测定白酒中8种甜味剂[J].食品科学,2016,37(2):178-181.
[4]卫生部食品卫生监督检验所.GB 2760—2011食品安全国家标准食品添加剂使用标准[S].北京:中国标准出版社,2011.
[5]陈良强,吴群,徐岩.酱香型白酒低产杂醇油粟酒裂殖酵母特性的研究[J].工业微生物,2013,43(3):1-6.
[6]李豆南,邱树毅.酱香大曲微生物菌群结构及微生物功能研究概述[J].中国酿造,2017,36(1):5-11.
[7]李欣,王彦华,林静怡,等.高通量测序技术分析酱香型白酒酒醅的微生物多样性[J].福建师范大学学报:自然科学版,2017,33(1):51-59. [8]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2008:105-108.
[9]齐向辉,王旭,林静,等.耐高糖酵母的筛选鉴定及其产多元醇分析[J].食品与发酵工业,2014,40(10):16-21.
[10]SPENCER J F,SALLANS H R.Prouduction of polyhydric alcohols by osmophilic yeasts[J].Can J Microbiol,1956,2(2):72-79.
[11]贺娟,卢大军,江宁,等.细菌血红蛋白基因在产D-阿拉伯糖醇酵母菌种的克隆与表达[J].微生物学报,2001,41(3):315-319.
[12]ONISHI H,SUZUKI T.Crobial production of xylitol from glucose[J]. Appl Microbiol,1969,18(6):1031-1035.
[13]范光先,诸葛健,徐成勇.高浓度盐对耐高渗酵母产多元醇的影响[J].工业微生物,2001,31(1):1-3.
[14]TAT L,COMUZZO P,STOLFO I,et al.Optimization of wine headspace analysis by solid-phase microextraction capillary gas chromatography with mass spectrometric and flame ionization detection[J].Food Chem, 2005,93(2):361-369.
[15]陈美竹.酱香白酒大曲与酿造过程酵母动态变化研究[D].贵阳:贵州大学,2016.
[16]YUE J,NARINE S S.Separation and quantification of vegetable oil based polyols by high performance liquid chromatography with evaporative light scattering detection[J].J Am Oil Chem Soc,2007,84(9): 803-807.
[17]WAMELINK M M C,SMITH D E C,JAKOBS C,et al.Analysis of polyols in urine by liquid chromatography-tandem mass spectrometry: Ausefultoolforrecognitionofinbornerrorsaffectingpolyolmetabolism [J].J Inherit Metab Dis,2005,28(6):951-963.
[18]SHETTY H U,HOLLOWAY H W,RAPOPORT S I.Capillary gas chromatography combined with ion trap detection for quantitative profiling of polyols in cerebrospinal fluid and plasma[J].Anal Biochem, 1995,224(1):279-285.
[19]宋林林,李净,谭光迅,等.枝江白酒含氮化合物和多元醇的定量分析[J].酿酒,2015,42(3):42-45.
[20]GE S L,WANG H,WANG Z F,et al.Sensitive measurement of polyols in urine by capillary zone electrophoresis coupled with amperometric detection using on-column complexation with borate[J].J Chromatogr B,2013,915-916:39-45.
[21]李泽.产D-阿拉伯醇酵母菌株的筛选及发酵条件研究[D].济南:山东轻工业学院,2012.
[22]卫生部食品卫生监督检验所.GB/T 5009.7—2008食品中还原糖的测定[S].北京:中国标准出版社,2008.
[23]张丽丽.高产D-阿拉伯糖醇酵母菌株的筛选及其发酵条件的研究[D].无锡:江南大学,2009.
[24]张志刚,李长文.高温大曲生产技术进展及发展趋势[J].中国酿造,2013,32(6):9-11.
[25]朱群英,江勇,甘钰.HPLC-ELSD法同时测定食品中5种糖[J].食品科学,2008,29(12):503-506.
[26]王凤伟.耐高渗赤藓糖醇生产菌的筛选与发酵条件优化[D].无锡:江南大学,2012.
[27]杨其义.木糖醇生产菌株的筛选及工艺优化[D].济南:齐鲁工业大学,2013.
[28]PORTER L,HRSTICH L,CHAN B.The conversion of procyanidins and prodelphinidins to cyaniding and delphinidin[J].Phytochemistry, 1985,25(1):223-230.
TS261.1
0254-5071(2017)05-0058-05
10.11882/j.issn.0254-5071.2017.05.012
2017-01-07
贵州省科技支撑计划项目(黔科合支撑[2017]2319);贵州省工业攻关项目(黔科合GZ字[2014]3012);贵州省重大专项项目(黔科合重大专项字[2015]6012)
白小燕(1990-),硕士研究生,研究方向为应用微生物。
*通讯作者:王晓丹(1980-),高级实验师,博士,研究方向为应用生物技术。
