水仙鳞茎膨大期各器官可溶性糖的含量及分布
2017-05-30蒲小龙郭志雄姚婷婷秦军徐世荣潘东明
蒲小龙 郭志雄 姚婷婷 秦军 徐世荣 潘东明
摘 要 以第3年种植的水仙品种‘金盏银台为材料,使用乙醇沉淀法制备可溶性糖测定溶液,利用蒽酮比色法测定其鳞茎膨大期不同组织和不同部位的可溶性糖含量。研究结果表明:水仙不同组织器官可溶性糖水平为:根<叶中<叶尖<叶基<主芽<鳞片。水仙叶片形成的碳水化合物能够逆浓度梯度向下运输,以供给鳞片和内球进行营养积累。不同层叶片及鳞片的可溶性糖测定发现,最外层叶片及鳞片的可溶性糖水平较其它层要低,总体上呈现出由外及里的递增趋势,说明水仙不同层叶片及鳞片为整个鳞茎的营养供给是通过由外及里,由上到下一层层供给生长需求的。
关键词 水仙;鳞茎膨大期;可溶性糖;蒽酮比色法
中图分类号 S682 文献标识码 A
Abstract Soluble sugars play an important role in plant structure and metabolism at the cellular and whole organism levels. They are involved in the responses to environmental stresses, metabolite signalling pathways, carbohydrates translocation and accumulation. Determination and distribution of soluble sugars is basic for the study of carbon metabolism in plants. In this work the levels of soluble sugars in different organs of Narcissus tazetta L. var. chinensis were analyzed in bulb swelling stage. The relationships between different organs were: roots < leaf middle < leaf apex < leaf base < main bud < scales. Carbohydrate translocation from leaves to scales was against the concentration gradient, in order to accumulate nutrients for scales and inside bulb. Determination of soluble sugars indifferent scales on different layers and inside bulb showed the level of soluble sugars in outermost layer leaf and scale was lower than other layers, leaf and scale soluble sugars were increasing trend from outside to inside, showed that Narcissus tazetta L. var. chinensis scales as vegetative organs provide nutrients for the whole bulb, is from outer layer to inner, from top to bottom for growth and development.
Key words Narcissus tazetta L. var. chinensis; bulb swelling stage; soluble sugar; anthrone colorimetry
doi 10.3969/j.issn.1000-2561.2017.03.002
中国水仙(Narcissus tazetta L. var. chinensis M. Roem.)俗称水仙,是石蒜科水仙属多年生草本植物,为三倍体无法结实,只能进行无性繁殖[1]。在栽培上主要通过母球分生的侧鳞茎进行扩增繁殖,通常侧鳞茎需要经过3 a的种植,积累足够的营养才能正常开花。3年生鳞茎为商品球,开花率可达100%,一、二年生鳞茎根据其营养状况可部分开花。水仙鳞茎不仅是其繁殖后代的重要器官,还是其营养储存器官,营养积累的多少直接关系其商品率和开花情况。
植物可溶性糖主要包括蔗糖、葡萄糖和果糖[2-3],在植物渗透调节中起关键作用[2-4],而且对环境胁迫高度敏感,具有调节生长和胁迫相关基因两重功能[3-5]。其不仅是植物主要的光合作用产物,也是主要的糖代谢和运转形式[2-6]。可溶性糖是淀粉合成的底物,其含量的高低与淀粉积累密切相关[7-9],也直接关系到鳞茎的营养状况。蔡春侠[10]对水仙鳞茎进行冷藏处理,通过测定鳞茎的中部鳞片(第3~5层)和鳞茎盘的可溶性总糖发现,各低温处理下,水仙鳞茎可溶性糖含量变化趋势与室温对照组相似:在贮藏初期,可溶性糖含量急剧增加并达到最高值,随后大幅下降,贮藏243 d降到最低点,可溶性糖在鳞茎盘和中层鳞片的变化趋势相似。谢炯等[11]对普陀水仙进行紫外辐射处理后,测定水仙葉和茎的可溶性总糖发现,随着辐射胁迫进程的深入,普陀水仙叶和茎中可溶性糖含量逐渐增多,说明随着辐射时间延长,普陀水仙叶和茎的渗透调节能力逐渐增加,而可溶性糖含量增加是其抗性增强的内在原因。丁安琪[12]对不同温度条件下水仙的可溶性糖进行了测定,分别取水仙主球鳞片和芽进行测试发现,水仙主芽的可溶性糖趋势为“M”字型逐渐上升后略有下降;而鳞片中的可溶性总糖含量随时间的推移逐渐降低,处理后期可溶性糖含量维持稳定状态。
以前对水仙可溶性糖的研究多数以环境因子处理后观察其变化,从而探究可溶性糖在环境因子诱导下的变化机制。另外,前人对水仙不同组织器官的划分与界定比较模糊,且多数集中于鳞茎,叶片和鳞片较多采用混合取样。而水仙不同层的叶片和鳞片相对独立,鳞片与鳞片之间的界限明显,有明显的膜结构隔离,是否能够进行物质的运输和交换有待进一步研究。就目前而言,对于自然环境中生长的水仙其生命周期里糖的代谢、运输、利用及积累机制的认识尚不清楚,尤其是其鳞茎膨大期,大量的可溶性糖转变为淀粉贮藏于鳞片中,鳞茎迅速膨大。水仙为营养繁殖,大量积累的能源物质为花芽分化和下一轮的鳞茎萌发和出苗奠定了营养基础。因此,了解水仙鳞茎膨大期可溶性糖的含量及分布有助于探究其能源物质的代谢、运转及利用。
本试验对水仙不同组织器官和不同部位的可溶性糖进行测定,分析水仙在鳞茎膨大期可溶性糖的含量变化及分布情况,为水仙糖代谢和糖信号转导研究奠定基础,同时对研究水仙营养积累、糖分运输以及水仙鳞茎休眠与花芽形成也具有一定的参考价值。
1 材料与方法
1.1 材料
试验材料采集自福建省漳州市蔡坂村,为第3年种植的水仙‘金盏银台品种。
1.2 方法
1.2.1 取样 漳州地区第3年种植的水仙绝大多数生长有5片叶,少有4片和6片叶,每片叶对应一层鳞片。因此,本试验选取第3年种植的生长势一致并生长有5片叶的水仙为试验材料,于鳞茎膨大期(3~5月)采集不同器官和不同部位的材料进行试验。样品采集的时间间隔分为两段:第1段每隔10 d采集1次,时间为2016年3月4日至2016年5月13日,共70 d;第2段每隔5 d采集1次,時间为2016年5月13日至2016年6月2日,共20 d。在鳞茎膨大期水仙生长状态比较平稳,因此,鳞茎膨大期开始后每隔10 d采集样品1次。随着生长的进行,鳞茎膨大期的后期开始叶片的衰老,而该阶段的水仙生长状态变化迅速,因此采样间隔为每隔5 d采集1次,直至叶片完全衰老枯黄。按叶片的生长发育先后将其编号为1~5层叶片,最外层叶片即最先发育的叶片编号为1,以此类推直到第5层叶;每片叶对应1层鳞片,鳞片编号与其对应的叶片编号相同,由外及里为1~5层鳞片。采集每层叶片的叶尖、叶中、叶基以及对应的鳞片,另外采集主芽及根。所有样品均称取0.5 g,并设立4个生物学重复。所有材料现场采集,使用手术刀片将样品剥离切割后称重,分别装入锡箔纸袋中,放置于液氮中速冻,最后包埋于干冰中带回实验室,保存于-80 ℃冰箱备用。
1.2.2 主鳞茎重量及纵横径比例测定 使用电子天平测量每一时期水仙主鳞茎重量(除去叶片和根,以及已与主鳞茎分离的侧鳞茎),使用游标卡尺测量主鳞茎横径和纵径,每期测量鳞茎30个。
1.2.3 可溶性糖的提取及测定 本试验对水仙可溶性总糖的提取方法进行了对比和优化,采用以下3种方法:
水提取法:将0.50 g样品放置于玻璃研钵中,加入少量石英砂,并加入2 mL蒸馏水研磨至均质。将匀浆转移至50 mL离心管中,并使用8 mL蒸馏水分两次清洗研钵,清洗液转移至同一离心管中。100 ℃水浴30 min,其间不时振荡混匀。冷却至室温后,8 000 r/min离心5 min,倾出上清液于25 mL容量瓶中。离心管中加入10 mL蒸馏水悬浮沉淀,100 ℃水浴20 min,其间不时振荡混匀,冷却后离心倾出上清液于25 mL容量瓶中。加入5 mL蒸馏水悬浮沉淀,涡旋振荡后,8 000 r/min离心5 min,合并上清液,并使用蒸馏水定容至25 mL。
乙醇提取法:此方法使用80%的乙醇作为提取溶剂,水浴温度80 ℃,操作步骤同水提取法。定容后,取2 mL提取液于蒸发皿中,65~75 ℃水浴蒸干,并使用2 mL蒸馏水分两次清洗蒸发皿,将清洗液转移至2 mL离心管备用。
乙醇沉淀法:样品先进行水提取,定容至25 mL。吸取蒸馏水提取液2 mL于10 mL离心管中,并加入无水乙醇6 mL,涡旋震荡后室温放置30 min。12 000 ×g离心10 min,倾出上清液于蒸发皿中,水浴蒸干,并使用2 mL蒸馏水分2次清洗蒸发皿,将清洗液转移至2 mL离心管备用。
可溶性总糖测定方法参照蒽酮比色法[13-15],配制蒽酮乙酸乙酯试剂并制作蔗糖标准曲线。吸取 0.1 mL样品提取液于20 mL玻璃试管内,加入1.9 mL蒸馏水和0.5 mL蒽酮试剂,缓慢加入5 mL浓硫酸,迅速混匀后置于80 ℃水浴中10 min,冷却至室温,于紫外分光光度计630 nm波长下测定其吸光值。
1.2.4 可溶性糖的提取方法筛选 以水仙鳞片为材料,分别使用3种方法提取可溶性糖,并使用蒽酮比色法测定其含量测定数据均为鲜重(FW)。为了更好的比对各方法的优劣,先将水仙鳞片用液氮研磨至粗颗粒,以达到起始材料一致的目的。迅速称取0.50 g粗颗粒于玻璃研钵中,共称取6份,分为2组,每组3个重复。第1组用于水提取法和乙醇沉淀法,第2组用于80%乙醇提取法。
1.2.5 各组织器官的可溶性糖测定 为了了解中国水仙鳞茎膨大期各组织器官中可溶性糖的变化,采用筛选出最优的可溶性总糖提取方法测定水仙不同组织部位的可溶性总糖含量。另外,为了探究内球鳞片与主芽可溶性糖水平差异,试验测定了两个不同时期内球第1层鳞片和主芽的可溶性糖含量,每个时期包含4个生物学重复,对内球鳞片和对应的主芽可溶性糖含量做了配对样本t检验。
2 结果与分析
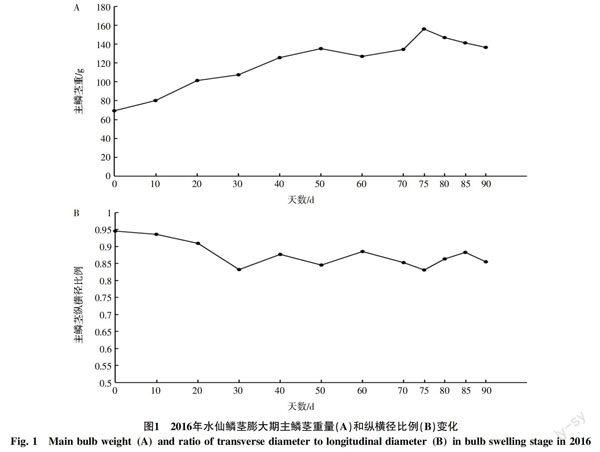
2.1 鳞茎膨大期主鳞茎重量和纵横径比变化
从3月开始,水仙主鳞茎重量不断增大,5月18日达到最大值156 g,后缓慢降低。可以看出,水仙鳞茎在膨大期球重不断增大,直至叶片迅速衰老期达到最大值,说明鳞茎的膨大受叶片生长状态的影响较大(图1-A)。水仙主鳞茎纵横径比例小于1,从3月开始纵横径比例逐渐降低,4月初纵横径比例基本稳定于0.85左右。从纵横径比例来看,水仙鳞茎为扁球状,鳞茎膨大期开始时,横径增长要比纵径增长快,说明在其鳞茎的近赤道面区域营养积累较多;随后纵横经比例趋于稳定,但主鳞茎的重量持续上升,说明鳞茎在纵向和横向的生长速率达到一致(图1-B)。
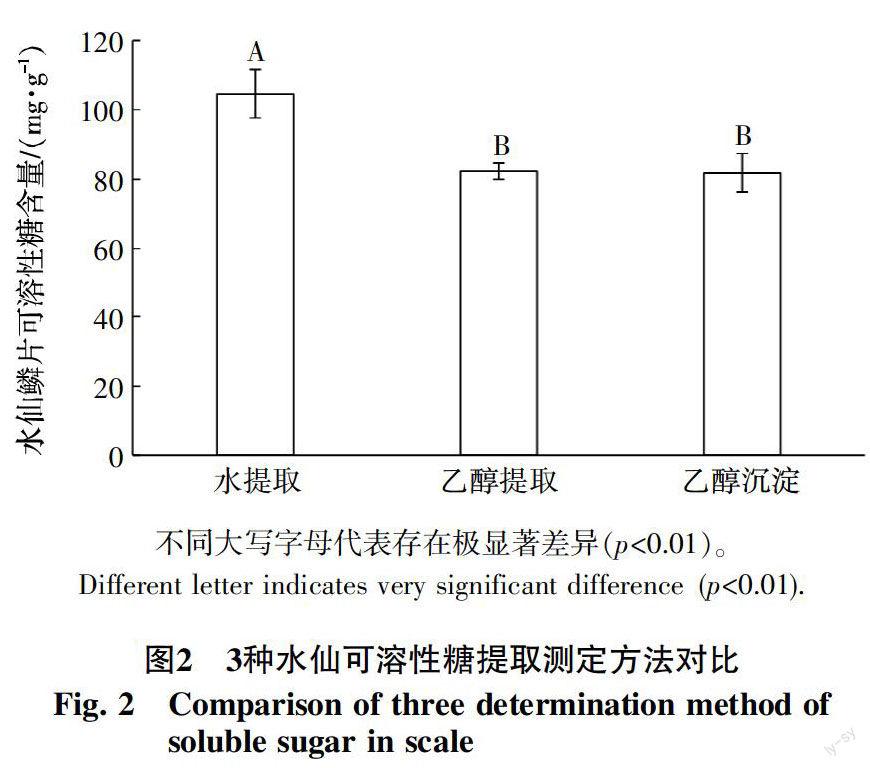
2.2 可溶性糖提取方法对比
对3种可溶性总糖提取方法进行对比试验,结果如图2。
单因素方差分析结果显示(图2),乙醇提取法和乙醇沉淀法无显著差异,而这2种方法与水提取法有极显著差异(p=0.003<0.01)。说明乙醇提取法和乙醇沉淀法对水仙鳞片可溶性糖含量的测定是等效的。但考虑到成本和水浴蒸发问题,本试验选择乙醇沉淀法。
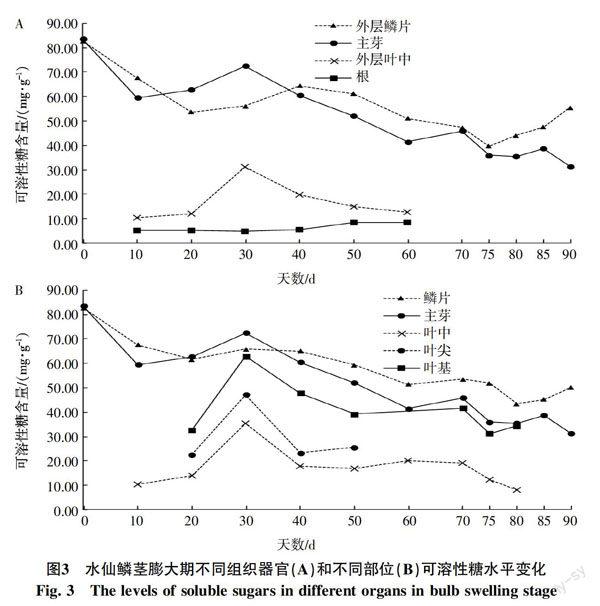
2.3 不同器官中可溶性糖的变化
对水仙不同组织部位可溶性总糖的测定结果显示,在鳞茎膨大期,最外层鳞片和主芽的可溶性糖水平比较接近且总体呈下降趋势。在整个过程出现2次低点,这可能是田间灌水和降雨导致组织含水量升高引起的。进入鳞茎膨大期40 d后,鳞片的可溶性糖含量开始高于主芽;75 d后鳞片的可溶性糖开始缓慢升高,而主芽的可溶性糖保持下降。30 d时,叶中的可溶性糖出现1次高峰,这可能是因为田间灌水干涸造成水分胁迫引起。60 d后,叶片从外到里,自上到下的顺序开始枯黄,部分数据无法采集。根的可溶性糖含量较低,在膨大期变化并不明显,60 d后开始消失(图3-A)。
最外层叶片和鳞片的生长和衰老比其他层要早,若仅仅以最外层的可溶性糖来考察水仙不通器官的可溶性糖水平是不够准确的。因此,为了进一步了解水仙不同部位可溶性糖含量的变化和分布,试验测定了5层叶片的叶尖、叶中、叶基、鳞片以及主芽的可溶性糖含量,每组数据4个生物学重复。结果显示,水仙各部位的可溶性糖含量从小到大为:根<叶中<叶尖<叶基<主芽<鳞片。进入鳞茎膨大期50 d后叶尖干枯,无法继续采集数据,80 d后所有叶片干枯,叶中和叶基数据无法采集。叶尖的可溶性糖含量较叶中高,可能是由于叶尖的细胞紧致,细胞间空隙小及细胞含水量低导致的。所有鳞片可溶性糖在不同时期的变化趋势与外层鳞片可溶性糖的变化趋势基本一致,说明各层鳞片在可溶性总糖含量的变化趋势上是一致的。40 d后,鱗片的可溶性糖含量始终大于主芽,并且在75~80 d左右出现缓慢上升,上升的时间与叶片完全干枯的时间重合,说明鳞片在鳞茎膨大期结束时可溶性糖含量的上升可能与鳞片自身淀粉的水解有关(图3-B)。
对2个不同时期水仙内球第1层鳞片和主芽的可溶性糖含量测定结果显示:配对样本相关性分析p=0.004<0.05,说明内球鳞片与主芽的可溶性糖存在一定的线性关系;配对样本t检验p=0.362>0.05,可以认为,内球鳞片与主芽的可溶性糖含量无显著差异(图5)。基于以上检验结果,可以认为,水仙内球可溶性糖含量是均匀分布的。因此,试验没有继续采集内球鳞片进行可溶性糖含量的测定。图4为水仙纵剖面图,直观地显示了主芽和内球鳞片的区别,主芽和内球鳞片共同构成了内球。
2.4 不同层叶片与鳞片可溶性糖变化
从2016年3月24日开始,对每一时期的5层叶片和鳞片的可溶性糖进行测定,如图6-A~J。图6-E由于叶尖枯黄,调整采样方案时未采集叶尖和叶基,因此未显示叶基可溶性糖含量。从图6可以看出,5层叶片及鳞片可溶性糖含量整体上显示出新叶高于老叶的趋势。同一部位不同层的可溶性糖含量总体差异不大,有个别类型材料显示出显著差异,而各个时期的变化差异趋势不相一致,这可能是不同时期新叶和老叶衰老程度不同造成的。
1~5层叶的叶尖可溶性糖含量总体为递增趋势,说明新叶叶尖比老叶叶尖的可溶性糖含量高(图6-A~D),随着叶片的衰老这种递增趋势更加明显。叶中的可溶性糖基本一致,而由于叶片的衰老,第1层叶中的可溶性糖通常会低于其他层(图6-A~H)。1~5层叶基可溶性糖含量的变化相对稳定,多个时期都显示出无显著差异,说明叶基处的可溶性糖水平相对一致(图6-A~D)。1~5层鳞片的可溶性糖含量随时期的变化不同,鳞茎膨大期开始时新叶鳞片的可溶性糖含量较老叶鳞片高(图6-A~B),随后趋于一致(图6-C~J)。有意思的是,在试验过程中我们发现,有些部位的可溶性糖显示出1、3、5层和2、4层跳跃式的变化趋势,而非1~5层的顺序递增或递减趋势(图6-C叶基、图6-E、图6-H鳞片和图6-I)。这说明水仙1~5层的可溶性糖分布可能有一定的方向性。
3 讨论
3.1 水仙可溶性糖提取方法的选择
样品的制备是准确定量的关键,而水仙鳞片及叶片含有大量的多糖[16],使用水提取法制备的样品受到可溶性多糖的影响,在蒽酮比色过程中干扰结果,导致可溶性糖测定结果偏大。因此,水提取法并不适合水仙可溶性糖的测定。使用80%乙醇可以有效地避免可溶性多糖的影响,但此方法制备一个样品需要25 mL的80%乙醇,若大量制备样品成本比较高昂。另外,此方法在高温水浴时,由于乙醇的挥发导致整个体系状态改变,对于每一样品的影响并不可控。因此,本文利用乙醇沉淀法做比对试验,这一方法既可以避免高温水浴时乙醇挥发对体系造成的影响,又可以降低成本。而且通过2次蒸馏水提取和1次清洗,保证尽可能提取完全,再用无水乙醇沉淀去除多糖干扰,进一步保证定量的准确性。虽然乙醇提取和乙醇沉淀2种方法测得的可溶性糖结果无显著差异,但考虑到提取过程更加稳定,成本也更加低廉,本文选择乙醇沉淀法制备可溶性糖测定液。本试验也为含有大量多糖的植物组织可溶性总糖的准确测定提供了一种简单,稳定的提取方法,排除多糖在显色反应中的干扰,保证可溶性总糖的准确测定。
3.2 水仙不同组织器官中可溶性糖的变化
可溶性糖是植物直接可利用的碳水化合物的存在形式,其含量的高低体现了植物体内可利用形态的物质和能量的供给状况[17]。骆世洪等[18]对沙生异翅独尾草不同器官中可溶性糖含量进行了研究,发现在盛花期之前根中可溶性糖和还原糖都高于叶,而在盛花期之后则叶的要高;花葶中可溶性糖和还原糖含量高于花。从苗期到花期,叶中的可溶性糖和还原糖含量不断增加到盛花期达到最高,而根中的可溶性糖和还原糖从苗期到营养生长期有所下降而后增加到盛花期达到最高。许森等[19]对甘薯的研究结果表明,可溶性糖由叶片转运至薯块用于淀粉的合成,薯块生长期间的淀粉质量分数与可溶性糖质量分数成负相关。已有的研究取样多数以混合取样,且对各组织器官的划分不够精细和明确,本文对水仙的叶尖、叶中、叶基、鳞片、主芽以及根分别进行了可溶性糖测定,发现水仙各组织器官可溶性糖水平为:根<叶中<叶尖<叶基<主芽<鳞片。中国水仙花后1个月左右进入鳞茎膨大期,有明显的鳞茎膨大现象,在此过程中大量的碳水化合物转变为淀粉储存于鳞片和内球中[12,20-21]。鳞片和内球是水仙营养物质储存最主要的器官,其可溶性糖水平在整个鳞茎膨大期都高于其他器官,总体趋势上为逐渐递减,这可能是叶片光合能力的下降和糖分转变为淀粉两方面的原因导致。叶片是光合作用的主要器官,主要合成碳水化合物供给生命活动需要,而在整个鳞茎膨大期其可溶性糖水平较鳞片和主芽低,说明水仙叶片形成的碳水化合物主要向下进行运输,以供给鳞片和内球进行营养积累;而且这种碳水化合物的向下运输是逆浓度梯度进行的,这种逆浓度梯度运输的能力说明其营养的积累是主动的而非被动的。
3.3 水仙不同层叶片及鳞片中可溶性糖的变化
多数研究表明,植物叶片合成的光合产物以可溶性糖的形式从“源”转运至“库”中,一部分为植物所利用,另一部分用来合成淀粉等产物。孙红梅等[22]利用比色法和色谱法对百合鳞茎发育过程中的可溶性糖进行了测定,结果显示,外部鳞片的糖消耗更多,比中部鳞片糖消耗的启动更早。毛洪玉等[23]对5个郁金香品种冷藏处理后的可溶性糖进行分析认为,可溶性糖在郁金香解除休眠的过程是由外向内,通过鳞茎盘调节来实现转运的。尽管已有的报道对球茎类花卉的不同鳞片进行了可溶性糖的研究,但对鳞片的划分不够明确,未明确指出各组织的具体位置。而水仙和郁金香等球茎类花卉的鳞茎通常是由一层层的鳞片组成,鳞片与鳞片之间处于相对隔离状态,能够轻松剥离,其营养的运转必须通过着生鳞片的鳞茎盘进行。这说明其营养的运输和利用是非横向进行的。自然生长的水仙,其鳞片由外及里、由上到下逐渐干缩,最后成膜状而腐烂消化,储藏休眠期的鳞茎的鳞片以同样的方式干缩成膜状后脱离,说明其营养运转是由外及里,一层接着一层进行。本文通过对鳞茎膨大期不同层鳞片的可溶性糖水平的测定发现,最外层叶片及鳞片的可溶性糖水平较其它层要低,部分组织呈现出由外及里的递增趋势,这说明水仙不同层叶片及鳞片作为库器官,供给养分是通过由外向里一层层进行的。
综上所述,可溶性糖的分布在一定程度上揭示了水仙营养运转和积累的模式:可溶性糖的运输符合由上到下、由外及里且逆浓度梯度的模式。叶片光合产物逆浓度梯度向下运输至鳞片进行储存与利用,而鳞片由外及里地将碳水化合物运输至生长点,供給其生长需求。
参考文献
[1] 王 瑞, 陈林姣, 赵玉辉, 等. 中国水仙的核型分析和小孢子发生中的细胞学研究[J]. 细胞生物学杂志, 2007, 29(1): 140-146.
[2] Prado F E, Boero C, Gallardo M, et al. Effect of NaCl on germination, growth, and soluble sugar content in Chenopodium quinoa Willd. seeds[J]. Botanical Bulletin-Academia Sinica Taipei, 2000, 41(1): 27-34.
[3] Rosa M, Prado C, Podazza G, et al. Soluble sugars-Metabolism, sensing and abiotic stress: A complex network in the life of plants[J]. Plant Signaling & Behavior, 2009, 4(5): 388-393.
[4] Boriboonkaset T, Theerawitaya C, Pichakum A, et al. Expression levels of some starch metabolism related genes in flag leaf of two contrasting rice genotypes exposed to salt stress[J]. Australian Journal of Crop Science, 2012, 6(11): 1 579-1 586.
[5] Gill P K, Sharma A D, Singh P, et al. Changes in germination, growth and soluble sugar contents of Sorghum bicolor (L.) Moench seeds under various abiotic stresses[J]. Plant growth regulation, 2003, 40(2): 157-162.
[6] Liu B, Li Y, Liu X, et al. Lower total soluble sugars in vegetative parts of soybean plants are responsible for reduced pod number under shading conditions[J]. Australian Journal of Crop Science, 2011, 5(13): 1 852-1 857.
[7] 王书丽, 郭天财, 王晨阳, 等. 两种筋力型小麦叶、粒可溶性糖含量及与籽粒淀粉积累的关系[J]. 河南农业科学, 2005(4): 12-15.
[8] Luo X, Huang Q. Relationships between leaf and stem soluble sugar content and tuberous root starch accumulation in cassava[J]. Journal of Agricultural Science, 2011, 3(2): 64-72.
[9] 袁圣勇, 罗兴录, 曾文丹, 等. 高低淀粉木薯品种可溶性糖转运、 分配与块根淀粉积累的关系研究[J]. 中国农学通报, 2013, 29(33): 153-157.
[10] 蔡春侠. 温度对水仙花球贮藏期间生理生化变化影响研究[D]. 福州: 福建农林大学, 2009.
[11] 谢 炯, 王再明, 唐晶腾, 等. 紫外辐射对普陀水仙生理生化指标的影响[J]. 中国农学通报, 2015(9): 194-199.
[12] 丁安琪. 温度对中国水仙休眠进程相关生理和基因表达的影响[D]. 福州: 福建农林大学, 2016.
[13] 李合生. 蒽酮比色法测定可溶性糖[M]. 植物生理生化实验原理和技术, 北京: 高等教育出版社, 2000: 195-197.
[14] 王学奎. 蒽酮比色法测定可溶性糖[M]. 植物生理生化实驗原理和技术(第二版), 北京: 高等教育出版社, 2006: 202-204.
[15] 李晓旭, 李家政. 优化蒽酮比色法测定甜玉米中可溶性糖的含量[J]. 保鲜与加工, 2013, 13(4): 24-27.
[16] 牛 炜. 水仙多糖及生物碱的提取、 纯化与检测[D]. 福州: 福建农林大学, 2013.
[17] 景艳莉. 百合鳞茎膨大发育生理与外源水杨酸影响初探[D]. 哈尔滨: 东北林业大学, 2007.
[18] 骆世洪, 马 淼, 马廷显. 沙生异翅独尾草不同器官中可溶性糖含量的消长规律[J]. 石河子大学学报(自科版), 2007, 25(1): 5-8.
[19] 许 森, 王永梅, 赵亚特, 等. 甘薯薯块生长过程中可溶性糖与淀粉质量分数的变化及其相关性分析[J]. 西南大学学报自然科学版, 2011, 33(10): 31-36.
[20] Feng Y, Zhu L, Pan T, et al. Characterization of summer dormancy in Narcissus tazetta var. chinensis and the role of NtFTs in summer dormancy and flower differentiation[J]. Scientia Horticulturae, 2015, 183: 109-117.
[21] 冯 莹. 中国水仙(Narcissus tazetta var. chinensis)芽休眠的分子机制研究[D]. 福州: 福建农林大学, 2014.
[22] 孙红梅, 汪可心, 王春夏, 等. 百合鳞茎发育过程中可溶性糖含量的变化[J]. 河北农业大学学报, 2008, 31(5): 61-65.
[23] 毛洪玉, 宁国龙, 刘 迪. 冷藏对郁金香鳞茎可溶性糖和蛋白质的影响[J]. 西北林学院学报, 2012, 27(1): 88-93.
