HCV RNA阳性标本PCR-荧光探针法病毒亚型未检出原因分析*
2017-05-25张立丽侯玉丽赵艳明黄雁翔于艳华娄金丽赵艳首都医科大学附属北京佑安医院临检中心北京100069
张立丽,侯玉丽,赵艳明,黄雁翔,于艳华,娄金丽,赵艳(首都医科大学附属北京佑安医院临检中心,北京 100069)
·临床检验技术研究·
HCV RNA阳性标本PCR-荧光探针法病毒亚型未检出原因分析*
张立丽,侯玉丽,赵艳明,黄雁翔,于艳华,娄金丽,赵艳
(首都医科大学附属北京佑安医院临检中心,北京 100069)
目的 探讨血清HCV RNA阳性,但PCR-荧光探针法病毒亚型检测未检出的原因。方法 收集2015年7月至2016年3月北京佑安医院临检中心分子室病毒载量>1 000 IU/mL但未测出病毒亚型的标本55例,采用基因测序方法对病毒扩增产物进行分型分析。结果 55例HCV病毒载量>1 000 IU/mL,但HCV病毒亚型未检出的标本中,其中3例为病毒载量接近病毒亚型检测下限,经测序分析为1b型2例,2a型1例;5例为检测试剂盒未覆盖亚型并且其探针位置无突变,HCV 1a型4例,6n型1例,占9.1%(5/55);47例因探针序列位置基因突变导致病毒亚型未检出,占85.5%(47/55),经测序发现其中1a型6例(6/47,12.8%),1b型32例(32/47,68.1%),2a型3例(3/47,6.4%),2b型1例(1/47,2.1%),3b型 1例(1/47,2.1%),6a型2例(2/47,4.3%),1b、6q、6c混合型1例(1/47,2.1%),6n型1例(1/47,2.1%)。探针序列位置基因突变组中以HCV病毒5′非翻译区(5′ UTR) 204 C/T突变为主(31/47, 66.0 %),其次为5′UTR 168 C/A突变(5/47, 10.6%)。结论 病毒载量低、试剂盒覆盖的病毒亚型有限、探针对应的序列存在变异均会影响PCR-荧光探针法检测HCV基因型,其中探针序列变异是病毒亚型未测出的主要原因。
丙型肝炎病毒;病毒基因型;病毒变异;病毒载量
HCV是一种有很高变异率的不均质病毒株,复制过程中所依赖的RNA多聚酶具有错配倾向[1]。不同的HCV基因型其致病毒力、预后及其抗病毒难度治疗的反应性方面都有差异,因此检测HCV基因型对临床的治疗方案选择、预后评估具有重要意义[2]。现有的HCV基因型检测试剂盒主要选取HCV的保守区域设计相应的特异性引物和探针,但临床存在HCV RNA阳性,基因分型未检测出的现象,给临床诊断和治疗带来极大困扰。针对该现象,我们总结分析HCV病毒载量阳性,但基因型不能分辨现象的原因及该部分患者的临床特征。
1 对象与方法
1.1 研究对象 收集2015年7月至2016年3月北京佑安医院临检中心分子室HCV病毒载量>1 000 IU/mL,但PCR-荧光探针法未测出病毒亚型的标本55例;随机选取同时期HCV病毒载量>1 000 IU/mL,且PCR-荧光探针法病毒分型为1b 亚型的标本50例作为对照组。所有患者HCV感染诊断均符合2011年版《慢性丙型肝炎防治指南》。研究组及对照组均未进行抗病毒治疗。
1.2 标本采集 抽取待检者清晨空腹静脉血2 mL,室温放置1 h,500×g离心分离血清后于-20 ℃保存。
1.3 试剂与仪器 磁珠法病毒DNA/RNA提取试剂盒、PCR-荧光探针法HCV核酸检测试剂盒(湖南圣湘公司);ABI 7500荧光PCR仪(美国ABI公司);HCV基因分型检测试剂盒(PCR-荧光探针法,中国泰普生物科学公司)。
1.4 HCV病毒载量检测 用磁珠法提取HCV RNA,在ABI 7500荧光PCR仪上用PCR-荧光探针法定量检测HCV核酸,按照试剂说明书进行操作。
1.5 HCV基因分型检测 用PCR-荧光探针法进行HCV基因分型,试剂盒覆盖的亚型为1b、2a、3a、3b、6a,按试剂盒要求进行操作。HCV各亚型的RNA最低检出量均为1 000 IU/mL。
1.6 未分型标本测序分析 用Sanger 测序,由中国泰普生物科学公司协助完成。在https://blast.ncbi.nlm.nih.gov网站进行序列比对。
1.7 肝功能相关生化项目检测 用Olympus AU5400全自动生物化学分析仪检测丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)等指标。
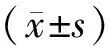
2 结果
2.1 测序结果分析 55例荧光探针法未分型标本中,经测序分析发现HCV 1a型4例,6n型1例,系检测试剂盒未覆盖亚型,占未分型病例的9.1%(5/55);47例因探针序列位置基因突变导致病毒亚型未检出,占85.5%(47/55);3例病毒载量分别为1 100、1 008、1 064 IU/mL,因接近病毒亚型检测下限而未能分型,经测序分析为1b型2例,2a型1例。病毒载量大于1 000 IU/mL、因探针序列位置基因发生变异而导致病毒亚型未测出的47例标本中,经测序发现其中1a型6例(6/47,12.8%),1b型32例(32/47,68.1%),2a型3例(3/47,6.4%),2b型1例(1/47,2.1%),3b型 1例(1/47,2.1%),6a型2例(2/47,4.3%),1b、6q、6c混合型1例(1/47,2.1%),6n型1例(1/47,2.1%)
2.2 HCV探针序列位置基因变异情况分析 47例突变组中以HCV病毒5′非翻译区(5′-untranslated region,5′-UTR) 204 C/T突变为主(31/47, 66.0%),其次为5′UTR168 C/A(5/47, 10.6%)、5′UTR 214 A/T(2/47, 4.3%)、5′UTR 214 A/C(2/47, 4.3%)、 5′UTR 168 C/G(2/47, 4.3%)、5′UTR 214 A/C (1/47, 2.1%)、5′UTR 212 TC/GT(1/47, 2.1%)、84 T/G(1/47, 2.1%)、5′UTR 216 T/C(1/47,2.1%)及5′UTR 220 T/G(1/47, 2.1%)。
2.3 HCV 1b基因突变型的临床特征 1b型5′UTR变异组32例与1b型无变异的52例(其中正常检出无变异50例,检出失败但非变异2例)患者ALT、AST水平比较,差异无统计学意义。但HCV 1b亚型5′UTR变异组、非变异组病毒载量(IU/mL)的lg值分别为5.7±1.3、6.6±0.5,两组比较差异具有统计学意义(P=0.02)。见表1。

表1 1b亚型5′UTR变异组与非变异组患者一般情况比较
3 讨论
HCV基因组为正链RNA,全长约9 600 bp,含有单一开放阅读框(open reading frame, ORF),编码3 000多个氨基酸组成的多聚蛋白前体。HCV目前分为1~7个基因型和若干个亚型,我国HCV基因亚型以1b型最为常见(56.8%),其次为2型(24.1%)、3型(9.1%)与6型(6.3%)[3],上述基因型在我们使用的试剂盒中均可检测。
已有研究表明,不同的HCV基因型对以干扰素为基础的治疗表现出不同的免疫应答反应。与基因型2、3、5和6相比,基因型1和4对基于干扰素的联合治疗敏感性较低,基因型1和4对标准的干扰素治疗耐受时间为48周,而2型和3型的耐受时间只有24周[4]。1型对干扰素治疗的持续应答率为70%,2型和3型的持续应答率可达到90%,4型的持续应答率仅有65%,而6型的持续应答率可达80%[5-6]。因此,HCV基因型在临床上常作为药物疗效的预测指标。另外,多数研究发现HCV 1b亚型与丙型肝炎的进展及发展成肝细胞癌具有密切关系[7],因此HCV基因型还可用来预测疾病进程和肝脏病变的严重程度,以提高丙型肝炎诊断的准确率。
HCV基因组的5′UTR共有341个核苷酸序列,在HCV基因组中最为保守,该区域包含一段必需顺式作用元件和一段序列更为保守的内源性核糖体进入位点(IRES)。IRES上游序列对病毒复制是必需的,而IRES的部分茎环结构在病毒蛋白的翻译过程中起着重要作用[8]。5′UTR是HCV中高度保守的序列,具有双重功能:一是含有IRES,可以指导蛋白质的合成;二是在负链中提供顺式作用复制元件(Cis-acting replication elements,CREs)指导子代正链的合成[9-10]。在本研究中,所用试剂盒是基于5′UTR序列进行HCV分型,这也是当前检测HCV基因型的主要方式。
目前,HCV基因分型方法包括血清学分型、特异性探针杂交法、特异性引物扩增法、DNA免疫酶分析法、限制性片段长度多态性分析法和核酸测序及同源性比较法[11],其中核苷酸同源性分型法最为准确可靠。临床检测中发现HCV RNA阳性,而基因型未测出的情况,分析其原因有以下几种:(1)病毒载量低,影响病毒亚型的检测;(2)试剂盒覆盖的病毒亚型有限,不在试剂盒检测范围内;(3)探针对应的序列存在变异。本研究中探针对应序列变异情况占未分型病例的85.5%(47/55),其中的1a和6n型属于本试剂盒未覆盖的亚型,具有试剂盒的局限性,而探针位点各种试剂盒通用,因此将其归为探针突变型,更具有广泛性。可以看出,RNA阳性、荧光探针法病毒亚型未测出的主要原因是由于探针对应序列的变异。
本研究结果显示,病毒载量阳性因基因变异导致病毒未分型病例中仍以1b 亚型为主要的HCV基因型,其次为1a型。此外,HCV基因型突变中不同亚型所占比例在不同区域中有一定差异[12]。在1b基因型突变组中,由于病毒突变所付出的适应性代价(即病毒为了逃避机体免疫功能所付出的代价)导致HCV载量相对无突变组较低,这个结果与其他学者报道的结果一致[13]。
总之,临床检验中会出现HCV RNA 阳性、病毒亚型未能测出的现象,其中特异性探针对应序列出现变异,影响探针结合是其主要原因,这部分患者在北京地区以1b 亚型为多见,并且病毒载量较非变异患者有减低的趋势。针对这一问题,有研究指出联合HCV多区段例如将非结构蛋白5B区和core区与现常用的5′UTR相结合,能提高检测HCV基因型的准确性及灵敏度[14]。
[1]Elberry MH, Darwish NHE, Mousa SA. Hepatitis C virus management: potential impact of nanotechnology[J].Virol J,2017,14(1):88.
[2]王文,博任浩. 丙型肝炎病毒F蛋白在病毒复制和致病中的作用[J] . 中国生物制品学杂志, 2011, 24(3): 349-353.
[3]苏迎盈, 刘慧鑫, 汪宁. 中国丙型肝炎病毒基因型分布[J]. 中华流行病学杂志, 2013, 34(1): 80-84.
[4]Simmonds P,Bukh J,Combet C,etal.Consensus proposals for a unified system of nomenclature of hepatitis C virus genotypes[J].Hepatology, 2005, 42(4): 962-973.
[5]Yu ML, Chuang WL. Treatment of chronic hepatitis C in Asia:when East meets West[J].J Gastroenterol Hepatol, 2009, 24(3): 336-345.
[6]Sato K, Hosonuma K, Yamazaki Y,etal. Combination therapy with ombitasvir/paritaprevir/ritonavir for dialysis patients infected with hepatitis C virus: A prospective multi-institutional study[J].Tohoku J Exp Med, 2017, 241(1): 45-53.
[7]Sugimoto K, Kim SR, Kim SK,etal. Comparison of daclatasvir and asunaprevir for chronic HCV 1b infection with telaprevir and simeprevir plus peginterferon and ribavirin, with a focus on the prevention of occurrence and recurrence of hepatocellular carcinoma[J].Oncology, 2015, 89(2):42-46.
[8]Caraballo Cortes K, Zagordi O, Jabońska J,etal. Spouse-to-spouse transmission and evolution of hypervariable region 1 and 5′ untranslated region of hepatitis C virus analyzed by next-generation sequencing[J]. PLoS One, 2016, 11(2): e0150311.
[9]Yi G, Wen Y, Shu C,etal. Hepatitis C virus NS4B can suppress STING accumulation to evade innate immune responses[J]. J Virol, 2015, 90(1): 254-265.
[10]Bartenschlager R, Lohmann V, Penin F. The molecular and structural basis of advanced antiviral therapy for hepatitis C virus infection[J].Nat Rev Microbiol, 2013, 11(7): 482-496.
[11] McCormick AL, Macartney MJ, Abdi-Abshir I,etal. Evaluation of sequencing of HCV core/E1, NS5A and NS5B as a genotype predictive tool in comparison with commercial assays targeting 5′UTR[J].J Clin Virol, 2015, 66: 56-59.
[12]卢恩昌,童永清,李艳,等. 湖北地区丙型肝炎患者 HCV 基因分型及 HCV NS5B 耐药突变位点分析[J]. 微循环学杂志,2015,25(1):42-45.
[13]毛维武, 杜鹏, 张文杰, 等. HCV 5′非编码区基因突变对标准抗HCV治疗方案疗效的影响[J]. 临床肝胆病杂志, 2015, 31(4): 585-587.
[14]黄辉红,周元平. HCV基因型和亚型:分型技术、临床意义及其流行病学研究[D]. 广州:南方医科大学, 2010.
(本文编辑:刘群)
北京市医管局“扬帆计划”重点专业项目(ZYLX201711);北京市丰台区科技项目(BJYAH2015YN15)。
张立丽,1977年生,女,副主任技师,硕士,研究方向为微生物学及分子诊断学;侯玉丽,1992年生,女,硕士研究生,研究方向为传染性疾病的早期诊断。两位对本文贡献等同,共为第一作者。
赵艳,研究员,E-mail:18911380390@163.com。
10.13602/j.cnki.jcls.2017.04.08
R446.6
A
2017-02-23)
