SU11274逆转肝细胞生长因子诱导的非小细胞肺癌细胞对厄洛替尼耐药作用及其机制研究
2017-05-24严春花吴叶丹安昌善
严春花,吴叶丹,安昌善
·论著·
SU11274逆转肝细胞生长因子诱导的非小细胞肺癌细胞对厄洛替尼耐药作用及其机制研究
严春花,吴叶丹,安昌善*
背景 肝细胞生长因子(HGF)能够在体外诱导敏感非小细胞肺癌(NSCLC)细胞形成对表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)耐药,敏感NSCLC对厄洛替尼的耐药机制可能与HGF刺激c-Met磷酸化有关。目的 旨在研究c-Met抑制剂SU11274在逆转HGF诱导的裸鼠体内敏感NSCLC对厄洛替尼耐药作用及其机制。方法 于2014年3月—2015年1月选择NSCLC细胞株H292及人胚肺成纤维细胞(MRC-5),通过酶联免疫吸附(ELISA)法检测MRC-5培养上清液中HGF水平,MTT法检测细胞增殖情况,应用Western blotting法检测细胞中c-Met及其下游通道蛋白的变化。建立H292细胞的裸鼠移植瘤模型,设对照组(C组)、HGF处理组(H组)、HGF+SU11274处理组(HS组)、HGF+1%二甲基亚砜(DMSO)处理组(HD组)、厄洛替尼处理组(E组)、HGF+厄洛替尼处理组(HE组)、HGF+厄洛替尼+SU11274处理组(HES组),观察肿瘤生长情况,测量肿瘤体积,称取肿瘤质量。免疫组织化学法检测裸鼠移植瘤组织中c-Met及其下游通道蛋白的变化。结果 ELISA法检测结果显示,MRC-5培养上清液中HGF水平为(1 262±90)pg/ml。MTT法检测结果显示,H292与MRC-5培养上清液混合培养后,H292在厄洛替尼IC50时的增殖率为97.07%。H292 MRC-5阳性细胞p-Met、p-STAT3、p-AKT、p-ERK1/2表达水平高于MRC-5阴性细胞(P<0.05)。处理方法与时间对肿瘤体积存在交互作用(P<0.001);处理方法对肿瘤体积主效应显著(P<0.001);时间对肿瘤体积主效应显著(P<0.001)。其中HES组第7、11、14、18、21、25天肿瘤体积小于HE组(P<0.05)。各组肿瘤质量比较,差异有统计学意义(F=39.120,P<0.001);其中HES组肿瘤质量小于HE组(P<0.05)。各组c-Met、p-Met、p-STAT3、p-AKT、p-ERK1/2表达水平比较,差异均有统计学意义(P<0.05);其中HES组c-Met、p-Met、p-STAT3表达水平低于HE组(P<0.05)。结论 MRC-5分泌的HGF能够在裸鼠体内诱导敏感NSCLC细胞株H292对厄洛替尼产生耐药,c-Met抑制剂SU11274可逆转HGF诱导敏感NSCLC细胞株H292对厄洛替尼耐药,其机制可能与抑制了HGF活化的c-Met及其下游通道蛋白相关。
癌,非小细胞肺;肝细胞生长因子;原癌基因蛋白质c-Met;SU11274;厄洛替尼
严春花,吴叶丹,安昌善.SU11274逆转肝细胞生长因子诱导的非小细胞肺癌细胞对厄洛替尼耐药作用及其机制研究[J].中国全科医学,2017,20(14):1707-1711.[www.chinagp.net]
YAN C H,WU Y D,AN C S.Mechanism of SU11274 reversing the resistance to erlotinib induced by hepatocyte growth factor in non-small cell lung cancer cells[J].Chinese General Practice,2017,20(14):1707-1711.
厄洛替尼为表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)的代表药物之一,作为非小细胞肺癌(NSCLC)靶向分子治疗药物,也不可避免地存在原发性或获得性耐药,且其机制尚不明确。Met及其配体肝细胞生长因子(HGF),作为包括NSCLC在内的多种恶性肿瘤的重要靶点,其介导的多个生物反应促进组织重塑、创口修复、器官平衡和肿瘤转移。SU11274为2003年开发的靶向c-Met小分子酪氨酸激酶抑制剂,其对肿瘤细胞的生成、生长、转移和侵袭均有重要作用。本研究旨在探讨c-Met抑制剂SU11274逆转HGF诱导的敏感NSCLC对EGFR-TKIs产生耐药的效果及其机制。
1 材料与方法
1.1 实验细胞株 实验于2014年3月—2015年1月进行,人NSCLC细胞株H292〔表皮生长因子受体(EGFR)野生型,敏感株〕,由上海市肺科医院中心实验室提供;人胚肺成纤维细胞(MRC-5),由上海生命科学院细胞库提供。雌性、4周龄BALB/c裸鼠〔购自上海斯莱克实验动物有限公司,许可证号为SCXK(沪)2003-0003〕49只,SPF级,体质量为56~65 g,平均体质量为(60±5)g。食用食物高压蒸气灭菌(45 min,120 ℃),饮水12~15 ppm,每日维持10 h光照和14 h无光的明暗周期。
1.2 实验方法
1.2.1 细胞复苏和传代培养 将H292悬浮液,放入10 ml含10%胎牛血清DMEM的离心管内,以1 500 r/min离心5 min,离心半径6 cm,离心、洗涤3次。吸取细胞混悬液,5% CO2、37 ℃恒温培养箱中孵育24 h,更换培养液孵育2~3 d,换液传代。
1.2.2 酶联免疫吸附(ELISA)法检测MRC-5培养上清液中HGF水平 消化细胞,分别将H292和MRC-5接种于6孔板,细胞培养箱孵育48 h。取上清液,以1 500 r/min离心5 min,离心半径6 cm,留取上清液存储。在酶标包被板中加入试剂稀释液后,加入标准物和细胞上清液,混匀,封板,室温孵育2 h。弃去液体,甩干,冲洗。加入酶标试剂,室温孵育1.75 h。弃去液体,甩干,冲洗。加入显色剂,室温孵育0.5 h。加入终止液,用酶标仪测量波长450 nm处OD值,以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据细胞上清液的OD值由标准曲线查出相应的浓度,再乘以稀释倍数即为细胞上清液中HGF水平。实验重复3次,取均值。
1.2.3 MTT法检测细胞增殖 取对数生长期的H292,用胰酶消化,接种于96孔板。24 h后细胞贴壁,加入100 μl浓度为100 mmol/L的厄洛替尼和MRC-5培养上清液,细胞培养箱中孵育72 h,加入MTT,细胞培养箱中孵育4 h,弃上清液,加入二甲基亚砜(DMSO)并震荡至完全溶解。测量波长530 nm处OD值,细胞增殖率=(OD实验组平均值-OD空白组平均值)/(OD对照组平均值-OD空白组平均值)×100%,其中实验组为厄洛替尼和MRC-5培养上清液,对照组为厄洛替尼,空白组为空白试剂。实验重复3次,取均值。
1.2.4 提取细胞总蛋白 取5×105个对数生长期的H292单独或与MRC-5培养上清液混合接种于6孔板,培养48 h;加入裂解液,在冰上裂解30 min~1 h,收入1.5 ml EP管,振荡,直至细胞成黏稠液体;以12 000 r/min离心20 min,离心半径6 cm,4 ℃冰冻离心,取上清液,-20 ℃保存待测。
1.2.5 BCA蛋白定量 将标准品和待测样本添加于96孔板中,加入200 μl BCA工作液,混匀,37 ℃孵育箱中孵育30 min,取出冷却至室温;测量波长562 nm处OD值,每孔的OD值扣除空白孔的OD值,绘制标准曲线,计算方程,R值需>0.99;根据标准曲线及方程,计算出样品的浓度,再乘以相应的稀释倍数。
1.2.6 Western blotting法检测细胞内蛋白表达 将待测样本及适量蛋白Marker加入到上样孔内,进行电泳。完成后,刮去浓缩胶,转膜。按照不同蛋白的分子量裁剪硝酸纤维素膜(NC膜),并封闭。孵育一抗,4 ℃摇床过夜。室温下脱色,摇床上摇动10 min,洗脱,重复3次。孵育二抗,在室温摇床上孵育1 h。洗脱3次。将NC膜进行扫描,用凝胶图像处理系统分析目的条带的分子量,包括c-Met、p-Met、信号转导及转录活化因子3(STAT3)、磷酸化STAT3(p-STAT3)、AKT、p-AKT、细胞外信号调节激酶(ERK1/2)、磷酸化ERK1/2(p-ERK1/2)、甘油醛-3-磷酸脱氢酶(GAPDH)。
1.2.7 裸鼠移植瘤模型的建立及药物抑瘤的分析 当裸鼠达到6周龄时,采用随机区组法分为7组,每组各7只:对照组(C组)、HGF处理组(H组)、HGF+SU11274处理组(HS组)、HGF+1%DMSO处理组(HD组)、厄洛替尼处理组(E组)、HGF+厄洛替尼处理组(HE组)、HGF+厄洛替尼+SU11274处理组(HES组)。C组和E组每只裸鼠右侧肋下皮下分别接种H292细胞悬液100 μl(密度为5×106个/ml),H组、HE组每只裸鼠右侧肋下皮下分别接种相同密度H292+MRC-5细胞悬液混合液100 μl,HS组、HES组每只裸鼠右侧肋下皮下分别接种H292+MRC-5+SU11274细胞悬液混合液100 μl。当肿瘤直径达到4 mm时,C组和H组给予1% Tween-80处理,E组、HE组、HES组接受25 mg·kg-1·d-1的厄洛替尼灌胃,5 d/周,连续4周。每3~4 d(第4、7、11、14、18、21、25天)测量1次肿瘤体积,肿瘤体积=肿瘤长径×肿瘤短径2/2,并绘制肿瘤生长曲线。给药结束后,处死裸鼠,并剥离肿瘤组织,称取肿瘤质量。
1.2.8 免疫组织化学检测 将剥离的肿瘤组织固定、包埋,制成石蜡切片。将石蜡切片脱蜡、水化,磷酸盐缓冲液(PBS)洗涤3次后孵育切片30 min,洗涤3次。将石蜡切片抗原修复,洗涤3次。5%羊血清,室温孵育30 min。弃去羊血清,洗涤3次后加入一抗,放入湿盒中室温1 h,4 ℃过夜。倒掉一抗,PBS冲洗5次。加入二抗后室温孵育2 h,PBS冲洗5次。快速加入二联苯胺(DAB),孵育约5 min,PBS冲洗3次。加入苏木素染液,再用PBS返蓝5 min,脱水,透明,中性树胶封固。将所有切片照相,每组选取10张照片,所有照片用IPP 6.0图像分析软件进行定量分析。记录c-Met、p-Met、STAT3、p-STAT3、AKT、p-AKT、ERK1/2、p-ERK1/2的表达水平。
2 结果
2.1MRC-5分泌HGF水平ELISA法检测结果显示,H292培养上清液中均未检测到HGF,MRC-5培养上清液中HGF水平为(1 262±90)pg/ml。
2.2MRC-5培养上清液中HGF对NSCLC细胞增殖率的影响MTT法检测结果显示,厄洛替尼对H292的IC50为(0.17±0.05)μmol/L,当与MRC-5培养上清液混合培养后,H292在厄洛替尼IC50时的增殖率为97.07%。
2.3MRC-5培养上清液中HGF对c-Met及其下游通道蛋白的影响Westernblotting法检测结果显示,H292MRC-5阴性和阳性细胞c-Met、STAT3、AKT、ERK1/2、GAPDH表达水平比较,差异均无统计学意义(P>0.05);H292MRC-5阴性和阳性细胞p-Met、p-STAT3、p-AKT、p-ERK1/2表达水平比较,差异均有统计学意义(P<0.05,见表1)。
2.4 各组肿瘤体积比较 处理方法与时间对肿瘤体积存在交互作用(P<0.001);处理方法对肿瘤体积主效应显著(P<0.001);时间对肿瘤体积主效应显著(P<0.001)。其中E组第7、11、14、18、21、25天肿瘤体积大于C组;HE组第7、11天肿瘤体积大于E组,第14、18、21、25天肿瘤体积小于H组,大于E组;HES组第7、11、14、18、21、25天肿瘤体积小于HS组和HE组,差异均有统计学意义(P<0.05,见表2)。
2.5 各组肿瘤质量比较C组肿瘤质量为(920±122)mg,H组肿瘤质量为(979±176)mg,HS组肿瘤质量为(1 031±88)mg,HD组肿瘤质量为(1 088±130)mg,E组肿瘤质量为(389±109)mg,HE组肿瘤质量为(564±176)mg,HES组肿瘤质量为(411±43)mg。各组肿瘤质量比较,差异有统计学意义(F=39.120,P<0.001);其中E组肿瘤质量小于C组;HE组肿瘤质量小于H组,大于E组;HES组肿瘤质量小于HS组和HE组,差异均有统计学意义(P<0.05)。
2.6 各组c-Met及其下游蛋白表达情况c-Met、p-Met定位于细胞膜和细胞质。STAT3定位于细胞质,p-STAT3定位于细胞核。AKT、p-AKT定位于细胞质。ERK1/2定位于细胞质,p-ERK1/2定位于细胞核。各组STAT3、AKT、ERK1/2表达水平比较,差异均无统计学意义(P>0.05)。各组c-Met、p-Met、p-STAT3、p-AKT、p-ERK1/2表达水平比较,差异均有统计学意义(P<0.05,见表3)。
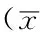
Table1Comaprisonofexpressionlevelsofc-MetanditsdownstreamsignalingproteinsintheculturesupernatantsofH292cellswithandwithoutMRC-5cells

细胞c-Metp-MetSTAT3p-STAT3AKTp-AKTERK1/2p-ERK1/2GAPDHMRC-5阴性44020±547633743±245793270±349941957±532362183±489851663±172453074±445632980±513867194±9737MRC-5阳性44139±556446937±136682299±640385269±671965557±203765673±474154793±308546392±543665157±6758t值0.1228.1292.60411.6500.9937.5651.0223.1061.159P值0.9140.0010.0600.0070.4250.0170.3540.0360.366
注:MRC-5=人胚肺成纤维细胞,STAT3=信号转导及转录活化因子3,p-STAT3=磷酸化STAT3,ERK1/2=细胞外信号调节激酶,p-ERK1/2=磷酸化ERK1/2,GAPDH=甘油醛-3-磷酸脱氢酶

表2 各组不同时间肿瘤体积比较
注:与C组比较,aP<0.05;与H组比较,bP<0.05;与HS组比较,cP<0.05;与E组比较,dP<0.05;与HE组比较,eP<0.05
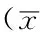
表3 各组c-Met及其下游通道蛋白表达水平比较±s,n=7)
注:与C组比较,aP<0.05;与H组比较,bP<0.05;与HS组比较,cP<0.05;与HD组比较,dP<0.05;与E组比较,eP<0.05;与HE组比较,fP<0.05
3 讨论
近年来,随着分子生物学的发展,促进了靶向药物治疗NSCLC的发展[1]。其中包括单克隆抗体和小分子抑制剂等许多新的药物,目前部分已经被批准用于NSCLC的治疗。
多个临床试验表明,厄洛替尼等第一代可逆性EGFR-TKIs以及阿法替尼(afatinib)等第二代不可逆性EGFR-TKIs,可通过与EGFR共价结合,阻碍EGFR自身磷酸化,抑制其下游通道激活,达到抑制肿瘤细胞的生长和肿瘤的血管生成,延长NSCLC患者的无进展生存期(PFS)[2-3]。TKIs在单独或联合治疗NSCLC患者中可有效阻止EGFR和c-Met[4]。厄洛替尼对非选择性NSCLC患者的有效率约为20%,80%的NSCLC患者对EGFR-TKIs耐药[5]。因此,阐明TKI产生获得性耐药机制尤为重要。
有研究表明,26%~40%的肺癌患者伴HGF高表达及EGFR-T790M继发突变,5%~33%的肺癌患者伴MET基因扩增和EGFR-T790M继发突变,4%~7%的肺癌患者伴HGF高表达及MET基因扩增,表明HGF/MET及EGFR-T790M继发突变为EGFR-TKIs耐药产生的重要靶点[6-7]。
研究发现,HGF/c-Met信号通路参与EGFR-TKIs的获得性耐药形成[8]。c-Met作为受体酪氨酸激酶家族的一员,与其特异性配体HGF相结合,可激活细胞内MAPK、PI3K/AKT和c-Src/FAK、STAT信号通路[9]。虽然EGFR-TKIs能够有效阻断EGFR及其下游信号通道,HGF却能够激活c-Met及其下游信号通道,促进肿瘤细胞增殖及肿瘤血管生成并转移。
本研究向H292加入含有HGF的MRC-5,再加入厄洛替尼抑制H292,结果显示H292增殖率明显提高。并且在H292细胞液中加入MRC-5细胞液后,MRC-5细胞培养液中的HGF能够磷酸化H292细胞中c-Met及其下游蛋白的表达。表明MRC-5能够分泌高浓度HGF,并且其分泌的HGF能够影响H292内蛋白表达。由此,本研究将MRC-5和H292混合种植于裸鼠皮下,建立HGF诱导的H292耐药模型。通过对肿瘤生长的各阶段观察并称取肿瘤质量,发现厄洛替尼能够有效抑制H292移植瘤的生长,但是对HGF+厄洛替尼+SU11274处理组的抑制作用明显高于HGF+厄洛替尼处理组,与单纯厄洛替尼处理组无差异,说明SU11274能够明显改善由HGF诱导的敏感NSCLC细胞对厄洛替尼的耐药形成。免疫组织化学检测结果显示,厄洛替尼处理组、HGF+SU11274处理组和HGF+厄洛替尼+SU11274处理组的p-Met、p-STAT3、p-AKT、p-ERK1/2表达均降低,低于HGF处理组、HGF+1%DMSO处理组和HGF+厄洛替尼处理组,表明厄洛替尼在HGF高表达的环境下不能抑制H292内c-Met、AKT、STAT3、ERK1/2的活化,但在无HGF或HGF高表达,联合SU11274处理时,则能够明显抑制H292内c-Met、AKT、STAT3、ERK1/2活化。进一步证实SU11274能够抑制HGF诱导激活c-Met以及其下游通道的蛋白c-Met、STAT3、AKT、ERK1/2的磷酸化。
作为现代肿瘤学中的新领域,EGFR-TKIs在NSCLC的治疗中,有着不可替代的重要意义。其治疗成功与否,依赖于准确地识别肿瘤的致癌途径,并有效抑制其恶性状态。关于HGF/MET丰富的生物学基础已启动准确评估致癌潜力及开发强效选择性抑制剂的通路。本研究通过在裸鼠体内构建耐药模型,并给予SU11274干预,证实其可抑制c-Met以及其下游通道蛋白c-Met、STAT3、AKT、ERK1/2的磷酸化,从而逆转HGF诱导的敏感NSCLC细胞株对厄洛替尼耐药,有望为NSCLC的治疗提供新途径。
作者贡献:严春花、安昌善进行文章的构思与设计、研究的实施与可行性分析、论文的修订、对文章整体负责;严春花、吴叶丹进行数据收集、数据整理、统计学处理;严春花进行结果的分析与解释、撰写论文;安昌善负责文章的质量控制及审校。
本文无利益冲突。
[1]PARK S,LANGLEY E,SUN J M,et al.Low EGFR/MET ratio is associated with resistance to EGFR inhibitors in non-small cell lung cancer[J].Oncotarget,2015,6(31):30929-30938.DOI:10.18632/oncotarget.5131.
[2]SORIA J C,WU Y L,NAKAGAWA K,et al.Gefitinib plus chemotherapy versus placebo plus chemotherapy in EGFR-mutation-positive non-small-cell lung cancer after progression on first-line gefitinib(IMPRESS):a phase 3 randomised trial[J].Lancet Oncol,2015,16(8):990-998.DOI:10.1016/S1470-2045(15)00121-7.
[3]SEQUIST L V,YANG J C,YAMAMOTO N,et al.Phase Ⅲ study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations[J].J Clin Oncol,2013,31(27):3327-3334.DOI:10.1200/JCO.2012.44.2806.
[4]BOTTING G M,RASTOGI I,CHHABRA G,et al.Mechanism of resistance and novel targets mediating resistance to EGFR and c-Met tyrosine kinase inhibitors in non-small cell lung cancer[J].PLoS One,2015,10(8):e0136155.DOI:10.1371/journal.pone.0136155.
[5]ROSELL R,CARCERENY E,GERVAIS R,et al.Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):a multicentre,open-label,randomized phase 3 trial[J].Lancet Oncol,2012,13(3):239-246.DOI:10.1016/S1470-2045(11)70393-X.
[6]YANO S,YAMADA T,TAKEUCHI S,et al.Hepatocyte growth factor expression in EGFR mutant lung cancer with intrinsic and acquired resistance to tyrosine kinase inhibitors in a Japanese cohort[J].J Thorac Oncol,2011,6(12):2011-2017.DOI:10.1097/JTO.0b013e31823ab0dd.
[7]XU L,KIKUCHI E,XU C,et al.Combined EGFR/MET or EGFR/HSP90 inhibition is effective in the treatment of lung cancers codriven by mutant EGFR containing T790M and MET[J].Cancer Res,2012,72(13):3302-3311.DOI:10.1158/0008-5472.CAN-11-3720.
[8]玄香兰,安昌善,周彩存.肝细胞生长因子诱导敏感非小细胞肺癌细胞对吉非替尼耐药及机制的研究[J].中国肺癌杂志,2013,16(1):1-6.DOI:10.3779/j.issn.1009-3419.2013.01.01. XUAN X L,AN C S,ZHOU C C.The mechanism of gefitinib resistance induced by hepatocyte growth factor in sensitive non-small cell lung cancer cells in vitro[J].Chinese Journal of Lung Cancer,2013,16(1):1-6.DOI:10.3779/j.issn.1009-3419.2013.01.01.
[9]GELSOMINO F,FACCHINETTI F,HASPINGER E R,et al.Targeting the MET gene for the treatment of non-small-cell lung cancer[J].Crit Rev Oncol Hematol,2014,89(2):284-299.DOI:10.1016/j.critrevonc.2013.11.006.
(本文编辑:贾萌萌)
Mechanism of SU11274 Reversing the Resistance to Erlotinib Induced by Hepatocyte Growth Factor in Non-small Cell Lung Cancer Cells
YANChun-hua,WUYe-dan,ANChang-shan*
DepartmentofRespiratoryMedicine,AffiliatedHospitalofYanbianUniversity,Yanji133000,China
*Correspondingauthor:ANChang-shan,Chiefphysician,Professor;E-mail:cs_an2003@aliyun.com
Background Hepatocyte growth factor(HGF) can induce non-small cell lung cancer(NSCLC) cells exerting resistance to epidermal growth factor receptor-tyrosine kinase inhibitors(EGFR-TKIs)in vitro,suggesting that HGF induced c-Met phosphorylation may be associated with the mechanism of erlotinib resistance in sensitive NSCLC.Objective The study aimed to demonstrate that c-Met inhibitor SU11274 can reverse the erlotinib resistance induced by HGF in sensitive NSCLC cells in nude mice.Methods This study was conducted from March 2014 to January 2015.Two cell lines including H292 and human embryonic fibroblast MRC-5 were chosen.The HGF produced by MRC-5 cells in cell culture supernatants was quantitated by enzyme-linked immunosorbent assay(ELISA).The proliferation of H292 cells was measured by using MTT assay and the expressions of c-Met and its downstream signaling proteins were examined by Western blotting.We selected forty-nine 6-week old nude mice and equally divided them into 7 groups,group C (control group),group H,group HS,group HD,group E,group HE,group HES,treated with H292 cell suspension,HGF,HGF+SU11274,HGF+1% DMSO,erlotinib,HGF+erlotinib,HGF+erlotinib+SU11274,respectively.The tumor growth was observed and the growth curve was drawn.The tumor weight was recorded.The expressions of c-Met and downstream signaling proteins in tumor tissues were determined via immunohistochemistry.Results ELISA assay found that the HGF level in the culture supernatant of MRC-5 cells was (1 262±90) pg/ml.MTT assay showed that in the mixture of H292 and MRC-5 cells culture supernatant with erlotinib concentration of IC50,the proliferation of H292 cells was 97.07%.The expressions of p-Met,p-STAT3,p-AKT and p-ERK1/2 in the culture supernatant of H292 with MRC-5 cells were higher than those in the H292 cell culture supernatant(P<0.05).Intervention method and duration exerted significant interaction effects on the tumor volume(P<0.001).Intervention method produced main effect on the tumor volume(P<0.001).Intervention duration had main effect on the tumor volume(P<0.001).The tumor volume was smaller in HES group than in HE group measured on the 7th,11th,14th,18th,21st and 25th days of intervention (P<0.05).The tumor mass differed significantly between the groups(F=39.120,P<0.001).HES group had less tumor mass than HE group did(P<0.05).Significant differences in the expressions of c-Met,p-Met,p-STAT3,p-AKT and p-ERK1/2 were found between the groups(P<0.05).The expressions of c-Met,p-Met,and p-STAT3 proteins were lower in HES group than those in HE group(P<0.05).Conclusion HGF secreted by MRC-5 induces erlotinib resistance in H292 cells in nude mice.c-Met inhibitor SU11274 reverses the resistance of HGF-induced sensitive NSCLC cells to erlotinib in vivo.The mechanism may be related to the inhibition of HGF-induced activation of c-Met and its signaling pathway proteins.
Carcinoma,non-small-cell lung;Hepatocyte growth factor;Proto-oncogene proteins c-Met;SU11274;Erlotinib
国家自然科学基金资助项目(81160291)
R 730.26
A
10.3969/j.issn.1007-9572.2017.14.012
2016-11-18;
2017-02-16)
133000吉林省延吉市,延边大学附属医院呼吸内科
*通信作者:安昌善,主任医师,教授;E-mail:cs_an2003@aliyun.com
