无机盐对甘草愈伤组织生长及总黄酮含量的影响
2017-05-23柳福智杨秀艳
柳福智,杨秀艳
(甘肃农业大学农学院,甘肃 兰州 730070)
无机盐对甘草愈伤组织生长及总黄酮含量的影响
柳福智*,杨秀艳
(甘肃农业大学农学院,甘肃 兰州 730070)
本研究以甘草无菌苗的下胚轴为供试材料,以MS+6-BA 0.5 mg/L+2,4-D 0.5 mg/L+NAA 0.5 mg/L+KT 0.4 mg/L+agar 8 g/L+sugar 30 g/L为基本培养基,利用组织培养技术并结合紫外分光光度法探究了MS培养基中5种不同无机盐浓度及各种成分之间的交互作用对甘草愈伤组织增长量、生理指标及次生代谢产物的影响。结果表明,适量增加KNO3和MnSO4·4H2O的含量有利于甘草愈伤组织生物量的积累;随着MS培养基中CaCl2·2H2O浓度的增加,有利于可溶性糖和总黄酮含量的积累;浓度为2533 mg/L KNO3最有利于提高POD活性;KH2PO4浓度在170~226 mg/L范围内,愈伤组织生长量和总黄酮含量显著提高;MS培养基中MgSO4·7H2O有利于甘草愈伤组织的生长及总黄酮的合成。而愈伤组织的生长状况与总黄酮的合成是多种无机盐离子之间交互作用的结果,通过正交试验及极差分析得出最优营养元素组合为MgSO4·7H2O 493 mg/L+MnSO4·4H2O 7 mg/L+KNO32533 mg/L+KH2PO4170 mg/L+CaCl2·2H2O 733 mg/L。
甘草;愈伤组织;无机盐;次生代谢
甘草(Glycyrrhizauralensis)为豆科(Leguminosae)甘草属(Glycyrrhiza)多年生、耐旱、耐盐碱的深根性草本植物[1-2],广泛分布于北纬45°的干旱半干旱地区。以根和根茎入药,具有补脾益气、止咳祛痰、抗溃疡、抗氧化、抗癌、保肝等功效,素有“十方九草,无草不成方”之说[3-7]。甘草除药用外,也作为食品、饮料、饲料、卷烟和化妆品行业用;也是荒漠或半荒漠地区重要防风固沙、改良土壤的植物,具有生态和经济双重价值[8]。近年来,随着全世界对甘草需求量的剧增,野生资源破坏严重,造成土地沙化面积增加,草场质量恶变,生态环境极其脆弱,甘草遂成为干旱半干旱地区亟待保护的植物资源。
目前,甘草培育以野生驯化和农家种植为主,栽培年限长达3年多,栽培甘草与野生甘草的各项光合特性指标均较接近,受强光的抑制作用不明显,才可有较强的光合作用[9],而且在生产中存在种子硬实严重、成苗率低、生长早期植株弱小、虫草害严重、自然栽培采收种子晚(至少栽培4年才能采收种子)、地下根茎进行无性繁殖系数低等问题,极大地限制了甘草的大面积推广应用和育种工作的开展[10]。因此,利用组织培养技术对甘草进行无性快繁,加快甘草次生代谢活性物质的提取已迫在眉睫。有关甘草组织培养多为愈伤组织诱导与分化方面的研究较多[11-15],而培养基类型及其中营养元素的浓度及培养条件对愈伤组织生长及次生代谢产物含量的积累有很大影响。研究表明[16-18],在培养基中添加不同质量分数的酵母提取物、水解酪蛋白、真菌诱导子、茉莉酸、稀土元素、碳源和氮源等可以有效地提高甘草愈伤组织中黄酮类化合物的合成;李琰等[19]研究了杜仲(Eucommiaulmoides)愈伤组织中不同次生代谢产物的积累对培养基中营养元素有最适要求,可见不同的植物或同种植物生物量的积累及次生代谢产物的大量合成对培养基中无机盐浓度有要求差异。有研究表明,不同浓度的氮源对愈伤组织的诱导和生长有显著的影响[20],不同的碳源对愈伤组织细胞生长及次生代谢产物的合成不一致,适宜的外源硅浓度对盐胁迫下甘草幼苗的生长有一定的缓解作用[21],若培养基中铵盐浓度过大会影响细胞生长[22]。即营养元素种类及浓度在细胞的生长和次生代谢过程中有着重要的作用,而且细胞的生长及次生代谢产物的合成是多种营养元素共同作用的结果,黄亚萍等[23]只从植物水平研究了氮磷钾配施对甘草育苗质量的影响,但有关MS培养基(Murashige and Skoog)中不同无机盐的浓度对甘草愈伤组织生长及次生代谢产物影响的研究国内鲜见报道。本研究以甘草无菌苗的下胚轴为外植体材料,通过研究MS培养基中5种不同浓度的无机盐对甘草愈伤组织的生物积累量、POD活性、可溶性糖及总黄酮含量等因素的影响,来探究营养元素对甘草愈伤组织生长及次生代谢产物的影响;通过优化5种无机盐浓度水平及多因素多水平正交试验,确立最优的营养元素培养组合,以期提高甘草愈伤组织生长率及次生代谢产物含量,通过快速繁殖来缓解甘草市场需求,对保护甘草资源提供理论依据和技术支撑。
1 材料与方法
1.1 试验材料与试验处理
1.1.1 试验时间 本试验始于2014年12月25日,终于2015年12月25日。
1.1.2 试验材料 以甘草种子无菌苗的下胚轴为供试材料。
1.1.3 无菌材料的获得 挑选优质的甘草种子,用98%浓硫酸处理30~40 min[24],无菌水冲洗3~5次,75%乙醇浸泡1 min,无菌水冲洗3~5次,0.1%升汞消毒8 min,无菌水冲洗3~5次,用无菌滤纸吸取种子表面的水分。于超净工作台上将处理过的甘草种子接种到经灭菌、不含任何激素的MS培养基中[25]。每瓶接入6粒无菌甘草种子,置培养架上,在温度为(25±1) ℃、光照时间为12~16 h/d、湿度为50%~70%的培养室条件下,使三角瓶中的种子发芽,生长15 d左右可获得甘草无菌苗。
1.1.4 愈伤组织的诱导 将已培养了15 d左右的无菌苗下胚轴作为外植体,切成0.3 cm左右的小段,在无菌条件下接种于已优化的MS+6-BA(6-苄氨基嘌呤)0.5 mg/L+2,4-D(2,4-二氯苯氧乙酸)0.5 mg/L+NAA(萘乙酸)0.5 mg/L+KT(6-糠氨基嘌呤)0.4 mg/L+琼脂8 g/L+蔗糖30 g/L的愈伤组织诱导培养基中(pH=5.8),暗培养4 d后,开始光照培养20 d可诱导出甘草愈伤组织。
1.1.5 愈伤组织的生长 筛选质地疏松、生长旺盛的甘草愈伤组织,在无菌条件下切成大小0.3 cm的愈伤组织小块,经MS+6-BA 0.5 mg/L+2,4-D 0.5 mg/L+NAA 0.5 mg/L+KT 0.4 mg/L+琼脂8 g/L+蔗糖30 g/L进行继代增值培养后,用作供试材料。试验以添加6-BA 0.5 mg/L+2,4-D 0.5 mg/L+NAA 0.5 mg/L+KT 0.4 mg/L+琼脂8 g/L+蔗糖30 g/L为基础,将MS培养基中的KNO3、KH2PO4、CaCl2·2H2O、MgSO4·7H2O、MnSO4·4H2O 5种无机盐设计成浓度梯度。单因素试验以MS[n/3MS(KNO3)],n=1, 2, 3, 4, 5。其他MS培养基中的营养元素的浓度均不变,无机盐浓度单位是mg/L,上述同样的方法对其他5种无机盐分别进行试验,即 KNO3的考察浓度为:633,1266,1900,2533,3166;KH2PO4的考察浓度为:56,113,170,226,283;CaCl2·2H2O的考察浓度为:146,293,440, 586,733;MgSO4·7H2O的考察浓度为:123,246,370,493,616;MnSO4·4H2O的考察浓度为:7,14, 22,29,37。试验重复3次,每个处理接种20瓶,每瓶接入4块大小相近的愈伤组织,接种的愈伤组织鲜重控制在0.10~0.20 g之间。愈伤组织生长条件与无菌苗获得条件相同。经25 d后,计算5个处理的增长量(g/flask)、可溶性糖含量(%)、总黄酮含量(%)、POD活性[U/(g·min)],优化培养基,进行多因素多水平的正交试验,找到最优营养元素组合。
1.2 测定项目与方法
1.2.1 增长量的计算 将培养 25 d的愈伤组织分别取出 (不同无机盐及同一无机盐不同浓度培养的愈伤组织每批取样 20个),用滤纸将其表面附着的培养基吸去,置于万分之一的分析天平上进行称重,然后取其平均值即得组织的鲜重。将称过鲜重的组织,置于烘箱中,首先在 105 ℃下烘 30 min,使其酶系灭活;再在 60 ℃下烘 3~4 h,使其干燥至恒重。算其相应处理的增长量,愈伤组织增长量=收获量/瓶-接种量/瓶。
1.2.2 可溶性糖含量的测定 甘草愈伤组织中的可溶性糖主要是指溶于水及乙醇的单糖和寡聚糖,可利用沸水浴提取和苯酚法测定其含量[26]。公式如下:
可溶性糖含量(%)=(CVT/106WVs)×100
式中:C为从标准曲线查得的葡萄糖量(μg);VT为样品提取液总体积(mL);Vs为显色时取样品液量(mL);W为样品重(g)。
1.2.3 总黄酮含量的测定 精密称取已研磨的甘草愈伤组织0.200 g,以75%乙醇作为提取溶剂,料液比为1∶50,浸泡样品30 min后超声提取40 min,过滤。滤渣以1∶30料液比超声提取30 min,过滤。合并2次的滤液,用75%乙醇定容至25 mL。精密吸取提取液5 mL,置25 mL容量瓶中,加水至6 mL,加5%亚硝酸钠溶液1 mL,混匀,放置6 min,加10%硝酸铝溶液1 mL,混匀,放置6 min,加4%氢氧化钠试液10 mL,再加水至刻度,摇匀,放置15 min,以不加提取液而加其他相应试剂为空白,在500 nm处测吸光度,平行测定3次。公式如下:
P={[(A+0.00193)×5×V]/0.01075×m×106}×100%
式中:P为总黄酮含量;A为吸光度值;5为稀释倍数;V为提取液体积(mL);m为愈伤组织的干重(g)。
1.2.4 过氧化物酶(POD)活性的测定 精密称取2 g新鲜甘草愈伤组织,剪碎置于研钵中,然后加5 mL 0.1 mol/L Tris-HCl(pH=8.5)缓冲液,冰浴研磨,以4000 r/min离心15 min,取上清液,残渣可用5 mL缓冲液提取一次,合并两次上清液,置冷处备用。过氧化物酶(POD)活性的测定按愈创木酚氧化法,反应液用紫外分光光度法于波长470 nm比色测定。
1.3 数据统计分析
每个处理的不同浓度每次测定重复3次,用SPSS 19.0对数据进行显著性(P<0.05)、极显著(P<0.01)及标准差分析,使用Excel 2007软件进行实验数据处理。
2 结果与分析
2.1 KNO3浓度对愈伤组织生长及次生代谢产物的影响
MS培养基中KNO3的浓度范围在633~3166 mg/L内,甘草愈伤组织的生长受到了促进,愈伤组织鲜重随KNO3浓度的增加而极显著性增加,因KNO3各个浓度愈伤组织鲜重含水量不同,在633~1266 mg/L和2533~3166 mg/L范围内干重增长差异不明显(表1)。总黄酮含量随KNO3浓度的增加而明显下降,可溶性糖含量和POD活性的最适浓度分别为1900和2533 mg/L,最高含量分别为(0.7866±0.004)%和(56.5543±0.358) U/(g·min) (表1)。不同浓度KNO3的愈伤组织生长状况与次生代谢产物含量不呈正相关,这说明愈伤组织生长和次生代谢产物的积累对无机盐浓度的要求不同(表1)。

表1 不同浓度KNO3对愈伤组织生长及次生代谢产物含量的影响Table 1 Effects of different concentrations of KNO3 on callus growth and secondary metabolites
注:数值用平均数±标准差表示,同列标有不同小写字母表示差异显著(P<0.05);标有不同大写字母表示差异极显著(P<0.01),下同。
Notes:Values are Means±standard deviation, followed by different lowercase letters within column differ significantly (P<0.05); followed by different uppercase letters within column differ significantly (P<0.01), the same below.
2.2 KH2PO4浓度对愈伤组织生长及次生代谢产物的影响
KH2PO4在56~283 mg/L的范围内愈伤组织的增长量极显著的呈先上升后下降的趋势,但以MS培养基中 KH2PO4的原浓度170 mg/L生长最适(表2);而总黄酮和可溶性糖含量随着处理浓度的增加而极显著升高,在浓度达到226 mg/L时含量达最大(表2)。POD是活性较高的一种与呼吸作用、光合作用及生长素的氧化等有关的酶,在170~226 mg/L的浓度内含量相对较高,这也表明在这个浓度范围内愈伤组织易老化,颜色翠绿且质地硬,这是因为POD能使组织中所含碳水化合物转化为木质素,增加木质化程度,即POD的活性可作为组织老化的一种生理指标(表2)。
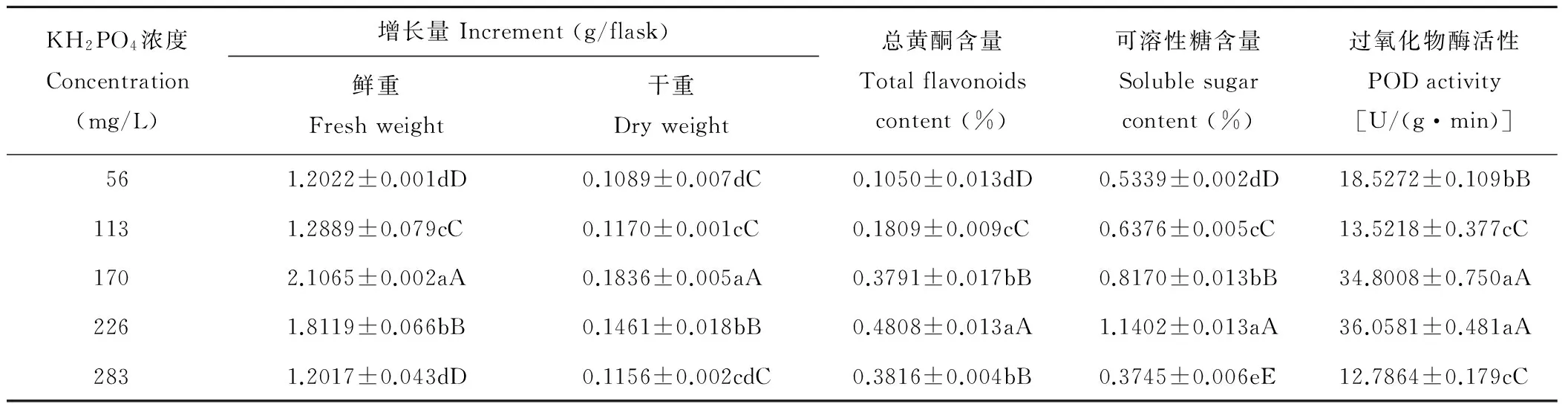
表2 不同浓度KH2PO4对愈伤组织生长及次生代谢产物含量的影响Table 2 Effects of different concentrations of KH2PO4 on callus growth and secondary metabolites
2.3 MgSO4·7H2O浓度对愈伤组织生长及次生代谢产物的影响
在123~370 mg/L范围内,随MgSO4·7H2O浓度的变大,甘草愈伤组织生长受到极显著的促进作用(P<0.01)(表3),说明浓度低于370 mg/L的MgSO4·7H2O不会对愈伤组织有胁迫作用,浓度在370~493 mg/L范围时愈伤组织生长最好,但MS培养基中MgSO4·7H2O原浓度有利于黄酮和可溶性糖含量的积累,增加或减少MS培养基中MgSO4·7H2O的浓度都极显著地抑制了总黄酮和可溶性糖的形成,最高含量分别为(0.3530±0.009)% 和(0.8135±0.008)%;POD的活性在246~493 mg/L内差异较小。
2.4 CaCl2·2H2O浓度对愈伤组织生长及次生代谢产物的影响
在146~733 mg/L范围内,增加CaCl2·2H2O的浓度,明显地抑制了愈伤组织的增长量,生长状况下降,但总黄酮含量和可溶性糖含量变化明显且在试验最大浓度733 mg/L时两种产物含量最高;而相同外植体愈伤组织的POD活性随 CaCl2·2H2O浓度水平的变动格局存在差异,在培养基原浓度时POD活性最强(表4)。
2.5 MnSO4·4H2O浓度对愈伤组织生长及次生代谢产物的影响
MnSO4·4H2O是MS培养基中为甘草愈伤组织提供微量元素的无机盐,当浓度小于29 mg/L,愈伤组织的生物积累量极显著的呈先减小后增加的趋势,超过29 mg/L时,破坏了养分平衡,愈伤组织生长不明显,而MnSO4·4H2O的浓度大于7 mg/L会极显著胁迫甘草愈伤组织中可溶性糖的合成,在试验浓度内POD活性和总黄酮含量差异极显著,而在培养基原浓度22 mg/L时含量积累最高(表5)。
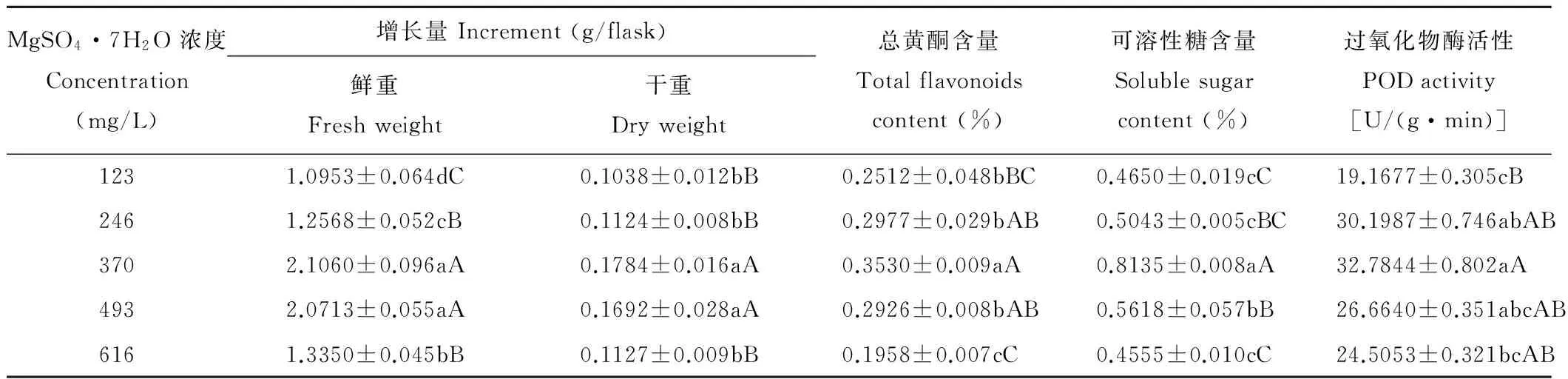
表3 不同浓度MgSO4·7H2O对愈伤组织生长及次生代谢产物含量的影响Table 3 Effects of different concentrations of MgSO4·7H2O on callus growth and secondary metabolites
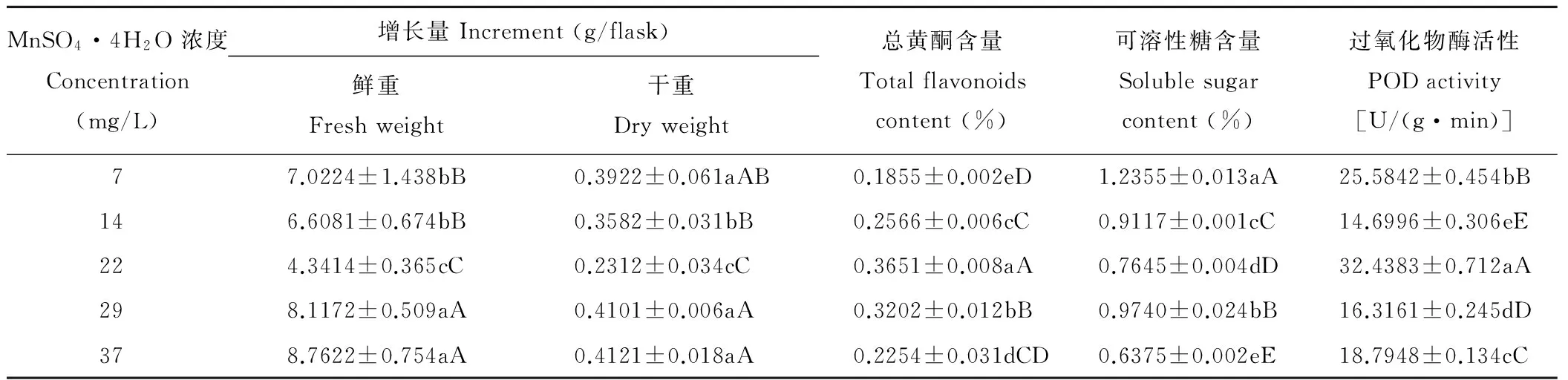
表5 不同浓度MnSO4·4H2O对愈伤组织生长及次生代谢产物含量的影响Table 5 Effects of different concentrations of MnSO4·4H2O on callus growth and secondary metabolites
2.6 不同营养元素优化组合对愈伤组织生长及次生代谢产物的影响
经过优选的5种无机盐浓度3个水平的正交试验,发现各个优化组合对甘草愈伤组织的生物量的积累及次生代谢产物的大量合成影响格局较大(表6、7)。对试验结果进行多指标的极差分析,5种无机盐离子对愈伤组织的生长状况和所测次生代谢产物的积累影响力的大小依次为:MgSO4·7H2O>MnSO4· 4H2O>KNO3>KH2PO4>CaCl2·2H2O,最好的培养组合为C3E1A2B2D3,即在MgSO4·7 H2O 493 mg/L、MnSO4· 4H2O 7 mg/L、KNO32533 mg/L、KH2PO4170 mg/L、CaCl2·2H2O 733 mg/L。可见镁元素是影响高产优质的甘草次生代谢产物的主因素,叶绿素的形成需要镁,镁是叶绿素的中心金属元素,愈伤组织细胞中镁含量的高低直接影响细胞对CO2的同化能力,进而影响细胞的生长和次生代谢产物的合成(表8)。

表6 因素水平 Table 6 Factors and levels mg/L
A: KNO3浓度 Concentration; B: KH2PO4浓度Concentration; C: MgSO4·7H2O 浓度Concentration; D: CaCl2·2H2O 浓度Concentration; E: MnSO4·4H2O 浓度Concentration.下同The same below.
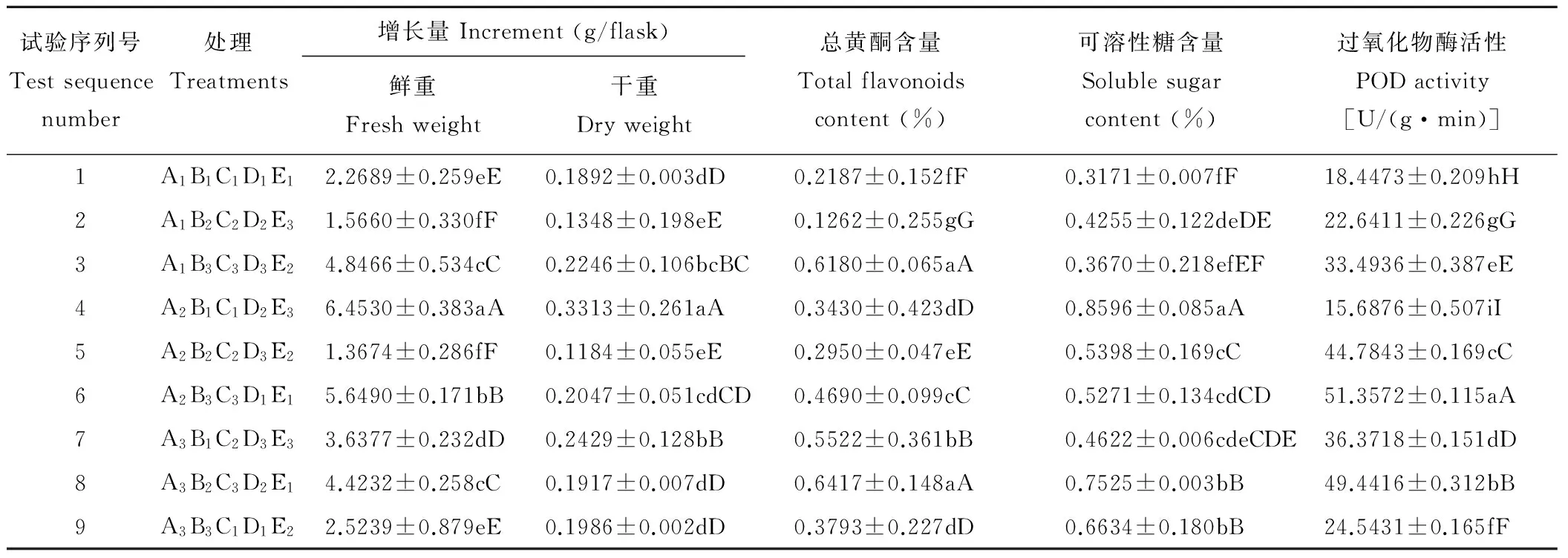
表7 不同营养元素优化组合对愈伤组织生长及次生代谢产物的影响Table 7 Effects of different medium component optimization on callus growth and secondary metabolites
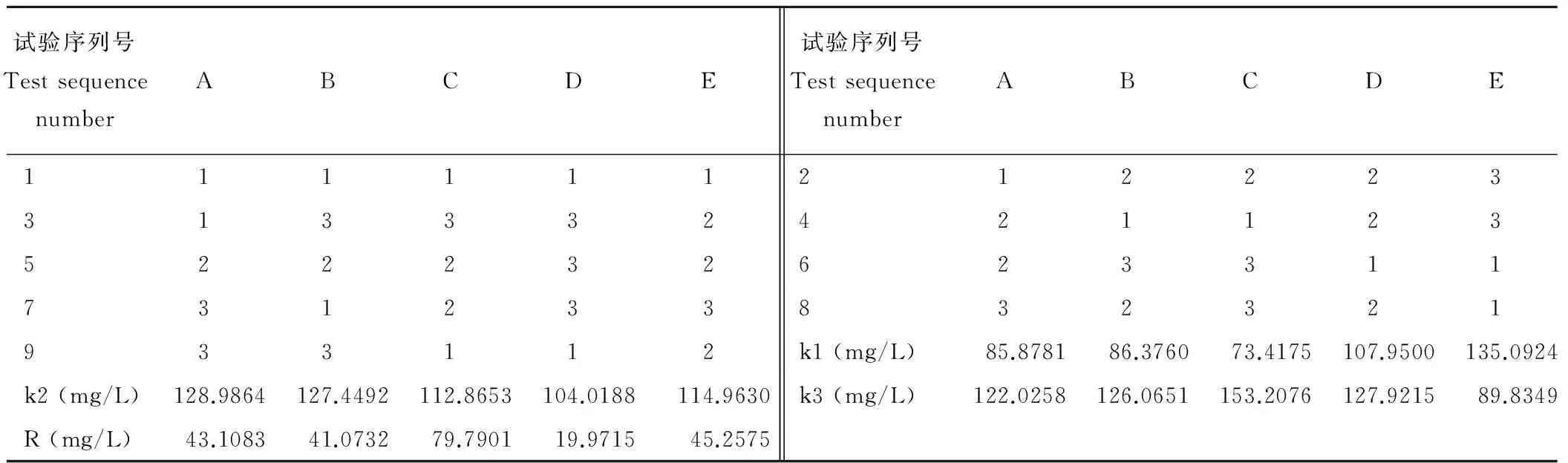
表8 不同营养元素优化组合 Table 8 Different medium component optimization
注:表8中的试验序列号和表7的试验序列号一样,代表每一个试验处理。其中,k1、k2、k3分别代表的是各个营养元素优选浓度水平为1、2和3下5个测量指标的总和,R代表的k1、k2和k3之间的极差,这是综合考察的方法。
Note: The test sequence numbers in Table 8 are the same as the numbers in Table 7, and represent each test treatment. Where k1, k2, k3 represent respectively the sum of the five measurement indices at the preferred concentration levels 1, 2 and 3 of each nutrient element, and R represents the difference between k1, k2 and k3, which is a comprehensive survey method.
3 讨论
培养基中的营养元素是愈伤组织细胞生长及初生代谢过程中化合物合成的物质基础,但植物种类的不同适合的培养基中无机盐浓度也不同[27]。对愈伤组织而言,较高浓度的无机盐有利于愈伤组织的生长,较低浓度的盐反而有利于次生代谢产物的大量合成[28]。因有此浓度效应,所以增殖细胞数量及获得次生代谢产物应选用不同浓度的培养基以满足所需。本试验研究了MS培养基中的KNO3、KH2PO4、CaCl2·2H2O、MgSO4·7H2O、MnSO4·4H2O五种无机盐的不同浓度对甘草愈伤组织的生物积累量、POD活性、可溶性糖含量和总黄酮合成的影响。结果表明,在试验范围内增加培养基中KNO3和MnSO4·4H2O的含量有利于甘草愈伤组织细胞生物量的积累,而增加CaCl2·2H2O的浓度反而使愈伤组织生长状况下降,培养基中KH2PO4和MgSO4·7H2O的原浓度均有利于愈伤组织生长,黄酮的最佳积累浓度1/3MS(KNO3)、4/3MS(KH2PO4)、3/3MS(MnSO4·4H2O、MgSO4·7H2O)、5/3MS(CaCl2·2H2O);无机盐浓度为3/3MS(KNO3、MgSO4·7H2O)、5/3MS(CaCl2·2H2O)、4/3MS(KH2PO4)、1/3MS(MnSO4·4H2O)时愈伤组织中的可溶性糖含量最高;MS培养基中的无机盐原浓度对POD的合成较适宜。用统计分析的方法对培养基中5种无机盐进行水平筛选,通过优化的5种无机盐3个水平的正交试验和极差分析,探明了各种无机盐成分对愈伤组织生物量积累与次生代谢产物合成的交互作用,得到了最优培养基是C3E1A2B2D3。为进一步稳定甘草愈伤组织有效生长速率和有效成分的大量合成,建立了稳定、高产的甘草愈伤组织生长及次生代谢产物生产体系。
综上所述,MS培养基中不同浓度的无机盐对愈伤组织生长状况与次生代谢产物含量无相关性,而且不同的次生代谢产物对营养元素的种类、数量和比例有不同的要求。这也证实了愈伤组织生长和次生代谢产物的形成对培养基中无机盐浓度要求差异很大。造成这种格局主要因为:1)细胞的生长及次生代谢产物的合成需要营养元素的参与,不同浓度的营养元素会影响培养基的渗透势,过高的渗透势使细胞失水,造成生理干旱,影响细胞的正常代谢,从而导致细胞生长缓慢[29]。在高盐的培养基中,细胞为了平衡渗透胁迫,体内会大量积累可溶性糖等渗透调节物质,使细胞保持较低的渗透势,提高了愈伤组织的渗透调节能力,可改善水分关系[30];细胞中会产生大量的活性氧自由基,破坏细胞膜、使生物大分子变性、许多代谢酶失活,进而使细胞的新陈代谢紊乱,但是细胞自身抗氧化系统中的过氧化物酶,它是一种保护剂,可以清除活性氧自由基,提高愈伤组织的抗逆性,而且黄酮类物质也可以提高细胞的抗氧化能力[31-32]。2)培养基中营养元素的吸收情况与愈伤组织吸收养分基因型的差异、细胞膜系统的离子交换量、酶活性、植物激素和植物毒素等有关,根据细胞内代谢活动的需要而进行选择性吸收。植物体内的硝酸还原酶的活性强烈影响植物对硝酸盐的吸收与利用,而植物体内酶的合成受某些基因的调控,进而影响了甘草愈伤组织细胞的生长及次生代谢产物合成中一些关键酶的合成[33]。营养元素对细胞内某些化合物的生物合成有调控作用,马生军等[34]以一年生甘草移栽苗为供试材料,研究表明适量浓度的锰对甘草SQS1(鲨烯合成酶1)基因的表达和甘草酸的积累具有一定的促进作用。所以植物对养分的吸收与积累动态主要受控于植物本身的遗传特性,但对植物营养基因的研究正处于方兴未艾的时刻,目前关于一个基因控制某种元素的吸收与利用的研究已被一些植物营养和遗传学者所关注。
References:
[1] Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China[S]. Beijing: Chemical Industry Press, 2015: 59-63. 药典委员会. 中华人民共和国药典[S]. 北京: 化学工业出版社, 2015: 59-63.
[2] Li X B, Chen L, Li G Q,etal. Ecological distribution and propagative technique research ofGlycyrrhizauralensisresources in China. Journal of Ecological Environment, 2013, 22(4): 718-722. 李学斌, 陈林, 李国旗, 等. 中国甘草资源的生态分布及其繁殖技术研究. 生态环境学报, 2013, 22(4): 718-722.
[3] Liang B, Yang A F, Huang F L,etal. Research advances on chemical constituents and pharmacological activities inGlycyrrhiza. Journal of Northeast Agricultural University, 2006, 37(1): 115-119. 梁冰, 杨爱馥, 黄凤兰, 等. 甘草属(Glycyrrhiza)化学成分及药理作用研究进展. 东北农业大学学报, 2006, 37(1): 115-119.
[4] Sun Y, Ai Y N R, Yan X H,etal. Research progress on the extraction methods and pharmacological effects of flavonoids from licorice. Xinjiang Journal of Traditional Chinese Medicine, 2009, 27(1): 72-75. 孙芸, 阿依努尔·吾买尔, 燕雪花, 等. 甘草黄酮的提取方法及药理作用研究进展. 新疆中医药, 2009, 27(1): 72-75.
[5] Gao X Y, Wang W Q, Wei S L,etal. Review of pharmacological effects ofGlycyrrhizaradixand its bioactive compounds. Chinese Journal of traditional Chinese Medicine, 2009, 34(21): 2695-2700. 高雪岩, 王文全, 魏胜利, 等. 甘草及其活性成分的药理活性研究进展. 中国中药杂志, 2009, 34(21): 2695-2700.
[6] Zhang B, Guan Y P, Tian Q L,etal. Advances in the study on the chemical constituents of flavonoids in Ural. Chinese Journal of Traditional Chinese Medicine, 2006, 28(9): 1362-1365. 张波, 官月平, 田庆来, 等. 乌拉尔甘草中黄酮类化学成分的研究进展. 中国药学杂志, 2006, 28(9): 1362-1365.
[7] Chen H. An overview of the pharmacological effects of licorice. Strait Pharmaceutical Journal, 2005, 17(4): 37-41. 陈红. 甘草药理作用概述. 海峡药学, 2005, 17(4): 37-41.
[8] Wang Z L, Du J C, Yu L Q,etal. Utilization value, research status and existing problems of licorice. Grassland in China, 2002, 24(1): 73-76. 王照兰, 杜建材, 于林清, 等. 甘草的利用价值、研究现状及存在问题. 中国草地, 2002, 24(1): 73-76.
[9] Zhao Z H, Cao J G, Wang W J,etal. Comparative study on the photosynthetic characteristics between the cultivatedGlycyrrhizauralensiswith different age limits and the wildG.uralensis. Acta Prataculturae Sinica, 2005, 14(3): 111-116. 赵则海, 曹建国, 王文杰, 等. 不同生长年限栽培甘草与野生甘草光合特性对比研究. 草业学报, 2005, 14(3): 111-116.
[10] Li M, Jiang Q, Zhang Q Y,etal. Study on the artificial cultivation technology of the arid zone in the middle of Ningxia Province. Chinese Agricultural Science Bulletin, 2005, 21(1): 144-148. 李明, 蒋齐, 张青云, 等. 宁夏中部干旱带甘草人工种植技术研究. 中国农学通报, 2005, 21(1): 144-148.
[11] Liu X, Wang Q, Yu B. Effects of different hormone combinations on callus induction and browning ofGlycyrrhizainflateBata. Journal of Gansu Agricultural University, 2010, 45(6): 88-93. 刘昕, 王清, 余斌. 不同外源激素对胀果甘草愈伤组织诱导及褐化的影响. 甘肃农业大学学报, 2010, 45(6): 88-93.
[12] Hu H Y, Wu X L, Liang X H. Induced cultivation ofGlycyrrhizainflataBatal callus. Pharmaceutical Biotechnology, 2004, 11(3): 170-172. 胡海英, 吴晓玲, 梁新华. 胀果甘草愈伤组织诱导培养. 药物生物技术, 2004, 11(3): 170-172.
[13] Lei C, Li P. Study on embryogenic callus induction ofGlycyrrhizainflateBat. Academic Journal of Second Military Medical University, 2010, 31(8): 909-911. 雷呈, 李斐. 胀果甘草胚性愈伤组织的诱导研究. 第二军医大学学报, 2010, 31(8): 909-911.
[14] Ge S J, Li G M, Ma Z Y,etal. Establishment of micropropagation system ofGlycyrrhizauralensis. Acta Prataculturae Sinica, 2007, 16(6): 107-112. 葛淑俊, 李广敏, 马峙英, 等. 乌拉尔甘草组培再生体系的研究. 草业学报, 2007, 16(6): 107-112.
[15] Ma W F, Huang H Y, Wang Q. Effect of exogenous hormone on callus induction and chromosome doubling ofGlycyrrhizauralensis. Acta Prataculturae Sinica, 2008, 17(3): 142-145. 马文芳, 黄惠英, 王清. 外源激素对甘草愈伤组织诱导及染色体加倍的影响(简报). 草业学报, 2008, 17(3): 142-145.
[16] Yang S H, Liu X F, Guo D A,etal. Effects of medium and culture conditions on callus growth and flavonoids synthesis in licorice. Journal of Jilin Agricultural University, 2005, 27(3): 289-292. 杨世海, 刘晓峰, 果德安, 等. 培养基及培养条件对甘草愈伤组织生长和黄酮类化合物合成的影响. 吉林农业大学学报, 2005, 27(3): 289-292.
[17] Yang S H, Tao J, Liu X F,etal. Effects of carbon source and nitrogen source on callus growth and flavonoid content inGlycyrrhizauralensis. Chinese Journal of Traditional Chinese Medicine, 2006, 31(22): 1857-1859. 杨世海, 陶静, 刘晓峰, 等. 培养基中碳源和氮源对甘草愈伤组织生长和黄酮类化合物合成的影响. 中国中药杂志, 2006, 31(22): 1857-1859.
[18] Yang S H, Liu X F, Guo D A,etal. Effects of different additives on the formation of flavonoids inGlycyrrhizauralensiscallus. Chinese Journal of Traditional Chinese Medicine, 2006, 41(2): 96-99. 杨世海, 刘晓峰, 果德安, 等. 不同附加物对甘草愈伤组织培养中黄酮类化合物形成的影响. 中国药学杂志, 2006, 41(2): 96-99.
[19] Li Y, Zhang C H, Ma X H. Effect of medium composition on the growth and secondary metabolites of callus. Journal of Wuhan Botanical Research, 2004, 22(4): 359-363. 李琰, 张朝红, 马希汉. 培养基成分对杜仲愈伤组织生长及次生代谢产物含量的影响. 武汉植物学研究, 2004, 22(4): 359-363.
[20] Kim S H, Kim S K. Effect of nitrogen source on cell growth and anthocyanin production in callus and cell suspension culture of ‘Sheridan’ grapes. Journal of Plant Biotechnology, 2002, 4(2): 83.
[21] Cui J J, Zhang X H, Li Y T,etal. Effects of exogenous Si on the morphological and physiological indexes of licorice seedlings under salt stress. Acta Prataculturae Sinica, 2015, 24(10): 214-220. 崔佳佳, 张新慧, 李月彤, 等. 外源Si对盐胁迫下甘草幼苗形态及生理指标的影响. 草业学报, 2015, 24(10): 214-220.
[22] Chen Y C, Yi F, Cai M,etal. Effect of amino acids, nitrate, and ammonium on the growth and taxol production in cell cultures ofTaxusyunnanensis. Plant Growth Regulation, 2003, 41: 265-2681.
[23] Huang Y P, Chen Y, Guo F X,etal. Effect of N,P,K combination fertilization on the cultivation quality ofGlycyrrhizauralensisseedlings. Acta Prataculturae Sinica, 2012, 21(2): 233-240. 黄亚萍, 陈垣, 郭凤霞, 等. 氮磷钾配施对甘草育苗质量的影响. 草业学报, 2012, 21(2): 233-240.
[24] Yang R, Wang L Q, Liu Y. Research progress on tissue culture of licorice. Chinese Herbal Medicine, 2014, 45(12): 1796-1802. 杨瑞, 王礼强, 刘颖. 甘草组织培养的研究进展. 中草药, 2014, 45(12): 1796-1802.
[25] Liu F C, Lv J M, Wu X Z,etal. Significant impact of different induction conditions on metabolic diversity of callus cell lines ofGlycyrrhizasp. Chinese Journal of Traditional Chinese Medicine, 2013, 38(23): 4056-4060. 刘凤彩, 吕建明, 吴秀祯, 等. 诱导培养条件显著改变甘草愈伤组织次生代谢产物的多样性. 中国中药杂志, 2013, 38(23): 4056-4060.
[26] Zhao H Q. The Basic Biology Experimental Guide of Plant Physiology[M]. Beijing: China Agricultural University Press, 2008: 80-82. 赵海泉. 基础生物学实验指导植物生理学分册[M]. 北京:中国农业大学出版社, 2008: 80-82.
[27] Li Y, Feng J T, Wang Y H,etal. Effects of basic media and culture conditions on callus growth and secondary metabolite content ofTripterygiumwilfordii. Forestry Science, 2010, 46(5): 64-69. 李琰, 冯俊涛, 王永宏, 等. 培养基及培养条件对雷公藤愈伤组织生长和次生代谢产物含量的影响. 林业科学, 2010, 46(5): 64-69.
[28] Shangguan X C, Guo C L, Jiang Y. A study on effects of media and plant hormones on callus induction ofCyclocaryapaliurus(Bata.l) iljinskaja stems and leavesinvitro. Acta Agriculturae Universitatis Jiangxiensis, 2006, 28(5): 678-682. 上官新晨, 郭春兰, 蒋艳. 培养基和植物激素对青钱柳茎段和叶片愈伤组织诱导的研究. 江西农业大学学报, 2006, 28(5): 678-682.
[29] Ge S J, Li X F, Tan B H,etal. Effect of different dispose on seed germination and peroridase (POD) enzymes ofGlycyrrhizauralensisFisch. Seed, 2008, 27(9): 42-45. 葛淑俊, 李秀凤, 谭冰海, 等. 不同处理对乌拉尔甘草种子发芽率及过氧化物酶活性的影响. 种子, 2008, 27(9): 42-45.
[30] Yang F, Liu Q L, Dai Z Z,etal. Effects of different explants and basic medium on callus induction and differentiation ofAgavesisalana. Journal of Tropical Crops, 2012, 33(3): 475-478. 杨峰, 刘巧莲, 代真真, 等. 不同基本培养基和外植体对剑麻愈伤组织诱导及分化的影响. 热带作物学报, 2012, 33(3): 475-478.
[31] Wang B J, Gao J F, Su W,etal. Influence of culture condition on callus growth and flavonoids biosynthesis of buckwheat. Journal of Nuclear Agriculture, 2013, 27(5): 591-597. 王鹏姬, 高金锋, 苏旺, 等. 培养条件对荞麦愈伤组织生长及黄酮合成的影响. 核农学报, 2013, 27(5): 591-597.
[32] Meng C N, Liu C, He J M,etal. The effects of increased UV-B radiation,NaCl stress and their combined treatment on the photosynthesis and flavone metabolism in wheat seedlings. Photon Journal, 2005, 34(12): 1868-1871. 孟朝妮, 刘成, 贺军民, 等. 增强UV-B辐射、NaCl胁迫及其复合处理对小麦幼苗光合作用及黄酮代谢的影响. 光子学报, 2005, 34(12): 1868-1871.
[33] Wang Y, Tang H R. Effects of nitrate on the growth and nitrate reductase activity in phaeocystis globosa. Chinese Bulletin of Botany, 2006, 23(2): 138-144. 王艳, 唐海溶. 硝酸盐对球形棕囊藻生长和硝酸还原酶活性的影响. 植物学通报, 2006, 23(2): 138-144.
[34] Ma S J, Wang W Q. The expression ofSQS1 gene and the content of glycyrrhizic acid ofGlycyrrhizauralensisFisch.in different concentrations of Mn2+. Acta Pharmaceutica Sinica, 2015, 50(1): 111-117. 马生军, 王文全. 不同浓度锰处理对甘草SQS1基因表达及其甘草酸含量影响的分析. 药学学报, 2015, 50(1): 111-117.
Effects of inorganic salts on the growth and total flavonoid content ofGlycyrrhizauralensiscallus
LIU Fu-Zhi*, YANG Xiu-Yan
CollegeofAgriculture,GansuAgriculturalUniversity,Lanzhou730070,China
In this study, five kinds of inorganic salts were added to Murashige and Skoog (MS) culture medium to determine their effects on the growth rate, physiological indexes, and secondary metabolite contents of licorice (Glycyrrhizauralensis) callus. The hypocotyledonary axis of sterile licorice seedlings was used as the experimental material. The culture medium consisted of MS+6-benyzlaminopurine (0.5 mg/L)+2,4-dichlorophenoxyacetic acid (0.5 mg/L)+naphthalene acetic acid (0.5 mg/L)+kinetin (0.4 mg/L)+agar (8 g/L)+sugar (30 g/L). Tissue culture and ultraviolet spectrophotometry methods were used to study the effects of inorganic salts at various concentrations in the culture medium on the growth and characteristics of licorice callus. Increasing amounts of KNO3and MnSO4·4H2O in the medium increased the biomass of licorice callus. Increasing concentrations of CaCl2·2H2O in the medium led to increased accumulation of soluble sugars and total flavonoids. The highest peroxidase activity was in callus in medium containing 2533 mg/L KNO3. Callus growth and total flavonoid content increased significantly as the KH2PO4concentration increased from 170 mg/L to 226 mg/L. The presence of MgSO4·7H2O in the MS medium promoted licorice callus growth and flavonoid synthesis. However, callus growth and total flavonoid synthesis were affected by the interactions among various inorganic salts. The results of an orthogonal test and range analysis indicated that the optimal combination of salts for growth and secondary product accumulation in licorice callus was as follows: MgSO4·7H2O 493 mg/L; MnSO4·4H2O 7 mg/L; KNO32533 mg/L; KH2PO4170 mg/L; and CaCl2·2H2O 733 mg/L.Key words:Glycyrrhizauralensis; callus; inorganic salt; secondary metabolites
10.11686/cyxb2016239
http://cyxb.lzu.edu.cn
2016-06-12;改回日期:2016-08-05
甘肃农业大学盛彤笙科技创新基金(GSAU-STS-1429)资助。
柳福智(1976-),男,宁夏隆德人,博士。E-mail:lfz_1976@126.com*通信作者Corresponding author.
柳福智, 杨秀艳. 无机盐对甘草愈伤组织生长及总黄酮含量的影响. 草业学报, 2017, 26(5): 118-126.
LIU Fu-Zhi, YANG Xiu-Yan. Effects of inorganic salts on the growth and total flavonoid content ofGlycyrrhizauralensiscallus. Acta Prataculturae Sinica, 2017, 26(5): 118-126.
