焉耆马的DRA与DQA基因遗传多态性及其序列分析
2017-05-22于丽娟张艳花徐新明吴伟伟阿米妮古丽阿不来孜田可川
于丽娟,张艳花,徐新明,吴伟伟,阿米妮古丽·阿不来孜,田可川
(新疆畜牧科学院畜牧研究所,新疆乌鲁木齐 830011)
焉耆马的DRA与DQA基因遗传多态性及其序列分析
于丽娟,张艳花,徐新明,吴伟伟,阿米妮古丽·阿不来孜,田可川*
(新疆畜牧科学院畜牧研究所,新疆乌鲁木齐 830011)
采用聚合酶链式反应-单链构象多态性(PCR-SSCP)方法检测焉耆马ELA-DRA*exon2、ELADQA*exon2的基因型,并对不同等位基因进行测序,对其核苷酸与氨基酸序列进行分析。结果表明:焉耆马的ELA-DRA*exon2共检出4个等位基因;ELA-DQA*exon2共检出9个等位基因,通过核苷酸序列比对发现其中3个为新等位基因。ELA-DRA*exon2、ELA-DQA*exon2的各等位基因序列分析结果表明,发生非同义替换的多态位点均主要分布在抗原结合位点对应的编码序列中。遗传多态性分析结果表明,焉耆马的ELA-DRA*exon2多态信息含量为0.4,属于中度多态。卡方检验结果表明,焉耆马在该ELA-DRA*exon2位点处于Hardy-Weinberg平衡(χ2>χ20.05)。本研究为马的抗病育种提供了理论基础。
焉耆马;主要组织相容性复合体;DRA;DQA;PCR-SSCP
主要组织相容性复合体(Major Histocompatibility Complex, MHC)广泛分布于各种脊椎动物体内,是一类编码免疫球蛋白样受体的高度多态的基因群。MHC基因的高度多态性,在机体免疫系统中发挥着非常重要的作用,与物种的抗病性和易感性以及种群繁殖力和生存力密切相关[1]。通过MHC的遗传多态性分析可以为家畜的抗病育种提供重要的理论依据。
马的MHC又称为马淋巴细胞表面抗原(Equine Lymphocyte Antigen,EIA),位于第20号染色体上,由I类、Ⅱ类和Ⅲ类分子组成。其中,Ⅱ类分子在呈递外源性抗原与免疫反应中起到重要的作用,它包含3个DQA位点、2个DQB位点和3个DRB位点以及1个DRA位点[2]。研究表明,MHC的多态性主要集中在Ⅱ类分子的DR和DQ基因座,它们所编码抗原功能区(抗原结合区)的第2外显子具有多态性。前人对ELA的研究主要集中在Ⅱ类分子上,研究发现其多态性与马的蚊虫叮咬过敏症、胃肠道与体外寄生虫的抗性/易感性、适应性进化、雄性马的睾丸素水平及精子数量、配偶选择等具有相关性[3-9]。
焉耆马是乘挽兼用的新疆优良地方马品种,具有体质结实、体格大、耐粗饲、抗热耐寒、抗病性强、在不同环境条件下的适应性和耐力性能较强等优点。本研究应用聚合酶链式反应-单链构象多态性(PCR-SSCP)技术与测序技术,对焉耆马的ELA-DRA*exon2与ELA-DQA*exon2的遗传多态性进行初步检测分析,旨在为进一步研究焉耆马MHC的抗病、易感性提供理论依据,为今后马的抗病标记辅助选择奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料 实验用50匹焉耆马均来自新疆巴音郭楞蒙古自治州焉耆县。每匹马经颈静脉采血10 mL,按6:1的比例加入ACD震荡混匀,投入液氮罐带回,-70℃冰箱保存。
1.1.2 主要试剂和仪器 琼脂糖、蛋白酶K、Tris饱和酚、Taq酶、dNTPs、DNA Marker:MarkerⅠ、琼脂糖凝胶DNA回收试剂盒、pGM-T连接试剂盒、TOP10感受态细胞、X-gal、IPTG等均购自北京天根生物技术有限公司;PBS、TE、TAE缓冲液等试剂实验室自备。ABI 9700 PCR仪(美国ABI公司)、DYY-Ⅲ32 型平板电泳槽(北京市六一仪器厂)、UV-1000凝胶成像系统(北京宾达英创科技有限公司)、BECKMAN ND-1000 Spectrophotometer 分光光度计(美国)、3-16K 型低温离心机(Sigma,德国)等。
1.2 方法
1.2.1 DNA提取 采用常规的酚-氯仿抽提法提取基因组DNA,用TE进行溶解。使用微量核酸蛋白检测仪检测各样品的DNA浓度和纯度并将其稀释至80 ng/μL,-20℃保存备用。
1.2.2 引物设计与PCR扩增 引物序列及扩增片段长度见表1。引物均由由上海生物工程有限责任公司合成。
PCR扩增反应体系20 μL:10×Buffer缓冲液2.0 μL、10 mmol/L dNTP1.6 μL、上下游引物(各50 pmol/μL)各0.2 μL、Taq DNA聚合酶0.3 μL、模板DNA(80 ng)1 μL、ddH2O补至20 μL。
经反复试验得到优化后的ELA-DRA*exon2的扩增条件:95℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,34个循环;72℃延伸10 min;4℃保存。ELA-DQA*exon2的扩增条件:95℃预变性5 min;94℃变性30 s,61.8℃退火30 s,72℃延伸30 s,34个循环;72℃延伸10 min;4℃保存。用1.5%琼脂糖凝胶对PCR产物进行电泳检测。
1.2.3 PCR产物的SSCP检测 3 μLPCR产物与12 μL变性剂混匀形成样品液,98℃变性5 min,立即置于冰上冷却至上样。变性样品液点入12%的非变性聚丙烯酰胺凝胶板中,4℃下140 V恒温恒压电压16 h,进行固定、氧化、银染和显色,用凝胶成像系统拍照保存结果,并进行分型,统计各基因型的个体数。
1.2.4 测序 根据SSCP分型结果,挑选不同的纯合子进行直接测序;选取不同的杂合子个体的PCR产物进行克隆测序。PCR产物经DNA片段快速纯化回收试剂盒纯化后回收,与PGM-T载体连接,然后转化大肠杆菌(E.coli)TOP l0菌株,PCR鉴定后由北京三博远志生物技术有限责任公司完成测序。
1.2.5 序列分析 测序结果用Mega4软件进行比较,检测核苷酸变异位点。利用ClustalX软件对所有序列进行比对,并且辅以人工校对,找出序列差异和变异位点。利用MEGA4对核苷酸和氨基酸序列进行统计分析。
1.2.6 统计分析 经SSCP分型后,统计每种基因型的数量,应用PopGen32软件计算其基因型频率、等位基因频率、群体杂合度(H)、有效等位基因数(Ne),利用Micrisatellite-Toolkit软件计算多态信息含量(PIC),并检验群体内基因型分布是否符合Hardy-Weinberg平衡定律。
2 结果与分析
2.1 PCR扩增ELA-DRA*exon2、ELA-DQA* exon2的PCR扩增产物经1.5%琼脂糖凝胶电泳检测,结果如图1所示。扩增片段与目的片段大小一致,无拖尾、杂带现象,特异性较好,可用于后续实验。
2.2 PCR-SSCP检测 由图2可知,焉耆马的ELA-DRA*exon2共检测出了5种基因型,4个等位基因,其中A、C 2种等位基因在纯合子中被检出,B、D 2种等位基因在杂合子中被检出。另外,焉耆马的ELA-DQA*exon2经PCR-SSCP检测共检测出11种等位基因,部分结果如图3所示。
2.3 焉耆马的ELA-DRA* exon2的群体遗传学分析
2.3.1ELA-DRA*exon2的基因型频率与基因频率由表2可知,焉耆马的ELA-DRA*exon2共存在AA、CC、AB、AC、AD 5种基因型,其中,AA型为焉耆马的优势基因型。等位基因以A等位基因为主,基因频率为0.71,B、D 2种等位基因只在杂合子中被检出。
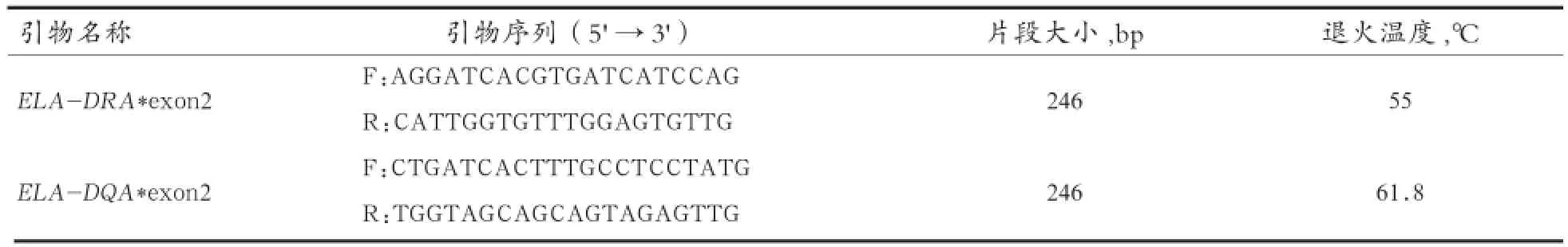
表1 引物序列、退火温度及扩增片段长度
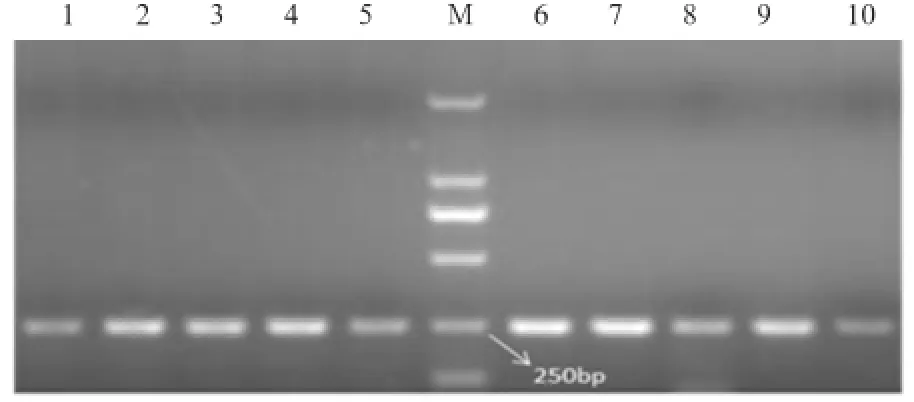
图1 ELA-DRA*exon2与ELA-DQA*exon2的PCR扩增产物
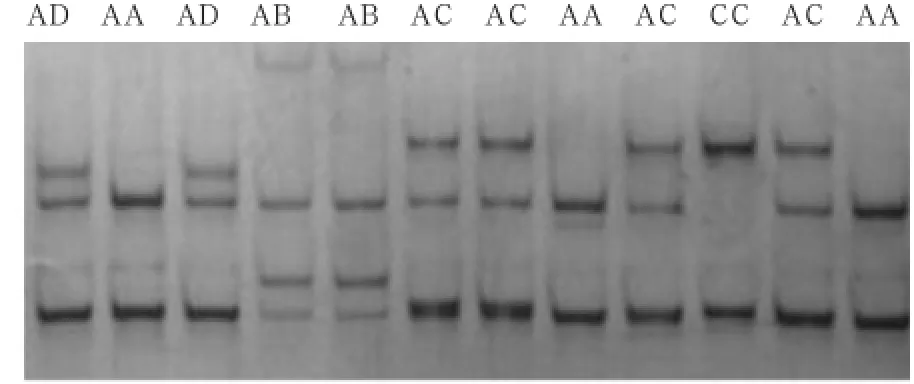
图2 ELA-DRA*exon2的SSCP电泳结果
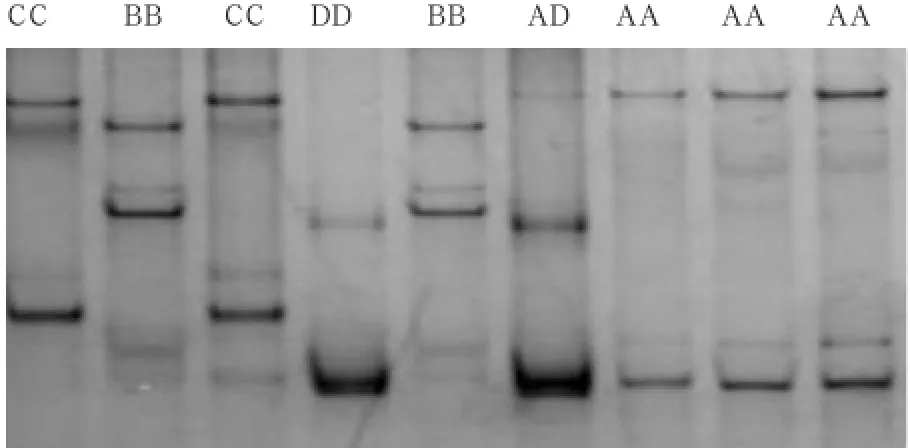
图3 ELA-DQA*exon2的SSCP电泳结果
2.3.2 焉耆马ELA-DRA*exon2的多态性分析 表3结果显示,焉耆马ELA-DRA*exon2的纯合度为0.547、杂合度为0.453、多态信息含量为0.4,介于0.25~0.5之间,属于中度多态。卡方检验结果表明,焉耆马在该位点均处于Hardy-Weinberg平衡
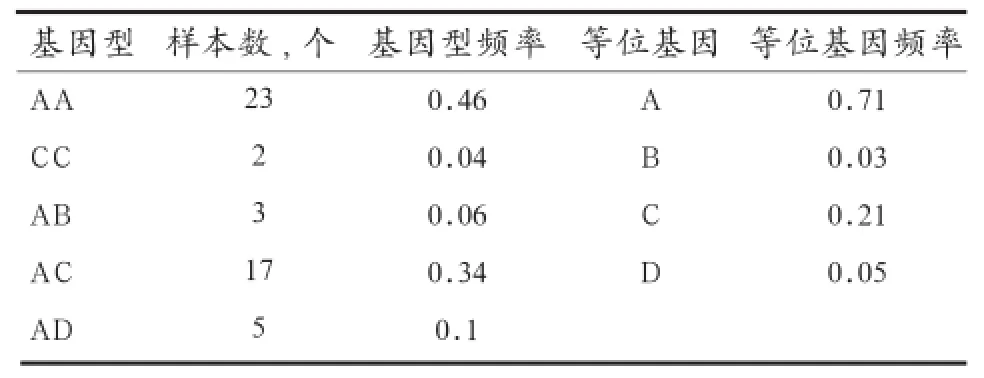
表2 ELA- DRA*exon2的基因型频率与基因频率

表3 ELA-DRA*exon2的遗传多态性参数
2.3.3ELA-DRA*exon2的序列分析 将测得的4个等位基因序列与GenBank中已公布的AJ575295.1进行比对,结果如图4所示。共发现有7处突变,A等位基因在第38位和197位分别发生了C→G、T→C的突变,B等位基因在第38位、142位、191、197位分别发生了C→G、G→A、C→G、T→C的突变,C等位基因在第38位、147位、197位分别发生了C→G、G→A、T→C的突变,D等位基因在第38位、58位、98位、197位分别发生了C→G、T→A、T→C、T→C的突变。将4条核苷酸序列翻译成氨基酸序列。由图5可知,5个位点处发生了非同义替换,2个位点发生了同义替换。在81个氨基酸残基中包含有21个ABS位点,对其进行分析后发现ABS中有4个氨基酸发生了非同义替换;而在剩余的60个non-ABS位点中仅有1个氨基酸发生了非同义替换。
2.4 焉耆马的ELA-DQA*exon2各等位基因序列分析 将测得的去除上下游引物后的9个等位基因的核苷酸序列与GenBank中已公布的U92505.1序列用MEGA4进行比对后发现,共存在27个核苷酸变异位点(图6)。将9条核苷酸序列翻译成氨基酸序列(图7),共有19个非同义突变,其中有11个为ABS位点。

图4 焉耆马ELA-DRA*exon2的不同等位基因的核苷酸序列比对

图5 焉耆马ELA-DRA*exon2不同等位基因的氨基酸序列比对

图6 焉耆马ELA-DQA*exon2的不同等位基因的核苷酸序列比对

图7 ELA-DQA*exon2的等位基因氨基酸序列比对
3 讨 论
近年来,对马的DRA、DQA方面的研究报道较多,分别研究了不同马属动物的ELA-DRA*exon2的多态性[8,10-12],在马中共发现了5种等位基因。将焉耆马的4种ELA-DRA*exon2基因的测序结果与GenBank中已公布的马的ELA-DRA*exon2等位基因的序列进行比对,发现A、B、C、D 4种等位基因分别与已报道的DRA*0101、DRA*0301、DRA*0201及DRA*0501相同。在国内,孟青龙[13]通过PCR-SSCP技术和PCR扩增产物直接纯化测序技术对7个品种马的ELA-DRA*exon2的基因多态性进行研究,共检测出3种等位基因。
马的ELA-DQA*exon2的多态性要比ELADRA*exon2高。到目前为止,已在马属动物中发现了37个等位基因,其中在马上发现了21个等位基因[8,12,14]。本研究在焉耆马中共检测出9种等位基因,将其测序结果与GenBank中已公布的马的ELADQA*exon2等位基因序列进行比对,结果发现其中的A、B、C、D、E、H等位基因分别与ELADQA*0201、ELA-DQA*0601、ELA-DQA*0801、ELA-DQA*0301、ELA-DQA*1501、ELADQA*1001相同,而F、G、I为新等位基因。孟青龙[13]通过用PCR-SSCP技术和PCR扩增产物直接纯化测序技术对7个品种马的ELA-DQA*exon2位点的基因多态性进行了研究,共检测出了10种等位基因,其中,三河马、锡尼河马在ELA-DQA*exon2位点存在8种等位基因,巴尔虎马、乌审马存在7种等位基因,纯血马存在6种等位基因、乌珠穆沁马存在5种等位基因。
通过以上对比可以发现,焉耆马的ELADRA*exon2、ELA-DQA*exon2的多态性较前人研究的其他品种马高[13],可能与焉耆马的生活环境有关。焉耆马主要生活在高寒牧区,平均海拔在2 500~2 700 m,年平均气温-4.7℃,绝对最低温度-46.6℃,四季区分不明显,无绝对无霜期。较强的选择压力造成了焉耆马的ELA-DRA*exon2、ELA-DQA*exon2的多态性。
将测序后的等位基因的核苷酸序列与翻译后的氨基酸序列对照后发现,ELA-DRA*exon2有5个位点处发生了非同义替换,其中4个处于ABS位点;ELA-DQA*exon2共有19个非同义突变,其中有11个为ABS位点。表明多态位点的分布具有“偏向性”,即多态位点以及产生的非同义替换集中出现在ABS的编码序列中。
4 结 论
焉耆马的ELA-DRA*exon2属于中度多态,焉耆马在该位点处于Hardy-Weinberg平衡。通过PCR-SSCP与测序分析相结合得出焉耆马的ELADRA*exon2、ELA-DQA*exon2均具有多态性,且ELA-DQA*exon2的多态性比ELA-DRA*exon2高;多态位点的分布具有“偏向性”,即多态位点以及产生的非同义替换集中出现在抗原结合位点的编码序列中。此研究结论将为马的抗病育种研究提供理论依据。
[1]吴云良, 鞠慧萍, 张红霞, 等. 濒危动物主要组织相容性复合体基因的研究现状及前景[J]. 生物技术通讯, 2007, 18 (5): 830-832.
[2]Tseng C T, Miller D, Cassano J,et al. Identification of equine major histocompatibility complex haplotypes using polymorphic microsatellites[J]. Anim Genet, 2010, 41(Suppl 2): 150-153.
[3]Kamath P L, Turner W C, Kusters M,et al. Parasitemediated selection drives an immunogenetic trade-off in plains zebras (Equus quagga)[J]. P Roy Soc B-Biol Sci, 2014, 281(1783): 1-10.
[4]Burger D, Dolivo G, Marti E,et al. Female major histocompatibility complex type affects male testosterone levels and sperm number in the horse (Equus caballus)[J]. P Roy Soc B-Biol Sci,2015, 282: 1-7.
[5]Burgera D, Meuwlya C, Martib E,et al. Investigation on female mate choice in horses and possible association with the MHC[J]. Anim Reprod Sci, 2010, 121: 63-64.
[6]Klumplerova M, Vychodilova L, Bobrova O. Major histocompatibility complex and other allergy-related candidate genes associated with insect bite hypersensitivity in Icelandic horses[J]. Mol Biol Rep, 2013, 40: 3333-3340.
[7]Janova E, Matiasovic J, Vahala J. Polymorphism and selection in the major histocompatibility complex DRA and DQA genes in the family Equidae[J]. Immunogenetics, 2009, 61: 513-527.
[8]Kamath P L, Getz W M. Adaptive molecular evolution of the Major Histocompatibility Complex genes, DRA and DQA,in the genus Equus[J]. BMC Evol Biol, 2011, 11(128): 1-16.
[9]Andersson L S, Swinbune J E, Meadows J R S,et al. The same ELA class II risk factors confer equine insect bite hypersensitivity in two distinct populations[J]. Immunogenetics, 2012, 64: 201-208.
[10]Brown J J, Thomson W, Clegg P,et al. Polymorphisms of the equine major histocompatibility complex class II DRA locus[J]. Tissue Antigens, 2004, 64: 173-179.
[11]Diaz S, Echeverria M G, It V,et al. Development of an ELA-DRA gene typing method based on pyrosequencing echnology[J]. Tissue Antigens, 2008, 72: 464-468.
[12]Janova E, Matlasovic J, Vahala J,et al. Polymorphism and selection in the major histocompatibility complex DRA and DQA genes in the family Equidae[J]. Immunogenetics, 2009, 61: 513-527.
[13]孟青龙. 马MHC-Ⅱ类分子遗传多样性的研究[D].呼和浩特: 内蒙古农业大学, 2005.
[14]Fraser D F, Bailey E. Polymorphism and multiple loci for the horse DQA gene[J]. Immunogenetics, 1998, 47: 487-490.
Genetic Polymorphism and Sequence Analysis of DRA and DQA Gene in Yanqi Horse
YU Li-juan, ZHANG Yan-hua, XU Xin-ming, WU Wei-wei, AMINIGULI ALAIBUZI, TIAN Ke-chuan*
(Institude of Animal Science, Xinjiang Academy of Animal Sciences, Xijiang Urumqi 830011, China)
ELA-DRA*exon2 andELA-DQA*exon2 of Yanqi horse were genotyped by polymerase chain reaction-single strand conformation polymorphism (PCR-SSCP) methods. Both the nucleotide sequences and the amino acid sequences of the different alleles were analyzed in these horses. The results showed four alleles ofELA-DRA*exon2 and nine alleles ofELA-DQA*exon2 were detected in 50 Yanqi horses, three new alleles were found by nucleotide sequences alignment. The estimation of the nucleotide sequences and the amino acid sequences of the different alleles in theELA-DRA*exon2 andELA-DQA*exon2 showed there was a higher ratio of non-synonymous substitutions in the antigen-binding site (ABS) region. The genetic polymorphism analysis showed that the PIC ofELA-DRA* exon2 is 0.4 in Yanqi horse, is moderately polymorphic. A Chi-square analysis suggested that the allele frequencies and genotype frequencies were in Hardy-Weinberg equilibrium in the Yanqi horse(χ2>χ20.05).This paper would provide a theoretical basis for resistance breeding of horses.
Yanqi horse;MHC;DRA;DQA; PCR-SSCP
S821.2
A
10.19556/j.0258-7033.2017-05-037
2016-08-06;
2016-12-23
新疆维吾尔自治区公益性科研院所基本科研业务经费资助项目(KyGy2016004);新疆绒毛用羊遗传育种与繁殖重点实验室(XJYS1105)
于丽娟(1986-),女,新疆博州人,高级实验师,硕士,研究方向为动物分子遗传,E-mail:yljxinjiang120@ sina.com
* 通讯作者:田可川(1963-),男,博士,研究员,研究方向为动物遗传育种,E-mail:tiankechuan@163.com
