绿宝石木瓜扦插生根关联酶活性的研究
2017-05-17刘萍萍孙志成赵亚楠
刘萍萍 ,孙志成,赵亚楠 ,吴 萍 ,王 川
(1.蒙阴县国有林场总场,山东 临沂 276200;2.山东鸿林工程技术有限公司;3.山东泉林嘉有现代农业股份有限公司;4.蒙阴县垛庄镇垛庄林业站;5.山东省梁山县馆驿镇人民政府林业站)
木瓜属蔷薇科木瓜属植物,为重要观赏树种和果树[1],木材坚硬可作床柱用[2]。扦插是一种常用的营养繁殖方法,不仅能大量繁殖,快速成型、开花,而且大大缩短育苗时间。由于木瓜插条较难生根[3],因此,研究木瓜扦插对良种木瓜的推广和发展,都具有重要的理论价值和实践意义。
许多研究表明,过氧化物酶(POD)、多酚氧化酶(PPO)、吲哚乙酸氧化酶(IAAO)活性与不定根的发生和发展有密切的关系,因此,研究木瓜扦插生根过程中相关生根关联酶的活性变化规律,有助于良种木瓜扦插繁殖的推广应用提供技术指导和理论依据。
已有研究表明,木瓜为难生根树种,本研究以木瓜属优良观赏品种绿宝石为研究对象,研究木瓜扦插生根过程中生根关联酶多酚氧化酶 (PPO)、吲哚乙酸氧化酶(IAAO)、过氧化物酶(POD)活性的动态变化过程。
1 材料和方法
1.1 试验材料及其制备
试验材料采自蒙阴县木瓜研究所木瓜基地的1a生木瓜实生苗干,2015年11月木瓜休眠后选取植株上无病虫害的当年生枝条,进行沙藏,沙藏湿度以60%为宜。
2016年3 月,剪取插穗长度12~15cm,在芽上1 cm剪成平口,下切口剪成马耳形,保持切口平滑,每50根困成一捆,将插穗在0.1%高锰酸钾溶液中消毒0.5 h,用浓度为500 mg/L的IBA溶液中浸泡插穗基部30min,选用珍珠岩+泥炭作为基质[4](选用2008曹玉翠木瓜扦插最佳实验组合)。
1.2 试验设计
取400个插穗分成两组,其中一组采用500mg/L的IBA浸泡30min后进行扦插,清水处理作为对照。扦插后每7天采样一次,每个处理随机选取10株,剪取插穗基部2cm范围内的表皮,剪碎后混匀,用于测量生理指标,试验设置3次重复。
1.3 基质处理及管理
扦插前7天喷洒0.5%的高锰酸钾溶液消毒,用黑色塑料薄膜覆盖5天后揭开薄膜,待药剂挥发至尽后扦插。扦插棚为智能控温控湿大棚,温度控制在20~30℃,湿度控制在70%~85%,每隔45分钟喷雾90s,每周喷一次800倍的多菌灵溶液。
1.4 生理指标测定
POD活性的测定采用愈创木酚比色法(张志良和瞿伟菁,2009),PPO活性的测定采用曹帮华(2005)的方法,IAAO活性的测定采用二氯酚比色法(张志良和瞿伟菁,2009)。
1.5 数据处理
利用Microsoft Excel 2016对数据进行统计分析和统计软件SAS 9.2软件进行方差分析。
2 结果与分析
2.1 IBA处理对扦插生根成活率和根系生长的影响
由表1可知,处理组生根率为68.2%,对照组生根率为15.8%,生根率提高52.4%。扦插14天左右后发现,处理组出现愈伤组织,而对照组出现于扦插后21天左右;处理组在35天左右,对照组出现于42天左右。说明经过IBA处理后,木瓜生根率显著提高,愈伤组织与不定根出现时期提前。

表1 IBA处理对扦插生根成活率的影响
2.2 IBA对木瓜扦插生根过程中相关酶活性的变化
2.2.1 IAAO活性的变化
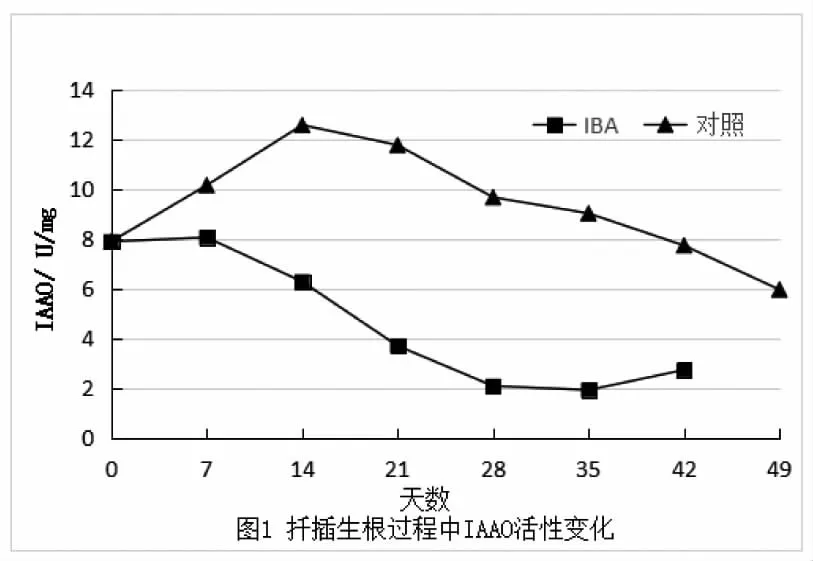
由图1及表2可见,与对照组相比IBA处理组保持较低值,且IAAO活性变化趋势相对简单,呈现先升高后缓慢下降,之后出现缓慢上升的趋势;对照组呈现先升高后缓慢下降的趋势。较低的IAAO活性有利于不定根的形成,以促进不定根的生长,这与Wiesmann(1988)等研究一致,当外源IBA进入植物组织后,会及时转化为IAA,IAA一个重要的生理功能就是促进不定根的形成,IAA含量的变化对木瓜扦插生根过程中不定根的发生有一定的影响,IAAO活性则呈下降趋势。插穗不定根大量形成以后,IAAO活性开始缓慢上升,IAA酶活性减弱。
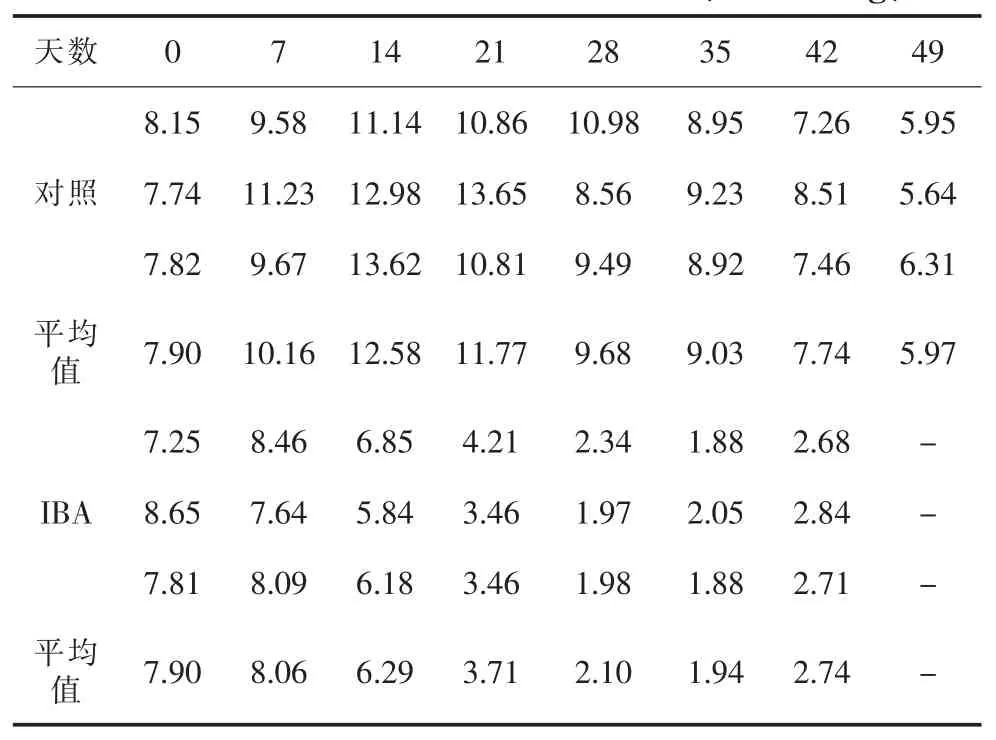
表2 扦插生根过程中IAAO活性变化(单位U/mg)
2.2.2 POD活性的变化


表4 扦插生根过程中PPO活性的变化 单位U/mg
由图2和表3可以看出,处理组的木瓜插穗中,POD活性的变化趋势与对照组基本一致,但活性显著的提高,并在愈伤组织形成时期(21d)和不定根发生时期(35d)出现较高和最高峰,且峰值出现明显提前。整体变化趋势是,先缓慢上升,后下降,又急剧上升,再下降趋势。POD对扦插生根的影响较为复杂,已有研究表明:POD活性在植物其扦插过程中会出现两个峰值(Gebhardt,1982),Syros等(2004)认为高活性的POD在一定程度上有利于扦插生根。
2.2.3 PPO活性的变化
由图3可知,IBA处理组的PPO活性在0~14天下降,14~35天急剧上升达到最高值后下降;对照组变化趋势基本一致,呈现出先下降后上升再下降的趋势,但处理组峰值出现显著提前,该变化趋势Gyana(2006)的研究结果一致。在木瓜插穗生根过程中,PPO能够催化酚类物质与IAA反应形成一种目前被普遍认为是生根辅助因子的物质 “IAA—酚酸复合物”(Haissig,1974;Bassuketal,1981)。 因此认为PPO活性的升高促进插穗不定根的大量发生,即PPO通过催化这种复合物的形成而影响根的发生。在插穗生根伸长期,细胞数量增多、不定根伸长可能会导致PPO活性下降,并且PPO参与了细胞壁的合成(Satoetal,1993)。在木瓜扦插初期,对照组和IBA处理组的PPO活性差异不显著。生根时期,IBA处理组PPO活性显著高于对照组。研究表明,PPO降低抑制生根辅助因子的产生,对于不定根的产生有不利影响(黄卓烈等,2002;曹帮华等,2008)。


表3 扦插生根过程中POD活性的变化 单位U/mg
3 结论与讨论
木瓜硬枝插穗经过IBA处理在扦插育苗过程中对植物的愈伤组织形成、不定根的发生以及缩短生根时间具有促进作用。在木瓜扦插的过程中,经IBA处理的插穗,POD活性与PPO的活性在不定根的发生时期显著提高;IBA处理的插穗内的IAAO的活性在扦插过程中保持较低水平。大量研究表明,在不定根形成时期,POD活性的提高是不定根形成的标志,生长素是对多种植物的愈伤组织的发生和不定根的形成具有关键性作用,但生长素并不是唯一的影响因素。也有研究认为IBA处理能够影响酶的活性及内源激素的成分,从而促进愈伤组织与生根基因的表达,形成不定根。
研究发现,在扦插过程中,要严格控制温度、湿度等条件,否则影响不定根的形成,对试验造成影响,在木瓜扦插过程中,各种酶得活性表现不一,存在差异,但表现出一定的变化规律,表明这些酶在植物扦插生根过程中不能单独存在和起作用,而是由各种酶之间的相互协调作用,共同影响植物不定根的产生与生长。
通过对绿宝石根系生长及酶活性的测定经过分析可知,500mg/L IBA浸泡插穗基部可以促进插穗不定根的形成,能够有效提高木瓜扦插生根率,但也有研究表明,不同浓度激素处理对植物影响不同,激素浓度过高或者过低都对插穗生根有一定的抑制作用。激素处理对于植物插穗扦插生根的最佳作用机制还有待作进一步研究,寻求最佳的技术条件,以促进该技术在林业领域更广泛的应用。
[1]张志翔.树木学[M].北京:中国林业出版社,2010.
[2]俞德浚等.中国植物志[M].北京:科技出版社,1974.
[3]陈丛梅.园林绿化树种嫩枝扦插试验[J].林业科技,2007,32(5):59-60.
[4]曹玉翠,曹帮华,贾波,等.木瓜硬枝扦插繁殖技术与生根关联酶活性研究[J].西南林学院学报,2008,(06):5-9.
[5]张志良,瞿伟菁,李小方.植物生理学实验指导[M].北京:高等教育出版社,2009.
[6]宋丽红,曹帮华.光叶楮扦插生根的吲哚乙酸氧化酶、多酚氧化酶、过氧化物酶活性变化研究[J].武汉植物学研究,2005,23(4):347-350.
[7]Wiesmann Z,RiovJ,Epstein E.1988.Comparison of movement and metabolism findole-3-acetic acid andi ndole-3-butyric acid in mungbean cuttings.PhysiolPlant,74:556-560.
[8]GebhardtK.1982.Activation of indole-3-acetic acid oxidase from horseradish and prunus by phenols and hydrogen peroxide(H2O2).PlantGrowth Regulation,1(2):73-84
[9]Syros T,Yupsanis T,Zafir iadisH,Economou AS.2004.Activity and isoforms of peroxidases,lign in and anatomy,during adventitious rooting in cuttings of Ebenus cretica L.J PlantPhysiol,161:69-77.
[10]GyanaR R.2006.Effect of auxins on adventitious root development from single nod cuttings of Camellia sinensis(L.)Kuntze and associated bio-chemical changes.Plant Biotechnology Division,48:111-117.
[11]Haissig B E.1974.Influences of auxins and auxin synergists on adventitious primordium in itiation and development.N Z J ForSci,4:311-323.
[12]扈红军,曹帮华,尹伟伦,等.不同处理对欧榛硬枝扦插生根的影响及生根过程中相关氧化酶活性的变化[J].林业科学,2007,(12):70-75.
[13]黄卓烈,李明,詹福建,谭绍满.不同生长素处理对桉树无性系插条氧化酶活性影响的比较研究 [J].林业科学,2002,(04):46-52.
[14]曹玉翠,曹帮华,贾波,等.木瓜硬枝扦插繁殖技术与生根关联酶活性研究[J].西南林学院学报,2008,(06):5-9.
