黑骨藤皂苷对特应性皮炎小鼠的治疗作用及对Th1型免疫反应的影响
2017-05-04鲍春梅孙广臣桂林医学院临床学院广西桂林54000桂林医学院药学院
鲍春梅,孙广臣(桂林医学院临床学院,广西桂林54000;桂林医学院药学院)
黑骨藤皂苷对特应性皮炎小鼠的治疗作用及对Th1型免疫反应的影响
鲍春梅1,孙广臣2
(1桂林医学院临床学院,广西桂林541000;2桂林医学院药学院)
目的 探讨黑骨藤皂苷对特应性皮炎(AD)小鼠的治疗作用及对Th1型免疫反应的影响。方法 30只BLAB/c雌性小鼠随机分为正常组8只,模型组10只,黑骨藤皂苷组12只。除正常组外,其余两组均需造模。将小鼠腹部体毛剃去,用1.5% 2,4-二硝基氯苯(DNCB)(丙酮∶橄榄油=4∶1)溶液100 μL涂在腹部剃毛处初次致敏,2周后在小鼠耳廓内外两侧相同位置涂1% DNCB溶液20 μL,1周重复刺激3次,连续2周,共造模30 d。从初次致敏起,黑骨藤皂苷组给予黑骨藤皂苷(0.002 g/d)灌胃,正常组和模型组分别给予等体积生理盐水灌胃,连续灌药30 d。从再次致敏当天(造模第14天)用游标卡尺测量每只小鼠两耳中部厚度,以后每次DNCB刺激前测量1次并记录,观察小鼠两耳外观肿胀情况。在末次耳部DNCB刺激12 h后取材,采用临床症状评分评价小鼠耳朵大体外观;切取耳部皮肤做病理切片,HE染色观察小鼠耳朵组织表皮厚度,甲苯胺蓝染色观察肥大细胞浸润情况;采用免疫组化法检测耳组织CD68蛋白的表达;采用ELISA法测定血清IgE、TNF-α、单核细胞趋化蛋白1(MCP-1)的表达。结果 与模型组比较,不同时间正常组与黑骨藤皂苷组左耳厚度均降低(P<0.05或<0.01)。正常组、模型组、黑骨藤皂苷组临床症状评分组间两两比较,P均<0.01。正常组、模型组、黑骨藤皂苷组耳部组织表皮厚度组间两两比较,P均<0.01;真皮层肥大细胞浸润数目组间两两比较,P均<0.01。与正常组比较,模型组组织CD68及血清TNF-α、IgE、MCP-1水平均升高;与模型组比较,黑骨藤皂苷组组织CD68蛋白及血清TNF-α、IgE、MCP-1水平均降低(P<0.05或<0.01)。结论 黑骨藤皂苷对AD小鼠有治疗作用,可抑制Th1型免疫反应。
特应性皮炎;黑骨藤皂苷;Th1型免疫反应;CD68;IgE;肿瘤坏死因子;小鼠
特应性皮炎(AD)是一种慢性反复发作伴瘙痒的炎症性皮肤病,全球有10%~20%儿童和1%~3%成人受其影响[1],病因与发病机制目前尚不清楚,可能与环境、免疫及基因等因素有关[2]。AD慢性期Th1细胞介导的免疫反应占优势[ 3],在慢性期,Th1细胞参与炎症反应,并产生肿瘤坏死因子(TNF-α),以介导细胞免疫为主,肥大细胞、巨噬细胞也可分泌TNF-α。临床上治疗AD主要集中在组胺受体拮抗剂和糖皮质激素的使用,但由于存在明显不良作用,使其临床应用受到限制。黑骨藤是贵州常用苗家草药,具舒筋活络、祛风除湿、止痛的功效,主治风湿麻木疼痛、跌打损伤、骨折及骨痛等[4]。黑骨藤中主要含有强心苷类、C21甾类、黄酮类和三萜皂苷类等成分,其中三萜皂苷类具有广泛的生物活性,如抗炎、抗肿瘤、抗菌和抗病毒以及降低胆固醇、降血糖、调节免疫等[5]。2016年6~7月,本试验用2,4-二硝基氯苯(DNCB)诱发小鼠特应性皮炎(AD)模型,探讨黑骨藤皂苷对特应性皮炎(AD)小鼠的治疗作用及对Th1型免疫反应的影响。
1 材料与方法
1.1 材料 动物:SPF级6~8周龄BLAB/c雌性小鼠30只,体质量约20 g,由桂林医学院实验动物中心提供。实验室温度(25±1)℃,相对湿度65%。试剂:黑骨藤购于广西玉林;DNCB、CD68购自abcam公司;鼠IgE ELISA Ready-SET-Go、鼠TNF-α ELISA Ready-SET-Go、鼠单核细胞趋化蛋白1(MCP-1) ELISA Ready-SET-Go均购自eBioscience公司。
1.2 黑骨藤皂苷提取物制备 120 g黑骨藤粉末用75%乙醇回流提2次,回收乙醇得浸膏,浸膏用适量乙醇溶解后依次用石油醚、正丁醇萃取,得到黑骨藤皂苷提取物6.7 g。
1.3 动物分组及AD模型的建立 30只BLAB/c雌性小鼠随机分为正常组8只、模型组10只、黑骨藤皂苷组12只,除正常组外,其余两组均需造模。参照文献[6]建立小鼠AD模型。将小鼠腹部体毛剃去,面积约2.5 cm×2.5 cm,实验当日用1.5% DNCB(丙酮∶橄榄油=4∶1)溶液100 μL涂在腹部剃毛处初次致敏,2周后再次致敏,在小鼠耳廓内外两侧相同位置涂1% DNCB溶液20 μL,1周重复刺激3次,连续2周,共造模30 d。成功造模小鼠可见耳部出现红斑、肿胀、渗出和结痂。从初次致敏起,给黑骨藤皂苷组小鼠灌中药黑骨藤皂苷(0.002 g/d),正常组和模型组小鼠分别给予等体积生理盐水灌胃,连续灌药30 d。在末次DNCB刺激12 h后,3组小鼠均眼球取血,并切取耳部皮肤做病理切片。
1.4 观察指标及其检测方法 ①小鼠耳朵肿胀程度:从再次致敏当天(干预第14天)用游标卡尺测量每只小鼠两耳中部厚度,以后每次DNCB刺激前(即造模第14、17、20、23、26、29、30天)测量1次并记录,观察小鼠两耳外观肿胀情况。②小鼠耳朵大体外观:采用临床症状评分评价。末次DNCB刺激12 h后取材,麻醉后对小鼠耳朵部位进行拍照。肉眼观察小鼠耳朵大体外观,分别将皮损红斑、水肿、抓痕、干燥程度分为正常(0分)、轻度(1分)、中度(2分)、重度(3分)[7]。依次为每只小鼠打分,将分数相加算其总和并计算每组平均值。③小鼠耳朵组织表皮厚度及肥大细胞浸润情况:末次DNCB刺激12 h后取小鼠左耳朵组织约1 cm×1 cm,于10%甲醛固定20 h,15%的EDTA脱钙2 d,石蜡包埋和病理切片(4 μm)。HE染色,每组任选10个高倍视野(×400)观察小鼠耳朵组织表皮厚度,通过Image J软件测量分析各组小鼠表皮厚度,算出平均值;甲苯胺蓝染色观察肥大细胞浸润情况,单盲法分别计算每组10个高倍视野(×400)真皮肥大细胞数,取其平均值。④小鼠耳组织CD68的表达:采用免疫组化法检测。石蜡切片脱蜡水化,3% H2O2消除内源性过氧化物酶活性,滴加5%血清封闭,依次滴加一抗、抗鼠二抗,然后滴加DBA显色,苏木素复染,脱水,透明,封片观察。通过Ipwin32软件分析各组小鼠棕黄色或棕褐色阳性细胞的平均光密度(A值),并算出每组平均值。⑤血清IgE、TNF-α及MCP-1水平:取小鼠眼球血1 mL,EDTA抗凝后3 000 r/min离心15 min。采用ELISA法测定血清中IgE、TNF-α、MCP-1的表达水平,实验具体步骤均按照试剂盒说明书进行操作。
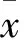
2 结果
2.1 3组不同时间左耳厚度比较 见表1。

表1 3组不同时间左耳厚度比较
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
2.2 3组左耳皮肤大体外观比较 成功建立小鼠AD模型及干预结束后,正常组小鼠耳部皮肤变化不明显,其他两组出现不同程度的红斑、水肿、抓痕、干燥等症状。用DNCB刺激小鼠耳朵造模第14天,模型组出现明显的红疹、水肿、抓痕及干燥症状,而黑骨藤皂苷组小鼠耳朵皮损较模型组有所减轻。正常组、模型组、黑骨藤皂苷组临床症状评分分别为(0.18±0.06)、(5.90±1.17)、(3.43±0.85)分。3组之间两两比较,P均<0.01。
2.3 3组耳部组织表皮厚度及真皮层肥大细胞浸润情况比较 正常组、模型组、黑骨藤皂苷组耳部组织表皮厚度分别为(1.09±0.18)、(7.94±3.05)、(3.32±0.80)mm,组间两两比较,P均<0.01;真皮层肥大细胞浸润数目分别为(7.40±1.65)、(29.20±4.02)、(13.00±1.94)个/400倍视野,组间两两比较,P均<0.01。
2.4 3组耳皮肤组织CD68蛋白及血清中IgE、TNF-α、MCP-1水平比较 CD68蛋白主要表达在胞质及部分胞核中,胞膜无特异性表达。各指标比较结果见表2。

表2 3组耳皮肤组织CD68蛋白及血清中IgE、TNF-α、MCP-1水平比较
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
3 讨论
目前关于AD动物模型的制备多采用小分子抗原反复刺激皮肤,其导致的慢性过敏性炎症反应类似人的AD[8]。DNCB作为一种常用的小分子抗原,其诱导的AD模型重复性较好。Choi等[6]应用1% DNCB和10 mg/mL DFE反复涂擦BLAB/c雌性小鼠耳部皮肤,成功建立了小鼠AD模型。本试验应用1% DNCB反复刺激BLAB/c雌性小鼠双耳内外两侧,小鼠耳部出现明显皮损样症状,组织病理湿疹样改变,皮损处组织CD68高表达,血清IgE、TNF-α、MCP-1水平升高,表明Th1优势型BLAB/c小鼠AD模型建立成功。
本研究结果显示,黑骨藤皂苷不仅减轻AD模型小鼠耳部肿胀程度及临床炎症症状,而且还抑制耳组织肥大细胞的浸润及表皮厚度的增加。人体皮肤组织中的肥大细胞在AD的发病机制中起着重要作用。在固有免疫和适应性免疫的炎性介质中,肥大细胞是惟一事先合成TNF-α的炎性细胞,当抗原刺激时可迅速分泌TNF-α,其数量与AD皮损程度呈正相关[9]。本研究发现黑骨藤皂苷可抑制AD模型小鼠病理组织中肥大细胞的浸润。
巨噬细胞分泌的炎症因子和趋化因子可促进血管增生、胶原合成以及纤维化[10]。在AD模型中,巨噬细胞在急性期与慢性期炎症皮肤中都高表达,CD68是巨噬细胞典型的表面标记物[11],巨噬细胞被激活后可产生TNF-α,参与Th1型细胞因子介导的Th1型免疫反应。该试验中模型组耳皮损组织CD68蛋白的表达水平明显高于正常组,黑骨藤皂苷组耳皮损组织CD68蛋白水平较模型组下降,提示黑骨藤皂苷可通过抑制巨噬细胞表面标记物CD68的表达,达到抗炎治疗作用。
IgE是AD的一个重要治疗靶点,作为肥大细胞的主要催化剂,可刺激肥大细胞释放细胞因子、趋化因子及组胺等生物活性物质[12]。 因此可以通过作用于IgE靶点来影响AD的结局。本研究结果显示,模型组血清IgE水平表达升高,黑骨藤皂苷组血清IgE水平下降,提示黑骨藤皂苷可以降低AD模型大鼠血清IgE水平。Ⅰ型细胞因子TNF-α作为一种重要的炎症前介质,可以诱导AD患者炎症反应中多种细胞因子的产生[13]。研究发现,TNF-α通过作用于IKK2介导炎症通路来加重AD模型炎症症状[14]。黑骨藤皂苷可能通过降低血清TNF-α水平,来减轻皮肤炎症因子的级联反应。T淋巴细胞介导的皮肤病角质细胞中可检测到MCP-1的高表达。MCP-1在单核细胞迁移到炎症部位中起重要作用,通过肥大细胞脱颗粒作用来调节Th1型免疫反应[15]。血清 MCP-1的水平与AD本身的病程变化和发展有关,可以辅助判断AD的病情严重程度。本研究结果显示,模型组血清MCP-1水平较正常组升高,黑骨藤皂苷组血清MCP-1水平比模型组降低,说明黑骨藤皂苷可以抑制AD模型大鼠血清MCP-1水平的表达。
总之,本研究结果表明黑骨藤皂苷对AD小鼠有较强的治疗作用,它的免疫调节机理目前尚不清楚,所以本试验尝试去鉴定黑骨藤皂苷与T淋巴细胞之间的关系,结果显示,其可能是通过抑制Th1型免疫作用来治疗AD,黑骨藤皂苷为临床AD的进一步治疗研究提供了新的理念。
[1] Leung DY, Boguniewicz M, Howell MD, et al. New insights into atopic dermatitis[J]. Clin Invest, 2004,113(5):651-657.
[2] Ricci G, Patriz IA, Bald IE, et al. Long-term follow-up of atopic dermatitis: retrospective analysis of related risk factors and association with concomitant allergic diseases[J]. J Am Acadermatol, 2006,55(5):765-771.
[3] Girolomoni G, Sebastani S, Albanesi C, et al. T-cell subpopulations in the development of atopic and contact allergy[J]. Curr Opin Immunol, 2001,13(6):733-737.
[4] 贵州省药品监督管理局.贵州省中药材,民族药材质量标准[M].贵阳:贵州科技出版社,2003:381.
[5] 申海艳,龚小见,李文敏,等.苗药黑骨藤中总皂苷含量的测定[J].中国实验方剂学杂志,2012,18(11):94-97.
[6] Choi EJ, Lee SH, wang JS, et al. DA-9601 suppresses 2, 4-dinitrochlorobenzene and dust mite extract-induced atopic dermatitis-like skin lesions[J]. Int Immunopharmacol, 2011,11(9):1260-1264.
[7] Matsuoka H, Maki N, Yoshida S, et al. A mouse model of the atopic eczema/dermatitis syndrome by repeated application of a crude extract of house-dust mite Dermatophagoides farinae[J]. Allergy, 2003,58(2):139-145.
[8] Matsumoto K, Mizukoshi K, Oyobikawa M, et al. Establishment of an atopic dermatitis-like skin model in a hairless mouse by repeated elicitation of contact hypersensitivity that enables to conduct functional analyses of the stratum corneum with various non-invasive biophysical instruments[J]. Skin Res Technol, 2004,10(2):122-129.
[9] Ohmori K, Minamide K, Goto S, et al. Time-of-day-dependent variations of scratching behavior and transepidermal water loss in mice that developed atopic dermatitis[J]. J Vet Med Sci, 2014,76(11):1501-1504.
[10] Mirza R, DiPietro LA, Koh TJ. Selective and specific macrophage ablation is detrimental to wound healing in mice[J]. Am J Pathol, 2009,175(6):2454-2462.
[11] Kiekens RC, Thepen T, Oosting AJ, et al. Heterogeneity within tissue-specific macrophage and dendritic cell populations during cutaneous inflammation in atopic dermatitis[J]. Br J Dermatol, 2001,145(6):957-965.
[12] Weston S, Halbert A, Richmond P, et al. Effects of probiotics on atopic dermatitis: a randomised controlled trial[J]. Arch Dis Child, 2005,90(9):892-897.
[13] Behniafard N, Gharagozlou M, Farhadi E, et al. TNF-alpha single nucleotide polymorphisms in atopic dermatitis[J]. Eur Cytokine Netw, 2012,23(4):163-165.
[14] Pasparakis M, Courtois G, Hafne M, et al. TNF-mediated inflammatory skin disease in mice with epidermis-specific deletion of IKK2[J]. Nature, 2002,417(6891):861-866.
[15] Matsukawa A, Lukacs NW, Standiford TJ, et al. Adenoviral-mediated overexpression ofmonocyte chemoattractant protein-1 differentially alters the development of Th1 and Th2 type responses in vivo[J]. J Immunol, 2000,164(4):1699-1704.
Therapeutic effect of Periploca forrestii saponin on atopic dermatitis in mice and its influence on Th1 type immune response
BAOChunmei1,SUNGuangchen
(1ClinicalCollegeofGuilinMedicalUniversity,Guilin541000,China)
Objective To investigate the therapeutic effect of Periploca forrestii saponin (PFS) on atopic dermatitis (AD) in mice and its influence on Th1 type immune response. Methods Thirty female BLAB/c mice were randomly divided into the normal group (n=8), model group (n=10), and PFS group (n=12). In addition to the normal group, mice in the other two groups were modeled. The mouse abdomen body was shaved and coated with 1.5% 2,4-dinitrochlorobenzene (DNCB) (acetone∶olive oil=4∶1) solution 100 μL for the initial sensitization at the abdominal shaving, after 2 weeks, 20 μL of 1% DNCB solution was applied at the same position on both sides of the mouse auricle, we repeated stimulation 3 times in 1 week, and for 2 weeks, a total of 30 d. From the the initial immunization, the PFS group was given PFS (0.002 g/d), and the normal group and the model group were given equal volume of normal saline for 30 days. The thickness of the middle ears of each mouse was measured with a vernier caliper on the day of re-sensitization (day 14), and the mice were observed and recorded every time before the DNCB was stimulated to observe the swelling of the ears of the mice. At 12 h after last ear DNCB stimulation, the appearance of mouse ears was evaluated by clinical symptom score. The epidermis thickness of the ear tissues was observed by HE staining, and the infiltration of mast cells was observed by toluidine blue staining. The expression of CD68 protein was detected by immunohistochemistry. The levels of IgE, TNF-α and MCP-1 in serum were measured by ELISA. Results Compared with the model group, the thickness of the left ear of the normal group and the PFS group decreased,P<0.05 orP<0.01. Significant differences were found in the clinical evaluations, ear skin tissue thickness and dermal layer mast cell infiltration number between the normal group, model group and PFS group, allP<0.01. Compared with the normal group, CD68 protein, serum TNF-α, IgE and MCP-1 increased in the model group. Compared with the model group, CD68 and serum TNF-α, IgE and MCP-1 decreased in the PFS group (P<0.05 orP<0.01). Conclusion PFS has a therapeutic effect on AD in mice, and it can inhibit the Th1 immune response.
atopic dermatitis; Periploca forrestii saponin (PFS); Th1-type immune response; CD68; IgE; tumor necrosis factor; mice
国家自然科学基金资助项目(81460474;81260462)。
鲍春梅(1987-),女,硕士研究生,主要研究方向为免疫药理。E-mail:1099548403@qq.com
孙广臣(1967-),男,博士,主要研究方向为免疫药理。E-mail:sungc2004@aliyun.com
10.3969/j.issn.1002-266X.2017.13.009
R758.2
A
1002-266X(2017)13-0032-04
2016-12-14)
