升降散对脓毒症大鼠心肌p38MAPK蛋白磷酸化水平的影响
2017-05-02钱风华丁纯蕾
赵 雷, 钱风华, 丁纯蕾, 王 进, 郭 健
上海中医药大学附属岳阳中西医结合医院急诊科,上海 200437
·论 著·
升降散对脓毒症大鼠心肌p38MAPK蛋白磷酸化水平的影响
赵 雷, 钱风华, 丁纯蕾, 王 进, 郭 健*
上海中医药大学附属岳阳中西医结合医院急诊科,上海 200437
目的: 探讨升降散保护脓毒症心肌损伤的分子机制。方法: 将雄性成年SD大鼠随机分为正常组、模型组、升降散组和p38抑制组。采用盲肠结扎穿孔术(CLP)制备脓毒症大鼠模型,造模后4、8、12、24 h进行观察。升降散组和p38抑制组大鼠分别于造模前2 h给予升降散灌胃和SB203580皮下注射。留取腹主动脉血标本和心脏组织作相关检测。观察和检测各时间点大鼠死亡率、血清心肌肌钙蛋白I(cTnI)、 B型利钠肽(BNP)、白介素-6(IL-6)水平以及心肌p-p38MAPK蛋白、p-p38MAPKmRNA、IL-6 mRNA的表达。结果: 模型组大鼠24 h死亡率25%,升降散组、p38抑制组大鼠死亡率均为15%,组间差异无统计学意义。模型组大鼠血清cTnI、BNP升高;升降散组cTnI造模后8、12、24 h较模型组改善(P<0.001),BNP造模后4、12、24 h较模型组改善(P<0.05)。升降散组和p38抑制组cTnI、BNP造模后各时间点差异无统计学意义。模型组大鼠血清IL-6升高,升降散组各时间点IL-6改善(P<0.001)。模型组大鼠心肌各时间点p-p38MAPK蛋白水平升高,升降散组各时间点p-p38MAPK蛋白水平均改善(P<0.05)。模型组大鼠心肌p-p38MAPKmRNA表达升高,升降散组p-p38MAPKmRNA在8、12、24 h改善(P<0.05)。模型组大鼠心肌IL-6 mRNA升高,升降散组和p38抑制组造模后4、8、12 h均改善(P<0.05),升降散组IL-6 mRNA造模后12 h下降优于p38抑制组(P<0.05)。结论: 升降散可有效降低脓毒症早期大鼠血清cTnI和BNP。升降散改善脓毒症心肌损伤可能与其下调脓毒症早期大鼠心肌p-p38MAPK蛋白水平,降低p-p38MAPKmRNA、IL-6 mRNA表达,从而抑制过度炎症反应有关。
脓毒症;心肌损伤;升降散;p38MAPK;炎症因子
脓毒症心肌损伤的发生机制复杂,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)和一氧化氮等心肌抑制性因子均参与其发生发展[1]。其中,过度炎症反应和炎症因子释放是早期脓毒症心肌损伤发病的重要机制。近年来,随着对细胞分子机制的深入研究,我们发现细胞受病原微生物刺激后,通过细胞内信号转导途径释放炎症因子或凋亡等,但其具体过程仍不清楚。因此,不断深入探寻脓毒症心肌损伤的分子机制,寻找能够早期药物阻断的靶点,避免病情急剧恶化成为研究热点。
中药升降散对脓毒症具有良好的疗效。前期研究[2-3]表明,脓毒症患者采用升降散结合西医常规治疗能有效改善患者发热、心悸等症状,降低血清肌钙蛋白I(cardiac troponin I,cTnI)等指标。研究[4]发现,升降散降低脓毒症大鼠血清中的炎症因子,具有脏器保护作用。而这些心肌抑制性炎症因子均为p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38MAPK)信号通路的相关因子。本研究通过进一步探讨升降散对脓毒症早期p38MAPK磷酸化及p-p38MAPKmRNA 、IL-6 mRNA的干预作用,初步揭示升降散改善早期脓毒症心肌损伤的分子机制,为中医药治疗脓毒症心肌损伤提供依据。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级远交群(SD)雄性成年大鼠104只,体质量180~220 g,由上海西普尔-必凯实验动物有限公司提供,许可证号:SCXK(沪)2013-0016。大鼠标准饲料喂养,自由摄食饮水,标准饲养条件下适应1周后活动正常者纳入本次实验。
1.2 主要试剂及仪器 大鼠IL-6、cTnI、BNP ELISA检测试剂盒购自武汉基因美生物科技有限公司。 p-p38MAPK抗体、GAPDH(CST)、p38MAPK抑制剂SB203580购自上海远慕生物科技有限公司。羊抗兔HRP标记二抗、驴抗山羊HRP标记二抗、羊抗鼠HRP标记二抗购自碧云天生物技术研究所。酶标仪(型号:MK3)、洗板机购自芬兰Labsystems 公司。
1.3 方 法
1.3.1 分组及造模 将SD大鼠按随机数字表法随机分为4组:正常组8只、模型组32只、升降散组32只、p38抑制组32只。正常组不予手术处理,模型组、升降散组、p38抑制组大鼠均采用盲肠结扎穿孔术(CLP)建立脓毒症大鼠模型。模型组、升降散组、p38抑制组于造模后4、8、12、24 h处死大鼠,每个时间点各8只,采集标本。
1.3.2 给 药 升降散组于造模前2 h分别给予升降散干膏粉2.5 g/kg(浓度为24 g/100 mL,每只大鼠灌胃量10.4 mL/kg)灌胃。正常组和模型组给予等量0.9%氯化钠液灌胃。p38抑制组于造模前2 h给予p38MAPK抑制剂(SB203580)2 mg/kg 腹腔皮下注射。
升降散干膏粉(僵蚕6 g、蝉蜕6 g、姜黄3 g、大黄12 g)由上海中医药大学附属岳阳中西医结合医院制剂室配制。
1.3.3 大鼠血清样本采集及相关指标测定 各组大鼠于造模后各时间节点处死大鼠,经腹主动脉采血8~10 mL,分离血清,ELISA法检测大鼠血清cTnI、BNP、IL-6水平。
1.3.4 大鼠心肌组织取样及p-p38MAPK相关因子的检测 大鼠处死后迅速分离左心室心肌并清洗,立即制备心肌匀浆。Western印迹法检测大鼠心肌p-p38MAPK;Real-Time PCR法检测p-p38MAPKmRNA、IL-6 mRNA。
p-p38MAPKmRNA扩增引物序列:Primer F 5′-TTC CCA GCA GTC CTA TCC-3′,Primer R 5′-CAG ATG GCA AGG GTT CAG-3′;IL-6 mRNA扩增引物序列:Primer F 5′-CAC CAG GAA CGA AAG TCA AC-3′,Primer R 5′-CAG TGG CTG TCA ACA ACA TC-3′。

2 结 果
2.1 一般情况 大鼠CLP造模前自由进食水,活动如常,皮毛有光泽,大便成形。模型组大鼠造模后出现活动减少、蜷缩、竖毛、进食水减少、皮毛枯燥、精神萎靡等表现。升降散组和p38抑制组大鼠活动、蜷缩、竖毛和进食水情况较模型组改善。
2.2 死亡率 模型组大鼠24 h死亡率25%,符合CLP造模标准。升降散组和p38抑制组大鼠24 h死亡率均较模型组低,均为13%,但3组差异无统计学意义。3组大鼠其他时间点均无死亡。
2.3 脓毒症心肌损伤模型评价 与正常组大鼠比较,模型组大鼠CLP造模后4、8、12、24 h光镜下见心肌细胞排列疏松、心肌细胞变性、肌浆浓缩、间质水肿(图1)。
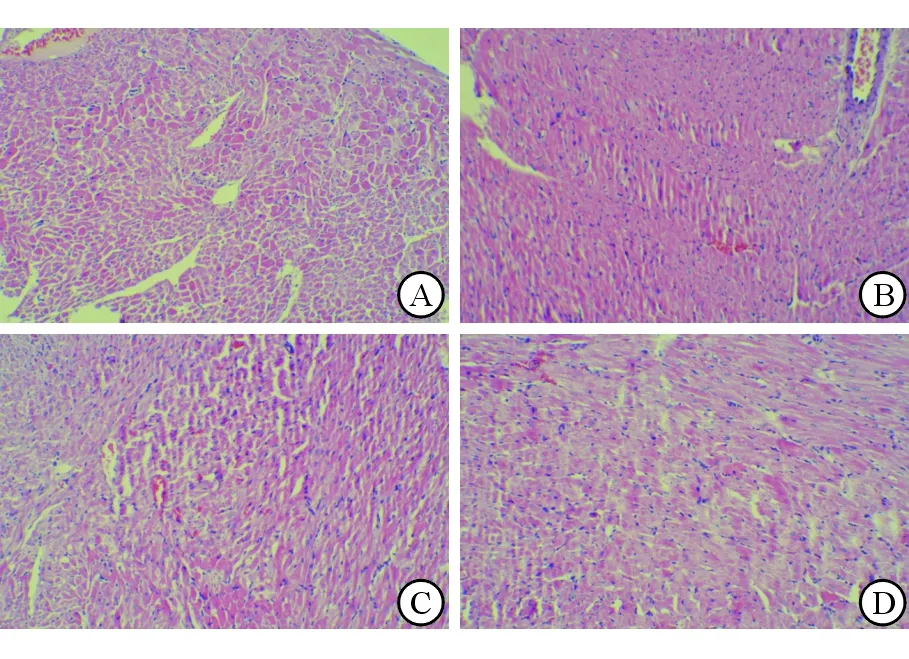
图1 模型组大鼠造模后各时间点心肌组织H-E染色结果
A: 造模后4 h; B: 造模后8 h; C: 造模后12 h; D: 造模后24 h.Original magnification: ×100
2.4 血清cTnI和BNP变化
2.4.1 血清cTnI变化 模型组大鼠血清cTnI造模后逐渐升高,24 h达高峰。模型组与正常组造模后各时间点cTnI差异均有统计学意义(P<0.001)。与模型组相比,升降散组cTnI造模后8、12、24 h下降(P<0.001),p38抑制组cTnI造模后各时间点均下降(P=0.024、P<0.001、P<0.001、P<0.001)。升降散组与p38抑制组造模后各时间点cTnI差异均无统计学意义(P=0.203、P=0.527、P=0.558、P=0.663,图2)。
2.4.2 血清BNP变化 模型组大鼠血清BNP造模后逐渐升高,24 h达高峰。模型组与正常组BNP造模后各时间点差异均有统计学意义(P<0.001)。与模型组比较,升降散组大鼠BNP造模后4、12、24 h改善(P<0.001),p38抑制组大鼠BNP造模后4、12、24 h改善(P=0.03、P=0.009、P<0.001)。升降散组与p38抑制组BNP各时间点差异均无统计学意义(P=0.166、P=0.664、P=0.187、P=0.617,图3)。
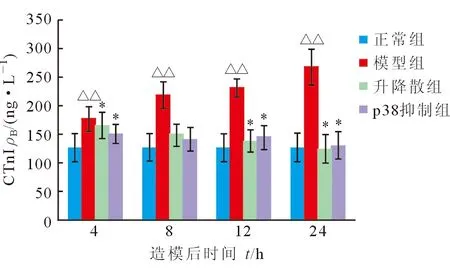
图2 各组大鼠cTnI浓度的变化
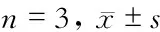
图3 各组大鼠BNP浓度的变化
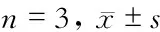
2.5 血清IL-6变化 模型组大鼠IL-6造模后迅速升高,12 h达高峰,24 h略有下降。模型组与正常组造模后各时间点差异均有统计学意义(P<0.001)。升降散组和p38抑制组IL-6造模后各时间点均较模型组明显改善(P<0.001)。升降散组和p38抑制组造模后各时间点差异均无统计学意义(P=0.737、P=0.213、P=0.090、P=0.596,图4)。
2.6 心肌p-p38MAPK蛋白及mRNA表达变化 模型组大鼠p-p38MAPK蛋白表达造模后逐渐升高,24 h达峰值;升降散组p-p38MAPK蛋白造模后各时间点均较模型组下降(P=0.004、P=0.001、P<0.001、P<0.001,图5、图6)。模型组大鼠心肌p-p38MAPKmRNA表达造模后逐渐升高,24 h达到峰值。升降散组p-p38MAPKmRNA造模后8、12、24 h较模型组下降(P<0.001,图7)。
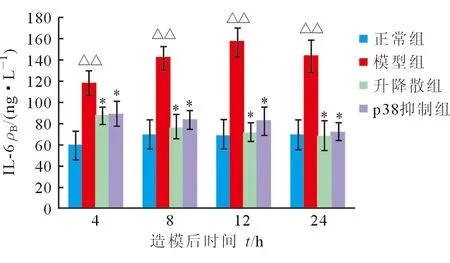
图4 各组大鼠IL-6变化
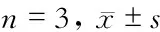
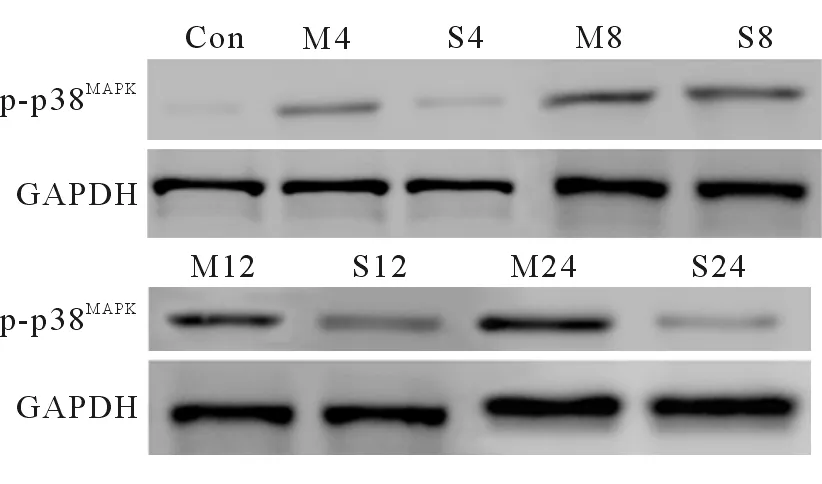
图5 大鼠造模后各时间点p-p38MAPK的表达变化
Con:正常组;M4:模型组4 h;S4:升降散组4 h; M8:模型组8 h;S8:升降散组8 h ;M12:模型组12 h;S12:升降散组12 h; M24:模型组24 h;S24:升降散组24 h
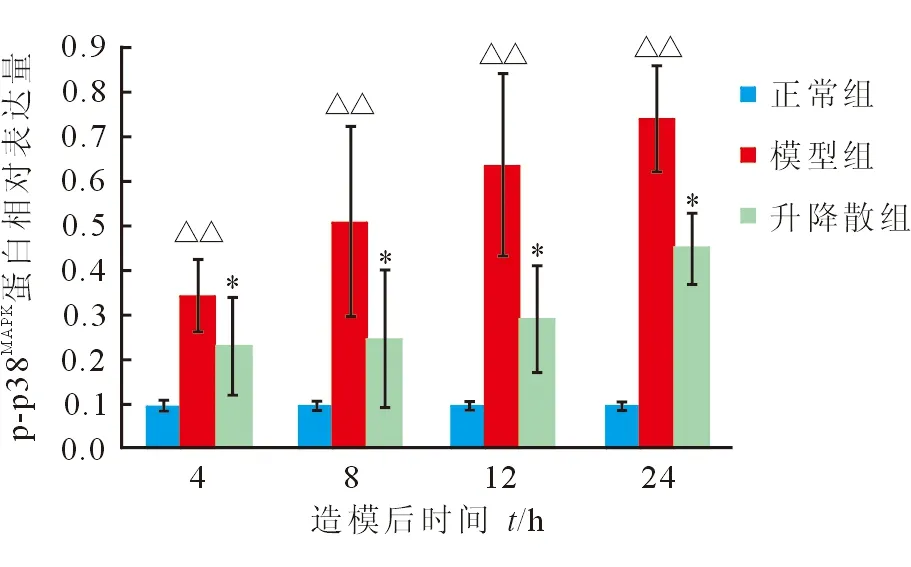
图6 各组大鼠p-p38MAPK/GAPDH变化
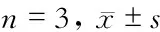
2.7 心肌IL-6 mRNA表达变化 模型组大鼠心肌IL-6 mRNA造模后表达迅速升高,8 h达峰值,12 h持续。模型组与正常组大鼠心肌IL-6 mRNA造模后各时间点差异有统计学意义(P<0.001)。与模型组相比,升降散组IL-6 mRNA造模后4、8、12 h表达均下降(P=0.036、P<0.001、P<0.001),p38抑制组IL-6 mRNA造模后8、12 h下降(P<0.001)。升降散组IL-6 mRNA造模后4、8、24 h与p38抑制组差异无统计学意义(P=0.192、P=0.696、P=0.987);造模后12 h,升降散组IL-6 mRNA下降优于p38抑制组(P=0.003)且降至正常组水平(P=0.071,图8)。
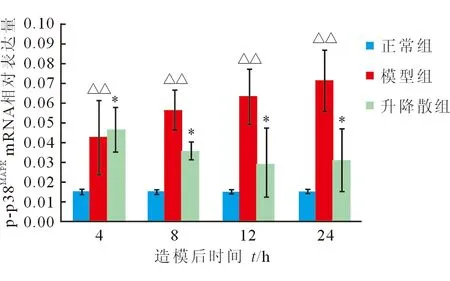
图7 各组大鼠p38MAPK mRNA表达的变化
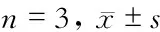
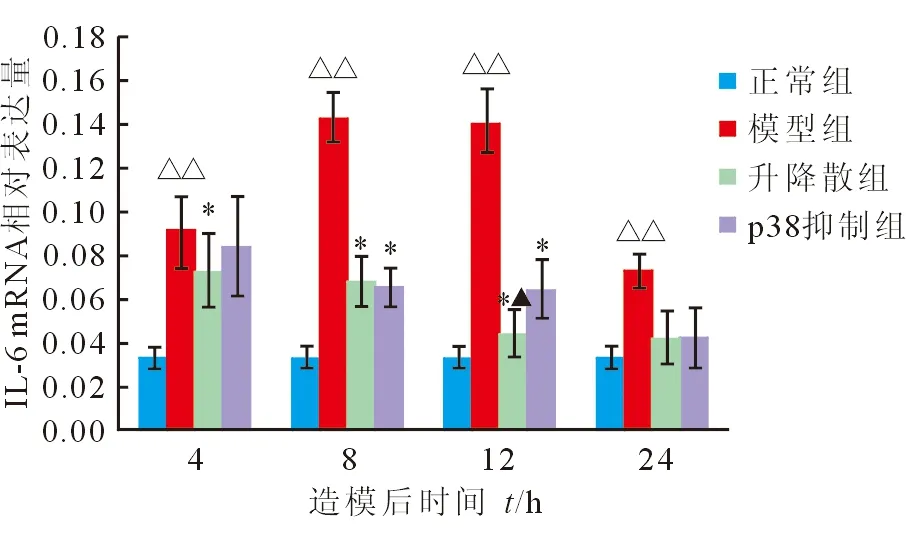
图8 各组大鼠IL-6 mRNA/GAPDH变化
3 讨 论
脓毒症心肌损伤发生机制复杂,炎症因子、线粒体功能障碍、细胞内钙离子超载和细胞凋亡等均参与其发生发展。不断深入探寻其发病机制,寻找早期药物阻断靶点,避免病情恶化成为该领域研究的热点。
脓毒症发病早期,在病原微生物、内毒素等刺激下,单核-巨噬细胞和心肌细胞通过细胞内信号转导途径释放大量炎症因子(如IL-6)等心肌抑制性因子,形成瀑布效应,造成心肌损伤、心肌收缩和(或)舒张功能障碍。循环和心肌组织中的心肌抑制性因子在早期脓毒症心肌损伤中起关键作用,可持续数小时至数天,造成心肌功能可逆性下降,随着抑制性因子下降,心功能可恢复正常[5]。
IL-6既有促炎作用又有抗炎作用,是一种备受关注的双向调节细胞因子。IL-6对脓毒症心肌损伤的作用机制包括:抑制粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factors, GM-CSF)、干扰素γ(interferon-γ, INF-γ)、巨噬细胞炎性蛋白2(macrophage inflammatory protein-2, MIP-2)等;促进释放TNF-α受体、可溶性合成IL-6受体拮抗物;诱导糖皮质激素合成;调节成纤维细胞增殖。研究[6]显示,IL-6可使心肌收缩力减弱,而清除体内或试管培养上清液中的IL-6后可消除和逆转心肌损伤。烧伤脓毒症大鼠模型中,IL-6可促进心肌炎症反应,导致心肌收缩功能障碍[7]。
通过CLP建立的持续性化脓性腹膜炎的感染灶模型的免疫特征、血流动力学变化和生化反应与脓毒症患者类似,宿主反应更为持久,炎症因子升高幅度相对平缓且作用持续时间长,更符合脓毒症发病特点,因此得到广泛使用[8]。本研究采用CLP建立多种细菌感染的脓毒症大鼠模型,模型组大鼠24 h死亡率为25%,血清IL-6上升幅度与以往研究相似[9]。模型组大鼠心肌组织病理检查示,心肌细胞排列疏松、心肌细胞变性、肌浆浓缩、间质水肿,同时血清cTnI、BNP明显升高,与既往研究结果[4]一致,说明该模型可用于脓毒症心肌损伤的实验研究。
丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)是一组丝氨酸/苏氨酸激酶,以级联方式依次被活化后,从胞质移至细胞核,调节转录因子活性,将信号传递入核,参与细胞分化、增殖和死亡。p38MAPK是MAPK家族成员,参与了炎症因子产生、心肌细胞凋亡等病理生理过程,是脓毒症心肌损伤发病机制中的共同信号通路和交汇点[10]。p38MAPK活化反应链包括:细胞刺激因素,如病原微生物产物、内皮素-1(endothelin-1,ET-1)、细胞因子,与受体特异性结合后,通过磷酸化MAPK激酶激酶(MAPKKK),促进MAPK激酶(MAPKK)基因表达,并使其蛋白磷酸化,诱导p38MAPK基因转录,p38MAPK进一步被磷酸化后(p-p38MAPK)从胞质内移位入细胞核,进而直接促进多种转录因子的表达,如促凋亡的激活转录因子2(activating transcription factors-2,ATF-2)、核转录因子κB(nuclear transcription factor-κB,NF-κB)、激活子蛋白-1(activator protein 1,AP-1)和热休克转录因子(heat shock transcription factor,HSF)等。此外,p38MAPK也可通过激活一些下游的丝氨酸/苏氨酸蛋白激酶来间接激活转录因子。因此,p38MAPK是脓毒症心肌损伤重要的信号分子,可影响多种炎症相关基因的表达。早期脓毒症心肌损伤时,心肌p-p38MAPK和其下游相关因子TNF-α、IL-6、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)在疾病发生、发展过程中的变化规律需要进一步深入研究和阐明。
SB203580是p38MAPK特异性抑制剂,通过竞争结合p38MAPK的ATP结合位点发挥抑制作用。既往研究[11]发现,SB203580对脓毒症大鼠有心脏保护作用。本实验目的是研究脓毒症发病早期心肌损伤的分子机制以及中药升降散的干预作用,故选择CLP造模后4、8、12、24 h进行评估和观察点。cTnI是诊断心肌损伤的“金标准”,能特异和敏感地反映心肌损伤。BNP可作为评价脓毒症心功能障碍及预测脓毒症预后的可靠指标。实验结果显示,升降散组与p38抑制组造模后早期cTnI和BNP水平均降低,且两组造模后早期血清IL-6水平及心肌IL-6 mRNA表达均降低。上述指标24 h均降至正常,提示升降散可减少炎症因子对心脏的损伤,抑制脓毒症早期过度炎症反应,对脓毒症大鼠早期心肌损伤发挥保护和干预作用。实验结果还显示,脓毒症早期大鼠心肌p-p38MAPK水平和p-p38MAPKmRNA表达逐渐升高,24 h达峰值。升降散组造模后各时间点心肌p-p38MAPK降低,造模后8、12、24 h心肌p-p38MAPKmRNA表达,提示升降散对p38MAPK信号通路有抑制作用,通过抑制心肌p38MAPK磷酸化和p-p38MAPKmRNA水平,减少IL-6 mRNA表达,从而调控炎症反应。另外,升降散组血清IL-6和心肌IL-6 mRNA改善较p38抑制组更迅速,12 h即恢复正常,提示除作用于p38MAPK通路外,可能还影响其他潜在靶点。
综上所述,本研究发现升降散可有效降低脓毒症早期大鼠血清cTnI、BNP,其分子机制可能为下调脓毒症早期大鼠心肌p38MAPK磷酸化水平及降低p-p38MAPKmRNA、IL-6 mRNA表达。此外,本研究以脓毒症心肌损伤早期大鼠为模型,而脓毒症心肌损伤中后期的相关研究还有待进一步进行。
[ 1 ] RUDIGER A, SINGER M.Mechanisms of sepsis-induced cardiac dysfunction[J].Crit Care Med, 2007, 35(6): 1599-1608.
[ 2 ] 周雄根, 朱 亮, 钱风华, 等.升降散对脓毒症瘀毒内阻证患者心肌肌钙蛋白I及一氧化氮的影响[J].中国临床医学, 2011, 18(3): 287-289.
[ 3 ] 钱义明, 朱 亮, 高 斌, 等.升降散对全身炎症反应综合征患者血清IL-2、IL-4、IL-6干预的影响[J].中外医疗, 2008, 27(10): 34-35.
[ 4 ] 朱 亮, 赵 雷, 钱风华, 等.升降散对脓毒症小鼠细胞炎症因子抑制作用的研究[J].中国中医急症, 2015, 24(3): 384-386,460.
[ 5 ] 胡才宝, 严 静, 李 莉, 等.脓毒症大鼠不同时期炎症因子水平与心功能关系的研究[J].中华危重症医学杂志(电子版), 2014, 7(3): 166-171.
[ 6 ] PATHAN N, FRANKLIN J L, ELEFTHEROHORINOU H, et al.Myocardial depressant effects of interleukin 6 in meningococcal sepsis are regulated by p38 mitogen-activated protein kinase[J].Crit Care Med, 2011, 39(7): 1692-1711.
[ 7 ] 帅 帅,曾其毅.脓毒症心功能障碍的研究进展[J].中国小儿急救医学,2010,17(2):169-171.
[ 8 ] 徐 盈, 苏 洁, 钟 玲, 等.脓毒症大鼠肿瘤坏死因子-α、内皮素-1、核因子κB表达与心肌损伤及药物影响的研究[J].昆明医科大学学报, 2013, (2): 27-31.
[ 9 ] 张文伟, 魏 威, 曹 红, 等.肿瘤坏死因子-α在脓毒症大鼠心肌损害中的表达及作用机制[J].中国老年学杂志, 2014, 34(13): 3682-3684.
[10] YANG M, WU J, MARTIN C M, et al.Important role of p38 MAP kinase/NF-kappaB signaling pathway in the sepsis-induced conversion of cardiac myocytes to a proinflammatory phenotype[J].Am J Physiol Heart Circ Physiol, 2008, 294(2): H994-1001.
[11] SU J, CUI X, LI Y, et al.SB203580, a p38 inhibitor, improved cardiac function but worsened lung injury and survival during Escherichia coli pneumonia in mice[J].J Trauma, 2010, 68(6): 1317-1327.
[本文编辑] 姬静芳
Molecular mechanism of the protective effect of theShengjiangsanon myocardial injury induced by sepsis
ZHAO Lei, QIAN Feng-hua, DING Chun-lei, WANG Jin, GUO Jian*
Department of Emergency, Yueyang Hospital of Integrated Traditional Chinese and Western Medicine, Shanghai 200437, China
Objective: To study the molecular mechanism of myocardial injury induced by traditional Chinese medicineShengjiangsan.Methods: Male adult SD rats were randomly divided into normal group, model group,Shengjiangsangroup and the p38 inhibitor group.By cecal ligation and puncture (CLP) of rat model of sepsis, the rat were observed at 4,8,12, and 24 h after operation.Shengjiangsangroup and p38 inhibited rats respectively filled the stomach and subcutaneous injected the SB203580 in preoperative 2 h before givingShengjiangsan.Blood samples from abdominal aortic were collected and heart tissue were detected.Observation and detection of each time node: mortality rate of rats, serum cTnI, BNP, IL-6 levels, myocardial p-p38MAPKprotein, p-p38MAPKmRNA, IL-6 mRNA expression.Results: Model group has the 25% of mortality rates, while theShengjiangsangroup and the p38 inhibitor group both were 15%, which had no statistical significance.The cTnI and BNP were increased in model group, while the cTnI of 8 h, 12 h and 24 h inShengjiangsangroup were both improved (P<0.001), and the BNP of 4 h,12 h, and 24 h were all improved after BNP(P<0.05), but the difference betweenShengjiangsangroup and the p38 inhibitor group has no statistical significance in every time node.The IL-6 level in the model group has been higher and while in theShengjiangsangroup it has been decreased in every time node (P<0.001).The p-p38MARKprotein level in model group grows higher, while the p-p38MARKprotein level in every time node ofShengjiangsangroup has improved(P<0.05).The expression of p-p38MARKmRNA has all improved in the 8 h,12 h, and 24 h ofShengjiangsangroup (P<0.05).The cardiac muscle Il-6 mRNA has improved in model group, whileShengjiangsangroup and p38 inhibitor group of 4 h, 8 h, and 12 h has both improved (P<0.05), and the IL-6 mRNA become lower in the 12 h ofShengjiangsangroup then of the p38 inhibitor group (P<0.05).Conclusions:Shengjiangsancan effectively reduce serum cTnI and BNP of the early sepsis rat.The molecular mechanism of thatShengjiangsanimproved myocardial injury in sepsis may be related to the regulation of sepsis early rat by reduction of the myocardial p-p38MAPKprotein level and the expression of p-p38MAPKmRNA and IL-6 mRNA, and also related to the inhibition the excessive inflammatory reaction.
sepsis; myocardial injury;Shengjiangsan; p38MAPK; inflammatory factors
2016-04-26 [接受日期] 2016-11-22
国家自然科学基金青年基金(81303101),上海市卫生和计划生育委员会项目(201440399).Supported by National Natural Science Youth Foundation of China (81303101), and Shanghai Municipal Commission of Health and Family Planning Project(201440399).
赵 雷, 副主任医师.E-mail: dr_zhaolei@aliyun.com
*通信作者(Corresponding author).Tel: 021-65161782, E-mail: smileqian1975@qq.com
10.12025/j.issn.1008-6358.2017.20160524
R 631
A
