手性荧光传感器的研究进展
2017-04-27路振宇张润坤李攻科
路振宇,张润坤,李攻科
(中山大学 化学与化学工程学院,广东 广州 510275)
综 述
手性荧光传感器的研究进展
路振宇,张润坤*,李攻科*
(中山大学 化学与化学工程学院,广东 广州 510275)
随着手性化合物在制药、不对称合成、生物科学及临床医学等领域应用的增长,迫切需要发展一种快速、灵敏的对映异构体检测技术。手性荧光传感器引起了人们的高度关注。近年来,发展了很多手性荧光传感器并对手性化合物表现出较高的选择性和灵敏度。该文综述了以1,1′-联-2-萘酚衍生物、杯芳烃衍生物、高分子聚合物、纳米材料、金属有机多孔材料为骨架的手性荧光传感器,总结了其在手性化合物识别中的应用,并展望了手性荧光传感器的发展方向。
手性化合物;对映体识别;荧光传感器;研究进展
“手性”一词来源于希腊语,它相当于人左手与右手的关系,彼此互为镜像但又不能重叠。自然界中手性化合物普遍存在,如构成人体基本组成的氨基酸、多肽、蛋白质等均具有手性。手性化合物在药物[1]、材料、食品添加剂、催化剂[2-3]等领域也占有很大的比重。特别是手性药物,越来越引起人们的重视,在所有的合成药物中外消旋体药物占比可达40%。但是,外消旋体药物往往一种具有药效,其对映体没有药效或者具有相反的药效[4-5]。例如,氯霉素消旋体是一种广谱抗菌药,用于治疗伤寒、肺炎、败血症等。但在氯霉素外消旋体中,只有左旋异构体具有杀菌作用,而右旋异构体完全无药效。具有镇定安眠作用的反应停药物,其右旋异构体是起镇定作用的有效成分,而左旋异构体对婴儿有致畸作用。因此,发展对手性化合物构型的识别技术成了近年来备受关注的研究领域。
已有许多分析技术用于手性化合物的识别,如液相色谱法(HPLC)[6-10]、气相色谱法(GC)[11-13]、毛细管电泳法(CE)[14]、超临界流体色谱法(SFC)[15]等。然而这些方法的仪器价格昂贵、耗时、样品损失较大。因此,发展快速简便、灵敏准确、选择性好的荧光识别方法越来越受到人们的重视。在手性荧光传感器的研究中,最主要的工作集中于设计合成具有选择性识别和传感性能的主体化合物,使其能与不同构型的客体分子作用产生荧光信号从而对手性化合物进行识别[16-20],如荧光增强、荧光猝灭和波长的变化等。目前,国内有关手性荧光传感器的综述性文章不多。成义祥等[21]、王超杰等[22]分别综述了以1,1′-联-2-萘酚及其衍生物构建的手性荧光传感器。近年来,更多新型的手性荧光传感器被开发出来,如基于高分子材料的荧光传感器,基于手性金属有机骨架的荧光传感器等。本文综述了近年来不同类型手性荧光传感器的研究进展,包括基于1,1′-联-2-萘酚衍生物、杯芳烃衍生物、高分子聚合物、纳米量子点以及金属有机多孔材料的荧光传感器。
1 基于1,1′-联-2-萘酚衍生物的手性荧光传感器
具有光学活性的1,1′-联-2-萘酚衍生物结构中含有特殊的C2手性轴,同时因具有结构稳定、有较高的发射效率和易于选择性功能化修饰等优点成为研究较多的化合物[23-25]。手性胺、氨基醇、氨基酸等化合物的手性识别在生物、医学、药物等方面具有重要意义,是研究较多的客体分子。手性化合物与此类传感器的识别位点作用,引起光诱导电子转移(PET) 及电子交换能量转移(EET) 等分子内能级的变化,使主客体间的相互作用能通过其发光强度和能量反映出来。自1978年Irie等[26]首次报道了1,1′-联萘对N,N-二甲基-α-苯乙胺的选择性识别以来,以1,1′-联-2-萘酚为基体的手性传感器引起了越来越多科研工作者的兴趣。表1中总结了1,1′-联-2-萘酚衍生物A-D的特征数据及其在对映体识别中的应用[27-30]。

表1 1,1′-联-2-萘酚衍生物的特征数据和应用Table 1 Characteristic data and applications of binol derivatives
Lin等[27]设计合成了基于1,1′-联-2-萘酚的荧光传感器A,与水杨醛、ZnⅡ组成手性荧光系统实现了对氨基醇对映体组成及浓度的同时检测。这种新型手性荧光检测系统具有快速、方便等特点,更易于实现手性化合物的高通量检测。Lin等[28]设计合成了对二元氨、氨基醇和氨基酸等手性化合物同时进行对映体组成及浓度检测的荧光分子探针B,这种新型手性荧光分子实现手性化合物组成及浓度同时检测的原因是其具有2个发射波长λ1和λ2,其中λ1对目标物浓度具有较高的荧光响应,而λ2对目标物结构具有较高响应。Zhu等[29]设计合成了一种含有硼酸酯基团的手性荧光传感器C,并用荧光光谱法研究了此传感器对α-苯乙胺和苯甘氨醇的选择性识别能力。当向含有传感器C的THF溶液中加入(R)-α-苯乙胺时,其荧光强度降低44%。在同样条件下,加入(S)-α-苯乙胺荧光强度只降低30%。作者采用1H NMR滴定的方法研究了其识别机理。研究表明:在选择性识别的过程中,主体分子中的B原子作为路易斯酸可与客体分子中的氨基基团形成主客体络合物。同时传感器C本身具有的刚性结构也是其具有对映异构体选择性识别能力的重要原因。
氨基酸是生物功能大分子蛋白质的基本组成单位,在人体及动物的生命活动中起着不可替代的作用。多数的氨基酸都具有手性中心,其D,L-构型存在着不同的生理活性,如L-构型的氨基酸能被人体直接吸收,而D-构型却不能。已有很多关于1,1′-联-2-萘酚类荧光传感器选择性识别氨基酸对映体的报道。Lyer等[30]用缩胺基硫脲基团修饰(S)-BINOL,合成了新型的、可选择性识别α-氨基酸的手性荧光传感器D。缩胺基硫脲基团增加了传感器D的手性识别位点。利用配体交换原理(α-氨基酸-Fe3+络合物更加稳定),传感器D与Fe3+组成的络合物可以进行α-氨基酸的识别。Yoon等[31]设计合成了一种新型的对氨基酸对映体进行选择性识别的荧光传感器E,其包含2个尿素基团和2个芘基团。当向含有传感器(S)-E的DMSO溶液中加入D-t-Boc-丙氨酸时,可观察到390 nm处的发射波长(λex=344 nm)具有明显的荧光猝灭;而加入L-t-Boc-丙氨酸时369 nm处荧光猝灭程度较小。这种现象的产生是由于主客体间形成了稳定氢键。
2 基于杯芳烃衍生物的手性荧光传感器
杯芳烃是一类由对位取代的苯酚与甲醛在碱性条件下反应得到的环状缩聚物。由于其具有与环糊精、冠醚相似的洞穴结构,被称为第三代超分子化合物。杯芳烃具有易于合成、空腔大小可调节、易于衍生化,以及能够借助氢键、范德华力、静电作用、疏水作用等非共价键协同作用识别客体分子等特点[32-34]。手性杯芳烃化合物因在氨基酸、氨基醇等手性化合物识别上具有良好的应用潜力而受到广泛重视。在已报道的杯芳烃衍生物手性荧光传感器中[35-40],部分表现出优异的手性识别能力。表2总结了杯芳烃衍生物H-K的特征数据及其在对映体识别中的应用。
杯[4]芳烃具有易于衍生化、易于合成及刚性结构稳定等优点,因此被广泛用作构建传感器的主体分子平台[35]。Diamond等[36]设计合成了对手性氨基醇进行选择性识别的杯[4]芳烃荧光传感器H。向传感器H的甲醇溶液中加入短链手性氨基醇时(如苯甘氨醇)无手性识别的效果,但当向此溶液中加入长链氨基醇时(如苯丙氨醇),可观察到荧光强度不同。而向传感器H的三氯甲烷溶液中加入R-苯丙氨醇时,在440 nm处会出现1个新的发射峰,而S-苯丙氨醇对其发射峰无影响。
Chen等[37]合成了包含冠醚基团、羧酸基团和萘环的杯[4]芳烃手性荧光传感器Ⅰ,此类传感器以冠醚基团和羧酸基团作为手性识别的位点,而萘环作为荧光发射团。随后,作者研究了此类手性荧光传感器对D,L-亮氨酸的手性识别能力,在二氯甲烷溶液中,当D-亮氨酸与传感器Ⅰ(n=3)作用时,会使其荧光强度降低19.3%;相同条件下,L-亮氨酸会使其荧光强度降低38.8%。因此,可以通过荧光强度变化对亮氨酸对映体进行选择性识别。
D,L-2-羟基丁二酸,又称苹果酸,其L-构型是人体内部循环的重要中间产物,易被人体吸收,常作为性能优异的食品添加剂广泛应用于食品、化妆品、医疗和保健品等领域[38]。因此,对D,L-2-羟基丁二酸对映体的识别研究具有重要的意义。He等[39]将蒽通过共价键连接到杯[4]芳烃上合成了可对D,L-2-羟基丁二酸进行选择性识别的荧光传感器J。作者通过荧光滴定的方法研究了此类传感器对D,L-2-羟基丁二酸的选择性识别能力,结果表明,D,L-2-羟基丁二酸对此传感器具有荧光猝灭作用。如在J1传感器中缓慢加入L-2-羟基丁二酸时,417 nm处的荧光发射强度降低40%;相同条件下,当加入D-2-羟基丁二酸时,其荧光发射强度降低70%,荧光猝灭效率ΔID/ΔIL为1.75,表现出较好的选择性识别能力。
表2 杯芳烃衍生物的特征数据和应用Table 2 Characteristic data and applications of calixarenes derivatives
He等[40]又设计合成了含有L-色氨酸单元的杯[4]芳烃荧光传感器K,并研究了此类荧光传感器对羧酸阴离子的识别能力。当向含有传感器K的DMSO溶液中加入N-Boc保护的丙氨酸阴离子时,发现当传感器K与D-丙氨酸阴离子作用时,荧光强度出现明显的猝灭现象;而当其与L-丙氨酸阴离子作用时,荧光强度几乎不发生变化。产生这种现象的原因是此荧光传感器与羧酸阴离子之间产生氢键所致。
3 基于高分子聚合物的手性荧光传感器
自Swager等[41]提出一种高分子线机制可有效放大荧光信号后,高分子聚合物荧光传感器得到了迅速发展。由于高分子荧光传感器可提高检测的灵敏度、降低检测限,因此已成功应用于金属离子、阴离子[42]、O2[43]、温度和TNT[44]等物质的检测。手性高分子聚合物具有化学结构丰富、易于修饰手性位点、灵敏度高等优点,在手性化合物分离、识别上极具吸引力。但到目前为止,关于高分子聚合物荧光传感器在识别手性化合物方面的报道较少。表3总结了高分子聚合物L-N的特征数据及其在对映体识别中的应用。

表3 高分子聚合物的特征数据和应用Table 3 Characteristic data and applications of polymers
ano mentioned in literature
Zhu等[45]合成了1种新型的手性离子型高分子荧光传感器L,此传感器对α-氨基酸阴离子具有较好的选择性识别能力。当向L的四氢呋喃溶液中加入L-丙氨酸阴离子时,420 nm处的发射峰红移到500 nm,同时伴随着荧光强度增强;然而,当加入D-丙氨酸阴离子时,420 nm处的发射峰会红移但对荧光强度无影响,其ef值为8.14。另外,传感器L还可对缬氨酸、脯氨酸、苯甘氨酸、苯丙氨酸和色氨酸对映体进行选择性识别,其ef值分别为6.21,3.11,14.03,12.37和1.11。
Zhu等[46]合成了基于Click-Binol的手性离子型高分子荧光传感器M,此传感器对色氨酸阴离子具有较好的识别效果。当向含有传感器M的四氢呋喃溶液中加入L-色氨酸阴离子时,能观察到较小程度的荧光增强。相同条件下加入D-色氨酸阴离子时,会出现很大程度的荧光增强现象同时伴随着红移现象,其ef(ef=(ID-I0)/(IL-I0))值为6.25。说明传感器M对色氨酸阴离子具有较好的选择性识别能力。这是因为D构型的色氨酸阴离子与传感器M中的手性识别骨架具有更强的作用力。
Yang等[47]以BINOL为基底设计合成了荧光高分子传感器N,此传感器对苯丙氨酸阴离子具有较好的选择性识别效果。当向含有高分子传感器N的THF/H2O溶液中加入D-苯丙氨酸阴离子时,能观察到较大程度的荧光增强。相同条件下S-苯丙氨酸阴离子只引起较弱的荧光增强。作者认为荧光增强的原因是传感器N的周围缺乏阴离子,其本身含有的缺电子基团—OH抑制了其荧光强度。向传感器N周围引入阴离子时,抑制了其光电子转移,从而引起荧光增强。同时传感器N具有选择性识别能力的原因是传感器N中的羟基及醚键与可R-苯丙氨酸阴离子形成更稳定的复合物。
Lin等[48]将p-亚苯基连接到(S)-1,1′-联-2-萘酚衍生物上合成了一种新型的共价高分子荧光传感器O。在Zn(Ⅱ)存在下向高分子传感器O中加入不同构型的氨基醇时,引起不同程度的荧光增强。如向含有传感器O+Zn(Ⅱ)(2 equiv.)的CH2Cl2溶液中加入R-亮氨醇时,在λ=535 nm处具有较强的荧光增强现象,而加入S-亮氨醇的荧光增强较弱,其ef值为3.5。结果表明,高分子荧光传感器O对氨基醇对映体具有较好的选择性识别能力。
4 基于纳米量子点的手性荧光传感器
半导体量子点(QDs),又称为半导体纳米微晶粒,其粒径范围通常为1 ~10 nm。由于受量子尺寸效应与介电效应的影响,半导体量子点具有独特的发光特性,如量子效率高、吸收和激发光谱宽、发射光谱窄、化学稳定性好等,因此半导体量子点化学传感器已成功应用于生物成像、环境监测等[49-51]领域。近年来,半导体量子点荧光传感器的种类及应用范围大大增加,但是应用于手性化合物的选择性识别才刚刚开始。将环糊精、L-半胱氨酸等手性分子连接到纳米量子点上,能够为对映体识别提供不可多得的手性环境,客体分子通过与量子点上的手性分子产生氢键、静电作用力、范德华力等作用,从而可引起纳米量子点荧光强度增强或猝灭,以及发射波长位移等。
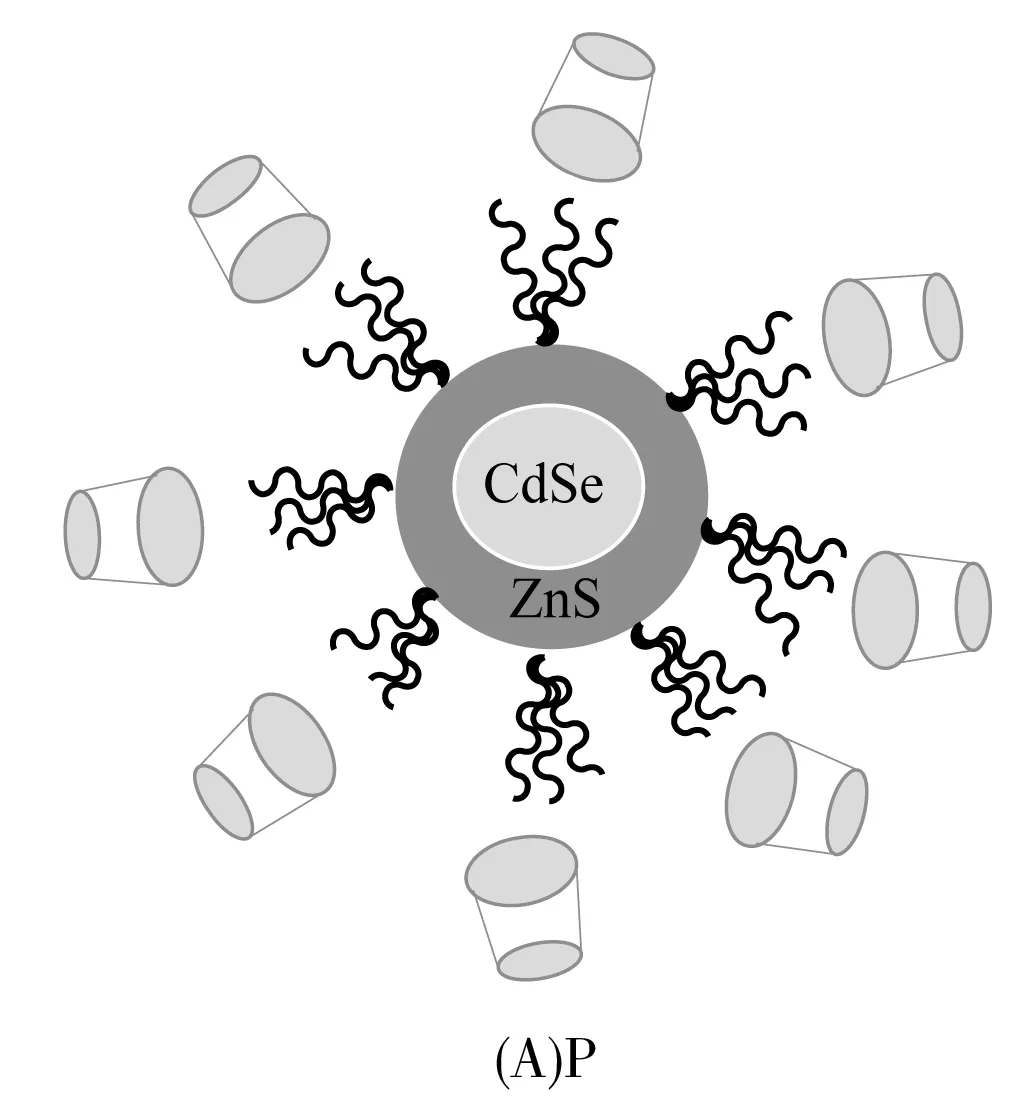
Li等[52]设计合成了环糊精修饰的CdSe/ZnS量子点荧光传感器P(图1A),并研究了此荧光传感器对D,L-酪氨酸和D,L-蛋氨酸等氨基酸的选择性识别能力。当将L-或D-酪氨酸加入此荧光传感器时会产生不同程度的荧光增强,其荧光强度增强比值[(IL-I0)/(ID-I0)]为7.09。相同条件下,L,D-蛋氨酸的荧光强度增强比值为3.4。因此,此手性荧光传感器对氨基酸对映体具有较好的选择性识别能力。
Willner等[53]设计合成了荧光共振能量转移(FRET)的手性主客体传感器Q(图1B)。此传感器通过苯硼酸将包含罗丹明B的β-环糊精连接到CdSe/ZnS量子点上,CdSe/ZnS量子点作为能量的给与者,罗丹明B作为能量的接受者。当1个客体分子替代罗丹明B时,荧光共振能量转移过程会被阻断,伴随着罗丹明B的荧光减弱而CdSe/ZnS量子点的荧光增强。研究发现,此手性传感器可用来识别D,L-苯丙氨酸和D,L-酪氨酸。当向此传感器中加入L-苯丙氨酸时,CdSe/ZnS量子点的荧光增强而罗丹明B的荧光减弱,但加入D-苯丙氨酸时此传感器的荧光强度基本不变。L,D-苯丙氨酸与β-环糊精的缔合常数分别为3.05×103L/mol和3.5×102L/mol。同样,该系统可用于选择性识别D,L-酪氨酸,其与β-环糊精的缔合常数分别为100 L/mol和2.2×103L/mol。
Simonet等[54]用D,L-半胱氨酸修饰CdSe/ZnS量子点合成了一种新型的荧光传感器R(图2A),用于选择性识别肉毒碱对映体。当向L-半胱氨酸修饰的CdSe/ZnS量子点中加入D-肉毒碱时,其荧光强度急剧下降;而加入L-肉毒碱时,其荧光强度几乎不变。这是因为L-半胱氨酸可以通过羟基、氨基、羧基等基团与D-肉毒碱形成氢键或产生静电作用力。相同条件下,L-肉毒碱能猝灭D-半胱氨酸修饰的CdSe/ZnS量子点,而D-肉毒碱对其影响较小。

Galian等[55]设计合成了N-乙酰基-L-半胱氨酸甲酯修饰的CdSe/ZnS量子点传感器S(图2B),并研究了此传感器对酮洛芬(KP)、萘普生(NP)、氟比洛芬(FP)和布洛芬(IP)等手性药物的选择性识别能力。当向此传感器的甲醇溶液中加入不同构型的酮洛芬时,观察到548 nm发射峰处的荧光强度发生不同程度的变化,其KR/KS(K为Stern-Volmer 猝灭常数)值为2.48。相同条件下,萘普生、氟比洛芬和布洛芬的KR/KS值分别为0.29,1.07和1.06。研究表明,此手性荧光传感器对手性药物表现出较好的选择性识别能力。
上述4种手性量子点荧光传感器已成功应用于手性对映体的选择性识别,但均是利用具有生物毒性的CdSe/ZnS量子点,在很大程度上限制了此类传感器的应用。为了克服上述缺点,Dong等[56]设计合成了β-环糊精修饰的Mn掺杂的ZnS量子点化学传感器,并研究了此传感器对色氨酸对映体的选择性识别能力。与文献[52-55]相比,此传感器用Mn代替了重金属Cd,在保持量子点发光性能不变的条件下减少了生物毒性。在激发波长为365 nm时,传感器T的荧光光谱在430 nm和590 nm处有2个发射峰。当向此传感器中加入L-色氨酸时,430 nm处的发射峰会蓝移到399 nm处,并且其荧光强度有很大程度的增强;而加入D-色氨酸时对此处的发射峰影响不大,两者的KR/KS(K=Inclusion constants)值为3.27。因此可根据荧光发射峰位移和强度的变化对色氨酸对映体进行选择性识别。作者认为此传感器可进行手性识别的原因是β-环糊精的手性腔与不同构型色氨酸之间的亲和力不同,并且L-色氨酸分子中的吲哚环在β-环糊精的催化下裂解产生更强的立体选择性。
5 基于金属有机多孔材料的手性荧光传感器
金属有机多孔材料—金属有机笼与金属有机骨架是通过金属离子与有机配体自组装形成的具有网络结构的晶态材料,具有比表面积较高,多孔骨架稳定,化学稳定性好,孔道表面易功能化,孔道尺寸易于调节等优点[57-58],已广泛应用于吸附、荧光、催化、分离、储氢和磁性等各领域[59-60]。手性多孔性材料为近年来兴起的手性荧光传感器,具有荧光量子产率高、特异性识别能力强、含有较多手性官能团或手性孔穴等特点,已成功地用于手性胺、单糖、手性醇等对映体的选择性识别。但到目前为止,以金属有机笼和金属有机骨架作为手性荧光传感器的相关报道不多。
Cui等[61]首先合成了手性荧光金属有机笼U(图3A),其对丙氨酸等氨基酸对映体具有较好的荧光感应和选择性识别能力。在四氢呋喃溶液中,手性金属有机笼U的荧光强度会随着D-和L-丙氨酸的加入而增强。与D-丙氨酸相比,L-丙氨酸可引起更强程度的荧光增强,其选择性因子KBH(R-L)/KBH(R-D)高达3.69。U可进行手性识别的主要原因是本身具有较大的手性孔,并且含有的—NH基团与不同构型分子之间的作用力不同。
Cui等[62]在U的基础上又合成了新的手性荧光金属有机笼V(图3B),其可通过荧光手性识别单糖和手性胺。单糖能够增大V的荧光强度,如在四氢呋喃溶液中,山梨糖醇可使其量子产率从7.29%增强到16.34%。作者认为可能原因是V和糖类形成了笼-糖类加合物,结构的改变使其发光种类减少。另外,V对D-葡萄糖、D-果糖、D-半乳糖等单糖也具有选择性识别能力,即D构型的单糖使S构型的V具有更快的荧光增长率。如D-葡萄糖的对映体选择性因子kbh(S-1)/kbh(R-1)值为1∶3.493,而L-葡萄糖为3.961∶1(kbh为单糖与V之间的缔合常数)。选择性因子不同的主要原因是糖类分子与V的缔合常数不同。
Lin等[63]设计合成了手性金属有机骨架荧光传感器W,并研究了其对氨基醇对映体的选择性识别性能。当向W的主体溶液中加入不同构型的氨基醇时,其荧光猝灭程度不同。如向主体溶液中分别加入2-氨基-1-乙醇、2-氨基-2-苯乙醇、2-氨基-3-苯丙醇、2-氨基-3-甲基-1-丁醇时,其猝灭率ksv(S)/ksv(R)值分别为1.25,1.17,1.39,3.12,表现出较好的对映体选择性识别能力。荧光传感器W对氨基醇对映体进行选择性识别的主要原因是氨基醇可与W骨架中的BINOL单元形成氢键。

6 结论与展望
综述了以1,1′-联-2-萘酚衍生物、杯芳烃及其衍生物、高分子聚合物、半导体量子点(QD)、金属有机骨架及金属有机笼为基础单元的手性传感器在对映体识别及荧光传感方面的研究进展。以1,1′-联-2-萘酚为基础构建的手性荧光传感器是研究最早并且识别效果较好的一种荧光传感器,已成功应用于对手性胺、氨基醇、氨基酸、α-2-羟基羧酸、手性醇和单糖等手性物质的识别。有关以高分子聚合物、以半导体量子点和金属配位聚合物为基础的手性传感器的研究才刚刚开始,传感器的构建方法、识别机理和应用范围等研究有待于深入。总体来说,手性传感器的构建处于初级阶段,目前面临的最大挑战是发展适用于水环境的荧光传感器和扩大选择性识别对象的范围。相信随着越来越多科研工作者的探索研究,手性荧光传感器必将作为一种灵敏、快速、有效的检测手性化合物的技术应用于实际生产及生活中。
[1] Caner H,Groner E,Levy L,Agranat I.DrugDiscov.Today,2004,9(3):105-110.
[2] Fleischer I.Angew.Chem.Int.Ed.,2016,55:7582-7584.
[3] Liu L,Yang Q,Yu H,Li J L,Pei Y N,Zhu H J,Li Z Q.Tetrahedron,2015,71:3296-3302.
[4] Ali I,Alam S D,Al-Othman Z A,Farooqi J A.J.Chromatogr.Sci.,2013,51:645-654.
[5] Schwaninger A E,Meyer M R,Maurer H H.J.Chromatogr.A,2012,1269:122-135.
[6] Woods R M,Patel D C,Lim Y,Breitbach Z S,Gao H Y,Keene C,Li G Q,Kürti L,Armstrong D W.J.Chromatogr.A,2014,1357:172-181.
[7] Sun P,Wang C,Padivitage N L T,Nanayakkara Y S,Perera S,Qiu H,Zhang Y,Armstrong D W.Analyst,2011,136(4):787-800.
[8] Wang D W,Wang X N,Feng M J,Song Y X.J.Instrum.Anal.(王东武,王西宁,丰梅君,宋莹雪.分析测试学报),2014,33(10):1123-1128.
[9] Wu P,Tang B,Lu Z Y,Kong J,Yuan L M.Chem.Res.(伍鹏,汤波,路振宇,孔娇,袁黎明.化学研究),2015,26(1):49-53.
[10] Lu Z Y,Wu P,Zi M,Yang C Y,Kong J,Yuan L M.J.Org.Chem.(路振宇,伍鹏,字敏,杨璨瑜,孔娇,袁黎明.有机化学),2015,35:217-222.
[11] Xie S M,Zhang Z J,Wang Z Y,Yuan L M.J.Am.Chem.Soc.,2011,133(31):11892-11895.
[12] Pan R,Chen H P,Yin P,Wang Q H,Jiang Y,Liu X.J.Instrum.Anal.(潘蓉,陈红平,尹鹏,汪庆华,蒋迎,刘新.分析测试学报),2014,33(7):766-772.
[13] Yin M M,Zhu X B,Liu Y L,Zhong J C,Chen F L.J.Instrum.Anal.(尹明明,朱小波,刘永良,钟江春,陈福良.分析测试学报),2011,30(3):298-301.
[14] Dixit S,Park J H.J.Chromatogr.A,2016,1453:138-142.
[15] Wu D R,Yip S H,Li P,Sun D,Mathur A.J.Chromatogr.A,2016,1432:122-131.
[16] Lin P.Chem.Rev.,2004,104(3):1687-1716.
[17] Lin P.Acc.Chem.Res.,2012,45(2):150-163.
[18] Zhang X,Yin J,Yoon J Y.Chem.Rev.,2014,114(9):4918-4959.
[19] Chen Z,Wang Q,Wu X,Li Z,Jiang Y B.Chem.Soc.Rev.,2015,44(13):4249-4263.
[20] Ward T J,Ward K D.Anal.Chem.,2010,82(12):4712-4722.
[21] Huang H,Zheng L F,Zou X W,Cheng Y X.Prog.Chem.(黄辉,郑立飞,邹小伟,成义祥.化学进展),2008,20(4):508-517.
[22] Yang L,Xu K X,Wang C J,Wang C J.Chin.J.Org.Chem.(杨丽,徐括喜,王晨娟,王超杰.有机化学),2013,33:2496-2503.
[23] Lin P.Acc.Chem.Res.,2014,47:1523-1535.
[24] Pereira M M,Calvete M J F,Carrilho R M B,Abreu A R.Chem.Soc.Rev.,2013,42:6990-7027.
[25] Phipps R J,Hiramatsu K,Toste F D.J.Am.Chem.Soc.,2012,134(20):8376-8379.
[26] Irie M,Yorozu T,Hayashi K.J.Am.Chem.Soc.,1978,100(7):2236-2237.
[27] Huang Z,Yu S S,Zhao X,Wen K L,Xu Y M,Yu X Q,Xu Y,Lin P.Chem.Eur.J.,2014,20(50):16458-16461.
[28] Wen K L,Yu S S,Huang Z,Chen L M,Xiao M,Yu X Q,Lin P.J.Am.Chem.Soc.,2015,137(13):4517-4524.
[29] Jiao J M,Wei G,Mao X R,Cheng Y X,Zhu C J.RSCAdv.,2014,4:5887-5892.
[30] Munusamy S,Lyer S K.Tetrahedron:Asymmetry,2016,27:492-497.
[31] Wang F,Nandhakumar R,Hu Y,Kim D,Kim K M,Yoon J.J.Org.Chem.,2013,78(22):11571-11576.
[32] Zheng Y S,Luo J.J.Incl.Phenom.Macro.,2011,71:35-56.
[33] Wenzel T J.J.Incl.Phenom.Macrocycl.Chem.,2014,78:1-14.
[34] Liu L Z,Kou Y H,Wang L Y,Cao D R.Chin.J.Org.Chem.(刘陆智,寇玉辉,汪凌云,曹德榕.有机化学),2011,31(7):964-972.
[35] Nimse S B,Kim T.Chem.Soc.Rev.,2013,42:366-386.
[36] Lynam C,Diamond D.J.Mater.Chem.,2005,15(2):307-314.
[37] Luo J,Zheng Q Y,Chen C F,Huang Z T.Tetrahedron,2005,61(35):8517-8528.
[38] Chi Z,Wang Z P,Wang G Y,Khan I,Chi Z M.Crit.Rev.Biotechnol.,2016,36(1):99-107.
[39] Qing G Y,He Y B,Chen Z H,Wu X J,Meng L Z.Tetrahedron:Asymmetry,2006,17(22):3144-3151.
[40] Qing G Y,He Y B,Wang F,Qin H J,Hu C G,Yang X.Eur.J.Org.Chem.,2007,11:1768-1778.
[41] Zhou Q,Swager T M.J.Am.Chem.Soc.,1995,117:12593-12602.
[42] Klucińska K,Stelmach E,Kisiel A,Maksymiuk K,Michalska A.Anal.Chem.,2016,88:5644-5648.
[43] Yu J,Hu D H,Barbara P F.Science,2000,298(5483):1327-1330.
[44] Wang E,Sun D M,Li H H,Sun X L,Liu J T,Ren Z J,Yan S K.J.Mater.Chem.C,2016,4:6756-6760.
[45] Song F Y,Fei N,Li F,Zhang S W,Cheng Y X,Zhu C J.Chem.Commun.,2013,49(28):2891.
[46] Wei G,Jiang Y L,Li F,Quan Y W,Cheng Y X,Zhu C J.Polym.Chem-Uk.,2014,5(18):5218.
[47] Zhao C H,Ouyang K B,Zhang J,Yang N F.Polymer,2016,93:9-13.
[48] Zhang X P,Wang C,Wang P,Du J J,Zhang G Q,Lin P.Chem.Sci.,2016,7:3614-3620.
[49] Sun M J,Zhao Z H,Chen H M,Nie F Q.Chemistry(孙默杰,赵志海,陈红梅,聂富强.化学通报),2016,79(8):691-698.
[50] Stanisavljevic M,Krizkova S,Vaculovicova M,Kizek R.Biosens.Bioelectron.,2015,74:562-574.
[51] Michalet X,Pinaud F F,Bentolila L A,Tsay J M,Doose S,Li J J,Sundaresan G,Wu A M,Gambhir S S,Weiss S.Science,2005,307(5709):538-544.
[52] Han C P,Li H B.Small,2008,4(9):1344-1350.
[53] Freeman R,Finder T,Bahshi L,Willner I.NanoLett.,2009,9(5):2073-2076.
[54] Carrillo-Carrión C,Crdenas S,Simonet B M,Valcrcel M.Anal.Chem.,2009,81(12):4730-4733.
[55] Delgado-Pérez T,Bouchet L M,de la Guardia M,Galian R E,Pérez-Prieto J.Chem.Eur.J.,2013,19(33):11068-11076.
[56] Wei Y L,Li H H,Hao H Y,Chen Y X,Dong C,Wang G F.Polym.Chem-Uk.,2015,6(4):591-598.
[57] Zhou H C J,Kitagawa S.Chem.Soc.Rev.,2014,43:5415-5418.
[58] Yi S,Brega V,Captain B,Kaifer A E.Chem.Commun.,2012,48:10295-10297.
[59] Song L F,Xia H Y,Chen H X,Li Z,Lu J J.Prog.Chem.(宋莉芳,夏慧芸,陈华鑫,李卓,卢佳佳.化学进展),2014,26(7):1132-1142.
[60] Huang G,Chen Y Z,Jiang H L.ActaChim.Sin.(黄刚,陈玉贞,江海龙.化学学报),2016,74:113-129.
[61] Xuan W M,Zhang M N,Liu Y,Chen Z J,Cui Y.J.Am.Chem.Soc.,2012,134(16):6904-6907.
[62] Dong J Q,Zhou Y F,Zhang F W,Cui Y.Chem.Eur.J.,2014,20(21):6455-6461.
[63] Wanderley M M,Wang C,Wu C D,Lin W B.J.Am.Chem.Soc.,2012,134(22):9050-9053.
Advances in Development of Chiral Fluorescent Sensors
LU Zhen-yu,ZHANG Run-kun*,LI Gong-ke*
(School of Chemistry and Chemical Engineering,Sun Yat-sen University,Guangzhou 510275,China )
Chiral compounds have been increasingly applied in many fields such as pharmaceutics,asymmetric synthesis,and biological and clinical analysis.The development of a high efficient and sensitive technique is an urgent demand for the rapid determination of compositions of enantiomers.Chiral fluorescent sensors as a sensitive fast effective detection tool have attracted a high attention.Various chiral fluorescent sensors with high enantioselective and sensitive recognition for chiral compounds have been developed.In this paper,the recent progress of chiral fluorescent sensors with binol derivatives,calixarenes,polymers,nanomaterials,metal orgaic porous materials as the units for chiral enantiomers are reviewed and their applications are summarized.Also,the future trends of chiral fluorescent sensors are proposed.
chiral compound;enantiomer recognition;fluorescent sensor;review
10.3969/j.issn.1004-4957.2017.04.023
2016-08-21;
2016-11-27
国家自然科学基金项目(21675178,21475153,21605163);广东省自然科学基金重点项目(2015A030311020);广东省公益研究与能力建设专项(2015A030401036);广州市科技计划项目(201604020165);高校基本科研业务费青年教师培育项目(31000-31610743)
O741.6;TL271.5
A
1004-4957(2017)04-0570-09
*通讯作者:张润坤,博士,副研究员,研究方向:光谱分析,Tel:020-84110922,E-mail:z0514024132@126.com 李攻科,博士,教授,研究方向:复杂样品分离分析、光谱与色谱分析,Tel:020-84110922,E-mail:cesgkl@mail.sysu.edu.cn
