超高效液相色谱-串联质谱法检测花生中36种农药及其代谢物残留
2017-04-27李凌云许晓敏黄晓冬郑姝宁刘新艳徐东辉
李凌云,吴 华,许晓敏,林 桓,黄晓冬,郑姝宁,刘新艳,徐东辉*
(1.中国农业科学院蔬菜花卉研究所,农业部蔬菜质量安全控制重点实验室,农业部园艺作物生物学与种质创制重点实验室,北京 100081;2.安捷伦科技(中国)有限公司,北京 100102)
超高效液相色谱-串联质谱法检测花生中36种农药及其代谢物残留
李凌云1,吴 华2,许晓敏1,林 桓1,黄晓冬1,郑姝宁1,刘新艳1,徐东辉1*
(1.中国农业科学院蔬菜花卉研究所,农业部蔬菜质量安全控制重点实验室,农业部园艺作物生物学与种质创制重点实验室,北京 100081;2.安捷伦科技(中国)有限公司,北京 100102)
建立了花生中36种农药及其代谢物残留的超高效液相色谱-串联质谱(UHPLC-MS/MS)快速检测技术。采用乙腈提取,增强型脂质去除净化剂(EMR-Lipid)净化,正离子多反应监测(MRM)模式测定。结果表明,所有农药的线性相关系数均大于0.994,在0.005,0.01,0.10 mg/kg 3个加标水平下,36种农药的平均回收率为70.4%~119%,相对标准偏差(RSDs)为1.3%~19.4%,方法的定量下限为0.002 5~0.05 mg/kg。该方法简便、快速,灵敏度高、净化效果好,适用于花生中农药多残留的快速检测分析。
农药残留;花生;脂质去除;超高效液相色谱-串联质谱(UHPLC-MS/MS)
花生是我国重要的经济和油料作物,在人们的日常生活中具有不可忽略的作用。由于花生在种植过程中易受多种病虫害的侵袭,需使用大量的农药加以防治,因此造成花生中农药残留超标的现象日益严重。花生的成分非常复杂,除了多糖、蛋白质和色素等物质外,还包含丰富的油脂[1]。这些油脂可与许多亲脂性农药互溶,严重干扰了目标农药与基质的有效分离,给农药的残留分析带来了很大的困难。因此,去除油脂,消除基质干扰,是建立花生基质中农药多残留分析技术的关键。
目前用于高油脂样品分析的前处理方法主要有固相萃取[2-5]、液液萃取[6]、凝胶色谱[7-10]和基质固相分散萃取[11]等。但这些方法溶剂消耗量大,且后续仍需繁琐的净化步骤,耗时长,不利于农残样品的大批量处理和农药事件的应急处理。近年来广泛应用的QuEChERs方法[12-14],在处理含油脂样品时多采用PSA+C18混合吸附剂去除油脂,但是PSA对酸类农药有吸附,易造成这些农药的测定结果偏低。增强型脂质去除净化剂(Enhanced matrix removal-lipid,EMR-Lipid)是一种新型高聚物吸附剂,可以有效吸附各类脂类化合物。吴岩等[15]曾将EMR-Lipid用于玉米中三嗪类除草剂的净化,发现EMR-Lipid能有效去除玉米基质对农药残留的干扰。EMR-Lipid在油脂含量更高的花生中的应用尚未见报道。
食品安全国家标准GB 2763-2014《食品中农药最大残留限量》规定了44种农药在花生中的最大残留限量,但针对这些农药在花生中的多残留快速检测方法尚未建立。本研究选择具有最大残留限量的36 种农药及其代谢物作为研究对象,通过使用EMR-Lipid材料改进QuEChERs净化步骤,建立了花生中36种农药多残留的UHPLC-MS/MS快速检测技术。该方法操作简单、省时、去脂效果好、回收率高,适用于大批量花生样品中农药残留的快速检测。
1 实验部分
1.1 仪器与试剂
LC-30A超高效液相色谱仪,LC-MS/MS-8050三重四极杆质谱仪均购自日本Shimadzu公司。
乙腈、甲醇、丙酮(HPLC级,美国JT Baker公司);乙酸铵(HPLC级,美国Fluka公司);甲酸(HPLC级,Dikma科技);水(纯净水,Milli-Q超纯水仪制备);增强型脂质去除分散剂(Agilent Bond Elut QuEChERS EMR-Lipid,美国安捷伦公司);36种农药标准品(纯度>96%,德国Dr.Ehrenstorfer公司);其他试剂均为分析纯,购自北京化学试剂公司。
1.2 标准溶液的配制
准确称取10.0 mg各农药标准品,根据农药的溶解度选用甲醇或丙酮进行溶解,定容至10 mL,配制成1 mg/mL的标准储备溶液。准确量取一定体积的各农药标准储备溶液,用甲醇定容,得到含36种农药的混合标准工作溶液,-20 ℃保存。
1.3 样品前处理
1.3.1 样品制备与提取 将花生仁粉碎,过20目筛,混匀,作为试样。精确称取5.00 g样品于100 mL离心管中,分别加入3 mL水和25 mL乙腈,使用匀浆机高速匀浆2 min后,加入2 g氯化钠和2 g无水硫酸镁,剧烈振摇1 min,5 000 r/min离心3 min,上清液待净化。
1.3.2 样品净化 加入3 mL水活化EMR-Lipid除脂分散剂,混合摇匀,然后加入上清液5.00 mL,剧烈振摇1 min,5 000 r/min 离心3 min,离心后的全部溶液转移至预先加入1 g 氯化钠和1 g无水硫酸镁的15 mL离心管中,剧烈振摇1 min,5 000 r/min离心3 min,上层乙腈相过0.22 μm滤膜,供UHPLC-MS/MS测定。
1.4 色谱条件
色谱柱:Waters ACQUITY UPLC BEH HSS C18(100 mm×2.1 mm,1.8 μm);流动相:A相为甲醇;B相为0.1%甲酸乙酸铵水溶液(1 mmol/L);梯度洗脱条件:0 min,20%;0~2 min,20%~60% A;2~14 min,60%~85% A;14~14.1 min,85%~95% A;14.1~17 min,95% A;17~17.1 min,95%~20% A;17.1~22 min,20% A;流速:0.3 mL/min;柱温:40 ℃;进样量:1 μL。
1.5 质谱条件
ESI离子源;接口电压4 000 V;正离子扫描;MRM监测模式;雾化气流量3 L/min,干燥气流量10 L/min,以上2种气体均为氮气,加热气流量10 L/min,该气体为空气;接口温度300 ℃;脱溶剂管温度250 ℃;加热模块温度400 ℃;碰撞气压力2.7×105Pa,该气体为氩气。
2 结果与讨论
2.1 质谱条件的优化
将36种农药分别配制成100 μg/L的标准溶液。不接色谱柱,标准溶液通过液相色谱注入质谱,进行一级质谱扫描确定各农药的准分子离子峰。利用仪器自动优化功能,优化二级碎片离子信息,获得定量和定性离子及质谱参数Q1(Quadrupole 1),Q3(Quadrupole 3)和碰撞能量(CE),相关参数见表1。
2.2 流动相的优化
以乙腈-水、甲醇-水、甲醇-乙酸铵水溶液和甲醇-甲酸乙酸铵水溶液分别作为流动相,考察了其对花生仁空白基质中36种农药混合标准溶液的分析结果。结果表明,甲醇-水作流动相时,敌百虫、高效氟吡甲禾灵等农药的灵敏度明显优于乙腈-水流动相。体系中加入乙酸胺,农药的灵敏度会进一步提高。另外由于36种农药均采用正离子扫描模式,流动相中加入少量甲酸有助于化合物电离,从而提高分析灵敏度。因此本实验最终选择甲醇-0.1%甲酸乙酸铵水溶液(1.0 mmol/L)作为流动相。通过优化梯度洗脱程序,36种农药得到了最佳分离(见图1)。
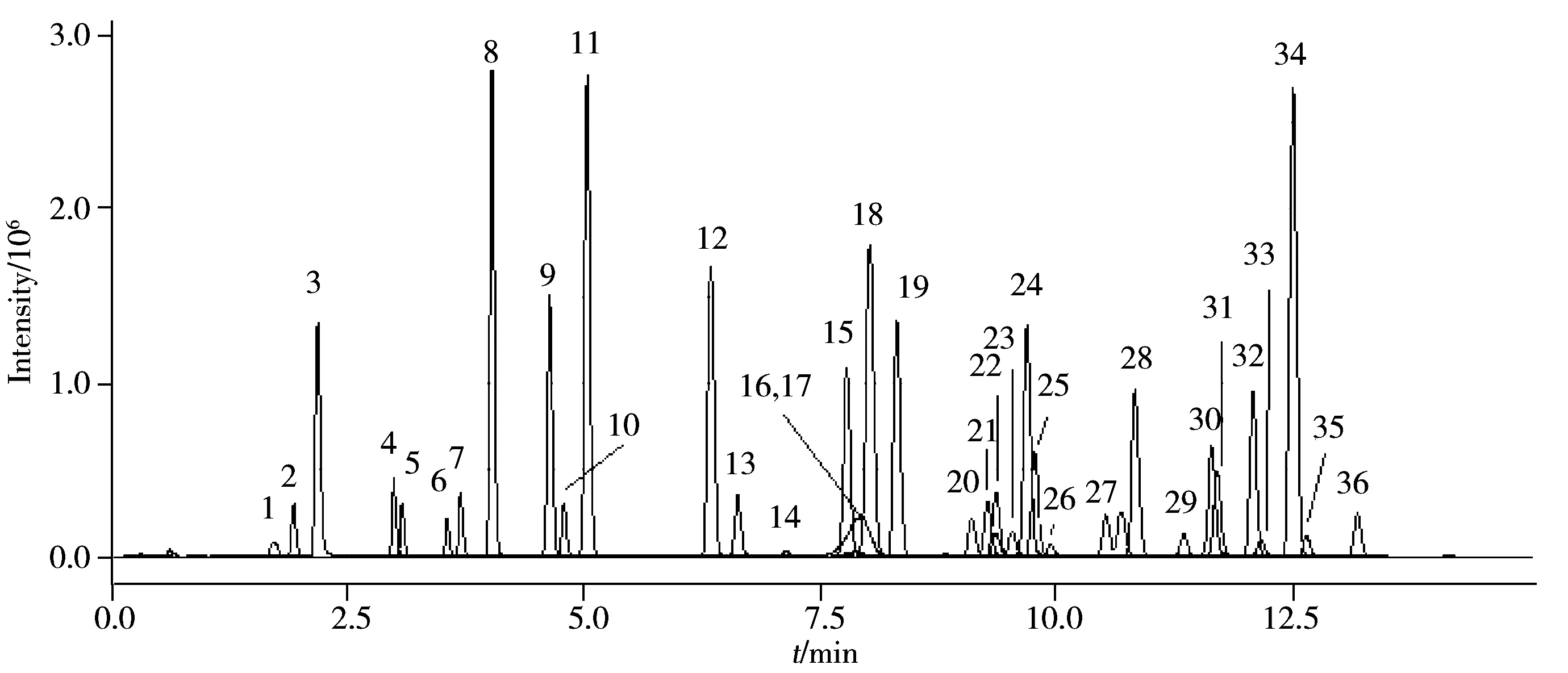
图1 花生仁空白基质中36种农药混合标准溶液的MRM总离子流图(0.05 mg/kg)Fig.1 Total ion chromatogram of peanut blank matrix spiked with 36 pesticides mixed standard solution at 0.05 mg/kg in MRM mode the peak numbers denoted were the same as those in Table 1
2.3 乙腈用量的优化
比较了乙腈用量对农药提取效率的影响。称取5 g样品,分别用5,10,20,25 mL乙腈进行提取,结果显示,在36种农药中,多菌灵的测定受乙腈用量的影响较大,5 mL乙腈提取时,多菌灵的回收率只有50%,而使用25 mL乙腈提取时,回收率则提高至82.9%。因此本实验初步确定乙腈提取液的体积为25 mL。研究发现,仅用乙腈作为提取剂,噻吩磺隆的回收率不足70.0%,尝试向花生中加入一定量的水,再用乙腈提取,结果发现噻吩磺隆的提取效率得到明显改善。这可能是由于水分子占据了噻吩磺隆在花生中的吸附位点,从而使噻吩磺隆更易被提取出。本实验继续对花生中水的加入量进行了优化,比较了分别加入3,5,10 mL水对农药回收率的影响。结果发现,当加水量为3 mL时,噻吩磺隆的回收率为85%,此时,其它农药的回收率无明显变化。但随着加水量的进一步增大,弱极性农药毒死蜱的回收率明显降低。所以本实验最终选择加水量为3 mL。
2.4 EMR-Lipid活化水用量的优化
与传统吸附剂不同,EMR-Lipid需要额外加入水进行活化。本实验对活化EMR-Lipid的水量进行了优化,比较了加水量3,5,10 mL时对测定结果的影响。结果显示,加水量对保留时间较大的化合物影响明显大于保留时间较小的化合物,如保留时间较小的3-羟基克百威,在3种不同加水量下的回收率分别为98.3%,97.5%和98.6%,保留时间较大的毒死蜱回收率分别为85.8%,76.8%和42%。由此可见,加水量过大,会导致弱极性农药的回收率降低,因此本实验最终使用3 mL水活化EMR-Lipid。
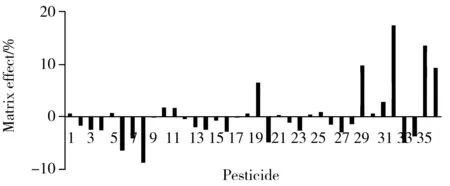
图2 36种农药在花生基质中的基质效应Fig.2 Matrix effects of 36 pesticides in peanut matrix the peak numbers denoted were the same as those in Table 1
2.5 基质效应考察
本文采用较为常用的相对响应值法评价基质效应,基质效应=(B/A-1)×100%[16],A为纯溶剂中农药的响应值;B为花生基质中添加相同浓度农药的响应值。正数表示基质增强效应,负数表示基质抑制效应。研究结果见图2,除了烯草酮和精吡氟禾草灵的基质效应分别为13.6%和17.4%以外,其它34种农药的基质效应绝对值均在0%~10%之间,基质效应不明显。由此可见,EMR-Lipid 能有效去除花生中的油脂,消除基质效应。
2.6 方法的线性范围、线性关系与定量下限
采用空白的花生基质溶液,准确配制含量分别为0.50,1.0,2.5,5.0,10,25,50,100,250 μg/L的系列混合标准工作溶液。按优化实验条件进行LC-MS/MS测定,以峰面积(y)对质量浓度(x,μg/L)作标准曲线,得到36种农药的线性回归方程,各农药的线性范围及相关系数见表1。所有农药的相关系数(r)为0.994 2~0.999 9。其中甲基异柳磷的线性范围为5~250 μg/L,特丁硫磷、甲草胺和乙草胺的线性范围为1.0~250 μg/L,其余32种农药及其代谢产物的线性范围均为0.5~250 μg/L。
定量下限采用加标回收进行验证,符合一定的准确度和精密度要求的最低加标浓度,确定为定量下限。结果显示,36种农药的LOQs为0.002 5~0.05 mg/kg(见表1),其中克百威、甲霜灵等13种农药的LOQ为0.002 5 mg/kg,噻吩磺隆、丙线磷等22种农药的LOQ为0.005 mg/kg,甲基异柳磷的LOQ为0.05 mg/kg。所有农药的LOQ均低于GB 2763-2014最大残留限量要求。
2.7 方法的回收率与精密度
采用基质匹配标准溶液-外标法定量,在花生基质中添加36种农药及其代谢物进行加标回收率实验,加标水平为0.005,0.01,0.1 mg/kg,每个加标水平重复6次。36种农药在3个加标水平下的平均回收率为70.4%~119%,相对标准偏差(RSD)为1.3%~19.4%。方法的准确度和精密度均符合残留分析的要求。

表1 36种农药的保留时间、MRM离子对、碰撞能量、定量下限(LOQs)以及花生基质中的加标平均回收率(0.1 mg/kg)和相对标准偏差(RSDs)(n=6)Table 1 Retention times(tR),MRM transitions,collision energies,LOQs,average recoveries and RSDs of 36 pesticides in peanut spiked at 0.1 mg/kg(n=6)
(续表1)
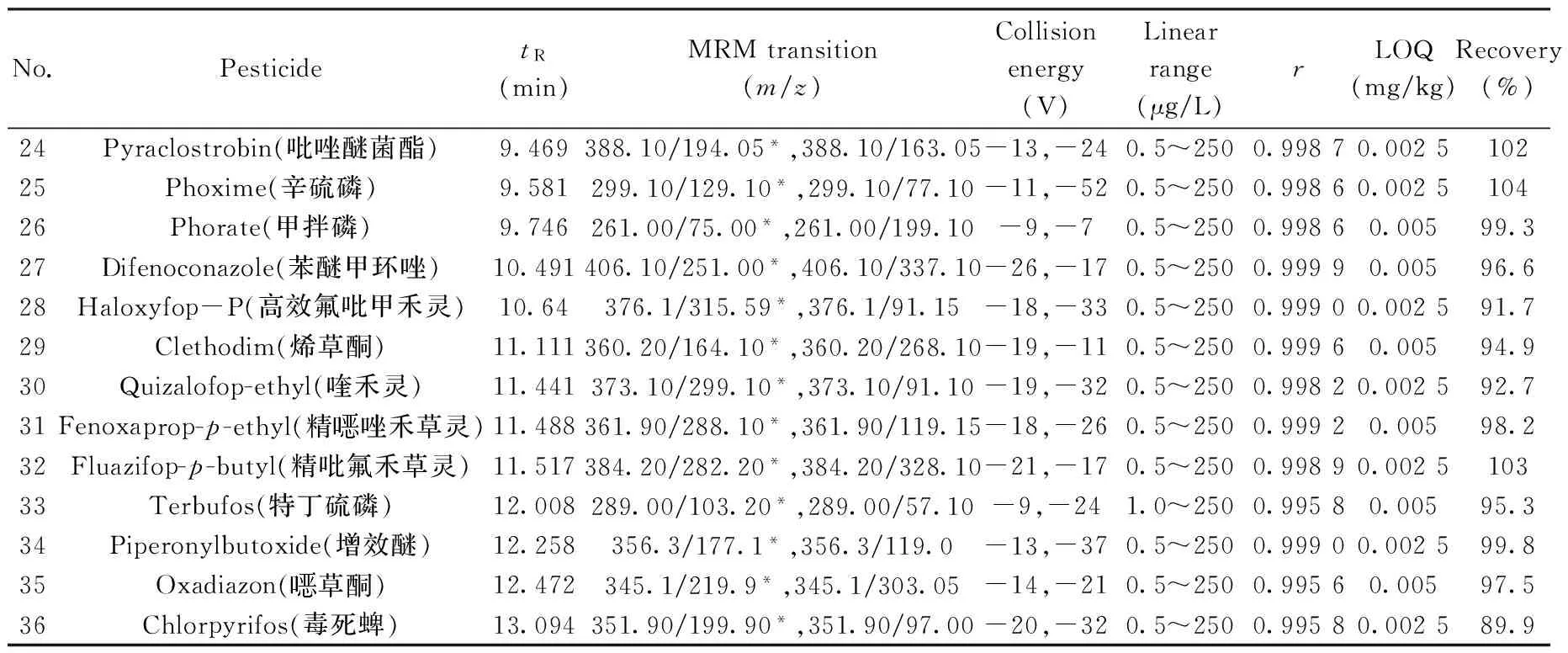
No.PesticidetR(min)MRMtransition(m/z)Collisionenergy(V)Linearrange(μg/L)rLOQ(mg/kg)Recovery(%)RSD(%)24Pyraclostrobin(吡唑醚菌酯)9.469388.10/194.05*,388.10/163.05-13,-240.5~2500.99870.00251023.425Phoxime(辛硫磷)9.581299.10/129.10*,299.10/77.10-11,-520.5~2500.99860.00251042.926Phorate(甲拌磷)9.746261.00/75.00*,261.00/199.10-9,-70.5~2500.99860.00599.35.827Difenoconazole(苯醚甲环唑)10.491406.10/251.00*,406.10/337.10-26,-170.5~2500.99990.00596.61.428Haloxyfop-P(高效氟吡甲禾灵)10.64376.1/315.59*,376.1/91.15-18,-330.5~2500.99900.002591.76.229Clethodim(烯草酮)11.111360.20/164.10*,360.20/268.10-19,-110.5~2500.99960.00594.96.330Quizalofop-ethyl(喹禾灵)11.441373.10/299.10*,373.10/91.10-19,-320.5~2500.99820.002592.75.631Fenoxaprop-p-ethyl(精唑禾草灵)11.488361.90/288.10*,361.90/119.15-18,-260.5~2500.99920.00598.23.332Fluazifop-p-butyl(精吡氟禾草灵)11.517384.20/282.20*,384.20/328.10-21,-170.5~2500.99890.00251033.333Terbufos(特丁硫磷)12.008289.00/103.20*,289.00/57.10-9,-241.0~2500.99580.00595.39.934Piperonylbutoxide(增效醚)12.258356.3/177.1*,356.3/119.0-13,-370.5~2500.99900.002599.82.435Oxadiazon(草酮)12.472345.1/219.9*,345.1/303.05-14,-210.5~2500.99560.00597.52.236Chlorpyrifos(毒死蜱)13.094351.90/199.90*,351.90/97.00-20,-320.5~2500.99580.002589.95.1
* quantitative ion
2.8 实际样品的测定
应用所建立的方法对超市和市场上购买的7个花生样品进行快速检测。其中4个花生样品被检测出含有毒死蜱残留(0.062,0.013,0.006 2,0.007 3 mg/kg),1个花生样品检出多效唑残留(0.002 7 mg/kg),但两种农药的检出量均未超出GB 2763-2014中规定的MRLs值。
3 结 论
本文采用UHPLC-MS/MS技术建立了花生中36种农药及其代谢物残留的定性、定量快速检测技术。样品经乙腈提取,EMR-Lipid除脂净化,最后经盐析萃取后上机分析。该方法简便、快速、灵敏,净化效果好,适用于花生样品中农药多残留的快速检测。
[1] Venkatachalam M,Sathe S K.J.Agric.FoodChem.,2006,54(13):4705-4714.
[2] Shimelis O,Yang Y H,Stenerson K,Kaneko T,Ye M.J.Chomatogr.A,2007,1165:18-25.
[3] Chen S A.FujianAnal.Test.(陈师安.福建分析测试),2012,21(1):8-11.
[4] Zhu Z Y,Feng M,He J,Xiong H X,Zeng Y.Chem.Anal.Meterage(朱臻怡,冯民,何健,熊华萱,曾义.分析化学计量),2010,19(1):19-21.
[5] Zheng Y B,Wang H Y.JournalofScienceofTeachersCollegeUniversity(郑永波,王海鹰.高师理科学报),2005,25(1):39-41.
[6] Pang S,Ding X X,Li P W,Zhou H Y,Jiang J,Deng X W,Du X H.Chin.J.OilCropSci.(庞帅,丁小霞,李培武,周海燕,姜俊,邓小伟,都晓慧.中国油料作物学报),2015,37(2):246-249.
[7] Fernández-Moreno J L,Arrebola-Liébanas F J,Garrido-Frenich A,Martinez Vidal J L.J.Chromatogr.A,2006,1111:97-105.
[8] Guardia-Rubio M,Marchal-López R M,Ayora-Caada M J,Ruiz-Medina A.J.Chromatogr.A,2007,1145:195-203.
[9] Bei F,Cui S H,Li J,Guo Q L,Lin L M.J.Instrum.Anal.(贝峰,崔淑华,李杰,郭庆龙,林黎明.分析测试学报),2012,31(Suppl):1-7.
[10] Cui S H,Guo Q L,Zhang F,Lin L M.Chin.J.Anal.Chem.(崔淑华,郭庆龙,张峰,林黎明.分析化学),2013,41(6):944-948.
[11] Zhan J,Li J D,Liu D H,Liu C,Yang G G,Zhou Z Q,Wang P.FoodChem.,2016,194:319-324.
[12] Chen X,Cheng L,Qu S C,Huang D L,Liu J C,Cui H,Jia Y B,Ji M S.Chin.J.Chromatogr.(陈溪,程磊,曲世超,黄大亮,刘佳成,崔晗,贾彦波,纪明山.色谱),2015,33(10):1080-1089.
[13] Lehotay S J,Mastovska K,Yun S J.J.AOACInt.,2005,88(2):630-638.
[14] Cunha S C,Lehotay S J,Mastovska K,Fernandes J O,Beatriz M,Oliveira P P.J.Sep.Sci.,2007,30:620-632.[15] Wu Y,Zhao W,Liu Y,Jiang B,Wei D X,Gou Y,Li L L,Han F,Zu Y G.Chin.J.Anal.Chem.(吴岩,赵伟,刘永,姜冰,魏东旭,勾越,李丽丽,韩峰,祖元刚.分析化学),2016,4(6):950-957.
[16] Chambers E,Wagrowski-Diehl D M,Lu Z L,Mazzeo J R.J.Chromatogr.B,2007,852(1/2):22-34.
Rapid Detection of 36 Pesticide Residues in Peanut by Ultra High Performance Liquid Chromatography-Tandem Mass Spectrometry
LI Ling-yun1,WU Hua2,XU Xiao-min1,LIN Huan1,HUANG Xiao-dong1,ZHENG Shu-ning1,LIU Xin-yan1,XU Dong-hui1*
(1.Key Laboratory of Biology and Genetic Improvement of Horticultural Crops,Ministry of Agriculture,Key Laboratory of Quality & Safety Control for Vegetable Products,Ministry of Agriculture,Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Beijing 100081,China;2.Agilent Technologies,Beijing 100102,China)
A multiresidue analytical method was developed for the rapid detection of 36 pesticides in peanut using ultra high performance liquid chromatography-tandem mass spectrometric technique(UHPLC-MS/MS).Peanut samples were extracted with acetonitrile,and then cleaned up with QuEChERS EMR-Lipid.The extract was detected by UHPLC-MS/MS.The positive ion mode and multiple reaction monitoring(MRM) mode were used to identify and quantify 36 pesticide residues in peanut.All pesticides had good linearity with correlation coefficients above 0.994.The average recoveries of the 36 pesticides ranged from 70.4% to 119% with relative standard deviations(RSDs) of 1.3%-19.4% at spiked levels of 0.005,0.01,0.10 mg/kg.The quantitation limits of this method were in the range of 0.002 5-0.05 mg/kg. With the advantages of simplicity,rapidness,sensitivity and good purifying effect,the method was suitable for the rapid determination of pesticide residues in peanut.
pesticide residues;peanut;enhanced matrix removal;ultra high performance liquid chromatography-tandem mass spectrometry(UHPLC-MS/MS)
10.3969/j.issn.1004-4957.2017.04.010
2016-10-24;
2016-11-30
国家蔬菜产品质量安全风险评估项目(GJFP2017002);国家重点研发计划项目(2016YFD0200200)
O657.63;F767.2
A
1004-4957(2017)04-0502-05
*通讯作者:徐东辉,研究员,研究方向:农产品质量安全,Tel:010-82106963,E-mail:xudonghui@caas.cn
