火龙果酵素中原花青素含量测定方法的建立
2017-04-27朱曼利郭会明孙宏韬李伟洪厚胜
朱曼利,郭会明,孙宏韬,李伟,洪厚胜,3*
火龙果酵素中原花青素含量测定方法的建立
朱曼利1,郭会明1,孙宏韬2,李伟2,洪厚胜2,3*
(1.南京工业大学化学与分子工程学院,江苏南京211800;2.南京工业大学生物与制药工程学院,江苏南京211800;
3.南京汇科生物工程设备有限公司,江苏南京210009)
采用香草醛-盐酸法对火龙果酵素中原花青素含量进行测定,考察反应温度、反应时间、香草醛质量浓度对溶液吸光度值的影响,并确定火龙果酵素中原花青素含量测定的方法。结果表明,原花青素含量的最适检测条件为1 mL火龙果酵素稀释液,5 mL 5 g/100 mL的香草醛甲醇溶液,4 mL 10%盐酸甲醇溶液,混匀后,35℃条件下显色反应20 min,在波长500 nm处测定吸光度值。精密度和重现性试验结果的相对标准偏差(RSD)值分别为1.23%和1.47%;平均回收率为99.5%~104.4%,RSD值为1.21%~2.11%。表明该法操作简便,精密度和重现性良好,准确性高,适用于火龙果酵素中原花青素含量的测定。
火龙果酵素;原花青素;香草醛盐酸法;测定
原花青素(proantho cyanidins)属于单聚体多酚物质[1],广泛存在于植物的花、果实、根茎中,常被用作功能性成分添加到保健品中[2]。据研究,这种类黄酮类物质是国际公认的天然植物抗氧化剂[3],其作用大,用途广。医学上,原花青素用来促进血液循环、保护视力,甚至能改善夜盲症患者的视力[4];与维生素C结合后有利于降低胆固醇含量[5];对皮肤病患者有抗过敏、滋润呵护的作用[6-7]。
火龙果(Hylocereus undulatusBritt)属于仙人掌科量天尺属植物,是一种富含维生素和水溶性膳食纤维的亚热带低能量多肉水果[8-9]。火龙果酵素是以火龙果为主要原料发酵而成的营养发酵液,是一类具有生物催化活性的物质总称,含天然植物发酵后的营养元素、益生菌等活性成分,其中丰富的超氧化物歧化酶(superoxide dismutase,SOD),脂肪酶、维生素等对人体机能修复、保健作用十分重要[10]。国内火龙果酵素工艺日趋成熟,塑形减肥产品、增强免疫保健产品等均为热门市售酵素产品[11]。由于原花青素结构的复杂性及测试方法的多样性,国内外并没有制定统一的对酵素产品标准定量的检测方法[12]。目前原花青素含量测试方法主要有正丁醇-盐酸法、香草醛法、铁盐催化法、Folin-Ciocaheau与高效液相色谱法(high performance liquid chromatography,HPLC)结合法、高铁盐-铁氰化钾分光光度法等。正丁醇-盐酸法应用较多,但易受酚类物质结构的影响,使测定结果偏低[13];铁盐催化法操作简便,特征明显,但是对反应体系中的含水量和铁离子浓度要求比较严格,因此重现性差[14];Folin-Ciocaheau与HPLC结合法结果相对准确,但得到的是原花青素的相对含量,不能作为定量分析的方法[15];高铁盐-铁氰化钾分光光度法是在铁盐催化反应的基础上确定原花青素含量与吸光度的关系,测试结果易受杂质的影响[16]。香草醛法操作方式较多,差别较大[17]。
本实验为探索香草醛-盐酸法检测火龙果酵素中原花青素含量的最佳测试条件,考察了反应温度、反应时间、香草醛质量浓度等对火龙果酵素中原花青素的影响,并确定适合火龙果酵素中原花青素含量的检测条件,以期为进一步测定保健饮品中原花青素含量提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
火龙果酵素原液:实验室自制;儿茶素标准品(纯度≥98%)、香草醛、甲醇、乙醇、盐酸(均为分析纯):天津尖峰天然产物有限公司;原花青素标准品(纯度≥98.5%):上海凌峰化学试剂有限公司。
1.2 仪器与设备
BSA124电子天平:赛多利斯科学仪器有限公司;FE20 pH计:梅特勒-托利多仪器有限公司;HH-6数显恒温水浴锅:常州国华电器有限公司;78-1磁力加热搅拌器:常州国华电器有限公司;UVmini-1240紫外分光光度计:日本岛津公司;3K15高速冷冻离心机:德国Sigma公司;手提式压力蒸汽灭菌器:上海华线医用核子仪器有限公司。
1.3 实验方法
1.3.1 火龙果酵素溶液的制备
取1 mL火龙果酵素原液5 000 r/min离心5 min,取上清液以蒸馏水稀释30倍,稀释后的酵素溶液备用。
1.3.2 标准品的选择及检测波长的确定
配制质量浓度为1.0 mg/mL的儿茶素和原花青素标准品溶液,准确吸取1 mL儿茶素标准品溶液(或原花青素标准品溶液)至试管中,分别加入5 mL 5 g/100 mL香草醛甲醇溶液,4 mL 10%盐酸甲醇溶液,并于刻度试管中摇匀,于35℃水浴中反应20 min,以甲醇为空白对照,在波长350~750 nm范围进行全波段扫描,并确定最大吸收波长。
1.3.3 标准曲线的绘制
分别吸取1.0mg/mL儿茶素标准溶液各0.05mL、0.10mL、0.15 mL、0.20 mL、0.25 mL、0.30 mL、0.35 mL、0.40 mL、0.45 mL、0.50 mL于刻度试管中,以甲醇定容至1 mL,配制成质量浓度分别为0.05 mg/mL、0.10 mg/mL、0.15 mg/mL、0.2mg/mL、0.25mg/mL、0.3mg/mL、0.35mg/mL、0.40mg/mL、0.45mg/mL、0.50mg/mL的系列梯度溶液,摇匀后加入5 mL 5g/100mL香草醛甲醇溶液,4mL10%盐酸甲醇溶液,混匀,以甲醇为空白对照,35℃恒温反应20 min后于波长500 nm处测定吸光度值,以儿茶素标准品质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。按照标准曲线回归方程计算样品中原花青素含量。
1.3.4 火龙果酵素与香草醛—盐酸反应的影响因素
反应温度的影响:取1mL火龙果酵素稀释液于试管中,加入5 mL 5 g/100 mL香草醛甲醇溶液,4 mL 10%盐酸甲醇溶液,摇匀,以甲醇为空白对照,分别在10℃、20℃、30℃、40℃、50℃、60℃条件下反应20 min,在波长500 nm处测定吸光度值。考察反应温度对火龙果酵素与香草醛—盐酸反应后溶液吸光度值的影响[18]。
香草醛质量浓度的影响:当香草醛甲醇溶液质量浓度分别为1 g/100 mL、2 g/100 mL、3 g/100 mL、4 g/100 mL、5 g/100 mL、6 g/100 mL时,考察香草醛质量浓度对火龙果酵素与香草醛—盐酸反应后溶液吸光度值的影响。
反应时间的影响:当反应时间分别为10 min、20 min、30 min、40 min、50 min、60 min时,考察反应时间对火龙果酵素与香草醛—盐酸反应后溶液吸光度值的影响。
1.3.5 测定方法的评价[19-21]
通过精密度、重复性、加标回收率试验,判断所建立的火龙果酵素中原花青素检测方法是否稳定、可靠和准确。回收率计算公式如下:
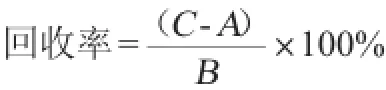
式中:A为样品所含被测成分的质量浓度,mg/mL;B为加入
标准品的质量浓度,mg/mL;C为实测值,mg/mL。
2 结果与分析
2.1 标准品的选择及最大吸收波长的确定
儿茶素和原花青素标准品在波长350~750 nm范围进行全波长扫描,结果见图1。
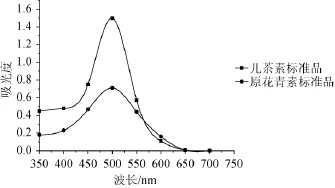
图1 儿茶素及原花青素标准品紫外扫描图Fig.1 UV scanning graph of catechin and proanthocyanidins standard substance
由图1可知,儿茶素标准品和原花青素标准品显色反应后,溶液的最大吸收波长均为500 nm,以儿茶素为标准品时,吸光度值比原花青素标准品高很多,灵敏度也高,且经济成本较低,故选择儿茶素为标准品较为合适,且测定最大吸收波长为500 nm。
2.2 标准曲线的制作
按照1.3.3实验步骤,以儿茶素标准品质量浓度(X)为横坐标,吸光度值A500nm(Y)为纵坐标,绘制标准曲线,结果如图2所示。由图2可知,标准曲线回归方程为Y=2.034 3X+ 0.046 7,相关系数R2=0.996 3,结果表明在0.1~0.45 mg/mL范围内,儿茶素质量浓度与吸光度值具有良好的线性关系。
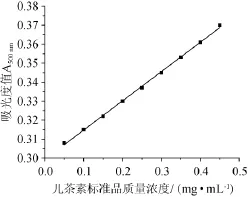
图2 儿茶素标准曲线Fig.2 Standard curve of catechin
2.3 火龙果酵素与香草醛—盐酸反应的影响因素
2.3.1 反应温度的影响
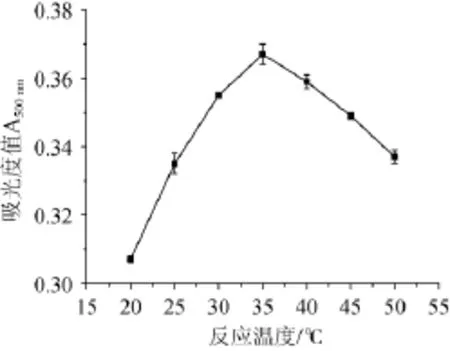
图3 反应温度对原花青素吸光度值的影响Fig.3 Effect of reaction temperature on absorbance value of proanthocyanidins
由图3可知,随着反应温度的增加,火龙果酵素与香草醛显色反应溶液的吸光度值呈先增加后减小的趋势,温度的升高使香草醛—盐酸与火龙果酵素稀释液中原花青素显色反应强烈,吸光度值变高,当反应温度为35℃时,反应溶液吸光度值达到最大;当反应温度超过35℃后,吸光度值快速减小,因此确定最适宜反应温度为35℃。
2.3.2 香草醛质量浓度的影响
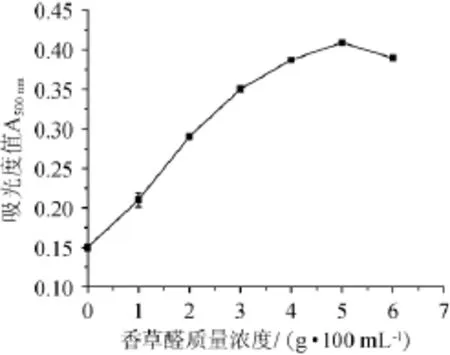
图4 香草醛质量浓度对原花青素吸光度值的影响Fig.4 Effect of vanillin concentration on absorbance value of proanthocyanidins
由图4可知,随着香草醛质量浓度的增加,吸光度值先迅速增加后趋于平缓,当香草醛质量浓度为5 g/100 mL时,吸光度值达到最大,继续增加香草醛质量浓度,吸光度值变化不大,为避免香草醛浓度过高而引起自身缩合发生变色的情况,最佳香草醛质量浓度采用5 g/100 mL。
2.3.3 反应时间的影响

图5 反应时间对原花青素吸光度值的影响Fig.5 Effect of reaction time on absorbance value of proanthocyanidins
由图5可知,吸光度值随反应时间的延长先增后减,当反应20 min时,吸光度值达到最大,反应20 min后,光照及显色反应过程中香草醛自身缩合引起吸光度值不断减小,最终趋于平缓。此时香草醛和火龙果中原花青素的显色得到充分反应,因此,确定最佳反应时间为20 min。
2.4 测定方法的评价
2.4.1 精密度试验
精确吸取1 mL火龙果酵素稀释液,按照优化后的测定方法,平行测定6次,计算原花青素的质量浓度及其相对标准偏差(relativestandarddeviation,RSD),结果见表1。由表1可知,检测结果RSD值为1.23%,表明该方法精密度良好。

表1 精密度试验结果Table 1 Results of precision tests
2.4.2 重复性试验
为验证方法的重现性,精密吸取1 mL火龙果酵素稀释液6份,此测定由不同测试人员在同一台仪器上完成,按照优化后测定方法,测定火龙果酵素中原花青素的吸光度值,计算原花青素的质量浓度,结果如表2所示。由表2可知,重复测定6次检测结果的RSD值为1.47%,表明该方法具有较好的重现性。

表2 重现性试验结果Table 2 Results of reproducibility tests
2.4.3 回收率试验
取火龙果酵素稀释溶液1mL,加入质量浓度为1.2 mg/mL、2.5 mg/mL、3.7 mg/mL的儿茶素标准溶液,按照优化后测定方法,测定火龙果酵素中原花青素的吸光度值,计算原花青素的含量,每组试验平行测定6次,并计算其回收率,结果如表3所示。由表3可知,原花青素的平均回收率为99.5%~104.4%,RSD为1.21%~2.11%。表明该方法准确度高,符合检测方法标准,可用于火龙果酵素中原花青素的检测。
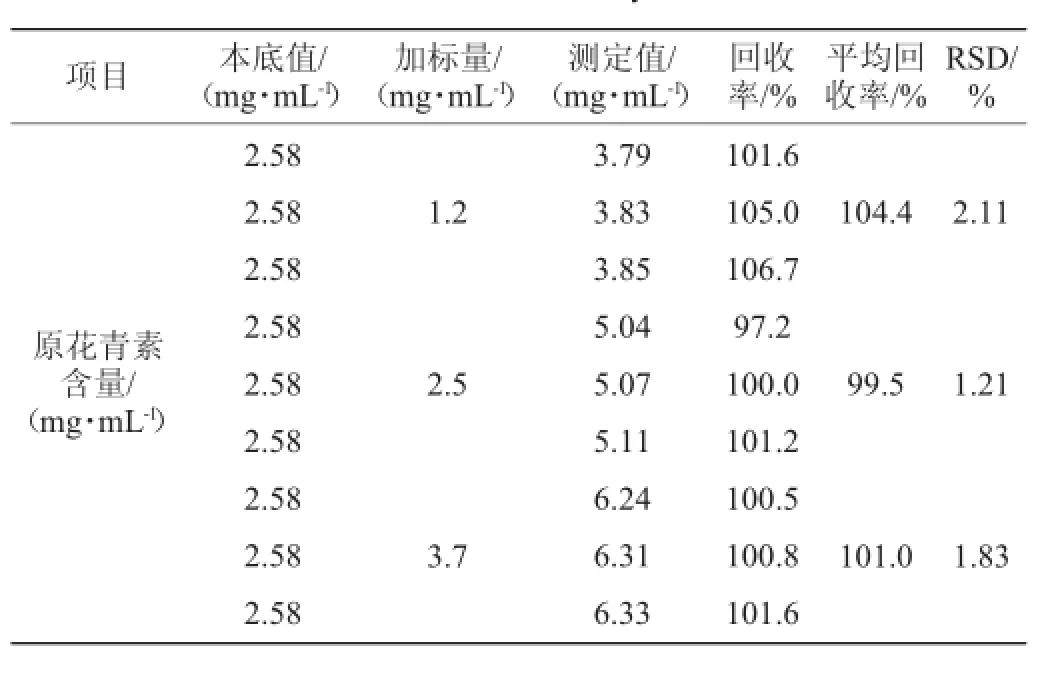
表3 回收率试验结果Table 3 Results of recovery rate tests
2.5 火龙果酵素中原花青素含量的测定

表4 不同火龙果酵素样品中原花青素含量的检测结果Table 4 Detection results of proanthocyanidins content in different pitaya enzyme
由表4可知,市售5种不同的火龙果酵素中原花青素含量有所差异,其中广州康滢生物科技有限公司生产的火龙果酵素产品中原花青素含量最高,为3.42 mg/mL。
3 结论
本实验采用香草醛-盐酸法建立火龙果酵素中原花青素含量的测定方法,同时考察了反应温度、时间、香草醛质量浓度对反应溶液吸光度值的影响,最终确定适合火龙果酵素中原花青素含量测定的方法。结果表明,香草醛-盐酸法测定火龙果酵素中原花青素含量的最适条件为:1 mL火龙果酵素溶液,5mL5g/100mL的香草醛甲醇溶液,4mL 10%盐酸甲醇溶液,混匀后35℃条件下显色反应20 min后在波长500 nm处测得吸光度值。在此条件下,该法操作简便,精密度和重现性试验结果的RSD值分别为1.23%和1.47%,平均回收率为99.5%~104.4%,RSD为1.21%~2.11%,表明该法具有较好的精密度、重现性,且回收率较高,适用于火龙果酵素中原花青素含量的测定。为火龙果酵素中原花青素含量提供有效的检测方法。
[1]董银卯,何聪芬,王领,等.火龙果酵素生物活性的初步研究[J].食品科技,2009,34(3):192-196.
[2]周秋枝,黄蕾,沈丹华,等.火棘果中原花青素含量测定方法的建立[J].食品工业科技,2013,34(7):314-318.
[3]孟玉彩,赵文,李慧玲,等.蔷薇红景天中原花青素含量的测定方法[J].食品研究与开发,2009,30(4):133-136.
[4]李利敏.八种油茶蒲提取物活性物质研究及其抗氧化活性比较[D].杭州:浙江大学,2013.
[5]夏宏义,杨勇,夏乐晗,等.柿果成熟过程中总酚和缩合单宁含量的变化[J].食品科学,2014,35(19):66-71.
[6]谭美亭.莲房原花青素的提取与分离纯化工艺研究[D].郑州:郑州大学,2012.
[7]孙皓,伍丽娜.石油醚提取葡萄籽中原花色素工艺研究[J].安徽农业科学,2012,40(25):12669-12670.
[8]张妍,吴秀香.原花青素研究进展[J].中药药理与临床,2011(6):112-116.
[9]张晶莹,胡文效,高德艳,等.葡萄籽原花青素检测方法的比较[J].中外葡萄与葡萄酒,2013(6):18-20.
[10]黄启亮.松针原花青素的制备及主要生物活性研究[D].金华:浙江师范大学,2012.
[11]张素华.沙棘及其提取物中原花青素含量的分析测定[J].沙棘,2008,21(1):16-18.
[12]杨磊,苏文强,汪振洋,等.落叶松树皮提取物中低聚原花青素含量测定方法的研究[J].林产化学与工业,2004,24(s1):111-114.
[13]陶钰.山竹果皮植物多酚及其抗氧化活性的研究[D].南宁:广西大学,2009.
[14]蒋其忠.茶籽壳原花青素的分离纯化、稳定性及抗氧化活性研究[D].合肥:安徽农业大学,2010.
[15]鄢又玉,夏婷,张育,等.三氯化铝比色测定火棘总黄酮方法的系统考察[J].食品研究与开发,2015,36(5):89-94.
[16]魏征,段汉林,李坤.一种能调节人体新陈代谢、分解体内脂肪的火龙果酵素制剂及制备方法:CN103960657A[P].2014-08-06.
[17]徐慧,王秋玲,韦刚,等.火龙果的保健功效及其研究进展[J].广西科学院学报,2010,26(3):383-385.
[18]李春阳,许时婴,王璋.香草醛-盐酸法测定葡萄籽、梗中原花青素含量的研究[J].食品科学,2004,25(2):157-161.
[19]何肖,王文凯,马明波,等.香草醛盐酸法定量薯莨色素提取液中的缩合单宁[J].现代纺织技术,2014,22(6):5-8.
[20]姚开,何强,吕远平,等.葡萄籽提取物中原花青素含量的测定[J].食品与发酵工业,2002,28(3):17-19.
[21]单虹丽,卿钰,杜晓,等.茶叶儿茶素总量比色测定的盐酸(硫酸)香草醛显色反应能力评价[J].林产化学与工业,2012,32(3):71-76.
Establishment of determination method of proanthocyanidins content in pitaya enzyme
ZHU Manli1,GUO Huiming1,SUN Hongtao2,LI Wei2,HONG Housheng2,3*
(1.College of Chemistry and Molecular Engineering,Nanjing Tech University,Nanjing 211800,China; 2.College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China; 3.Nanjing Highke Biotechnology Equipment Co.,Ltd.,Nanjing 210009,China)
The content of proanthocyanidins in pitaya enzyme was determined by vanillin-HCl method.The effects of reaction temperature,time and vanilline content on solution absorbance values were investigated,and the determination method of proanthocyanidins content in pitaya enzyme was established.The results showed that the optimum detection conditions were pitaya enzyme dilute solution 1 ml,5 g/100 ml vanillin methanol solution 5 ml,10%HCl methanol solution 4 ml,after blending,the reaction was carried out at 35℃for coloration 20 min and then absorbance value was detected at the wavelength of 500 nm.The relative standard deviation(RSD)of precision and reproducibility tests results were 1.23%and 1.47%, respectively.The average recovery rate 99.5%-104.4%,RSD was 1.21%-2.11%,which indicated that the method was easy and simple,and had good precision and reproducibility and high accuracy,and was suitable for the determination of proanthocyanidins content in pitaya enzyme.
pitaya enzyme;proanthocyanidins;vanillin-HCl method;determination
TS261.7;TS218;TQ920
0254-5071(2017)04-0184-04
10.11882/j.issn.0254-5071.2017.04.038
2016-12-19
国家高技术研究发展计划‘863计划’(2012AA021201)
朱曼利(1992-),女,硕士研究生,研究方向为改善肠胃中药酵素的制备工艺及其功能特性。
*通讯作者:洪厚胜(1965-),男,教授,博士,研究方向为生物过程装备。
