热力学统计物理课程中的化学势
2017-04-25何开华
万 淼,何开华,吕 涛
(中国地质大学(武汉) 数学与物理学院, 湖北 武汉 430074)
热力学统计物理课程中的化学势
万 淼,何开华,吕 涛
(中国地质大学(武汉) 数学与物理学院, 湖北 武汉 430074)
对大学本科《热力学统计物理》课程中的“化学势”这一概念进行了探讨,然后推导了化学势在热力学和统计物理两部分中的多种表达式,分析得到其物理含义是系统粒子数目改变时系统能量的改变量.最后讨论了化学势在统计物理和热力学中的理论应用以及在相变和化学反应中的实际应用,通过这些实例加深了学生对化学势的理解.
化学势; 热力学统计物理; 热力学第一定律; 相变; 化学平衡
热力学统计物理是研究物质热现象和热运动规律的重要物理学科,它概念多且抽象,方法多且灵活,所涉及的学科也较多,因此,它是物理专业本科生必修的难度最大的课程之一.无论是热力学部分,还是统计物理部分,都引入了“化学势”这一重要的物理量,它不仅会在大学本科生的后续物理课程里出现,而且还会在平衡化学、电化学、半导体物理和固体材料学等学科里得到广泛应用.
化学势最初是由美国工程师、化学家、理论物理学家吉布斯(Josiah Willard Gibbs)在研究化学反应和不同化学物质的状态时提出的[1]:即假设我们将无穷小量的任何物质放入静水压力下的任何均匀系统中(该均匀系统仍保持均匀,而且熵和体积也不变),那么该均匀系统的能量的增量除以加入的物质的量,就是该系统中此物质的化学势.
根据多年本科教学的经验我们发现,一些教科书仅直接从吉布斯函数的全微分给出化学势的定义,然而该定义显得突兀强硬,以至于学生难以理解[2-3].化学势的概念和应用贯穿了课程始终,但其表达形式多样,含义亦不甚明确,学生普遍感到混乱,难以对其加以应用.针对这种现象,本文从学生熟悉的热力学第一定律出发来引入“化学势”这一概念,并从热力学和统计两方面阐述其含义,最后通过分析化学势在物理和化学中的应用来加深学生对这一概念的理解.
1 化学势的表达式
1.1 热力学中的化学势 在前期课程《热学》里曾讲授过热力学第一定律:即系统在终态B和初态A的内能之差UB-UA等于在过程中系统从外界吸收的热量与外界对系统所做的功之和.也就是说,做功和(或)传热所传递的能量都转化为系统的内能.其数学形式可写为:UB-UA=Q+W.如果系统经历的是一个无穷小的过程,则可以表示为[2]:
dU=Q+W,
(1)
这里,dU是系统内能的变化,Q是系统从外界吸收的热量,W是外界对系统所做的功.由于Q和W不是态函数,所以用表示微分式而非完整微分.上式中的初态和末态都是平衡态,但过程所经历的中间状态并不需要是平衡态,因此对非静态过程也适用.
上述热力学第一定律概括了所有自然现象的能量守恒原理,包含了传热和做功,即此时热力学系统只与外界交换功和(或)热量.现在我们把系统与周围环境的交互扩展到“物质的交换”,为了简单,我们考虑了物质量n为的单相系.内能由于其广延性,依赖于总的物质的量.对于物质的量产生变化(dn)的任一无穷小过程,(1)式可以扩展为[4]:
dU=Q+W+μdn,
(2)
可见μ为强度量,被称为化学势.
通过态函数熵表达传热量,仅考虑体积膨胀功,并将系统扩展为多组元系统,则(2)式可以改写为:
(3)
μi是组元i(原子、分子或原子核)的化学势,T是热力学系统的绝对温度,P是系统的压强,dS和dV分别是热平衡时系统的熵S和体积V的无限小变化量,dni是i组元粒子数目ni的无限小变化量.如果除了体积膨胀功还有其他形式的功,例如电场磁场做功,那么还应在上式中加上其他的功.
化学势和所有其他的强度量一样,可以通过热力学基本方程来加以定义,从(3)式可以得到化学势的表达式为:
(4a)
该表达式既适用于可逆过程,又适用于不可逆过程.
对凝聚态系统而言(例如化学溶液),上述表达式并不方便,因为当粒子数增加时难以控制体积和熵为常数,此时可以用更方便一些的化学势的表达式.即通过做勒让德变换,得到另一个热力学势——吉布斯函数G=U+pV-TS.它的微分是dG=dU+pdV+Vdp-TdS-SdT,代入(3)式可得
(5)
因此化学势的另一表达式则为:
(4b)
在确定的温度和压强下,系统吉布斯函数的变化则可以简写为
(6)
同理,可由焓H=U+pV和自由能F=U-TS得到化学势的另外两个表达式:
(4c)
(4d)
化学势的不同的表达方式都是相当的,这意味着它们有着相同的物理含义;但是却可以有选择地在不同条件下进行使用:化学势是一摩尔物质在等熵等容下的内能,是一摩尔物质在等熵等压下的焓,是一摩尔物质在等温等容下的自由能,是一摩尔物质在等温等压下的吉布斯函数.需要注意的是:化学势具有能量的量纲.
1.2 统计物理中的化学势 下面我们将从热力学的宏观态过渡到统计物理的微观态.在热力学极限条件下,即N→∞,V→∞(但N/V粒子数密度n固定),系统所有可能的微观状态的实际数目用Ω(N,E,V)表示.考虑两个分别处于平衡态的系统,它们的宏观态则应该分别用Ni,Ei,Vi描述,可能的微观态数分别用Ωi(Ni,Ei,Vi)表示,其中(i=1,2).假设将这两个系统进行热接触,组成一个大的孤立系统,即允许粒子的交换、能量的交换、和各自体积的改变,但是总粒子数、总能量、和总体积都不变.当这个由两个子系统组成的大的孤立系统达到平衡态时,平衡条件为[5]:
(7a)
(7b)
(7c)
如果定义:
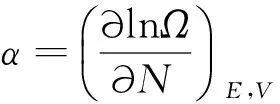
则(7)式可写为α1=α2,β1=β2,γ1=γ2.为了确定α,β,γ的物理意义,可将下面(8),(9)两个全微分式进行分析和比较:
d lnΩ=βdE+γdV+αdN,
(8)
开系的热力学基本方程:
(9)
可得:
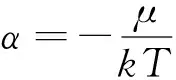
上式与热力学中的热动平衡条件μ1=U2,T1=T2,p1=p2相当.
由玻尔兹曼关系S(N,E,V)=klnΩ(N,E,V),并结合(9)式可得:
即
(10a)
(10b)
(10c)
(10)式与热力学的(3)式所表达的内容相同.(10b)式与热力学中化学势的表达式(4a)含义一致.
以上讨论实际上是基于以为参量的微正则系综,如果在以为参量的正则系综里,化学势则可以表示为:
(11)
(11)式与热力学中化学势的表达式(4d)含义一致.无论是(10b)式还是(11)式,都反映出化学势是系统粒子数目改变时,系统能量的改变量;这一点在热力学的(4)式中也有所表达.
2 化学势的应用举例
2.1 在物理中的应用 以上(4)、(10b)和(11)式都是化学势的表达式,在具体应用中,要根据系统的参量来选择合适的状态函数,从而选择合适的表达式来计算化学势.例如,通过玻尔兹曼统计分析理想气体时,单原子分子的理想气体的配分函数为:
可见,配分函数是T和V的函数,因此,应该选择(11)式进行计算化学势:
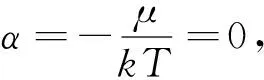
金属中的自由电子气体是强简并的费米气体,因此不能使用经典统计,而得用费米统计进行分析.在体积V内,在ε~ε+dε的能量范围内,电子的平均电子数为:
对其进行积分:
可见,化学势μ是温度T和电子密度N/V的函数.温度为0K时,电子气体的化学势也称为费米能级,是0K时电子的最大能量.类似上式,对电子总数进行积分,可得:
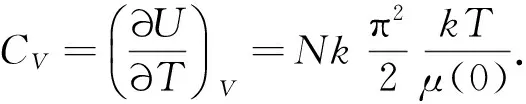
通过化学势能推导出热力学中的吉布斯-杜亥姆方程(Gibbs-Duhem relation),该方程描述了热力学系统中各组分化学势的变化量之间的关系[6],例如二元系在确定的温度和压强下,各组分的化学势有如下关系n1dμ1+n2dμ2=2.该方程推导如下,根据化学势的表达式(4b)式,可以将吉布斯函数写成:
则全微分式为:
将(5)式代入上式,可得吉布斯-杜亥姆方程:
从该方程可以看到,在确定的温度和压强下,各组元的物质的量和各自化学势的变化量必须满足一定的条件,即两部分乘积之和必须为零.
化学势在相变的研究中是必不可少[7-8],通常是通过一个常量来描述相变的热力学过程,例如冰的融化能够通过温度来描述,即熔点(固相和液相两相平衡时的温度).一杯带有冰块的水,当温度高于0 ℃时,水分子呈液相,因为液相的水分子的化学势低于固相的水分子的化学势;当一些冰融化了,水分子开始从固相转变为化学势更低的液相,所以冰块开始变小;当温度低于0 ℃时,固相的水分子具有更低的化学势,所以冰块开始变多;当温度刚好等于熔点0 ℃时,水和冰的化学势是相等的,冰块既不增多也不减少,系统处于平衡状态.
如同重力势能一样,化学势是势能的一种泛化,利用化学势的概念很容易解释一些物理现象,如球从山上滚落到山下时,球是从重力势能高的地方运动到重力势能低的地方;类似地,当分子经历溶解、熔化、反应等过程时,它们总是自发地从化学势高处转向化学势低处,且分子数目发生了变化,例如,溶解于均匀系的分子的自发扩散过程.对于确定的温度,分子在浓度高的地方具有高的化学势,在浓度低的地方具有低的化学势.分子从化学势高处运动到化学势低处,伴随着自由能的释放.
2.2 在化学中的应用 化学势在有些领域也被称为总化学势,它被分为内部化学势和外部化学势,分别来源于内部因素(密度、温度和焓等)和外力场(电势能差、重力势能差等)[9].特别是在电化学、半导体物理和固体物理中,化学势是指内部化学势,而用电化学势来特指总化学势[9-11].电化学势完全表征了离子运动所受到的影响,而化学势包含了除电力以外的所有影响因素,例如在电化学中,离子不总是从化学势高处运动到低处,但是它们一定时从电化学势高处运动到低处.
化学势在化学中应用广泛[12-13],包括熔化、沸腾、蒸发、溶解度、渗透、分配系数、液液萃取和色谱分析法等,例如盐酸分解(HCl=H++Cl-,当盐酸分子分解时,没有分解的分子的浓度在减小,而生成的离子的浓度在增加;所以盐酸分子的化学势在减小,正负离子的化学势之和在增加;当反应物和生成物的化学势相等时,系统则处于平衡态,反应不再向正方向也不再向反方向进行了.在热平衡态下,系统T和P压强确定时(但是可以和外界交换粒子个数),系统的吉布斯函数最小,因此有dG=0,结合前面讨论得到的(6)式可得:
如果上式未被满足,化学反应的方向势必使吉布斯函数减少,即
可见,利用化学势可以判断化学反应进行的方向,并为化学反应提供建立平衡常量的方法.
3 结 语
化学势是热力学统计物理中举足轻重的一个物理量,正确理解和掌握化学势这一概念很重要.学生在学习该门专业课时,已经在大学一年级的《热学》课程里学习过热力学三大定律,我们从学生熟悉的热力学第一定律着手,与传热和做功作类比,通过内能的广延性,引入化学势这一强度量.这么做由浅入深,顺理成章,逻辑清晰,在对过去253位学生的调查里,有82.6%的学生表示,这种方法比书中直接定义化学势就是摩尔吉布斯函数“更加容易理解”,只有4.4%的学生表示跟书中直接给出的定义“差不多”.我们曾以小论文或课堂讨论的形式促使学生做与“化学势”相关的调研,希望通过应用举例来加深学生对“化学势”的理解,其中28.3%的学生觉得“明显有效”,而58.7%的学生觉得“一般有效”.
[1]Gibbs.J.W.Ontheequilibriumofheterogeneoussubstances[J].TransactionsoftheConnecticutAcademyofArtsandSciences,1876,3:108-248.
[2] 汪志诚.热力学统计物理 [M].第4版.北京:高等教育出版社,2008.
[3] 马本堃,高尚惠,孙煜.热力学与统计物理学 [M].第2版.北京:高等教育出版社,1996.
[4]LandauL.D.,Lifshitz.E.M.StatisticalPhysics[M].第3版.北京:世界图文出版公司,1999.
[5]Pathria.R.K.StatisticalMechanics[M].第2版.北京:世界图文出版公司,2003.
[6]MorandiG.,Napoli,F.Ercolessi.E.StatisticalMechanics[M].第2版.北京:世界图文出版公司,2004.
[7]Smirnov.B.M.Berry.R.S.PhaseTransitionsofSimpleSystems[M].北京:北京大学出版社,2013.
[8]Hillert.M.PhaseEquilibria,PhaseDiagramsandPhaseTransformations:TheirThermodynamicBasis[M].2ndEdition.北京:北京大学出版社,2014.
[9]Ganguly.J.ThermodynamicsinEarthandPlanetarySciences[M].BerLin:Springer,2008.
[10] 阿伦·J. 巴德, 拉里·R. 福克纳. 电化学方法原理和应用[M].第2版.邵元华,朱果逸,董献堆,张柏林,译.北京:化学工业出版社,2005.
[11]Economou.E.N.ThePhysicsofSolids[M].北京:世界图书出版公司,2014.
[12]Reif.F.BerkeleyPhysicsCourse[M].北京:机械工业出版社,2014.
[13]Hillert.M.PhaseEquilibria,PhaseDiagramsandPhaseTransformations:TheirThermodynamicBasis[M].2ndEdition.北京:北京大学出版社,2014.
Chemical Potential in Thermodynamics and Statistical Physics
Wan Miao, He Kaihua, Lv Tao
(China University of Geosciences (Wu Han), School of Mathematics and Physics, Wuhan 430074, China)
In the report, the chemical potential in the course of Thermodynamic and Statistical Physics for the undergraduates was discussed, the various expressions of the chemical potential in thermodynamics and statistical physics parts were deduced, the conclusion that its physical significance is the change of the system energy when the number of particles was changed was obtained. At last, the theoretical and practical application of the chemical potential and its practical application in phase transition and chemical reaction were discussed, which deepen the understanding of the students about the chemical potential.
chemical potential; thermodynamics & statistical physics; First Law of Thermodynamics; phase transition; chemical equilibrium
2016-12-01
国家自然科学基金资助项目(41474067);中国地质大学教学研究项目(2015A31)
万淼(1980-),女,湖北武汉人,讲师,博士,主要从事大学物理教学与凝聚态物理研究工作.E-mail:wmwhdz@163.com
1004-1729(2017)01-0088-06
O414
A DOl:10.15886/j.cnki.hdxbzkb.2017.0016
