模拟体系中Ph IP的产生规律及抑制作用研究
2017-04-20于春娣邵泽平张燕王硕
于春娣,邵泽平,张燕,王硕,*
(1.教育部食品营养与安全重点实验室,天津科技大学,天津300457;2.青岛农业大学食品科学与工程学院,山东青岛266109)
模拟体系中Ph IP的产生规律及抑制作用研究
于春娣1,2,邵泽平1,张燕1,王硕1,*
(1.教育部食品营养与安全重点实验室,天津科技大学,天津300457;2.青岛农业大学食品科学与工程学院,山东青岛266109)
杂环胺(Heteryclic Aromatic Amines,HAAs)是富含蛋白质的食物在烤、炸、煎等热加工过程中产生的一类有害物质,在Ames实验中表现出潜在的致突变性和致癌性。以日常热加工肉类食品中产生量最多的杂环胺PhIP(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine)为研究对象,考察了在溶液模拟体系中,不同摩尔量的前体物质,加热温度和加热时间下PhIP的产生规律。采取超声波辅助提取了甘薯叶中的黄酮类物质,提取物对模拟体系中PhIP生成具有明显的抑制作用,抑制率为67.31%。其抑制率大小高于槲皮素、芦丁、甘草素和葛根素。
模拟体系;杂环胺;甘薯叶;黄酮类物质
近年来,人们对食品安全的关注程度不断提升,不仅关注食品中的农药残留和兽药残留等各种化学性危害,食品加工过程中所带来的安全问题也逐渐进入人们的视野,其中,在高温加热肉类食品时出现的一类具有潜在强致癌性和致突变性的物质——杂环胺,最近三十年受到全世界科学家们的关注[1]。杂环胺是一类带杂环的伯胺,主要是由含蛋白质丰富的食物(尤其是肉类食品)在烤、炸、煎过程中,蛋白质和氨基酸发生热解反应产生的,至今,在烹调的各类食品中发现并分离鉴定出超过30种的杂环胺[1]。杂环胺类化合物具有致突变性和致癌性的特殊毒性作用,是目前通过Ames实验检测到的最有突变活力的化合物,致突变能力远远大于多环芳烃(PAHs),其中有大多数已被证明可致使实验动物的器官组织生成多种肿瘤[2]。国际肿瘤研究机构(IARC)把杂环胺2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline(MeIQx)和PhIP划分为可能致癌物(2B)[3]。
在人类的日常饮食生活中,几乎每天都会食用高温加工的肉类食品,杂环胺的摄入就无法避免,因此,如何减少人类日常饮食中杂环胺的产生,以及如何避免杂环胺的摄入引起的人类健康隐患,成为目前迫切需要解决的食品安全问题。在PhIP的模拟体系中添加黄酮类物质是一种简单实用的抑制PhIP形成的方法。黄酮类物质来源广泛,主要来自于水果、蔬菜、茶、葡萄酒、植物的种子或是植物根,获得方法也较为简单。黄酮类物质作为天然抗氧剂的一种,对杂环胺的生成影响比较大。近年来,国内外已经有许多研究人员报道了在肉类食品加工过程中加入黄酮类物质可以有效抑制杂环胺的形成。Ka-Wing Cheng等[4]实验证实了柚皮素对PhIP具有抑制作用,我们研究小组也发现了几种黄酮类物质对PhIP的生成具有抑制作用[5]。
甘薯叶大多数被废弃,但是,甘薯叶中含有大量的黄酮类物质,这些物质具有抗氧化、抗癌、抗突变、增强免疫力等作用。基于甘薯叶黄酮类物质的这些作用,本实验采用超声波辅助提取了甘薯叶中的黄酮类物质,以日常热加工肉类食品中产生量最多的PhIP为研究对象,考察了在溶液模拟体系中,甘薯叶黄酮类物质对其生成量产生的影响,并与槲皮素,芦丁,甘草素和葛根素对PhIP的生成量影响进行了比较。为进一步开发利用甘薯叶这一资源提供科学的理论依据,为实现食品热加工过程中PhIP的有效控制提供应用基础。
1 材料与方法
1.1 试剂与材料
PhIP标准品:加拿大Toronto公司;芦丁标准品:日本TCI公司;色谱纯甲醇:德国Merck公司;槲皮素、葛根素、甘草素、甲酸和甲酸铵:百灵威科技有限公司(上海);乙酸铵、二甘醇、肌酐和苯丙氨酸:美国sigma公司;乙醇、氢氧化钠、硝酸铝和亚硝酸钠等均购于天津国药集团化学试剂有限公司。
甘薯叶购于山东省莱阳市一农家(2013年9月),将新鲜的甘薯叶洗净后,晒干,粉碎,用80目筛过后置于干燥器内,待用。
HyperSep C18(200mg/5mL):美国Thermo Scientific公司;丙磺酸阳离子交换柱(200mg/5mL):加拿大SILICYCLE公司。
1.2 仪器与设备
Agilent6410三重四极杆串联质谱仪(电喷雾离子源ESI):美国Agilent公司;Milli-Q纯水仪:美国Millipore公司;干浴加热器(SBH200D/3):英国BIBBY公司;固相萃取仪:美国SUPELCO公司;紫外可见分光光度计:上海尤尼柯仪器有限公司;酸度仪:瑞士METTLER-TOLEDO公司。
1.3 甘薯叶黄酮类物质的提取与含量测定方法
在王玫等[6]的提取甘薯叶中的黄酮方法的基础上,进行了改动,主要步骤为:称取5.0 g甘薯叶粉末于250mL具塞锥形瓶中,加入200mL 80%乙醇溶液,浸泡过夜,超声波辅助提取40min后,静置离心分离,上清液用AB-8大孔树脂柱层析,洗脱液采用铝盐显色——可见分光光度法,以芦丁标准品为对照,测定甘薯叶中的总黄酮含量。测完总黄酮含量后,洗脱液冷冻干燥4℃保存。
1.4 PhIP液相色谱串联质谱(LC-MS/MS)定量分析方法
参照Zhang等的方法[7],采用丙磺酸阳离子交换柱和C18柱串联的固相萃取方法,对模拟体系反应液中的PhIP进行分离,净化和富集。固相萃取最后洗脱液氮气吹干后,用1mL色谱纯甲醇复溶,离心,过0.22μm有机微孔过滤膜,置于液相进样小瓶中,进行HCLCMS/MS分析测定PhIP的含量。HCLC-MS/MS分析条件:使用Zorbax Eclipse Plus C18液相色谱柱(2.1× 150mm),柱温箱控制在25℃,流动相由乙腈(A)和甲酸铵/甲酸(B)溶液(pH 3.5)组成,流速为0.2mL/min,采用梯度洗脱程序:第0min时,A占10%;第10min时,A升至60%;第14min时,A降到10%。后运行时间为9min。离子源为ESI;采用正离子扫描和多反应监测串联质谱(MS/MS)模式。主要工作参数为:雾化气(氮气)压力为40 psi;毛细管电压为4 000 V。干燥气(氮气)流速和温度分别为10 L/min和350℃;驻留时间为90ms。
1.5 溶液模拟体系中PhIP的产生规律
采用肌酐和苯丙氨酸为前体物质,二甘醇水溶液为溶剂建立PhIP的模拟体系,通过单因素实验,系统考察反应前体物质比例、反应温度、反应时间对PhIP生成量的影响。
1.6 模拟体系中黄酮类物质对PhIP形成的影响
在PhIP的模拟体系中,添加等量(5mg)的槲皮素,芦丁,甘草素,葛根素和提取的甘薯叶黄酮类物质,以不添加黄酮类物质的模拟体系为空白对照组,用预热后的干浴加热器130℃加热2 h。LC-MS/MS测定其PhIP含量,与无黄酮类物质的空白对照组产生的PhIP含量进行比较,计算出各黄酮类物质对PhIP的抑制率,通过抑制率比较各黄酮类物质对PhIP形成的影响。
2 结果与分析
2.1 甘薯叶总黄酮类物质的提取率
采用乙醇为提取溶剂,超声波辅助提取,优化提取时间,提取温度,料液比等提取条件,制得总黄酮粗提物,进一步采用AB-8大孔树脂柱层析纯化得甘薯叶黄酮类物质提取物。以芦丁标准品为对照,铝盐显色——可见分光光度法测定甘薯叶总黄酮含量,以吸光度值为纵坐标,芦丁标准品的浓度为横坐标,绘制标准曲线,得线性方程为:Y=0.121 2X+0.002,R2= 0.999 6。实验所制备的甘薯叶总黄酮的提取率为8.32%,纯度达62.15%。
2.2 溶液模拟体系下PhIP的产生规律
2.2.1 前体物质的量对PhIP形成的影响
2.2.1.1 肌酐的量对PhIP形成的影响
在3mL二甘醇水溶液(含水14%)中,固定苯丙氨酸的量为0.1mmol,肌酐的量分别为0.05、0.1、0.2、0.3、0.4mmol,130℃加热2 h,研究肌酐的量对溶液模拟体系中PhIP形成的影响,每个肌酐浓度下重复3次试验,通过单向方差分析和邓肯检验对实验结果进行统计分析,结果有显著差异(P<0.05),如图1所示。

图1 肌酐的量对溶液模拟体系中Ph IP形成的影响Fig.1 Theeffectof creatinineon the form ation of Ph IP in solutionmodelsystem
研究发现(图1),随着肌酐量的增加,PhIP的生成量先增加后减少,当肌酐和苯丙氨酸的量都为0.1mmol时,PhIP产生量最多;肌酐的量从0.1mmol增加到0.2mmol时,PhIP的生成量出现明显的降低;再增加肌酐的量时,PhIP的生成量基本保持不变。
2.2.2.2 苯丙氨酸的量对溶液模拟体系中PhIP形成的影响
设定苯丙氨酸的量分别为0.05、0.1、0.2、0.3、0.4 mmol,固定肌酐的量为0.1mmol,将苯丙氨酸和肌酐加入到3mL二甘醇水溶液(含水14%)中,130℃加热2 h,研究苯丙氨酸的量对模型体系中PhIP形成的影响,每个苯丙氨酸浓度下重复3次试验,通过单向方差分析和邓肯检验对试验结果进行统计分析,试验结果有显著差异(P<0.05),如图2所示。
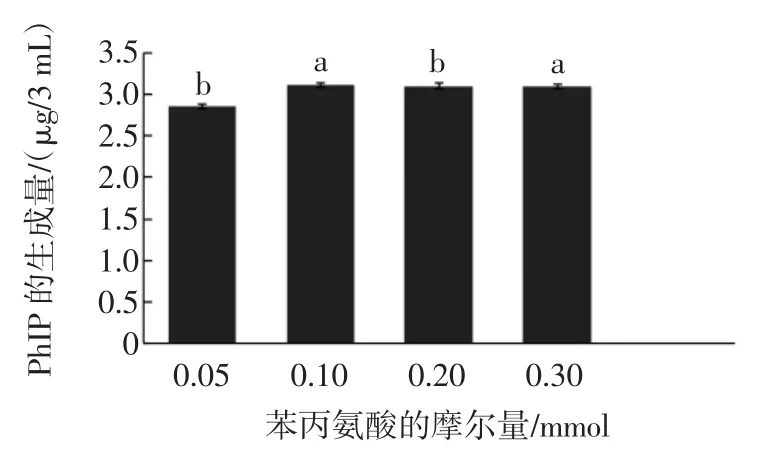
图2 苯丙氨酸的量对溶液模拟体系中Ph IP形成的影响Fig.2 Theeffectof phenylalanineon the form ation of Ph IP in solutionmodelsystem
通过图2研究发现,随着苯丙氨酸的量的增加PhIP的生成量先增加,而后基本不变,当苯丙氨酸和肌酐的量都为0.1mmol时,PhIP产生量最多。
2.2.2 加热温度对PhIP形成的影响
选择苯丙氨酸和肌酐为0.1mmol,加热时间为2h。考察不同加热温度(100、130、160、180、200℃),溶液模拟体系中PhIP形成的影响,结果如图3所示。

图3 加热温度对溶液模拟体系中Ph IP形成的影响Fig.3 Theeffectofheating tem peratureon the formation of Ph IP in solutionmodelsystem
由图3可知在模拟体系中加热温度对PhIP的生成量有显著的影响,当加热温度从100℃升高到200℃之间,随着温度的升高,PhIP的生成量不断增加,反应温度低于130℃时,PhIP的生成速度缓慢;当温度大于130℃时,PhIP的生成量增加迅速。
2.2.3 加热时间对PhIP形成的影响
综合考虑实际烹调温度,选择130℃加热,分别考察不同加热时间(30、60、90、120、150min)对PhIP形成的影响,结果如图4所示。

图4 加热时间对溶液模拟体系中Ph IP形成的影响Fig.4 Theeffectof heating timeon the form ation of Ph IP in solutionmodelsystem
结果表明,PhIP的生成量随着加热时间的延长而不断增加,其中加热时间从1 h增加到2 h时,PhIP的生成量增加迅速,当加热时间超过2 h后,PhIP的生成量增加缓慢。
2.3 甘薯叶黄酮对PhIP形成的影响
采用0.1mmol肌酐和0.1mmol苯丙氨酸,溶于3mL的二甘醇-水溶液(含水14%)中,130℃加热2 h的模拟体系,研究甘薯叶黄酮提取物对抑制PhIP的抑制作用,同时与槲皮素、芦丁、甘草素、葛根素的抑制作用进行比较。结果见表1。

表1 五种黄酮类物质(5mg)对Ph IP的抑制率(n=3)Table1 The inhibition of Ph IPwith five flavonoids(5mg)(n=3)
在溶液模拟体系中加入相同质量(5mg)的五种黄酮类物质,对PhIP的产生均有不同程度的抑制作用,五种黄酮类物质对PhIP的抑制率顺序是:甘薯叶黄酮类物质>芦丁>槲皮素>甘草素>葛根素。黄酮抑制PhIP的作用早有研究报道,不同的黄酮结构不同,其抗氧化能力、清除自由基能力不同,因此对PhIP的抑制率有所不同。研究发现,在所研究的五种黄酮类物质中,实验制备的甘薯叶黄酮对PhIP的抑制率最高(67.31± 1.56)%,表现出很强的PhIP抑制能力,这可能是由于甘薯叶黄酮为多种黄酮类物质的混合物,不同活性组分协同作用的结果,可进一步分离鉴定甘薯叶黄酮组分,明确单组分对PhIP的抑制活性。
3 结论与讨论
本研究通过考察反应前体物质比例、反应温度、反应时间对PhIP生成量的影响,研究了模拟体系下PhIP产生的产生规律:在3mL的二甘醇水溶液(含水14%)中,当肌酐和苯丙氨酸的量都为0.1mmol,在130℃下加热2 h时PhIP的产生量最多。溶液模拟体系接近于实际肉类食品体系,简化了PhIP的分析过程,排除了肉类食品中其他成分对杂环胺生成的影响,为后期研究杂环胺的生成和抑制机理提供了理论基础。
许多研究表明,黄酮类物质对PhIP有明显的抑制作用,例如,Weisburger等[9]研究表明,大豆苷元和染料木素均可以抑制PhIP的形成;Oguri等[10]证实了表没食子儿茶素没食子酸酯、槲皮素等黄酮类物质减少了80%的PhIP的生成,Cheng等[11]综合考察了多种黄酮类物质对模拟体系和牛肉饼中PhIP的抑制效果,发现柚皮素、根皮苷和槲皮素能明显抑制PhIP的生成,这些与本实验的结果一致。本试验提取的甘薯叶黄酮类物质,其对PhIP的抑制率明显高于芦丁,槲皮素,甘草素和葛根素,主要是因为提取物是多种物质的混合物,这些物质中有对PhIP的抑制作用更强的黄酮类物质存在,有待于进一步对提取物进行分离纯化,为甘薯叶黄酮的开发利用奠定基础。
[1]ALAEJOSM S,AFONSOAM.Factors thataffect the contentofheterocyclic aromatic amines in foods[J].Comprehensive Reviews in Food Scienceand Food Safety,2011,10(2):52-108
[2]KNIZEM G,SALMON C P,FELTON JS.Mutagenic activity and heterocyclic amine carcinogens in commercialpet foods[J].Mutation Research/Genetic Toxicologyand EnvironmentalMutagenesis,2003, 539(1/2):195-201
[3]IARC.Some Naturally Occurring Substances:Food Item and Constituents,Heterocyclic Aromatic Amines and Mycotoxins//IARC Monographson the Evaluation ofCarcinogenic Risks to Humans,No. 56[R].Lyon InternationalAgency for Research on Cancer,1993
[4]CHENG KW,WONGCC,CHOCK,et al.Trapping of phenylacetaldehyde as a key mechanism responsible for naringenin's inhibitory activity inmutagenic 2-amino-1-methyl-6-phenylimidazo [4,5-b]pyridine formation[J].Chemical research in toxicology,2008, 21(10):2026-2034.
[5]ZHANGY,LUOZ,SHAOZ,etal.Effectsofantioxidantsofbamboo leaves and flavonoids on 2-amino-1-methyl-6-phenylimidazo [4,5-b]pyridine(PhIP)formation in chemicalmodel systems[J]. Journalofagriculturaland food chemistry,2014,62(20):4798-4802
[6]王玫,张泰铭,熊运海.超声波法提取紫甘薯叶总黄酮的工艺研究[J].广州化学,2010,35(2):13-18
[7]ZHANG Y,LIN C,FANGG,et al.Tandem solid phase extraction coupled to LC-ESI-MS/MS for the accurate simultaneous determination of five heterocyclic aromatic amines in processedmeat products[J].European Food Research and Technology,2012,234(2):197-205
[8]ZHANG Y,YUC,MEIJ,etal.Formation andmitigation of heterocyclic aromatic amines in fried pork[J].Food additives&contaminants Part A,Chemistry,analysis,control,exposure&risk assessment,2013,30(9):1501-1507
[9]WEISBURGER JH.Inhibition ofPhIPmutagenicity by caffeine,lycopene,daidzein,and genistein[J].Mutation Res,1998,416:125-128
[10]OGURIA,SUDAM,TOTSUKA Y,etal.Inhibitory effectsofantioxidants on formation of heterocyclic amines[J].Mutation research, 1998,402(1/2):237-245
[11]CHENG KW,CHEN F,WANG M.Inhibitory activities of dietary phenolic compoundson heterocyclicamine formation inboth chemicalmodelsystem and beefpatties[J].Molecular nutrition&food research,2007,51(8):969-976
[12]KIKUGAWA K.Involvementof free radicals in the formation ofheterocyclic amines and prevention by antioxidants[J].Cancer Lett, 1999,143(2):123-126
The Study of Formation Rule and Inhibitory Effect on Ph IP in M odel System
YUChun-di1,2,SHAO Ze-ping1,ZHANGYan1,WANGShuo1,*
(1.Key Laboratoryof Food Nutrition and Safety,Ministry of Education ofChina,Tianjin University ofScience and Technology,Tianjin 300457,China;2.Collegeof Food Scienceand Engineering,Qingdao Agricultural University,Qingdao266109,Shandong,China)
Heterocyclic aromatic amines(HAAs)are a kind ofharmful substances generated in protein-rich foods during high-temperature cooking(e.g.baking,frying and grilling),and the potentialmutagenicity has been demonstrated in Amesexperiments.In thispaper,2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine(PhIP)whichwas themostabundantHAAsgenerated in daily cookingwas chose as the research target,the effectof differentmolar amount of creatinine and phenylalanine,and the influence of different heating time and temperaturewere studied,and established the optimal solution model system of PhIP formation.The total flavonoid in sweetpotato leaveswasextracted by ultrasonicmethod,the extracthad inhibitory effecton the formation of PhIP,the inhibition ratiowas67.31%,more than quercetin,rutin,liquiritigenin and puerarin.
modelsystem;PhIP;sweetpotato leaves;flavonoid
10.3969/j.issn.1005-6521.2017.07.005
2016-05-15
于春娣(1979—),女(汉),讲师,博士,研究方向:食品安全检测技术和食品加工过程安全控制。
*通信作者
