不同色泽花生衣抗氧化活性研究
2017-04-20肖春玲田理刚岳思远郭毅晶高媛李凯娅
肖春玲,田理刚,岳思远,郭毅晶,高媛,李凯娅
(山西师范大学食品科学学院,山西临汾041004)
不同色泽花生衣抗氧化活性研究
肖春玲,田理刚,岳思远,郭毅晶,高媛,李凯娅
(山西师范大学食品科学学院,山西临汾041004)
为研究不同色泽花生衣的抗氧化能力,分别测定红色、粉红色、黑色花生衣的总酚、总黄酮含量,并建立二苯代苦味酰基自由基(DPPH·)体系、羟基自由基(·OH)体系、三价铁还原力体系、亚铁离子螯合体系,测定并对比3种不同色泽花生衣的抗氧化能力。结果表明:红色花生衣的抗氧化活性最强,对羟自由基、DPPH自由基的半抑制浓度IC50分别为0.046 1、0.005 17mg/mL;粉红色花生衣的抗氧化活性次之,对羟自由基、DPPH自由基的半抑制浓度IC50分别为0.098 4、0.006 43mg/mL;而黑色花生衣的抗氧化活性相对稍差,对羟自由基、DPPH自由基的半抑制浓度IC50分别为0.161 7、0.00678mg/mL。3种不同色泽花生衣都具有较强的抗氧化活性,是效果较好的天然抗氧化剂。
不同色泽花生衣;总酚;总黄酮;抗氧化活性
花生在我国产量巨大,花生衣作为花生加工过程中的副产物之一,其产量也十分巨大,据折算我国花生衣年产约18万t,而其商业价值十分低廉。花生衣中含有丰富的酚类物质,具有较高的抗氧化活性,可以作为天然抗氧化剂[1]。花生衣含有丰富的营养成分,并有止血、散瘀、消肿的功效,临床上有广泛的应用。中医理论认为,“脾统血”,气虚的人就容易出血,花生红衣正是因为能够补脾胃之气,所以能达到养血止血的作用,这在中医上讲叫“补气止血”。西医认为,花生红衣能抑制纤维蛋白的溶解,增加血小板的含量,改善血小板的质量,改善凝血因子的缺陷,加强毛细血管的收缩机能,促进骨髓造血机能[2]。原花色素由儿茶素、表儿茶素聚合而成,具有很强的生物活性,其主要的生理活性表现为能够清除人体内过剩的自由基,提高人体的免疫能力,并具有较强的抗氧化能力,可作为防癌、抗突变、防治心血管疾病药物的主要有效成分,可用作安全无毒的新型天然抗氧化剂[3]。
本文通过建立不同的抗氧化体系[4],测定并对比3种不同色泽花生衣的抗氧化能力,为不同色泽花生衣的深加工提供理论依据。
1 试验材料及仪器设备
1.1 试验原料
大白沙花生衣,四粒红花生衣,黑花生衣都购自山西临汾尧丰市场,产地东北。
1.2 试验试剂
三羟甲基氨基甲烷:天津市科密欧化学试剂有限公司;Folin-Ciocalteu:天津市科密欧化学试剂有限公司;邻苯三酚:天津市兴复精细化工研究所;没食子酸,芦丁标准品(纯度99%)Sigma公司;二苯代苦味酰基自由基(DPPH·):东京化成工业株式会社;硝酸银:天津市迈斯科化工有限公司;邻菲罗啉、盐酸、氢氧化钠、三氯甲烷、无水乙醇、过氧化氢、硝酸钠、亚硝酸钠、氯化铁、磷酸二氢钠、磷酸氢二钠、铁氰化钾、三氯乙酸、硫酸亚铁、铁氰化钾、水杨酸均为国产分析纯。
1.3 主要仪器与设备
RE-52旋转蒸发器:上海亚荣生化仪器厂;JA2603B型电子天平:上海精科天美科学仪器有限公司;WFJ7200型可见分光光度计:上海尤尼柯仪器有限公司;HH-4型数显恒温水浴锅:江苏省金坛市荣华仪器制造有限公司;FZ102型微型植物粉碎机:天津市泰斯特仪器有限公司;SHB-Ⅲ循环水式多用真空泵:郑州长城科贸有限公司;DKL(FC)-4远红外电热食品烤炉:广东多利食品机械厂;DT5-4B型低速台式离心机:北京时代北利离心机有限公司。
2 试验方法
2.1 花生衣预处理
将购置的花生(去壳)装入载物盘,放入烘箱中,在60℃恒温下烘干2 h后取出。采用直接分离法,将花生红衣剥落,放入载物袋,用粉碎机粉碎至40目~60目,密封存装,并将之置于棕色瓶中阴凉干燥处贮藏,备用。
2.2 不同色泽花生衣提取液的制备
准确称取不同色泽的花生衣粉末5 g各3份放入3个锥形瓶中,用体积分数为80%的乙醇为溶剂提取花生衣酚类物质。提取条件为:60℃恒温水浴,提取时间2 h,料液比1∶15(g/mL),取上清液,残渣再以料液比1∶15(g/mL)加入提取剂60℃水浴2 h[5]。合并两次提取液,残渣过滤,提取液在4 000 r/min的条件下离心15min分离得上清液,40℃真空旋转蒸发减压浓缩得三种不同色泽花生衣酚类物质粗提物,定容至25mL,得供试液,放入冰箱中低温保存备用。
2.3 多酚的测定
2.3.1 没食子酸标准液的制备和标准曲线的制作
精确称量没食子酸标准品25mg,用蒸馏水溶解后定容于250mL容量瓶,得到0.1mg/mL的标准储备溶液。分别移取没食子酸标准储备溶液0.00、0.30、0.60、0.90、1.20、1.50mL置于25mL具塞比色管,分别加入1mLFolin酚试剂,摇匀后再分别加入2mL质量分数为12%的Na2CO3溶液,用蒸馏水定容至25mL,摇匀。室温下避光反应2 h后,在波长为765 nm处测定吸光度,平行3组,取平均值。以吸光度值为纵坐标,没食子酸标准溶液的质量浓度为横坐标绘制标准曲线[6]。得到回归方程:Y=4.330 5X+0.017 9(R2=0.995 9,0~0.16mg/mL)。
2.3.2 总酚含量的测定
准确量取待测样品液0.1mL,加80%的乙醇稀释10倍。准确吸取不同色泽花生衣稀释的样液各1mL,加入1mLFolin酚试剂,摇匀后再加入2mL质量分数为12%的Na2CO3溶液,定容至25mL,摇匀后在室温下避光反应2 h后,在波长为765 nm处测定吸光度值,并将其数值带入没食子酸标准曲线回归方程,计算总酚含量。每组试验重复3次,分别平行取样。以蒸馏水做空白。
2.4 黄酮的测定
2.4.1 芦丁标准液的制备和标准曲线的制作
称取芦丁药品0.061 5 g,用80%的乙醇溶液溶解,定容至250mL,得到单位体积溶质质量浓度为0.246mg/mL的芦丁标准液。准确吸取芦丁标准液0、1.0、2.0、3.0、4.0、5.0mL于25mL容量瓶中,依次加入5%的亚硝酸钠溶液0.5mL,摇匀放置6min后,加入10%的硝酸铝溶液0.5mL,摇匀,放置6min后再加入5%的氢氧化钠溶液4mL,用80%的乙醇溶液定容10mL,摇匀,放置15min后在波长为510 nm处测定吸光度值,重复3次,取平均值。以吸光度值为纵坐标,芦丁标准液的质量浓度为横坐标绘制标准曲线[7]。得回归方程Y=0.582 5X+0.017 6(R2=0.994 7,0~1.4mg/mL)。
2.4.2 总黄酮含量的测定
准确量取待测样品液0.1mL,加80%的乙醇稀释10倍。准确吸取不同色泽花生衣稀释样液各1mL,分别加入5%的NaNO2溶液0.5mL,摇匀后放置6min,加入10%的Al(NO3)3溶液0.5mL,摇匀后放置6min,再加入5%的NaOH溶液4mL,定容至10mL,摇匀后放置15min,用80%的乙醇作为空白对照,在波长为510 nm处测定吸光度值,重复3次,取平均值。并将其数值带入芦丁标准曲线回归方程,计算总黄酮含量。
2.5 抗氧化活性的测定
2.5.1 二苯代苦味酰基自由基(DPPH·)清除能力的测定
准确称取24mg DPPH,用无水甲醇溶解并定容于250mL容量瓶中,DPPH浓度为60μg/mL,避光保存(0~4℃);分别吸取不同色泽花生衣提取样液用80%乙醇稀释成不同倍数。分别吸取0.5mL不同色泽花生衣稀释样液于试管中,分别加入2.5mLDPPH·液混合摇匀,避光反应30min,在波长为517 nm处测定吸光度值,重复3次,取平均值。空白组用80%乙醇代替样液,同时做颜色对照,对照组用80%乙醇代替DPPH溶液。计算不同色泽花生衣样液对DPPH·清除率。DPPH·清除率/%=[A0-(A1-A2)]/A0×100%。式中:A0为0.5mL 80%乙醇和2.5mLDPPH溶液的吸光值;A1为0.5mL样品溶液和2.5mLDPPH溶液的吸光值;A2为0.5mL样品溶液和2.5mL 80%乙醇的吸光值。
2.5.2 羟基自由基(·OH)清除能力的测定
利用过氧化氢和铁离子混合产生羟自由基,在体系内加入水杨酸产生有色物质,该物质在510 nm波长处有最大吸收波长。反应体系中含8.8mmol/L H2O21 mL、9mmol/L FeSO41mL、9mmol/L水杨酸-乙醇溶液1 mL、不同色泽花生衣提取液的稀释液1 mL。在37℃反应0.5 h,以80%乙醇为空白,在510 nm处测量不同色泽花生衣提取液的吸光度。考虑到不同色泽花生衣提取液的吸光度,以9mmol/LFeSO41mL、8.8mmol/LH2O21mL、不同色泽花生衣提取液1mL和1mL蒸馏水在510 nm波长处的吸光度作为花生衣提取液的本底吸光度[8-9]。

式中:A0为空白对照液的吸光度;A1为加入不同色泽花生衣提取液的吸光度;A2为不加水杨酸-乙醇溶液的不同色泽花生衣提取液本底的吸光度。
2.5.3 Fe2+螯合能力的测定
分别吸取不同色泽花生衣提取样液用80%乙醇稀释成不同倍数,取不同稀释倍数提取样液1mL于试管中,分别加入2mL 0.2%FeSO4溶液,37℃恒温水浴30min,然后加入0.5mL 0.3%邻二氮菲,在37℃恒温水浴中反应10min,各加20mL蒸馏水。在510 nm处测定吸光值,设空白对照为A0,样液的吸光值为A1,不加邻二氮菲时溶液的吸光值为A2,平行测试3次,计算Fe2+的螯合率[8]。
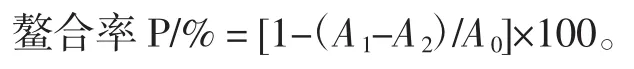
2.5.4 还原力的测定
采用普鲁士兰法测定黑花生衣色素的还原能力:取一定浓度的样品水溶液0.5mL,加入0.2mol/L、pH= 6.6的混合磷酸盐缓冲液和1%铁氰化钾溶液各2.5 mL并混合均匀,混合液在50℃下反应20min后自然冷却。冷却完后,在室温下加入2.5mL、10%三氯乙酸溶液,接着以4 000 r/min的速度离心10min。然后取2.5mL上清液,加入2.5mL的蒸馏水,最后加入1mL 0.1%的FeCl3溶液,混合均匀,10min后测定700 nm处吸光度。重复3次,取平均值。
3 结果与分析
3.1 不同色泽花生衣中的总黄酮、总酚含量
不同色泽花生衣中总黄酮、总酚含量的测定结果分别见图1和图2。
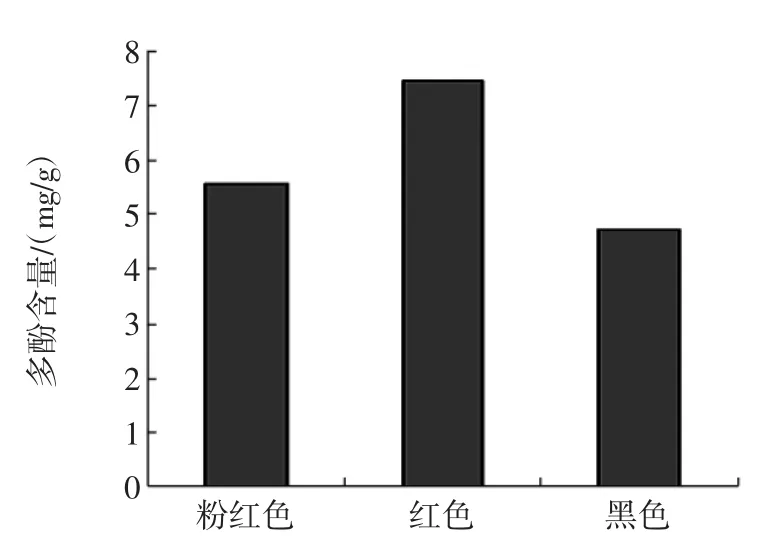
图1 不同色泽花生衣总多酚含量Fig.1 Totalpolyphenolcontentof peanut skin With various colors
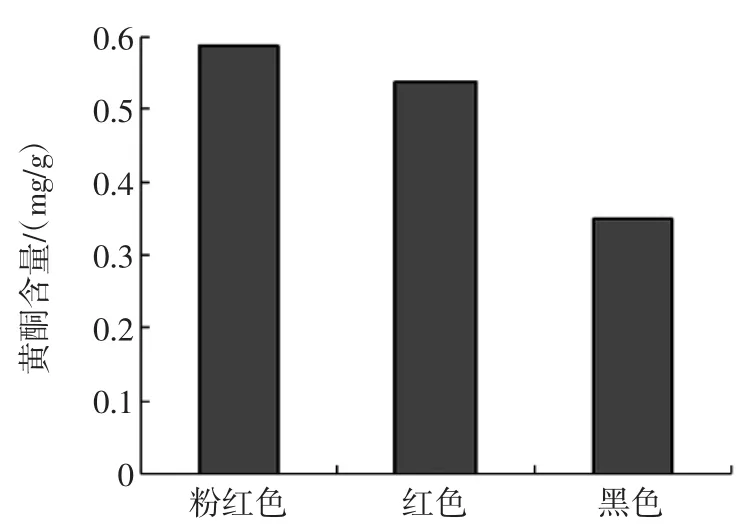
图2 不同色泽花生衣黄酮含量Fig.2 Contentof flavonoidsof peanut skin with variouscolors
由图1可知,3种不同色泽花生衣中总多酚含量不等,红色花生衣总多酚单位质量比最高,其次是粉红色花生衣,黑色花生衣多酚含量最低。由图2可知,在同一条件下,不同色泽花生衣的总黄酮含量不等,粉红色花生衣的总黄酮含量略高于红色花生衣,黑色花生衣的总黄酮含量最低。
3.2 不同色泽花生衣提取液对DPPH自由基的清除能力
自由基清除剂可提供电子与DPPH·的单电子配对,DPPH·被还原并使其颜色变浅,在516 nm波长处的吸光度值变小,而吸光度变小的程度与自由基被清除的程度呈线性关系,故此,用清除率来表示抗氧化效果,如果清除率越大,则抗氧化能力就越强[9]。表1表示了不同色泽花生衣提取液清除DPPH回归方程及IC50值比较。

表1 不同色泽花生衣提取液清除DPPH回归方程及IC50值比较Table1 The regression equation of scavenging DPPH free radicals by peanutskinWith variouscolorsn and com parison of IC50value
由表1可知红色花生衣提取液的IC50最高,粉红色花生衣和黑色花生衣提取液的IC50相差无几。
3.3 不同色泽花生衣的提取液对羟基自由基的清除能力
羟自由基是氧化能力很强的自由基,在活性氧中其化学性质最活泼,反应性极强,寿命很短,是自由基中已知的最强氧化剂,几乎可以与任何大分子物质(如蛋白质、核酸)等发生作用而造成损害,而这种损伤是癌症启动和促进的基础。·OH在细胞内可由H2O2与Fe2+或Cu2+反应生成,从而对细胞造成毒害作用。是目前所知活性氧中对生物体毒性最强、危害最大的一种自由基。不同色泽花生衣清除DPPH自由基的效果见表2。

表2 不同色泽花生衣提取液清除羟自由基回归方程及IC50值比较Table2 The regression equation of scavenging hydroxyl radical by peanut skin With variouscolorsand comparison of IC50value
由表2可得红色花生衣的IC50>粉红色花生衣的IC50>黑色花生衣的IC50。
3.4 不同色泽花生衣提取液Fe2+螯合力的比较
一些金属离子在脂质的氧化过程中起催化作用,因此可螯合金属的物质能间接地起到抗氧化作用。邻二氮菲能够与Fe2+形成紫红色的络合物,当有其他螯合剂存在时,紫红色变浅,因此可通过吸光值的变化,评价物质对Fe2+的螯合能力。本试验对不同色泽花生衣粗提物的螯合能力进行了测定,结果如图3所示。

图3 不同色泽花生衣提取液Fe2+螯合力Fig.3 Ferrous ion chelating ability of peanut skin With various colors
从图3中可以看出,花生衣粗提物对Fe2+具有一定的螯合能力。3种花生衣Fe2+螯合力随浓度的变化趋势一致,都随着浓度的下降而下降,但是在相同浓度条件下,粉红色花生衣的Fe2+螯合力最高。其次为黑色花生衣,红色花生衣Fe2+螯合力最低。但在稀释至100倍后的黑花生衣的Fe2+螯合力低于红色花生衣的Fe2+螯合力且此后一直呈现这种趋势。总体上可得三种不同色泽花生衣的Fe2+螯合力相差不大,呈现平稳趋势。
3.5 不同色泽花生衣提取液的还原能力
还原能力是表示抗氧化物质提供电子能力的重要指标,还原力大的样品,是良好的电子供应者,其供应的电子除了可使Fe3+还原为Fe2+外,亦可与自由基反应,使自由基成为较稳定的物质[10]。许多研究证实抗氧化活性同还原力是密切相关的。一般情况下,样品的还原能力与抗氧化活性之间有显著的相关性,本文对不同色泽花生衣粗提物的还原能力进行了测定,结果如图4所示。
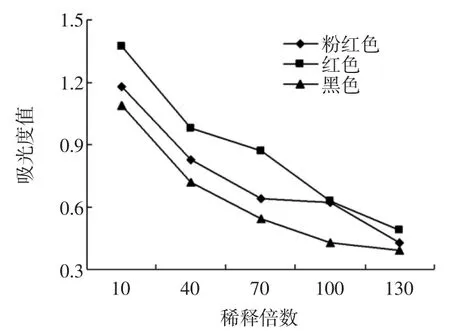
图4 不同色泽花生衣提取液对Fe3+的还原能力Fig.4 Reduction Power of peanut skin with various colors
由图4可知,随着浓度的增大,不同色泽花生衣提取液的吸光值不断升高,还原能力在不断的增强,说明样品浓度越大,对三价铁离子的还原作用越强,红色花生衣的还原力大于其余两种色泽的花生衣,其次是粉红色花生衣,黑色花生衣的还原力最小。
4 结论
花生衣中含有黄酮类和多酚类等生理活性物质,具有抗氧化的作用。3种不同色泽花生衣提取液均具有一定的抗氧化活性。在羟自由基、DPPH自由基、铁还原力3个不同的抗氧化体系中,红色花生衣提取液的抗氧化活性始终最强,对羟自由基、DPPH自由基的半抑制浓度IC50分别为0.046 1、0.005 17mg/mL;粉红色花生衣提取液的抗氧化活性次之,对羟自由基、DPPH自由基的半抑制浓度IC50分别为0.098 4、0.006 43mg/mL;而黑色花生衣提取液的抗氧化活性相对稍差,对羟自由基、DPPH自由基的半抑制浓度IC50分别为0.161 7、0.006 78mg/mL;在Fe2+螯合力体系中粉红色花生衣的螯合率最大,其次为黑色花生衣,红色花生衣螯合率稍低,但三者螯合率相差不大。由4个抗氧化体系可得红色花生衣的抗氧化活性最强,粉红色次之,黑色花生衣抗氧化活性相对较低,这与3种不同色泽花生衣提液中总多酚含量的高低排序相一致,表明多酚类物质在花生衣提取液的抗氧化活性中有重要作用。
[1]Constanza K E,White B L,Davis JP,etal.Value-added processing of peanut skins:antioxidant capacity,total phenolics,and procyanidin content of spray-dried extracts[J].Journal of agricultural and food chemistry,2012,60(43):10776-10783
[2]温志英,刘晶,刘焕云.花生红衣综合利用现状及发展前景[J].中国粮油学报,2010,25(1):143-146
[3]刘大川,刘强,吴波,等.花生红衣中白藜芦醇、原花色素提取工艺的研究[J].食品科学,2005,26(7):144-148
[4]刘翠,刘红芝,刘丽,等.花生红衣多酚类物质的制备及其抗氧化活性研究进展[J].中国粮油学报,2015,30(8):137-141
[5]姚永志,左锦静,王子涵.乙醇提取花生红衣多酚物质的研究[J].中国油脂,2007,32(3):51-53
[6]李巨秀,李利霞,曾王旻,等.燕麦多酚提取工艺及抗氧化活性研究[J].中国食品学报,2010,10(5):14-21
[7]张少颖.不同加工方法对花生总黄酮含量的影响[J].中国粮油学报,2010,25(8):104-108
[8]Akowuah G A,Ismail Z,Norhayati I,et al.The effects of different extraction solvents of varying polarities on polyphenols of Orthosiphon stamineus and evaluation of the free radical scavenging activity[J].Food Chemistry,2005,93(2):311-317
[9]杜蕾,李新华.陈芳芳.黑花生衣色素抗氧化作用的研究[J].食品工业科技,2012,33(2):100-103
[10]吕英华,苏平,那宇,等.桑椹色素体外抗氧化能力研究[J].浙江大学学报,2007,33(1):102-107
Research on Antioxidant Activity of Peanut Skin With Various Colors
XIAOChun-ling,TIAN Li-gang,YUESi-yuan,GUOYi-jing,GAOYuan,LIKai-ya
(Schoolof Food Science,ShanxiNormalUniversity,Linfen 041004,Shanxi,China)
For the study of peanut skin with various colors of antioxidant capacity,red,pink,black peanuts were separatelymeasured the totalphenoland flavonoids content,and establish the bitter acyl diphenylgeneration system of free radical(DPPH·)and hydroxyl radical(·OH)system,ferric iron reduction force system,the ferrous ion chelating system,measuring and comparing three peanutskin with various colors antioxidant capacity.The results showed that the strongestantioxidantactivity of red peanuts,half inhibitory concentration of hydroxyl radicals,DPPH free radicals IC50were 0.046 1,0.005 17 mg/mL;pink peanuts garment antioxidant activity times,half inhibitory concentration of hydroxyl radicals,DPPH free radicals IC50were 0.098 4,0.006 43mg/mL;and antioxidantactivity ofblack peanutsare relatively less,half inhibitory concentration ofhydroxyl radicals,DPPH free radicals IC50were 0.161 7 and 0.006 78mg/mL.Three peanut skin with variouscolorshasstrongantioxidantactivity,isagood naturalantioxidanteffect.
peanutskinwith variouscolors;totalphenol;total flavonoids;antioxidantactivity
10.3969/j.issn.1005-6521.2017.07.003
2016-03-25
山西师范大学质量工程项目(SD2015CXXM-59)
肖春玲(1966—),女(汉),教授,硕士,研究方向:天然产物的提取。
