DNMT1、DNMT3A和蛋白磷酸酶1γmRNA在低氧预适应晚期相小鼠海马组织变化
2017-04-20张柱霞贾小娥姜树原刘晓蕾许文强张颜波
谢 伟 张柱霞贾小娥 姜树原 石 蕊 刘晓蕾 许文强 张颜波 邵 国,4*
(1.包头医学院生物医学研究中心,内蒙古 包头 014060;2.包头医学院基础医学与法医学院细胞生物与遗传学教研室,内蒙古 包头 014060; 3. 泰山医学院附属医院神经内科,山东 泰安 271000;4. 首都医科大学宣武医院 北京 100053)
DNMT1、DNMT3A和蛋白磷酸酶1γmRNA在低氧预适应晚期相小鼠海马组织变化
#并列第一作者;*通讯作者
谢 伟1#张柱霞1#贾小娥1姜树原1石 蕊1刘晓蕾1许文强1张颜波3,4*邵 国1,4*
(1.包头医学院生物医学研究中心,内蒙古 包头 014060;2.包头医学院基础医学与法医学院细胞生物与遗传学教研室,内蒙古 包头 014060; 3. 泰山医学院附属医院神经内科,山东 泰安 271000;4. 首都医科大学宣武医院 北京 100053)
目的 研究小鼠低氧预适应模型中DNA甲基化和PP1γ基因表达伴随低氧后时间的变化机制,阐明低氧是否通过DNA甲基化来调控PP1γ表达,发挥其脑保护作用。方法 小鼠侧脑室注射5-aza-cdR (10 μM, 5 μl),之后进行低氧处理,分别于低氧后0、1、2、3、4天处死小鼠,利用实时荧光定量PCR检测甲基转移酶DNMTs和PP1γ mRNA的表达变化。结果 低氧后1天DNMT1和低氧后2天DNMT3A的mRNA表达受到抑制(P<0.05),且不受甲基转移酶活性的影响。5-aza-cdR对DNMT1的表达没有影响(P>0.05);但明显抑制DNMT3A的表达(P<0.05)。低氧抑制PP1γ mRNA表达(P<0.05),且有低氧后时间依赖性。甲基转移酶对PP1γ表达有抑制作用(P<0.05),且与低氧后时间有关。结论 随着低氧后时间的延长,低氧通过改变DNA甲基化,尤其是DNMTs表达变化,调控PP1γ基因表达,实现其脑保护作用。
蛋白磷酸酶1;DNA甲基化;DNA甲基转移酶;低氧预适应;小鼠
缺血/低氧预适应(ischemia/hypoxia preconditioning, I/HPC)是指机体受到一次或多次短暂、非致死性缺血/低氧刺激后,对更严重甚至致死性缺血/低氧刺激产生耐受的现象[1],其通过启动内源性保护机制,使大脑对缺血/低氧产生保护作用[2-3]。然而确切分子机制尚无定论。
DNA甲基化是在DNA甲基转移酶(DNA methyltransferase, DNMT)的催化下,将甲基转移至DNA分子的碱基上,通过CpG岛的甲基化控制靶基因特异性表达。研究显示缺血/低氧可降低甲基化水平[4],因此推测I/HPC可能通过改变DNA甲基化进而调节靶基因表达来产生脑保护作用。
蛋白磷酸酶1(protein phosphatase 1, PP1)是参与脑保护的重要因子,是一类去磷酸化酶,通过控制去磷酸化和磷酸化过程,调控脑的能量代谢。同时PP1在突触可塑性的形成中发挥重要作用,参与学习记忆的形成[5]。本实验室前期研究发现,急性低氧可引起PP1γ表达变化[6],但其在低氧后不同时间的变化情况及甲基化改变是否参与其中,仍需深入研究。
因此,本文首先明确DNA甲基化和PP1γ表达伴随低氧后时间的变化机制,并利用DNA甲基转移酶抑制剂5-氮-2'脱氧胞苷(5-aza-2'deoxycytidine, 5-aza-cdR),鉴定低氧条件下是否通过DNMTs途径调控PP1γ表达变化来实现其脑保护作用,为进一步揭示I/HPC脑保护作用的分子机制奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 体重为18~22 g雄性昆明小鼠(6~8周)60只,购于内蒙古大学动物实验中心。
1.1.2 试剂 5-aza-cdR和BSA购自Sigma公司;TRIzol购自Takara公司;逆转录试剂盒superscript III购自Invitrogen公司;2×Real-time PCR Mix 购自Takara公司;引物合成由上海生工公司完成;其余试剂为国产试剂。
1.2方法
1.2.1 小鼠大脑立体定位注射5-aza-cdR 小鼠使用1%戊巴比妥钠进行麻醉,麻醉后固定于大脑立体定位仪上,去除头顶鼠毛,消毒皮肤,在头顶部正中切口,暴露前囟,根据小鼠脑图谱,于前囟后0.5mm,中线右侧1 mm,垂直深度2.5 mm,向实验组小鼠右侧脑室缓慢注入5-aza-cdR (10 μmol/L) 5μl,每次注射时间为5 min,留针2 min。注射完成并消毒后,缝合伤口。对照组注射等体积的1%牛血清白蛋白(bovine albumin, BSA)。
1.2.2 小鼠低氧处理 手术完成后休息2 d,实验组和对照组小鼠分别进行低氧处理:小鼠放置在250 ml的广口瓶中,塞紧橡胶塞,实时观察小鼠的呼吸状态。待小鼠出现腹式呼吸后,拔下胶塞,取出小鼠,此为小鼠低氧1次。取出小鼠后,待小鼠呼吸恢复,再次迅速对其低氧,共重复4次,此为小鼠低氧预适应,即低氧4次。低氧和低氧预适应完成后即刻处死小鼠为小鼠0天低氧组(0.1组,0.4组),低氧后1天处死为1天低氧组(1.1组,1.4组),低氧后2天处死为2天低氧组(2.1组,2.4组),低氧后3天处死为3天低氧组(3.1组,3.4组),低氧后4天处死为4天低氧组(4.1组,4.4组),未低氧直接处死为未低氧组(0.0组),分组如表1、2所示。各组小鼠处死后,立即剥离小鼠左右海马和皮层,准备提取mRNA样本。

表1 大脑立体定位注射5-aza-cdR小鼠分组表

表2 大脑立体定位注射BSA小鼠分组表
1.2.3 实时荧光定量PCR检测DNMT1、DNMT3A和PP1γ在mRNA水平的表达变化 TRIzol法提取各组组织总RNA后,使用Nondrop 2000微量分光光度计检测总RNA的纯度和含量。使用1 μg的RNA样本用于逆转录合成cDNA。以cDNA为模板,利用荧光定量PCR检测DNMT1、DNMT3A和PP1γ在mRNA水平的表达变化。使用ABI公司的96孔板,反应体系为:cDNA 1 μl,引物1 μl,无菌水8 μl,Mix 10 μl,在ABI7900HT Real-time PCR反应仪上反应,每个样本设置3个复孔。PCR反应条件为: 95 ℃预变性3 min;循环为95 ℃变性3 min,59 ℃退火30 s,72℃延伸30 s,共进行40个循环,72 ℃终末延伸5 min。使用β-actin为内参,以mRNA/β-actin mRNA的相对丰度值表示实验结果,特异性引物序列如下:
作为一种新型经济模式和商业模式,物流业发展共享经济中难免会遇到质疑和困难,有些问题会引起政府或者有关部门的干涉和禁止。在共享经济的快速发展与应用中,其更新速度远远超出了目前政府所监管的范畴和能力,政府还没有一个针对性地健全监管制度,一定程度上阻碍了物流业共享经济的发展。基于这种背景,为了更好地利用共享经济促进我国绿色物流的建设、实现对社会物流费用的有效降低,政府要充分发挥出其监管作用,建立起针对物流共享平台搭建以及合理运行的相关监管制度,形成一个允许试错、宽容、多元化、开放的经济环境,打破一味禁止和限制的监管弊端,完善经济环境,为物流共享经济的发展提供必要保障。
DNMT1F:CCTGGCTAAAGTCAAGTCCCT
DNMT1R:GTGTGTGTTCCGTTCTCCAAG
DNMT3A F:GGCCGAATTGTGTCTTGGTG
DNMT3A R:CCATCTCCGAACCACATGAC
PP1gamma F:GAGAACGAGATCCGAGGACTC
PP1 gamma R:CGTATTCAAACAGACGGAGCAA
β-actin F:GGCTGTATTCCCCTCCATCG
1.3 统计学分析
各组实验数据以均值±标准差表示,用SPSS 19.0数据统计软件中的t-test和two way ANOVA方法进行处理和分析,P≤0.05被认为有统计学意义。
2 结 果
2.1 实时荧光定量PCR检测DNMT1在mRNA水平的表达变化
在对照组中(侧脑室注射BSA),比较低氧对DNMT1转录水平的影响。与未低氧组(0.0组)相比较,结果显示低氧(低氧一次组)后1天(1.1组)、2天(2.1组)和3天(3.1组) DNMT1的mRNA表达显著降低(P<0.05),有统计学意义(图1A);而4天(4.1组) DNMT1表达虽有降低,但无统计学意义(P>0.05) (图1A)。低氧预适应组(重复4次低氧)与低氧组相比,DNMT1表达虽有升高,但无统计学意义(P>0.05) (图1A)。
在实验组中(侧脑室注射了5-aza-cdR),在使用甲基转移酶抑制剂后,与未低氧组(0.0组)相比,低氧(低氧一次组)后1天(1.1组)、3天(3.1组)和4天(4.1组) DNMT1的mRNA表达显著降低(P<0.05),有统计学意义(图1B);而2天(2.1组) DNMT1表达虽有降低,但无统计学意义(P>0.05) (图1 B)。低氧预适应组(重复4次低氧)与低氧组相比,DNMT1表达虽有升高,但仅在1天(1.4组)有统计学意义(P<0.05) (图1 B)。
比较在未低氧、低氧(低氧一次组)和低氧预适应(重复4次低氧)条件下,5-aza-cdR对DNMT1表达的影响,结果显示5-aza-cdR 虽可降低DNMT1表达,但是没有统计学意义(P>0.05) (图1C)。在小鼠低氧后1天、2天、3天和4天时,5-aza-cdR对DNMT1的表达没有显著的影响(P>0.05) (图1 D)。
以上结果揭示,低氧处理1、2、3、4天DNMT1 mRNA的表达受到抑制,且不受甲基转移酶活性的影响;5-aza-cdR对DNMT1在mRNA水平的表达没有明显的影响。
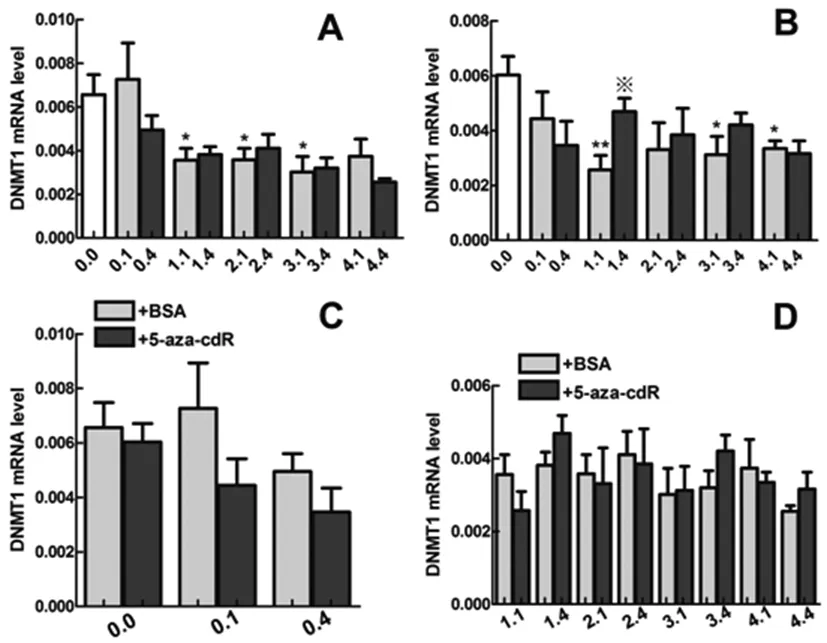
图1 实时荧光定量PCR检测不同处理组中DNMT1在mRNA水平的表达变化
注:A: 小鼠侧脑室注射BSA后,低氧和低氧预适应对DNMT1转录水平的影响(n=4;*P≤0.05,低氧一次组与未低氧组之间的比较)。B: 小鼠侧脑室注射5-aza-cdR后,低氧和低氧预适应对DNMT1转录水平的影响(n=4;*P≤0.05,**P≤0.01低氧一次组与未低氧组相比;※P≤0.05, 相同天数下低氧四次组与低氧一次组相比)。C: 比较在未低氧、低氧和低氧预适应条件下, 5-aza-cdR对DNMT1转录水平的影响。D: 低氧后1天、2天、3天、4天,5-aza-cdR对DNMT1转录水平的影响。
2.2 实时荧光定量PCR检测DNMT3A在mRNA水平的表达变化
在对照组中(侧脑室注射BSA),比较低氧对DNMT3A转录水平的影响。与未低氧组(0.0组)相比较,结果显示低氧(低氧一次组)后2天(2.1组)、3天(3.1组)和4天(4.1组) DNMT3A的mRNA表达显著降低(P<0.05),有统计学意义(图2 A);而1天(1.1组) DNMT3A表达虽有降低,但无统计学意义(P>0.05) (图2 A)。低氧预适应组(重复4次低氧)与低氧组相比,DNMT3A表达进一步降低,且低氧预适应后1天(1.1组)、4天(4.1组)表现出统计学意义(P<0.05) (图2 A)。
在实验组中(侧脑室注射了5-aza-cdR),与未低氧组(0.0组)相比,低氧(低氧一次组)后2天(2.1组)和4天(4.1组) DNMT3A的mRNA表达显著降低(P<0.05),有统计学意义(图2 B);1天和3天变化无统计学意义(P>0.05) (图2 B)。低氧预适应组(重复4次低氧)与低氧组相比,DNMT3A的表达变化无统计学意义(P>0.05) (图2 B)。
在未低氧、低氧(低氧一次组)和低氧预适应(重复4次低氧)条件下, 5-aza-cdR 虽可降低DNMT3A表达,但只在未低氧条件下才有统计学意义(P<0.05) (图2 C)。在小鼠低氧后1天、2天、3天和4天时,5-aza-cdR对DNMT3A的表达没有显著的影响(P>0.05) (图2 D)。
以上结果揭示,低氧处理2天后DNMT3A的mRNA表达水平降低,且不受甲基转移酶活性的影响;5-aza-cdR对DNMT3A有明显的抑制作用,但是这种抑制作用受到氧含量的调控。

图2 实时荧光定量PCR检测不同处理组中
注:A: 小鼠侧脑室注射BSA后,低氧和低氧预适应对DNMT3A转录水平的影响(n=4;**P≤0.01,*P≤0.05, 低氧一次组与未低氧组相比;※P≤0.05, 相同天数下低氧预适应组与低氧组相比)。B: 小鼠侧脑室注射5-aza-cdR后,低氧和低氧预适应对DNMT3A转录水平的影响(n=4;**P≤0.01, 低氧一次组与未低氧组相比)。C: 比较在未低氧、低氧和低氧预适应条件下, 5-aza-cdR对DNMT3A转录水平的影响(n=4;*P≤0.05相同低氧条件下,5-aza-cdR组与BSA组相比)。D: 低氧后1天、2天、3天、4天,5-aza-cdR对DNMT3A转录水平的影响。
2.3 实时荧光定量PCR检测PP1γ在mRNA水平的表达变化
在对照组中(侧脑室注射BSA),比较低氧对PP1γ转录水平的影响。与未低氧组(0.0组)相比较,结果显示低氧后2天(2.1组)、3天(3.1组)和4天(4.1组) PP1γ的mRNA表达显著降低(P<0.05),有统计学意义(图3 A);此外,随着低氧后时间的延长,PP1γ的mRNA表达呈下降趋势,但是在低氧后第4天出现回升。低氧预适应组与低氧组相比,PP1γ表达无显著性变化(P>0.05) (图3 A)。
在实验组中(侧脑室注射了5-aza-cdR),与未低氧组(0.0组)相比,低氧后3天(3.1组)和4天(4.1组) PP1γ的mRNA表达显著降低(P<0.05),有统计学意义(图3 B)。低氧预适应组与低氧组相比,PP1γ表达没有显著的变化趋势,但是第4天(4.4组),PP1γ表达却显著增加(P<0.05) (图3 B)。
比较在未低氧、低氧(低氧一次组)和低氧预适应(重复4次低氧)条件下, 5-aza-cdR对PP1γ表达的影响,结果显示在低氧和低氧预适应条件下,5-aza-cdR 虽可上调PP1γ表达,但无统计学意义(P>0.05) (图3 C)。在小鼠低氧后1天、2天、3天和4天时,5-aza-cdR可上调实验组PP1γ的转录水平,且在第1天和第2天具有统计学差异(P<0.05) (图3 D)。
以上结果揭示,低氧抑制PP1γ的mRNA表达水平,且PP1γ表达有低氧后时间依赖性;甲基转移酶抑制剂对PP1γ有明显的促进作用,低氧不影响这种作用的发挥。
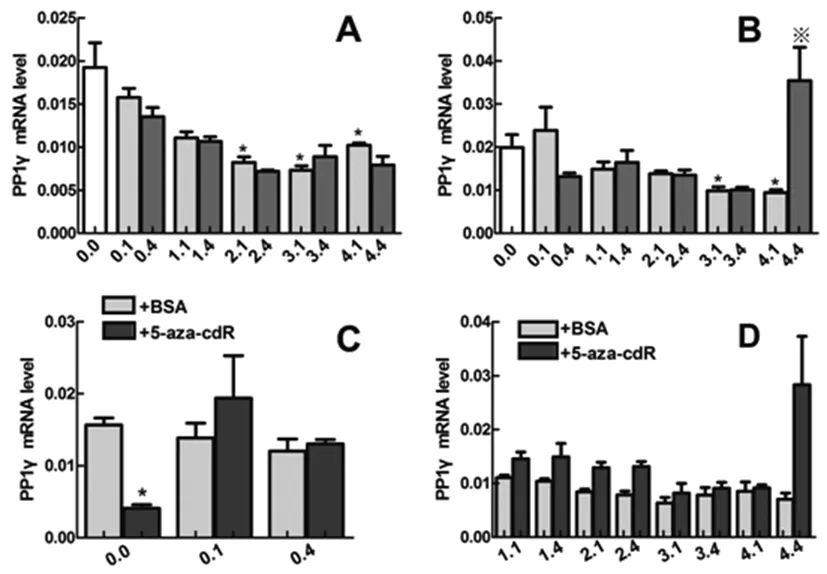
图3 实时荧光定量PCR检测不同处理组中PP1γ在mRNA水平的表达变化
注:A: 小鼠侧脑室注射BSA后,低氧和低氧预适应对PP1γ转录水平的影响(n=4;*P≤0.05, 低氧一次组与未低氧组相比)。B: 小鼠侧脑室注射5-aza-cdR后,低氧和低氧预适应对PP1γ转录水平的影响(n=4;*P≤0.05, 低氧一次组与未低氧组相比;※P≤0.05, 相同天数下低氧四次组与低氧一次组相比)。C: 比较在未低氧、低氧和低氧预适应条件下, 5-aza-cdR对PP1γ转录水平的影响。D: 低氧后1天、2天、3天、4天,5-aza-cdR对DNMT3A转录水平的影响。
3 讨 论
DNA甲基化是表观遗传学变化之一,其主要发生在CpG二核苷酸中胞嘧啶第五位碳原子上,并由DNMTs负责对DNA进行甲基化修饰,最终通过调控基因表达变化参与神经发育和分化、突触可塑性等过程[7]。目前存在三种有催化活性的甲基转移酶:DNMT1是维持型甲基化酶;DNMT3A和DNMT3B为从头合成型甲基化酶。有研究显示DNMTs表达改变可以延迟缺血/低氧对大脑的损伤[8];另一方面,缺血/低氧可降低整体甲基化水平[4]。因此,我们推测在缺血/低氧调节神经组织某些基因表达过程中,DNA甲基化可能存在重要作用。但DNA甲基化,尤其是DNMTs表达是否会随着低氧后时间的增加发生变化,并参与低氧脑保护过程,则需要本实验研究加以印证。
有研究初步探索了DNMTs在缺血/低氧条件下的表达变化规律,例如蒙古沙鼠经短暂全脑缺血处理后,在24 h内神经元DNMT1表达没有变化,而加长缺血时间到2、4、5和7天后DNMT1表达降低,因此推测DNMT的表达变化在低氧条件下有时间依赖性[9]。为了证实这个推论,本研究分别给予小鼠低氧后0、1、2、3和4天依次处死,观察DNMT的变化。结果显示:急性低氧对DNMT1的转录水平没有影响,但低氧处理1天后DNMT1的mRNA表达水平受到抑制;低氧后2天DNMT3A的mRNA表达水平开始下降,这些结果与之前报道一致。同时,为了深入研究DNMTs表达在低氧条件下的变化,我们对小鼠侧脑室注射5-aza-cdR,其为DNA复制过程中的核苷酸类似物,可与DNA甲基转移酶共价结合形成复合物从而抑制甲基转移酶活性[10]。结果显示低氧对DNMT1和DNMT3A的抑制作用不受甲基转移酶活性的影响。此外,5-aza-cdR对DNMT1的转录水平没有明显的影响;但对DNMT3A有明显的抑制作用,但是受到氧含量的调控。综上,我们验证了上述的推论,证实低氧抑制了DNMTs的表达,并且这种抑制作用的发挥有时间依赖性。
以上结果已证实低氧可使DNA甲基化发生改变,之后是否能调控某些基因表达来发挥神经保护作用,则需要进一步检测。PP1是脑内一类重要的去磷酸化酶,其下游的激活蛋白CREB(cAMP反应原件结合蛋白)可以上调神经生长因子和脑源性神经营养因子表达,发挥神经保护作用。但PP1可使磷酸化的CREB发生去磷酸化,进而导致其失活。因此,研究显示PP1常通过下调自身表达,发挥保护作用。例如,成年大鼠受到情境性恐惧刺激后,海马中DNMTs表达上调,并引起PP1启动子区的甲基化增加,其转录减少[11]。在低氧预适应小鼠模型中,也发现海马区磷酸化的CREB水平升高。我们前期研究同样发现,急性小鼠低氧模型中PP1表达下降[12]。而本研究进一步探讨低氧后1、2、3和4天小鼠脑区PP1表达发生的变化情况,实验结果揭示:低氧抑制PP1γ的表达水平,且PP1γ表达有低氧后时间依赖性。所以低氧条件下,PP1γ表达水平的降低,对小鼠海马起到一定的神经保护作用。同时,使用5-aza-cdR后,PP1γ表达明显增加。因此,我们推测DNMTs介导了PP1γ启动子区高甲基化,从而调控PP1γ基因的转录,PP1γ在低氧条件下的表达下降与DNMTs介导的PP1γ基因启动子区高甲基化导致的转录沉默有关。DNA甲基化很可能是低氧预适应参与脑保护的机制之一。
综上,在小鼠低氧模型中,与能量代谢密切相关的PP1γ表达下调,且随着低氧后天数增加逐渐降低,可通过降低代谢来实现神经保护作用。而DNA甲基化也参与了对PP1γ的表达调控:抑制DNA甲基化,低氧条件下PP1γ表达增加。因此,低氧通过改变DNA甲基化,尤其是DNMTs表达变化,调控PP1γ基因表达,实现其脑保护作用。这进一步丰富了I/HPC脑保护作用的分子机制。
[1] Shao G, Lu GW. Hypoxic preconditioning in an autohypoxic animal model[J]. Neurosci Bull, 2012, 28(3):316-320.
[2] Lu GW, Shao G. Hypoxic preconditioning: Effect, mechanism and clinical implication (part. 1)[J]. Zhongguo Ying Yong Sheng Li Xue Za Zhi, 2014, 30(6):489-501.
[3] Shao G, Zhang R, Wang ZL, et al. Hypoxic preconditioning improves spatial cognitive ability in mice[J]. Neurosignals, 2006, 15(6):314-321.
[4] Shahrzad S, Bertrand K, Minhas K, et al. Induction of DNA hypomethylation by tumor hypoxia[J]. Epigenetics, 2007, 2(2):119-125.
[5] Stockwell J, Chen Z, Niazi M, et al. Protein phosphatase role in adenosine a1 receptor-induced ampa receptor trafficking and rat hippocampal neuronal damage in hypoxia/reperfusion injury[J]. Neuropharmacology, 2016, 102:254-265.
[6] Zhang S, Zhang Y, Jiang S, et al. The effect of hypoxia preconditioning on DNA methyltransferase and pp1gamma in hippocampus of hypoxia preconditioned mice[J]. High Alt Med Biol, 2014, 15(4):483-490.
[7] Graff J, Kim D, Dobbin MM, et al. Epigenetic regulation of gene expression in physiological and pathological brain processes[J]. Physiol Rev, 2011, 91(2):603-649.
[8] Endres M, Meisel A, Biniszkiewicz D, et al. DNA methyltransferase contributes to delayed ischemic brain injury[J]. J Neurosci, 2000, 20(9):3175-3181.
[9] Lee JC, Park JH, Yan BC, et al. Effects of transient cerebral ischemia on the expression of DNA methyltransferase 1 in the gerbil hippocampal ca1 region[J]. Neurochem Res, 2013, 38(1):74-81.
[10] 孙明英, 张柱霞, 杨洁, 等. 5-aza-cdr对低氧预适应神经细胞NG108的DNMTs表达的影响[J]. 泰山医学院学报, 2015, 36(12):1321-1323.
[11] Miller CA, Sweatt JD. Covalent modification of DNA regulates memory formation[J]. Neuron, 2007, 53(6):857-869.
[12] 张柱霞, 孙明英, 杨洁, 等. 5-Aza-CdR和低氧对小鼠海马中蛋白磷酸酶-1γ表达及对学习记忆的影响[J]. 动物医学进展, 2015, 36(9):59-63.
The changes of DNMT1,DNMT3A and Protein Phosphatase 1γmRNA in later phase of hypoxic preconditioning mice
XIE Wei1ZHANF Zhu-xia1JIA Xiao-e1,2#JIANG Shu-yuan1SHI Rui1LIU Xiao-lei1XU Wen-qiang1ZHANG Yanbo3*SHAO Guo1,4*
(1. Biomedical Research Center, Baotou Medical College, Baotou, Inner Mongolia Autonomous Region,Baoton 014060, China;2. School of Basic Medical and Forensic Medicine, Dept. of Cell Biology and Genetics, Baotou Medical College, Baotou, Inner Mongolia Autonomous Region,Baotou 014060, China; 3. Dept. of Neurology,Affiliated Hospital of Taishan Medical College, Taian 271000, China;4. Beijing key laboratory of Hypoxic Conditioning Translational Medicine, Xuanwu Hospital, Capital Medical University, Beijing 100053,China)
Objective: In hypoxic preconditioned mouse model, to study the changes of DNA methylation and protein phosphatase 1 expressions with the time after hypoxia. To reveal the hypoxia may regulate the PP1γ expression via the DNA methylation to play role in brain neuroprotection. Methods: The experimental group mice were injected with 5-aza-cdR (10 μmol/L, 5 μl), then they were treated by hypoxia and last they were euthanasia after zero/one/two/three/four day's hypoxia. Real-time PCR was used to examine the mRNA levels of DNMTs and PP1γ in the mice hippocampus. Results: The results showed that the mRNA level of DNMT1 was decreased after one day since hypoxia and DNMT3A decreased after two day since hypoxia (P<0.05), those changes might not be affected by the activity of DNA methyltransferases. The mRNA level of DNMT3B was restrained by 5-aza-cdR (P<0.05), but not DNMT1 (P>0.05). The mRNA levels of PP1γ were down-regulated by hypoxia (P<0.05). The mRNA levels of PP1γ were increased with 5-aza-cdR (P<0.05), and the increases had the relationship with the time after hypoxia. Conclusion: As the extension of time after hypoxia, the hypoxia may regulate the expression of PP1γ via the change in DNA methylation, especially DNMTs expression, to take part in the brain neuroprotection.
protein phosphatase 1; DNA methylation; DNA methyltransferase; hypoxic; mice
国家自然科学基金项目(81060212,81160244,81360316,81460283,81550038,81660307,81660204);内蒙古自然科学基金(2014MS0810,2015BS0801,2015BS0807,2016MS (LH)0307);包头医学院博士科研启动基金(BSJJ201632,BSJJ201623,BSJJ201617);内蒙古自治区高等学校科学技术研究项目(NJZY16207);泰山医学院高层次培育课题(2016GCC02)。
谢伟(1985—),男,内蒙古包头市人,博士,包头医学院中心实验室讲师,主要研究方向神经低氧保护。
张柱霞(1990—),女,山东莱芜人,博士,主要研究方向神经生物学。
R392
A
1004-7115(2017)02-121-05
10.3969/j.issn.1004-7115.2017.02.001
2016-11-12)
