右美托咪定对谷氨酸诱导的大鼠神经系统毒性作用的影响
2017-04-20李欣明李松泽刘洪涛
李欣明,李松泽,刘洪涛
(中国医科大学附属盛京医院麻醉科,沈阳110004)
右美托咪定对谷氨酸诱导的大鼠神经系统毒性作用的影响
李欣明,李松泽,刘洪涛
(中国医科大学附属盛京医院麻醉科,沈阳110004)
目的探讨右美托咪定(Dex)对大鼠谷氨酸神经毒性作用的影响及其机制。方法采用脑室注射谷氨酸制作大鼠脑谷氨酸神经毒性模型,将36只SD大鼠随机分为对照组(C组)、谷氨酸损伤组(G组,脑室注射谷氨酸)、Dex1组(脑室注射谷氨酸前30 min腹腔注射Dex 50 μg/kg)和Dex2组(脑室注射谷氨酸前30 min腹腔注射Dex 100 μg/kg)。2 h后取脑,分离出右侧海马组织测定超氧化物歧化酶和丙二醛,剩余脑组织测定脑含水量。另用尼氏染色法检测神经细胞受损状态。结果Dex1组和Dex2组的脑组织含水量、丙二醛水平比G组明显降低,超氧化物歧化酶明显升高。同G组相比,Dex1组、Dex2组海马尼氏染色结果显示神经细胞损伤减轻明显。结论Dex预处理可以明显减轻谷氨酸介导的神经毒性作用,其机制可能是通过增加超氧化物歧化酶,抑制氧化应激反应从而拮抗谷氨酸引起的细胞神经毒性作用。
右美托咪定;谷氨酸神经毒性;氧化应激反应
谷氨酸是脑内一种重要的兴奋性神经递质,广泛参与大脑神经各种活动,但脑组织中过多的谷氨酸则可过度激活谷氨酸受体,造成不同程度的继发性损害。谷氨酸神经毒性在多种中枢神经系统急、慢性疾病中起重要作用,例如阿尔茨海默病、帕金森病、癫痫、缺血性脑卒中、抑郁症等[1⁃2],适当调控神经系统中的谷氨酸信号系统的作用,能够有效控制各种原因所致的神经系统功能损伤。右美托咪定(dexmedetomidine,Dex)是一种新型的高选择性α2肾上腺素能受体激动药,具有良好的镇静、催眠、顺行性遗忘作用,现已广泛应用于临床[3]。基础实验研究[4]表明Dex对大脑等机体的重要脏器损伤具有保护作用,在培养的鼠神经元中注射谷氨酸盐诱导神经损害,给予Dex能够显著减少神经损伤[5],初步证实Dex对谷氨酸神经毒性具有显著的保护作用,但在体实验还未见报道,本研究拟建立大鼠在体脑谷氨酸神经毒性模型,观察Dex的作用效果。
1 材料与方法
1.1 材料
SD大鼠,雄性,体质量220~250 g,由北京华阜康生物科技有限公司提供。Dex购于江苏恒瑞医药股份有限公司。L⁃谷氨酸购于Sigma公司。超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒购于南京建成生物技术公司。尼氏染色液购于碧云天生物技术公司。
1.2 实验分组
健康雄性SD大鼠36只,采用随机数字表法随机分为对照组(C组)、谷氨酸损伤组(G组)、Dex1组(脑室注射谷氨酸前30 min腹腔注射Dex 50 μg/kg)、Dex2组(脑室注射谷氨酸前30 min腹腔注射Dex 100 μg/kg),每组9只。
1.3 动物模型制作
SD大鼠术前12 h禁食饲料,能自由饮水。腹腔注射10%的水合氯醛麻醉,剂量为3 mL/kg。麻醉后于脑立体定位仪上双耳插入耳杆固定,皮肤消毒后,剪刀剪开皮肤,钝性分离皮下组织并刮掉骨膜,清晰暴露前囟(Bregma点),以前囟为基准点,在其后1.0 mm,矢状缝右侧旁开1.5 mm处钻开颅骨,进针深度4 mm[6],用微量注射器行侧脑室注射4 μL谷氨酸(1 mg/kg)[7],C组侧脑室注射等容量生理盐水。取针后观察大鼠行为学改变,造模成功的标志为大鼠出现癫痫样抽搐。术后饲养室温保持在(22±2)℃,控制湿度稳定在50%±10%。术后2 h处死大鼠。每组取6只剥开颅骨分离出脑组织,迅速分离出右侧海马组织,将其快速置-80℃冷冻用于测定SOD、MDA。将分离出海马后剩余脑组织用于测定脑含水量,每组再取3只多聚甲醛灌注取脑后用于尼氏染色。
1.4 给药
Dex1组和Dex2组如前所述,G组只造成脑谷氨酸毒性模型,造模前30 min腹腔注射等量生理盐水。C组侧脑室注射等容量生理盐水,造模前30 min腹腔注射等量生理盐水。
1.5 尼氏染色
大鼠在脑室注射谷氨酸2 h后,以10%水合氯醛腹腔注射将其麻醉,开胸经心尖灌流生理盐水,接着灌注4%多聚甲醛内固定,断头取脑。多聚甲醛固定1周后,梯度乙醇脱水,石蜡包埋,制成8 μm厚的切片,进行尼氏染色(焦油紫法)。
1.6 SOD和MDA测定
取离心后的各组大鼠海马组织匀浆,按照试剂盒说明书,采用硫代巴比妥酸法测定SOD,采用黄嘌呤氧化酶法测定MDA。
1.7 脑含水量测定
取分离海马后剩余脑组织,以滤纸吸去表面血迹和脑脊液,用电子天平精确测量脑组织湿重,将脑组织放入恒温干燥箱(70℃)烘烤48 h至恒重,置于干燥缸冷却10 min后取出,用同一天平测量其干重(2次称重误差<0.2 mg)。用干湿重法计算脑组织含水量,计算公式为:脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.8 统计学分析
2 结果
2.1 脑组织含水量
结果显示,谷氨酸毒性可造成脑含水量增加,不同剂量的Dex均能抑制脑含水量的增加,缓解脑水肿(P<0.05)。Dex1组与Dex2组比较无统计学差异(P>0.05)。见表1。
表1 脑组织含水量Tab.1 Cerebral water content

表1 脑组织含水量Tab.1 Cerebral water content
1)P<0.05 compared with G group.
?
2.2 SOD和MDA
SOD能清除自由基,使细胞免受氧化损伤。MDA为脂质过氧化的有害产物,间接地反映出组织受到自由基攻击的程度。脑室注射谷氨酸后海马组织MDA的含量明显增加,给予Dex后能显著降低MDA水平(P<0.05),减轻损伤。见表2。给予Dex后,Dex1组和Dex2组SOD含量与G组比较都明显上升(P<0.05)。Dex1组与Dex2组比较无统计学差异(P>0.05)。见表3。
2.3 脑尼氏染色
光镜下见C组大鼠海马CA3区神经元排列有钙超载进而引起许多下级神经毒性级联反应,导致细胞损伤、凋亡[11]。2009年Dex在中国上市,广泛用于神经外科手术、心脏手术、区域镇静、重症监护室的镇静和全麻辅助药等方面。研究[12]表明Dex具有神经保护作用,其机制较为复杂,为了探讨Dex是否能够通过作用于谷氨酸相关的通路,改善谷氨酸引起的神经毒性作用,本研究通过大鼠脑谷氨酸毒性作用模型进行观察研究。谷氨酸的中枢毒性作用会使脑组织出现明显的水肿,过氧化物的含量明显增高[13]。结果证明,脑室内谷氨酸增高,能够使海马组织中MDA含量明显升高,引起明显的脑组织水肿,同时也发现SOD的水平明显降低。当腹腔预先注射50 μg/kg或100 μg/kg Dex时,谷氨酸引起的海马组织中MDA的含量明显降低,脑组织水肿也有明显改善,SOD的水平相对于单纯谷氨酸刺激组又有明显的升高。尼氏染色结果也证实给予Dex后能减序,细胞形态和结构正常,尼氏体大而明显。G组神经元排列紊乱,细胞稀疏,尼氏体缩小或模糊不清,有的细胞出现核固缩。Dex1组与Dex2组少量细胞尼氏体缩小,但细胞形态及结构基本正常,接近C组,和G组比较损伤减轻。Dex1组与Dex2组比较损伤程度相仿。见图1。
表2 海马组织中MDA含量Tab.2 The level of MDA in hippocampus
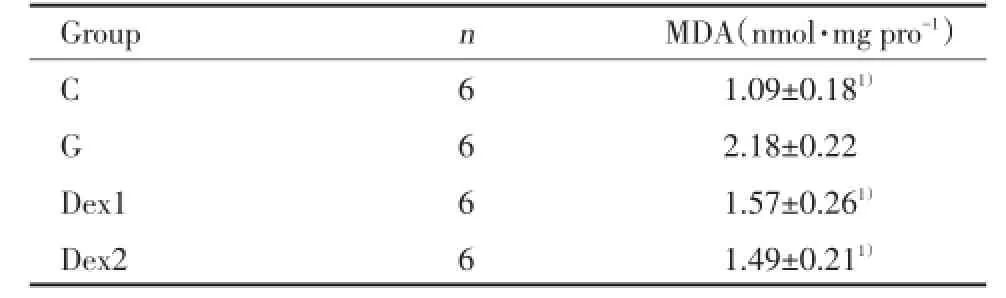
表2 海马组织中MDA含量Tab.2 The level of MDA in hippocampus
1)P<0.05 compared with G group.
?
表3 海马组织中SOD含量Tab.3 The level of SOD in hippocampus
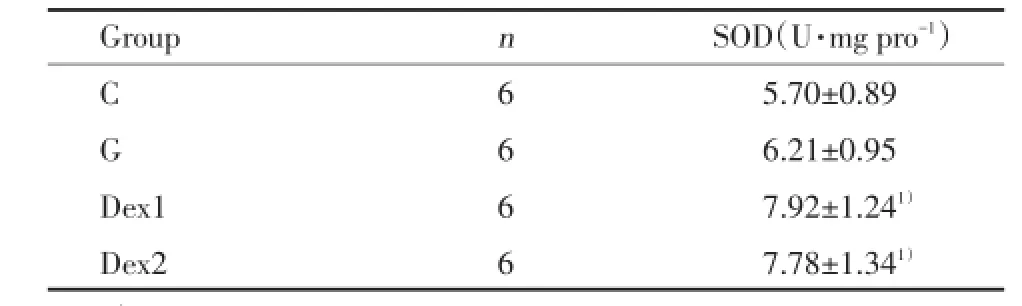
表3 海马组织中SOD含量Tab.3 The level of SOD in hippocampus
1)P<0.05 compared with G group.
?
3 讨论
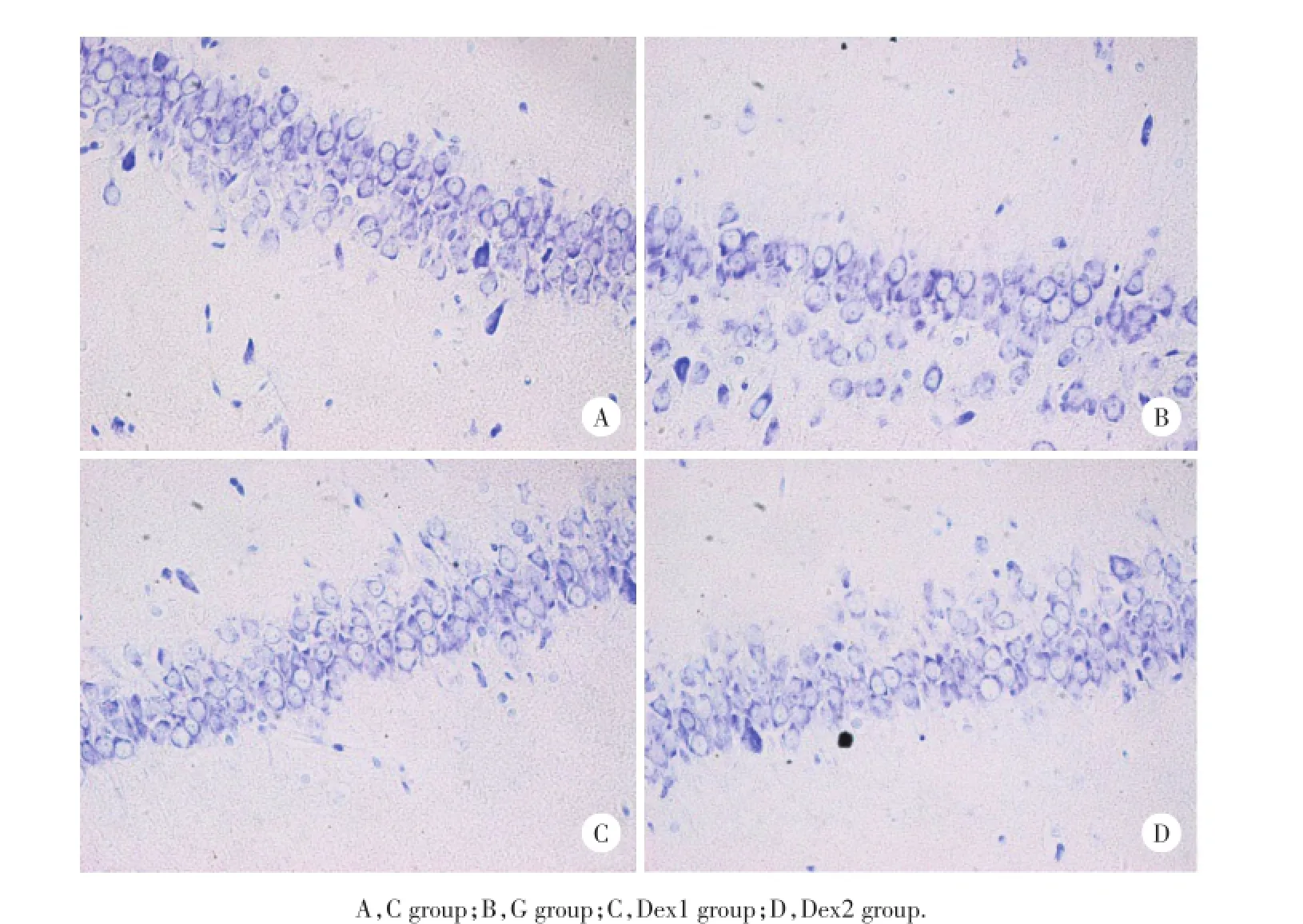
图1 CA3区的病理改变×400Fig.1 The pathologic change in CA3×400
谷氨酸是神经系统内最重要的兴奋性神经递质,过多的谷氨酸堆积造成继发性神经毒性。谷氨酸神经毒性造成脑损伤的机制主要是大量激活各种谷氨酸受体产生兴奋性神经毒性[8]和抑制细胞膜上谷氨酸/胱氨酸转运子的功能,产生氧化性毒性[9],造成钠、水的内流,使神经元急性肿胀,形成脑水肿[10],大量离子型谷氨酸受体激活,造成细胞内轻海马CA3区神经元的损伤及凋亡情况。说明过度的谷氨酸刺激会导致大量过氧化物生成,引起神经细胞的损伤,同时,升高的过氧化物会使SOD代偿性增高。提前给予不同剂量Dex,能显著减轻谷氨酸毒性造成的脑水肿,使海马组织中MDA含量降低,使能清除自由基的SOD进一步升高,从而产生显著的神经系统保护作用。结果分析发现50 μg/kg与100 μg/kg Dex对观察结果的影响无明显差别,具有相同的神经保护作用。
综上所述,Dex能够明显减轻谷氨酸介导的神经毒性作用,其机制可能是抑制氧化应激反应造成的神经毒性,其详细的机制还有待于进一步研究。
[1]ZHANG LN,HAO L,WANG HY,et al.Neuroprotective effect of resveratrol against glutamate⁃induced excitotoxicity[J].Adv Clin Exp Med,2015,24(1):161-165.DOI:10.17219/acem/38144.
[2]潘静,陈生弟.NMDA受体与神经退行性疾病的关系[J].上海交通大学学报(医学版),2009,29(1):98-101.
[3]PAN X,ZHANG Z,HUANG YY,et al.Electrophysiological effects of dexmedetomidine on sinoatrial nodes of rabbits[J].Acta Cardiol Sin,2015,31(6):543-549.DOI:10.6515/ACS20150424C.
[4]刘先保,张春芳,詹鸿.右美托咪定器官保护作用研究进展[J].中国现代应用医学,2013,30(10):1148-1151.DOI:10.13748/j. cnki.issn1007⁃7693.2013.10.013.
[5]DEGOS V,CHARPENTIER TL,CHHOR V,et al.Neuroprotective effects of dexmedetomidine against glutamate agonist⁃induced neu⁃ ronal cell death are related to increased astrocyte brain⁃derived neu⁃rotrophic factor expression[J].Anesthesiology,2013,118(5):1123-1132.DOI:10.1097/ALN.0b013e318286cf36.
[6]PAXINOS Q,WATSON C.The rat brain in stereotaxic coordinates[M].New York:Academic Press,2007:188-207.
[7]丁燕,魏欣冰,韩玉霞,等.辛伐他汀对谷氨酸损伤的大鼠海马组织中AMPA受体G1uR2表达的影响[J].山东大学学报(医学版),2009,47(5):38-41.
[8]JAN L,PAMELA M.Chronic Glutamate toxicity in neurodegenera⁃tive diseases⁃what is the evidence?[J].Front Neurosci,2015,16(9):469.DOI:10.3389/fnins.2015.00469.
[9]PIANI D,FONTANA A.Involvement of the cystine transport system xc⁃in the macrophage⁃induced glutamate⁃dependent cytotoxicity to neurons[J].J Immunol,1994,152(7):3578-3585.
[10]NICHOLH D,ATTWEL D.The release and uptake of excitatory amino acids[J].Trends Pharmacol Sci,1990,11(11):462-468.
[11]NEWELL DW,BARTH A,PAPERMASTER V,et al.Glutamate and non⁃glutamate receptor mediated toxicity caused by oxygen and glucose deprivation in organotypic hippocampal cultures[J]. J Neurosci,1995,15(11):7702-7711.
[12]王洋,陈克研,张铁铮,等.右美托咪定神经保护作用研究进展[J].创伤与危急重病医学,2014,4(2):85-87.DOI:10.16048/j. cnki.tccm.2014.02.009.
[13]KANG Y,TIZIANI S,PARK G,et al.Cellular protection using Flt3 and PI3Kα inhibitors demonstrates multiple mechanisms of oxidative glutamate toxicity[J].Nat Commun,2014,17(5):3672. DOI:10.1038/ncomms4672.
(编辑 于溪)
Effects of Dexmedetomidine Hydrochloride on Glutamate⁃induced Neurotoxicity in Rats
LI Xinming,LI Songze,LIU Hongtao
(Department of Anesthesiology,Shengjing Hospital,China Medical University,Shenyang 110004,China)
ObjectiveTo investigate the effects and mechanism of dexmedetomidine hydrochloride preconditioning against glutamate⁃induced neurotoxicity.MethodsThe model of glutamate⁃induced neurotoxicity was established by the injection of glutamate into lateral cerebral ventricle. Thirty⁃six SD rats were randomly divided into control group(C group),glutamate⁃induced neurotoxicity group(G group),Dex1 group and Dex2 group.Dex1 group and Dex2 group received intraperitoneal injection of dexmedetomidine respectively at a dose of 50 μg/kg or 100 μg/kg before glutamate application.Two hours later,the rats were sacrificed and hippocampus was separated to measure the level of SOD and MDA.The rest of each brain was used to measure the degree of brain edema.Pathological changes were observed under microscope with Nissl’s staining.Re⁃sultsIn contrast to G group,brain edema and MDA concentration in Dex1 group and Dex2 group were significant lower,while SOD concentra⁃tions were significantly increased and the pathological change in Dex1 group and Dex2 group were relieved obviously compared to glutamate⁃in⁃duced neurotoxicity group.ConclusionDexmedetomidine preconditioning can significantly attenuate glutamate⁃induced neurotoxicity,which is properly related to the inhibition of oxidative⁃stress reaction.
dexmedetomidine;glutamate⁃induced neurotoxicity;oxidative⁃stress reaction
R614.2
A
0258-4646(2017)04-0302-04
10.12007/j.issn.0258⁃4646.2017.04.004
国家自然科学基金(81271370)
李欣明(1987-),男,医师,硕士研究生.
刘洪涛,E-mail:2895364359@qq.com
2016-10-13
网络出版时间:
