Akt和SRC在Exosomes促进同源肺癌细胞迁移中的作用
2017-04-20解世林曲晶磊范一博车晓芳侯科佐曲秀娟刘云鹏王晓楠康健胡雪君
解世林,曲晶磊,范一博,车晓芳,侯科佐,曲秀娟,刘云鹏,王晓楠,康健,胡雪君
(中国医科大学附属第一医院1.呼吸疾病研究所老年病呼吸感染科;2.肿瘤内科,辽宁省抗肿瘤药物与生物治疗重点实验室;3.呼吸疾病研究所呼吸内科,沈阳110001)
·论著·
Akt和SRC在Exosomes促进同源肺癌细胞迁移中的作用
解世林1,曲晶磊2,范一博2,车晓芳2,侯科佐2,曲秀娟2,刘云鹏2,王晓楠1,康健3,胡雪君1
(中国医科大学附属第一医院1.呼吸疾病研究所老年病呼吸感染科;2.肿瘤内科,辽宁省抗肿瘤药物与生物治疗重点实验室;3.呼吸疾病研究所呼吸内科,沈阳110001)
目的研究肺癌细胞来源的Exosomes对其分泌细胞及同源肿瘤细胞迁移的影响,初步探讨PI3K/Akt和SRC信号转导通路在此过程中的作用。方法采用密度梯度离心法,从肺癌细胞A549的上清液中分离出肺癌细胞来源的Exosomes,利用透射电子显微镜观察Exosomes的形态,用Western blotting实验观察蛋白的表达。Transwell实验检测细胞的迁移能力。结果透射电子显微镜下观察肺癌A549细胞来源的Exosomes,其具有特征性的盘状结构,由双层膜构成,直径30~100 nm。Western blotting结果显示Exosomes表面富含CD9分子。A549细胞来源的Exosomes以剂量依赖性的方式促进A549和其同源肿瘤细胞HCC827细胞的迁移,并伴随Akt和SRC的活化。结论肺癌细胞来源的Exosomes能促进其分泌细胞和同源肿瘤细胞的迁移,其机制可能与Akt和SRC的活化有关。
Exosomes;迁移;肺癌;Akt;SRC
Exosomes是纳米级的由细胞分泌至胞外的囊性小泡体[1]。多种类型的细胞都可分泌Exosomes,其中包括肿瘤细胞、免疫细胞和上皮细胞等[2⁃4]。近年来,研究热点主要集中于肿瘤细胞及免疫细胞分泌的Exosomes。有研究[5]显示,肿瘤细胞来源的Exosomes可改变其周围的微环境,从而促进肿瘤的转移。然而,Exosomes是否能影响其分泌细胞及同源肿瘤细胞的迁移能力及其机制尚不清楚。本研究探讨了肺腺癌细胞A549分泌的Exosomes对自身及同源肿瘤细胞HCC827迁移能力的影响,以及PI3K/Akt和SRC通路在其中的作用,为进一步阐明肺癌来源的Exosomes对转移的自我调控机制提供新思路。
1 材料与方法
1.1 材料
CD9、β⁃actin抗体购自Santa Cruze公司,phosph⁃Akt、Akt、phosph⁃SRC、SRC抗体购自美国Cell Sig⁃naling公司,Transwell小室购自美国Corning公司。
1.2 细胞培养
肺癌细胞系A549、HCC827购自上海细胞库。人肺癌细胞A549、HCC827生长于含有12 U/L庆大霉素、100 mL/L灭活胎牛血清的RPMI1640培养液中,于37℃、5%CO2的孵育箱内培养,2 d左右传代1次。所有实验均采用对数生长期细胞。
1.3 Exosomes的制备
肺癌A549细胞在培养48 h后,收集上清液,以备提取Exosomes。首先,在4℃条件下,将收集的细胞上清液通过多步骤离心,去除细胞及细胞碎片(300g5 min、2 000g20 min、10 000g70 min)。然后将上清液移入高速离心管中,100 000g120 min。离心管中加满PBS溶液,再次4℃100 000g120 min离心。得到提纯的Exosomes沉淀。PBS 450 μL重悬,0.22 μm滤膜除菌,Bardford法测定蛋白含量,分装后,-80℃保存备用。
1.4 电镜
Exosomes超速离心成的沉淀,于4℃经固定液(2%多聚甲醛,2.5%戊二醛)固定1 h,PBS洗涤后,再经l%锇酸固定,梯度乙醇脱水,环氧树脂包埋、聚合。最后,超薄切片、铅铀染色,于透射电子显微镜下观察并摄片。
1.5 Western blotting检测蛋白表达
提取A549细胞来源的Exosomes,经超声破碎后加入上样缓冲液,煮沸5 min。不同浓度(0 μg/mL,5 μg/mL,20 μg/mL)Exosomes作用于对数生长期的A549细胞48 h后,同时收集A549细胞,将其裂解,与3×样品缓冲液混合后,煮沸5 min。将Exosomes样品和A549细胞裂解物进行聚丙烯酰胺(SDS⁃PAGE)凝胶电泳,湿法转印至硝酸纤维素膜上。5%脱脂牛奶封闭1 h后,分别加入一抗,以辣根过氧化物酶标记的羊抗鼠IgG作为二抗,ECL法显色,GIS凝胶图像分析系统照相并处理。
1.6 Transwell法检测细胞迁移能力
采用6.5 mm直径、10 μm厚度、8 μm孔径的聚碳酸酯多孔滤膜(24孔板Transwell小室)。将A549或HCC827细胞(3.0×104个)悬浮于200 μL无血清RPMI1640培养液中,并种植在小室的上层。下室加入含2.5%血清RPMI1640培养液500 μL。实验组加入15 μg/mL Exosomes,对照组加入同体积的PBS溶液。37℃培养24 h后,用PBS轻轻冲洗上室,用棉签去除膜上层未迁移的细胞。37℃风干20 min后,将小室膜进行瑞氏吉姆萨法固定、染色1 h。PBS冲洗风干后,于显微镜下观察穿膜细胞数,随机取5个视野,计数5个视野穿膜细胞总数。实验重复至少3次。迁移增加率=100%×(实验组穿膜细胞数-对照组穿膜细胞数)/对照组穿膜细胞数。
1.7 统计学分析
采用SPSS 16.0统计软件进行数据分析。所得数据均为3次独立实验结果,用x±s表示。2组之间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 A549细胞来源的Exosomes的验证
透射电子显微镜下观察,肺癌A549细胞的上清液中分离出肿瘤来源的Exosomes为双层膜构成的盘状结构,直径约30~100 nm(图1A)。进一步用Western blotting检测Exosomes的标志性蛋白,即四次跨膜分子CD9。结果发现Exosomes与等量的细胞裂解物相比,富含有更多的外泌体标志性蛋白CD9(图1B)。证明成功提取了A549细胞来源的Exosomes。

图1 肺腺癌A549细胞来源的Exosomes的验证×50 000Fig.1 Validation of exosomes isolated from the lung adenocar⁃cinoma cells,A549×50 000
2.2 肺癌细胞A549来源的Exosomes促进其分泌细胞的迁移
Transwell法检测A549细胞来源的Exosomes作用于A549细胞后,迁移能力的变化。结果表明,15 μg/mL A549来源的Exosomes作用于其自身24 h后,细胞的迁移能力明显提高(P<0.05),见图2。
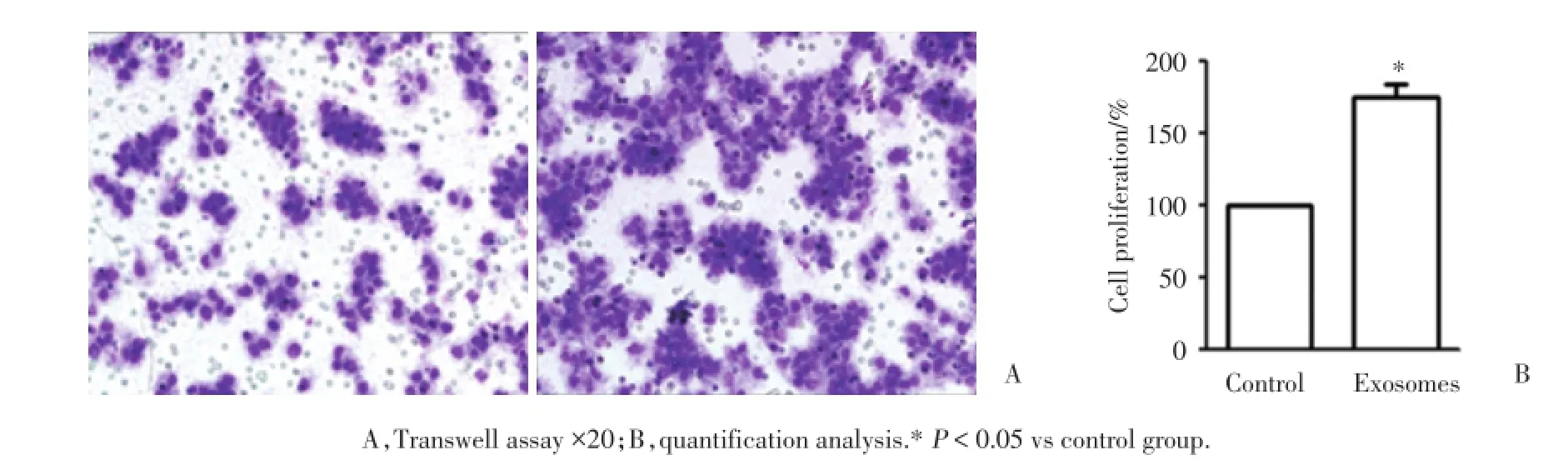
图2 A549来源的Exosomes促进A549细胞的迁移瑞氏吉姆萨法Fig.2 Exosomes derived from A549 cells promoted migration of A549 cells#Giemsa staining
2.3 Exosomes促进同源肺癌细胞HCC827的迁移
用Transwell法检测Exosomes作用于肺癌细胞HCC827后,细胞迁移能力的变化。结果表明,15μg/mL A549来源的Exosomes作用于HCC827细胞24 h后,细胞的迁移能力明显提高(P<0.01),见图3。
2.4 Exosomes诱导其分泌细胞中Akt和SRC的活化

图3 A549来源的Exosomes促进HCC827细胞的迁移瑞氏吉姆萨法×20Fig.3 Exosomes isolated from A549 cells promoted the migration of HCC827 cells Giemsa staining×20
Western blotting检测不同浓度的Exosomes作用于A549细胞48 h后,Akt和SRC的表达变化。结果表明,A549细胞来源的Exosomes可以剂量依赖性的方式促进A549细胞中Akt和SRC的活化。
3 讨论
Exosomes是细胞主动分泌至胞外的小囊泡,携带其来源细胞的重要遗传信息,介导细胞间的信息交流,促进肿瘤的增殖及转移等过程[6⁃7]。已有文献报告,肺癌来源的Exosomes可促其转移,然而其是否能促进其分泌细胞自身和同源肿瘤细胞的迁移及其机制尚不明确。
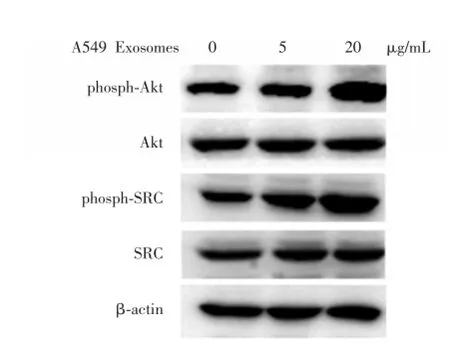
图4 Western blotting检测不同浓度的Exosomes作用于A549细胞后蛋白的表达Fig.4 Western blotting depicting the exosome⁃specific protein expression in response to treatment of the A549 cells with exosomes of different concentrations
既往研究[8]显示肿瘤来源的Exosomes可改变其微环境,从而促进肿瘤的转移。胰腺癌来源的Exo⁃somes可引发转移前位(niche)形成,从而促进胰腺癌细胞向肝脏转移[9];慢性淋巴细胞白血病细胞来源的Exosomes诱导间充质干细胞转变成癌相关成纤维细胞,从而促进慢性淋巴细胞白血病细胞迁移[10]。然而肺癌来源的Exosomes是否可影响其分泌细胞及其同源肿瘤细胞的迁移尚不明确。本研究结果显示,将A549细胞来源的Exosomes作用于其分泌细胞及同源肿瘤细胞后,迁移能力明显增强,提示肺癌细胞来源的Exosomes可促进其分泌细胞及其同源肿瘤细胞的迁移。
既往研究[5,11⁃13]证实,PI3k/Akt信号通路和SRC的活化促进胃癌、肠癌及乳腺癌等多种实体肿瘤的转移。近年的研究[14]显示,肺癌细胞来源的Exo⁃somalintegrins α6β4 and α6β1可通过激活肺癌细胞的SRC,促进其转移;肺腺癌细胞来源的Exosomes中的促肿瘤转移分子转移金属蛋白酶组织抑制剂⁃1可通过PI3K/Akt的活化,促进肺癌A549细胞的进展及转移[15]。本研究发现,A549细胞分泌的Exosomes以剂量依赖性的方式激活Akt和SRC,促进A549细胞的迁移能力增强。这些结果提示,肺癌来源的Exosomes可能通过激活Akt和SRC信号通路促进其分泌细胞及同源肺癌细胞的转移。
综上所述,肺癌来源的Exosomes不仅能够促进其分泌细胞的迁移,同时还可促进同源细胞的迁移,并伴随Akt和SRC的活化,提示PI3K/Akt及SRC通路是Exosomes促进其分泌细胞的迁移机制之一。本研究为进一步明确肺癌细胞自我调控迁移的机制和寻找治疗肺癌的靶分子提供重要的科学依据,具有潜在的临床应用价值。
[1]THÉRY C,ZITVOGEL L,AMIGORENA S.Exosomes:composition,biogenesis and function[J].Nat Rev Immunol,2002,2(8):569-579.DOI:10.1038/nri855.
[2]KOSAKA N.Decoding the secret of cancer by means of extracellular vesicles[J].J Clin Med,2016,5(2):22.DOI:10.3390/jcm50200 22.
[3]XU AT,LU JT,RAN ZH,et al.Exosome in intestinal mucosal immu⁃nity[J].J Gastroenterol Hepatol,2016,31(10):1694-1699.DOI:10.1111/jgh.13413.
[4]GANGALUM RK,BHAT AM,KOHAN SA,et al.Inhibition of the expression of the small heat shock protein αB⁃crystallin inhibits exo⁃ some secretion in human retinal pigment epithelial cells in culture[J].J Biol Chem,2016,291(25):12930-12942.DOI:10.1074/jbc. M115.698530.
[5]DERITA RM,ZERLANKO B,SINGH A,et al.c⁃Src,insulin⁃like growth factor I receptor,G⁃protein⁃coupled receptor kinases and ko⁃cal adhesion kinase are enriched into prostate cancer cell exosomes[J].J Cell Biochem,2016,118(1):66-73.DOI:10.1002/jcb.25611.
[6]JEREZ S,ARAYA H,THALER R,et al.Proteomic analysis of exo⁃somes and exosomes⁃free conditioned media from human osteosarco⁃ma cell lines reveals secretion of proteins related to tumor progres⁃sion[J].J Cell Biochem,2017,118(2):351-360.DOI:10.1002/ jcb.25642.
[7]OHNO S,KURODA M.Exosomes⁃mediated targeted delivery of miRNAs[J].Methods Mol Biol,2016,1448:261-270.DOI:10.1007/978⁃1⁃4939⁃3753⁃0_19.
[8]KUMAR B,GARCIA M,MURAKAMI JL,et al.Exosome⁃mediated microenvironment dysregulation in leukemia[J].Biochim Biophys Acta,2016,1863(3):464-470.DOI:10.1016/j.bbamcr.
[9]ZHANG Y,WANG XF.A niche role for cancer exosomes in metasta⁃sis[J].Nat Cell Biol,2015,17(6):709-711.DOI:10.1038/ncb31 81.
[10]PAGGETTI J,HADERK F,SEIFFERT M,et al.Exosomes re⁃leased by chronic lymphocytic leukemia cells induce the transition of stromal cells into cancer⁃associated fibroblasts[J].Blood,2015,126(9):1106-1117.DOI:10.1182/blood⁃2014⁃12⁃618025.
[11]GU H,JI R,ZHANG X,et al.Exosomes derived from human mes⁃enchymal stem cells promote gastric cancer cell growth and migra⁃tion via the activation of the Akt pathway[J].Mol Med Rep,2016,14(4):3452-3458.DOI:10.3892/mmr.2016.5625.
[12]JI H,GREENING DW,BARNES TW,et al.Proteome profiling of exosomes derived from human primary and metastatic colorectal cancer cells reveal differential expression of key metastatic factors and signal transduction components[J].Proteomics,2013,13(10/11):1672-1686.DOI:10.1002/pmic.201200562.
[13]DENG Z,CHENG Z,XIANG X,et al.Tumor cell cross talk with tu⁃mor⁃associated leukocytes leads to induction of tumor exosomal fi⁃bronectin and promotes tumor progression[J].Am J Pathol,2012,180(1):390-398.DOI:10.1016/j.ajpath.2011.09.023.
[14]HOSHINOA,COSTA⁃SILVA B,SHEN TL,et al.Tumour exosome integrins determine organotropic metastasis[J].Nature,2015,527(7578):329-335.DOI:10.1038/nature15756.
[15]CUI H,SEUBERT B,STAHL E,et al.Tissue inhibitor of metallo⁃proteinases⁃1 induces a pro⁃tumourigenic increase of miR⁃210 in lung adenocarcinoma cells and their exosomes[J].Oncogene,2015,34(28):3640-3650.DOI:10.1038/onc.2014.300.
(编辑 于溪)
Role of Akt and SRC Pathways in Exosome⁃mediated Migration of Homologous Lung Adenocarninoma Cells
XIE Shilin1,QU Jinglei2,FAN Yibo2,CHE Xiaofang2,HOU Kezuo2,QU Xiujuan2,LIU Yunpeng2,WANG Xiaonan1,KANG Jian3,HU Xuejun1
(1.Institute of Respiratory Disease,Department of Respiratory and Infectious Disease of Geriatrics,The First Hospital,China Medical University,Shenyang 110001,China;2.Department of Medical Oncology,The First Hospital,China Medical University,Shenyang 110001,China;3.Institute of Respiratory Disease,Department of Respiratory Medicine,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo investigate the effect of Exosomes derived from lung cancer cells on the migration of secretory cells and homologous tu⁃mor cells and to explore the role of PI3K/Akt and SRC signaling pathways in this process.MethodsExosomes were isolated from the supernatant post density gradient centrifugation of A549,lung cancer cells.Morphology of the Exosomes was studied using transmission electron microscopy. Protein expression was analyzed using Western blotting.Cell migration was analyzed by a transwell assay.ResultsThe double⁃membrane⁃bound Exosomes appeared as discal⁃shaped structures,30⁃100 nm in diameter.Western blotting showed that CD9 was abundant in the Exosomes.The Exosomes promoted the migration of A549 cells and their homologous tumor cells,HCC827 in a dose⁃dependent manner,accompanied by the acti⁃vation of Akt and SRC.ConclusionThe Exosomes derived from A549(lung cancer)cells promote the migration of the secreting cells and the homologous tumor cells.The mechanism may be correlated with the activation of Akt and SRC.
Exosomes;migration;lung cancer;Akt;SRC
R734.2
A
0258-4646(2017)04-0294-04
10.12007/j.issn.0258⁃4646.2017.04.002
国家自然科学基金(81372546,81472193);辽宁省科学技术计划(2014226033,2014225013,L2014296);辽宁省教育厅重点实验室基础研究(LZ2014037)
解世林(1987-),女,助教,硕士.
胡雪君,E-mail:huxuejun2008@hotmail.com
2016-10-12
网络出版时间:
