构建用于相关基因筛选的微小亚历山大藻产毒株基因组文库
2017-04-14杨翠琪赵力超
杨翠琪,赵力超,2,李 献,王 丽,2,*
(1.华南农业大学食品学院,广东广州 510642;2.暨南大学食品安全与营养研究院,广东广州 510632)
构建用于相关基因筛选的微小亚历山大藻产毒株基因组文库
杨翠琪1,赵力超1,2,李 献1,王 丽1,2,*
(1.华南农业大学食品学院,广东广州 510642;2.暨南大学食品安全与营养研究院,广东广州 510632)
麻痹性贝毒素(paralytic shellfish poisonings,PSP)严重威胁海产食品质量安全,其主要是由水体中的甲藻代谢产生。利用分子生物学和生物信息学技术构建微小亚历山大藻ATMW02基因组文库,探求与PSP产生相关的基因群。经过与无毒亚历山大藻L35对比筛选,获得ATMW02株系特异性的DNA片段,然后,利用反向PCR扩展该片段的旁侧序列,分析其序列特征和功能,探讨有可能引起藻株致毒的关键酶。通过序列分析获得一段去除了内含子的240 bp大小的核苷酸序列,这条核苷酸序列在终止密码子之外的非编码区突变了三个碱基,并且存在三个非常保守的铜离子结合区。其对应的氨基酸序列翻译的对象是甲硫氨酰氨肽酶(methionine amino peptidase,MAP),氨基酸比对分析,其与芬地亚历山大藻MAP氨基酸序列相似性达到97%。研究结果为深入研究亚历山大藻产毒机制奠定了理论基础,同时,为加强海产品监控和质量安全提供有力的技术支持。
亚历山大藻,麻痹性贝毒素,基因组文库,分子生物学
海洋中的某些藻类,例如有毒亚历山大藻(Alexandrium),其分泌的有毒物质-麻痹性贝毒素(paralytic shellfish poisoning,PSP),是目前分布最广、危害最大的一种藻毒素[1],在鱼、虾、贝类等生物体内蓄积,对海产品安全有严重影响[2]。PSP会麻痹人的神经,轻度中毒会出现口唇部位发麻,重则引发呼吸困难、心脏功能紊乱。现已知海洋中有13种单细胞甲藻可产生麻痹贝毒素,我国沿海发现的有毒甲藻主要有三种[3]:贝玛亚历山大藻(Alexandriumtamarense)、微小亚历山大藻(Alexandriumminudum)、链状亚历山大藻(Alexandriumacatenella)。随着基因工程技术的迅速发展,人们对生物体基因的结构、功能表达及其调控机理的研究逐渐深入到分子水平,构建基因组文库己成为遗传研究实验室的常规策略。它对于分离特定的基因片段,研究基因的表达调控、基因组的结构和功能,以及人类和动植物的基因组工程等都有极其重要的作用。
大量的生理生态学和遗传学研究结果认为,毒素基因具有成块性,一旦某个特定毒素合成的基因被定位,可以采用某些分子生物学手段,如基于PCR 的引物步移(Primer walking PCR)法分离出完整的毒素合成基因组。现在已经知道一个基因的表达在很大程度上是由它的旁侧序列调控的,克隆基因的旁侧序列已经成为分子生物学研究中的常规工作之一。在测定已知基因片段的旁侧基因序列方法上,常用的有染色体DNA步移、锚定引物PCR、加入衔接头等方法[4-8]。其中应用染色体DNA步移的方法以其准确性高而常用。反向PCR技术是DNA步移方法的一种,它可以对一个已知序列DNA的两侧未知序列进行扩增和研究,在分子生物学研究中有广泛应用。
构建亚历山大藻产毒株基因组文库并从中筛选与毒素产生相关的基因片段,可为采取对应措施提供背景知识。一般认为,麻痹性贝毒素的表达受中间合成酶的影响,有基因群参与其中[9-10]。通过研究产毒株与无毒株的基因差别来了解PSP相关基因群。目前已经分离得到产毒株微小亚历山大藻ATMW02和无毒株L35。本文通过构建微小亚历山大藻ATMW02的基因组文库,使其含有与PSP产生相关基因群,经过与无毒株L35对比筛选,获得ATMW02株系特异性的DNA片段,然后,利用反向PCR研究特异性片段的旁侧序列,分析其序列特征和功能,探讨有可能引起藻株致毒的关键酶,进一步验证与PSP毒素产生的关系。研究结果将对有毒藻产毒机理或者产毒藻株的快速基因鉴定具有理论参考作用,同时对保障海产品消费安全至关重要。
1 材料与方法
1.1 材料与仪器
蛋白酶K、Taq酶、T4连接酶、Ex Taq DNA聚合酶 大连宝生物公司;Xho I、Sau3AI、Hind III酶 Takara生物技术有限公司;DNA凝胶纯化试剂盒 美国MBI公司;DGL2000 DNA分子量标准 北京鼎国生物技术有限责任公司;X-Gal、IPTG、氨苄青霉素 北京鼎国生物技术有限责任公司;PMD-18T质粒、有毒微小亚历山大藻ATMW02和无毒塔玛亚历山大藻L35 由暨南大学水生生物研究所提供;大肠杆菌DH5α鼎国生物工程有限公司,甘油冻存在-80 ℃;甘油 上海生工生物工程有限公司,分析纯;f/2培养基 参考文献[11]配制。
GeneAmp PCR system 9700PCR仪 美国ABI应用生物系统公司;WFH-20ZB紫外投射分析仪 上海精科实业有限公司;FC-16C高速冷冻台式离心机 方统生物技术有限公司;GE-100核酸电泳仪 杭州生物科技有限公司;Gel Doc EQ凝胶成像系统 美国BIO-RAD公司。
1.2 实验藻株处理
藻种的鉴定已通过光学显微镜及扫描电镜形态观察,结合rDNA序列比较等方法确定。单藻种培养在含500 mL f/2培养液的1000 mL锥形瓶中,接种密度约为160 cells/mL,培养温度(20±1) ℃,光照强度为100 μmol photons/(m2·s),由白色荧光灯供光,光∶暗=12 h∶12 h。每天定时晃动锥形瓶2次,每周更换培养基1次。每天早上9:00,取藻液滴于浮游生物计数框上,在光学显微镜下镜检计数。
1.3 实验方法
1.3.1 亚历山大藻基因组DNA提取 利用冻融-CTAB方法提取基因组DNA[11]。
1.3.2 插入片段制备 在灭菌的、洁净的PCR反应管中,用限制性内切酶Sau3A I部分酶切基因组DNA,酶切体系见表1。

表1 亚历山大藻基因组DNA酶切体系
轻混后,37 ℃酶切2 h后,75 ℃、15 min失活Sau3AI酶。酶切结束后用等体积酚∶氯仿∶异戊醇(25∶24∶1)抽提一次,氯仿∶异戊醇(24∶1)抽提一次,小心吸出水相并加入1/10体积的3 mol/L乙酸钠(pH5.2)和两倍体积的冰预冷的无水乙醇,于-20 ℃中静置数小时。然后在4 ℃下最大转速离心,沉淀用冰预冷的70%乙醇洗一次,待乙醇挥发完全后,溶于适量无菌超纯水中保存于-20 ℃。
1.3.3 酶解DNA片段克隆至T载体
1.3.3.1 插入片段的量 连接反应中需要的插入片段的量采用以下公式:
插入片段的量(ng)=加入载入载体的量(ng)×插入片段的大小(kb)×插入片段和载体的摩尔比/载体大小
式中的PMD-18T载体系统插入的DNA片段和载体的摩尔比3∶1的连接比例。加入载入载体的量为50 ng。插入片段大小为200 bp~2 kb。载体大小为2.6 kb,浓度为50 ng/μL。
1.3.3.2 插入片段与供体载体的体外连接 反应前将2×快速连接缓冲液混匀,在灭菌的0.2 mL PCR反应管中依次按照表2加入组分。
连接反应:在16 ℃条件下,反应过夜。

表2 连接反应体系
1.3.4 制备大肠杆菌DH5α感受态细胞 参照文献[11]。
1.3.5 转化子质粒提取 在过夜培养的生长有白色菌落和蓝色菌落LB/氨苄/IPTG/X-Gal平板上,用无菌的接种针挑取白色菌落,接种在含有100 mg/mL氨苄青霉素的LB液体培养基中,37 ℃振荡培养过夜,在相应的每个白色菌落做上标记。提取质粒,通过凝胶电泳确认是否含有质粒及其质粒的大小。
1.3.6 序列测定及特异性鉴定 将提取的含有插入片段的质粒进行序列测定,去除质粒本身DNA序列,得到插入片段的DNA序列。根据测序结果,设计合成扩增引物,分别扩增产毒微小亚历山藻ATMW02和无毒藻塔玛亚历山大藻L35基因组DNA,根据扩增结果进行特异性鉴定。
1.3.7 反向PCR法分析与产毒相关DNA片段上游未知序列 常规PCR技术是扩增两个引物之间的DNA片段,而反向PCR是用反向的引物来扩增两引物之外的DNA片段。其目的是扩增一般已知目的顺序旁侧的DNA[9-13]。由于反向PCR可用于研究与已知DNA片段相连的未知DNA序列,因此又被称为DNA步移。此法所选择的引物虽与已知DNA序列互补,但两引物3′端是反向的。反向PCR扩增前,先用限制性内切酶酶切DNA,然后用连接酶使带有粘性末端的DNA片段进行自身环化,最后用一对反向引物进行PCR扩增,得到的线性DNA将含有两引物外侧的未知序列,如图1所示。
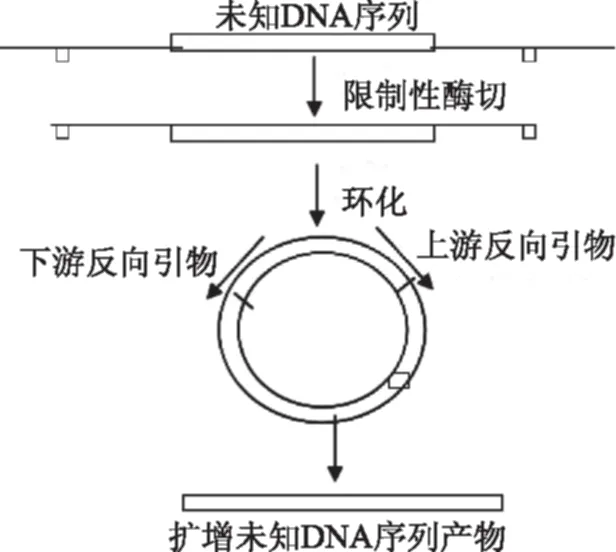
图1 反向PCR扩增特异性片段两端未知序列原理图Fig.1 Process of amplification of the two ends of specific DNA fragment by inverse PCR
1.3.7.1 引物设计和限制性内切酶选择 反向PCR中,上游引物应该靠近序列3′端,下游引物应该偏向序列5′端。限制型内切酶的酶切位点应该在已知下游序列前,而且必须保证引物之间和上游引物后面无该限制性内切酶的酶切位点。另外,限制性内切酶的选择还应该考虑:酶切识别位点不可有简并位点,因为可能会影响下一步的连接反应;避免选择稀有的内切酶,一来价钱过高,二来往往这种内切酶浓度较低,影响酶切效果;尽量避免识别位点较短的内切酶,因为酶切后能够获得的序列可能过短,需要的目的序列信息过少。在本实验中,以插入片段序列信息为已知序列的模板,设计反向引物获得旁侧未知序。
1.3.7.2 限制性内切酶酶切消化染色体DNA 酶切消化的反应体系见表3。轻混后,37 ℃反应2 h。反应后将PCR管放于75 ℃,15 min灭活内切酶。酶切产物放于-20 ℃或直接进行下一步实验。

表3 PCR产物酶切反应体系
1.3.7.3 酶切产物的自身环化 用T4连接酶进行酶切产物的自身连接环化,反应体系见表4。环化条件:在PCR仪中16 ℃反应过夜。94 ℃反应15 min,来终止反应。

表4 自身环化反应体系
1.3.7.4 反向PCR反应 将引物均溶解并稀释至10 μmol/L浓度。反向PCR反应体系见表5。

表5 反向PCR扩增体系
按照下列程序进行PCR扩增:第一步,94 ℃变性5 min;第二步,按照下列参数重复30个循环,94 ℃变性0.5 min,52 ℃退火1 min,72 ℃延伸2 min;最后延伸72 ℃、7 min。该反应程序是第一类限制性内切酶反向PCR程序,其他反向PCR的退火温度因设计的引物不同而有所改变。
浓度为1%的琼脂糖进行凝胶电泳,电压为100 V时间为30 min。
1.3.7.5 扩增片段测序及序列分析 直接将反向PCR的扩增产物进行测序。测序的结果用contig1、chromas进行序列拼接。使用DNATool软件对DNA序列进行分析,在http://www.ddbj.nig.ac.jp/search/blast-e.html网站应用BLASTN程序对获得的基因片段进行同源性检索。用Gene tool软件去除序列中的内含子,然后用计算机软件BioEdit将拼接后的核苷酸序列翻译成氨基酸序列。将其他物种的氨基酸序列(来自GenBank)用BioEdit包含的Clustal W package进行多序列对位分析,并预测获得的该部分氨基酸的二级结构功能位点。
2 结果与分析
2.1 插入片段制备结果
按本文方法,共获得150 μg亚历山大藻ATMW02和L35基因组DNA,0.5 μg/μL,A260/A280为1.80,电泳结果表明获得的基因组DNA为大分子量,质量较好。经酶切后,DNA大片段被降解,制备的插入片段大小大部分介于200 bp~2 kb之间,连续片段分布,符合载体插入片段要求。
2.2 插入片段大小
选择PMD-18T载体系统进行DNA未知片段的克隆,该载体可用于PCR 产物的克隆,含有T7和SP6 RNA聚合酶启动子,其侧翼和多克隆位点区相接,多克隆位点区位于β半乳糖苷酶的α肽编码区内。α肽插入失活允许在指示培养基用颜色直接筛选重组克隆。插入片段成功克隆至PMD-18T载体中,可阻断β半乳糖苷酶的编码序列,因而重组克隆可在指示培养基上通过颜色进行筛选,选择白斑菌落作为可能的转化子。
在过夜培养的生长有白色菌落和蓝色菌落LB/氨苄/IPTG/X-Gal平板上,用无菌的接种针挑取白色菌落,接种在含有氨苄青霉素的LB液体培养基中,37 ℃振荡培养过夜,在相应的每个白色菌落做上标记。全部提取质粒,通过凝胶电泳确认是否含有质粒及其质粒的大小。阳性质粒电泳图见图2,具体插入DNA片段大小通过测序分析获得。
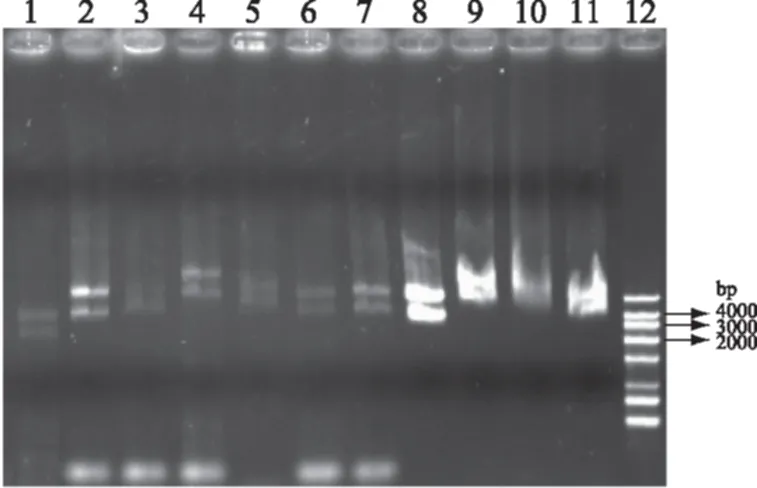
图2 提取的部分质粒电泳图Fig.2 Partial plasmids extracted from transformants注:1:质粒载体;2~11:从平板上挑选的部分白色菌落提取的质粒;12:DL4000 Marker。
2.3 序列测定及特异性鉴定结果
通过质粒测序,其中获得一段长度为1014 bp大小的DNA片段。根据这段序列的测序结果,设计一对引物,分别扩增有毒微小亚历山大藻ATMW02基因组DNA和无毒塔玛亚历山大藻基因组L35的DNA,判断这段序列的特异性。同时,扩增两株亚历山大藻属特异性核糖体保守区域。根据获得的DNA片段设计的序列特异性引物为:A-U:5′-TAACC GAGGTTAAAGCTAAGC-3′;A-D:5′-GATTCACCG GCAACCCGACT-3′。同时,利用甲藻18S rDNA专一性引物:B-U:5′-TGTGTGAAAGATTAAGCCATG-3′;B-D:5′-ACTTCTCCTTCCTCTAAGTGA-3′,PCR扩增两株亚历山大藻ATMW02基因组作为背景对照。根据获得的DNA片段设计的引物退火温度Tm为52 ℃,属特异性引物退火温度为55 ℃,扩增结果见图3,结果显示引物对为属特异性引物两者均有扩增,ATMW02有强烈的扩增反应,而L35没有扩增迹象。
麻痹性贝毒素(PSP)是一类嘌呤化合物,没有对应翻译的核酸序列,是由多种相关基因合成不同的酶,再由酶作用合成PSP。微小亚历山大藻ATMW02为PSP产毒藻株,应含有PSP产生过程完整的相关基因群,无毒藻株L35则相关基因群至少不完整。因此,分离PSP相关基因群一个特征为相对于无毒藻株的有毒株株系特异性。从图3结果看出,两种藻株均可以扩增出甲藻专一性DNA片段。而利用本文获得的特异性DNA片段设计的引物可以在ATMW02基因组中扩增出1000 bp左右大小的特异性条带有强烈扩增信号,而在L35基因组中不能扩增出相应的特异性条带,说明这段序列具有产毒株特异性,可能为产麻痹性贝毒素(PSP)相关的DNA片段。两种藻株中都能扩增的条带说明是亚历山大藻背景条带,与PSP毒素产生关系不大。
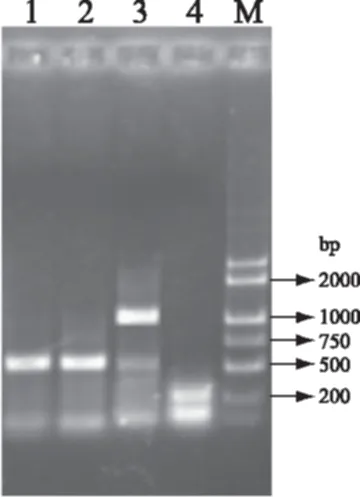
图3 筛选片段的ATMW02与L35的株系特异性Fig. 3 Strain specificity of gene fragment between ATMW02 and L35注:1、2:引物对为属特异性引物;3、4:引物对为本文分析序列。
2.4 反向PCR引物设计与限制性内切酶选择
已知特异性DNA片段可能与产毒有关,通过反向PCR方法探知其旁侧DNA序列,寻找与产毒相关的基因群。对特异性片段DNA序列分析后选择AsuII和XhoI 这两种限制性内切酶分别对特异性DNA片段进行酶切。酶切后,两个粘性末端会结合成环,未知的DNA序列环于环中。根据酶切位点设计引物,引物与已知DNA序列互补,但两引物3′端是反向的。针对限制性酶AsuII设计的反向PCR引物为:上游引物AsuII-U:5′-TCGCCATCAGTAGTT CGCTC-3′;下游引物AsuII-D:5′-GCAACGAGTTAA ACAACGAG-3′。针对限制性酶XhoI设计的反向PCR引物为:上游引物XhoI-U:5′-TCGGTGCC GCTACTGCCCGC-3′;下游引物XhoI-D:5′-GCACATCCGGTGATCTT GA-3′。序列及引物分析结果见图4。

图4 反向PCR引物及内切酶分析Fig.4 Primers and endonucleases for inverse PCR注:内切酶酶切位点以方框标示,引物序列及方向以箭头标示。
2.5 反向PCR扩增产物分析

图7 微小亚历山大藻ATMW02的MAP部分氨基酸序列与其他物种的比对结果Fig.7 The alignment of partial MAP sequences among five species注:Alexandrium fundyense:AAD20316;Arabidopsis thaliana:AAG33975;Oryza sativa:XP_473849;Bos Taurus:AAI13347.1. 比对结果的方框部分是MAP铜离子结合区域。
通过反向PCR扩增产毒微小亚历山大藻A.minitumATMW02特异性DNA片段两侧未知区域,其中利用AsuII酶得到750 bp左右的片段,利用XhoI酶得到1.0 kb左右的片段。将反向PCR产物送至测序,测序结果分别是755 bp和1100 bp。将所得的两段DNA序列与之前得到的特异性片段进行拼接并去除其中内含子,获得一段去除了内含子的240 bp大小的核苷酸序列。参照Alexandiumfundyense(芬地亚历山大藻)的开放阅读框架[14],利用BioEdit软件将拼接后的序列翻译成氨基酸。反向PCR产物电泳图及序列结构分析结果参见图5及图6。
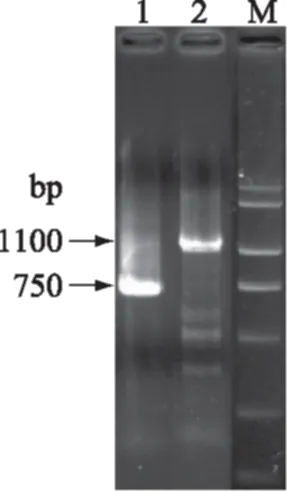
图5 反向PCR产物电泳图Fig.5 Inverse PCR product注:Lane M:DL2000 DNA分子量标准;Lane 1,2:利用AsuII酶得到的反向PCR产物,利用XhoI酶得到的反向PCR产物。

图6 核苷酸序列分析Fig.6 Nucleotide sequence analysis注:方框中部分是核苷酸序列的氨基酸翻译产物。
反向PCR扩增结果翻译的氨基酸序列经过在NCBI数据库中Blast比较分析,发现其中471~710 bp之间一段氨基酸序列翻译的对象属于甲硫氨酰氨肽酶(methionine aminopeptidase,MAP)氨基酸序列的一部分,通过序列比对发现,其与芬地亚历山大藻A.fundyenseMAP的氨基酸序列的相似性为97%,与拟南芥(Arabidopsisthaliana)相似性为53%,与水稻(Oryza sativa)相似性为55%,与牛(Bos Taurus)的相似性为51%(图7)。
甲硫氨酰氨肤酶(MAP)广泛存在于从低等到高等的所有生物体中,在蛋白质加工过程中负责切除新生肤链N端的起始甲硫氨酸,这对于对蛋白质的修饰、成熟以及在细胞中的准确定位等极其重要,MAP活性是正常生理功能所必需的。一般在原核生物中,MAP单基因单拷贝就能满足细胞的正常生理功能,但真核生物中却至少存在两种构型的MAP。Taroncher-Oldenburg等利用同步化技术和差异显示技术,发现,甲硫氨酰胺肽酶有可能参与了麻痹性贝毒素的生物合成,推测其对应的map基因与毒素合成有关,且为表达上调基因[14]。
MAP具有金属离子依赖性,已知在A.fundyense中该酶具有5个铜离子结合位点,在本文微小亚历山大藻ATMW02甲硫氨酰胺肽酶的部分氨基酸序列中发现3个区域,分别为GHG、LEP和EHT,同时也说明这三个区域在MAP中高度保守。
在http://searchlauncher.bcm.tmc.edu/seq-search/struc-predict.html网站上,分析这段氨基酸序列的二级结构及其功能位点,发现该酶具有三个功能区域,分别是:位于29~34的GTTFTL是N-14烷基化位点(N-myristoylation site);位于47~50的TWDD是酪蛋白激酶II磷酸化位点(Casein kinase II phosphorylation site);位于57~59的SDR是蛋白激酶磷酸化位点(protein kinase phosphorylation site)。
分析这段核苷酸序列,发现在编码区与已报道的核苷酸序列完全相同,主要区别在3′端的非编码区,本研究得到的这段序列在非编码区末端突变了三个碱基CAG(见图6中标下划线的碱基),并且已报道的研究也发现差别均在终止密码子之外的非编码区。因此,可以判断不可能是由同一转录产物不同加工造成的。据研究,在微小亚历山大藻ATMW02中存在至少三个map基因拷贝,它们分别转录得到三种mapmRNA分子,或者转录得到两种mapmRNA后,由反式拼接或者RNA编辑产生第三种mapmRNA[15]。根据序列同源性MAP分为MAP-I和MAP-II两类,两者的区别在于MAP-II的C端插入了一个约60个氨基酸残基组成的a螺旋[16],通过分析在本文微小亚历山大藻ATMW02的C端没有发现60个左右的氨基酸插入,所以判断微小亚历山大藻A.minitumATMW02的MAP可能为I型酶。
到目前为止,对亚历山大藻的产毒基因和产毒机制的研究还处于刚起步阶段[17-22],产毒基因和具体产毒机制都不清楚。在原核生物中,MAP单基因单拷贝就能满足细胞的正常生理功能,但是真核生物中却至少存在两种构型的MAP。Giglione发现在细胞的不同空间可能需要不同的MAP酶来执行其功能[23]。亚历山大藻正常生长代谢需要MAP的多个基因拷贝,本研究发现的这段非编码区碱基发生突变,根据生物信息学分析,推测其突变可能是由于在生长代谢过程中,MAP执行了不同的生理功能需求,在转录水平上对毒素的产生进行了调控,map基因通过其编码产物对其他产毒相关基因进行了诱导,使其具有活性表达,开始毒素合成。
3 结论
本文通过构建微小亚历山大藻A.minitumATMW02文库,筛选到具有产毒株阳性而无毒株阴性的株系特异性重组片段,并运用反向PCR方法扩增及测定特异性片段两端未知DNA片段,同时对获得序列的特征和功能进行了分析。用稀有限制性内切酶Sau3A I酶切微小亚历山大藻ATMW02基因组DNA,通过插入片段与载体的连接、转化以及平板筛选,获得一段1014 bp大小的特异性DNA片段。然后通过PCR验证其在有毒株中有强烈的扩增信号,而在无毒株中无扩增信号,判断该片段具有产毒株株系特异性。利用反向PCR分析特异性片段旁侧DNA序列信息。通过序列分析获得其中一段240 bp大小的核苷酸序列,其对应的氨基酸序列翻译的对象是甲硫氨酰氨肽酶(MAP)。氨基酸比对分析发现,其与芬地亚历山大藻MAP氨基酸序列相似性达到97%。获得的氨基酸序列中发现存在三个非常保守的铜离子结合区,其二级结构存在三个功能区域。
本研究对于深入研究藻毒素产生的机理提供了一种新的思路,运用分子生物学手段和生物信息学分析能够对相关基因群进行有效解析。研究结果对于快速检测有毒藻株、安全有效监测海产食品、防止污染麻痹性贝毒素污染的海产食品流入市场、保障消费者饮食安全等方面都具有积极的促进作用[24-25]。
[1]陈剑刚,朱炳辉,梁素丹,等. 固相萃取-高效液相色谱-串联质谱法测定贝类产品中麻痹性贝类毒素[J]. 中国卫生检验杂志,2016(1):4-8.
[2]周海霞,韩立民.我国海产品质量安全可追溯体系建设问题研究[J].中国渔业经济,2013,31(1):70-74.
[3]李政菊,胡蓉,吴霓,等. 海南岛近岸海域贝类中的麻痹性贝类毒素[J]. 海洋环境科学,2016(2):168-173,195.
[4]Trinh Q,Xu W T,Shi H,et al. An A-T linker adapter polymerase chain reaction method for chromosome walking without restriction site cloning bias[J]. Analytical Biochemistry,2012,425(1):62-67.
[5]Rudi K,Fossheim T,Jakobsen K S. Restriction cutting independent method for cloning genomic DNA segments outside the boundaries of known sequences[J]. Biotechniques,1999,27(6):1176-1177.
[6]Tamme R,Camp E,Kortschak R D,et al. Nonspecific,nested suppression PCR method for isolation of unknown flanking DNA[J].Biotechniques,2000(5):895-902.
[7]Dastur R S,Kachwala M Y,Khadilkar S V,et al. Identification of deletions and duplications in the Duchenne muscular dystrophy gene and female carrier status in western India using combined methods of multiplex polymerase chain reaction and multiplex ligation-dependent probe amplification[J]. Neurology India,2011,59(6):803-809.
[8]Krishnamurthy V V,Khamo J S,Cho E,et al.Multiplex gene removal by two-step polymerase chain reactions.[J]. Analytical Biochemistry,2015,481:7-9.
[9]樊立静. 亚历山大藻生长和产毒相关基因的基础研究[D]. 青岛:中国海洋大学,2006.
[10]董啸天. 我国海水养殖产品食品安全保障体系研究[D]. 青岛:中国海洋大学,2014.
[11]王丽. 近海食源微生物产毒特性的基因分析及其快速检测研究[D].广州:华南理工大学,2008.
[12]Xiao Y H,Luo M,Fang W G,et al. PCR walking in cotton genome using YADE method[J]. Acta Genetica Sinica,2002,29(1):62-66.
[13]Zhang Z,Gurr S J. Walking into the unknown:a ‘step down’ PCR-based technique leading to the direct sequence analysis of flanking genomic DNA[J]. Gene,2000,253(2):145-150.
[14]Taroncher-oldenburg G,Andeson D M. Identification and characterization of three differentially expressed genes,encoding S-adenosylhomocysteine hydrolase,methionine aminopeptidase,and a histone-like protein,in the toxic dinoflagellateAlexandriumfundyense[J]. Applied and Environmental Microbiology,2000,66(5):2105-2112.
[15]孙乃恩,孙东旭,朱德熙. 分子遗传学[M]. 南京:南京大学出版社,1990.
[16]Anelia A,Mamoru S,Masahiro S,et al. Molecular cloning,expression and characterization of three distinctive genes encoding methionine aminopeptidases incyanobacteriumSynechocystissp. strain PCC6803[J]. Arch Microbiol,2003,180:185-193.
[17]张树刚. 亚历山大藻产毒生理及合成机制研究[D].厦门:厦门大学,2006.
[18]卞中园,杨锡洪,解万翠,等. 初始密度对微小亚历山大藻生长及产麻痹性贝类毒素的影响[J]. 水产学报,2013(1):78-85.
[19]黄翔. 卤虫对微小亚历山大藻和塔玛亚历山大藻生长及产毒的影响[D].广州:暨南大学,2013.
[20]黄世玉,王雪虹,张丽莉. 磷浓度对2种有毒亚历山大藻生长和产毒力的影响[J]. 水生态学杂志,2012(1):107-111.
[21]李昌伟,冯超,江天久. N、P、Fe、Mn对微小亚历山大藻生长及产毒的影响[J]. 海洋环境科学,2014(3):341-345.
[22]毛丹卉,解万翠,杨锡洪,等. 微小亚历山大藻中麻痹性贝类毒素的冻融法提取优化[J]. 广东农业科学,2015(13):102-108.
[23]Giglion C,Serero A,Pierre M,et al. Identificaiton of eukaryotic peptide deformylases reveals universality of N-terminal protein processing mechanisms[J]. EMBOJ,2000,19(21):5916-5929.
[24]孔凡洲,徐子钧,于仁成,等. 黄渤海海域贝类麻痹性贝毒的检测与分析[J]. 中国海洋大学学报:自然科学版,2007(2):305-309.
[25]于仁诚,周名江. 麻痹性贝毒研究进展[J]. 海洋与湖沼,1998(3):330-338.
Construction of genomic library of strains producingAlexandriumMinudumalgae for the screening of related genes
YANG Cui-qi1,ZHAO Li-chao1,2,LI Xian1,WANG Li1,2,*
(1.College of Food Science,South China Agricultural University,Guangzhou 510642,China;2.Institute of Food Safety and Nutrition in Jinan University,Guangzhou 510632,China)
Paralytic shellfish poison(PSP),which is mainly produced by dinoflagellates of water,is a serious threat to Marine food quality and safety.AlexandriumminutumATMW02 genomic library was built to search the related gene group in PSP by using molecular biology and bioinformatics technology. After compared with non-toxicAlexandriumL35,a specificity fragments of the DNA in ATMW02 was obtained and the flanking sequences were expanded through reverse PCR. By analyzing the sequence features and functions,the key enzymes were explored that migth cause the poison also obtained a 240 bp nucleotide sequence without intron. This nucleotide sequence mutated three bases outside the termination codon and existed three conservative copper-binding domain,which could be translated into MAP and 97% match with theAlexandiumfundyenseMAP. The results of this study provided a theoretical foundation for further research onAlexandriumtoxin-producing mechanisms. In the meantime,it could provided technical support to enhance marine food quality and supervision.
Alexandriumminudum;paralytic shellfish poison;genomic library;molecular biology
2016-07-25
杨翠琪(1995-),女,大学本科,研究方向:食品科学与工程,E-mail:2744243473@qq.com。
*通讯作者:王丽(1980-),女,博士,副教授,研究方向:食品微生态与质量安全,E-mail:wangli_scau@scau.edu.cn。
广东省科技计划项目(2016A040403103);国家自然科学基金项目(31301445);国家星火计划(2015GA780080);广东省级“质量工程项目”-精品资源共享课“食品微生物检验学”。
TS254.7
A
1002-0306(2017)06-0179-07
10.13386/j.issn1002-0306.2017.06.026
