RORα高表达抑制人胃癌MGC803细胞上皮-间质转化
2017-04-14赵晓红
苏 坚,赵晓红,刘 芳,夏 红,苏 波,凌 晖,曾 希,苏 琦
RORα高表达抑制人胃癌MGC803细胞上皮-间质转化
苏 坚1,2,赵晓红2,3,刘 芳2,夏 红2,苏 波2,凌 晖2,曾 希2,苏 琦2
目的 在构建RORα高表达人胃癌MGC803细胞的基础上,观察RORα高表达对MGC803细胞上皮-间质转化(epithelial-mesenchymal transformation, EMT)的影响。方法 采用相差显微镜观察RORα高表达对MGC803细胞形态的影响。RT-PCR、Western blot、免疫荧光与免疫组化法检测EMT相关分子表达。裸鼠实验检测RORα高表达对移植瘤生长的影响。结果 相差显微镜显示,RORα高表达细胞较MGC803细胞大小较一致,呈圆形或椭圆形,异型性降低。Western blot检测结果显示,RORα高表达可明显下调MGC803细胞Snail蛋白表达(P<0.05)。RT-PCR与Western blot检测结果显示,RORα高表达可下调vimentin和上调E-cadherin mRNA与蛋白表达。免疫荧光检测结果显示,RORα高表达组细胞Snail与vimentin阳性信号表达较对照组明显减弱,而E-cadherin阳性信号显著增强。RORα高表达组移植瘤较对照组生长减慢(P<0.05),移植瘤体重较对照组明显降低,抑瘤率为26.55%(P<0.05)。RORα高表达组较对照组癌细胞异型性降低。RORα高表达组较对照组的Ki-67、CD34与vimentin阳性表达均明显降低,而E-cadherin阳性表达明显增强。结论 RORα高表达可体内外抑制人胃癌细胞EMT。
胃肿瘤;RORα;人胃癌MGC803细胞;上皮-间质转化
我国胃癌发生率与病死率位居所有恶性肿瘤的第2位。多数患者就诊时已发生侵袭转移,5年生存率低于10%[1,2]。因此,研究胃癌侵袭转移机制,寻找靶点具有重要意义。维甲酸相关孤核受体α(retinoid acid receptor related orphan receptor α, RORα)是核受体超家族成员之一,可调节多种正常组织细胞的发育和分化、生物代谢、机体稳态维持及高级神经功能等。并且,RORα在肿瘤中表达下调,与肿瘤发生密切相关,可能是肿瘤治疗的靶点[3,4]。本课题组前期实验发现RORα在胃癌中低表达,与胃癌发生和分化程度有关[5]。本实验进一步探讨RORα高表达对胃癌细胞上皮-间质转化(epithelial-mesenchymal transformation, EMT)的影响及其相关机制。
1 材料与方法
1.1 细胞培养 人胃癌MGC803细胞由湖南省高校肿瘤细胞与分子病理学重点实验室保存,RORα高表达RORα/MGC803细胞与空载体vector/MGC803细胞也由本实验室构建[6],分别置于含10%小牛血清的RPMI 1640培养基中,37 ℃ 5%CO2饱和湿度的培养箱内传代培养。取对数生长期的细胞用于实验。
1.2 主要试剂 RNA提取试剂盒购自OMEGA公司;逆转录试剂盒与BCA蛋白定量试剂盒为Promega公司产品;RORα、E-cadherin、vimentin与β-actin抗体购自Abcam公司;Snail、Ki-67与CD34抗体与ECL发光试剂盒购自Santa Cruz公司;新生牛血清购自杭州四季青生物公司。引物用Primer Premier 5.0软件设计,由上海生工公司合成。羊抗兔IgG-HR和羊抗小鼠IgG-HRP购于凯基生物;羊抗小鼠IgG(H+L)购于Protech生物公司。DAPI和正常山羊血清购于博士德生物公司。MaxVision试剂盒购自福州迈新公司。
1.3 相差显微镜观察 MGC803细胞与RORα高表达MGC803细胞培养24 h后,倒置相差显微镜观察细胞形态学变化。
1.4 RT-PCR Total RNA Kit提取细胞总RNA,AMV酶作用下逆转录合成cDNA。设计并合成PCR引物序列:vimentin:F 5′-ACACCCTGCAATCTTTCA GACA-3′,R 5′-AGAAATCCTGCTCTCCTCGCCT-3′,产物长度635 bp;E-cadherin:F 5′-CTCCCAATACA TCTCCCTTCAC-3′,R 5′-CGCCTCCTTCTTCATCATAGTAA-3′,产物长度423 bp;β-actin:F 5′-TCTACAATGAGCTGCGTGTGG-3′,R 5′-GGAACCGCTCATTGCCAATG-3′,产物长度498 bp。PCR反应条件:94 ℃ 5 min;94 ℃ 40 s,各基因Tm退火45 s 72 ℃延伸80 s,28个循环;72 ℃ 10 min。5 μL的PCR产物经1%的琼脂糖电泳,嗅化乙啶染色,通过IS1000图像分析软件读取条带灰度值,相对值以目的基因与β-actin灰度值之比表示。
1.5 Western blot 收集细胞,提取细胞总蛋白,BCA法测定蛋白浓度,每组取等量样本进行SDS-PAGE凝胶电泳,电泳后转膜,封闭1 h,加一抗,4 ℃过夜,TBST洗膜,加二抗孵育1 h,洗膜,ECL发光,X片曝光、显影、定影。
1.6 细胞免疫荧光实验 将对数期的MGC803细胞制成悬液,每孔接种5×105个细胞,待贴壁细胞融合至80%时,弃旧培养基。取出盖玻片,PBS洗5 min×3次,4%多聚甲醛固定细胞,常温下静置15 min,PBS洗5 min×3次;0.5%Triton覆盖细胞后,常温下静置30 min,PBS洗5 min×3次,吸干净残存PBS液;山羊血清封闭,37 ℃孵育1 h;吸净封闭液,加入一抗,湿盒内4 ℃过夜;第2天移置37 ℃复温1 h,PBS洗5 min×3次;暗室中加FITC的二抗,37 ℃避光孵育1 h,PBS洗5 min×3次。染核:将0.4 μg/μL的DAPI覆盖细胞,常温下避光静置2~5 min,PBS洗5 min×3次,甘油封片在荧光显微镜下观察。
1.7 裸鼠成瘤实验 裸鼠购自北京维通利华实验动物公司,4周龄雄性,分为MGC803细胞组与RORα高表达组,每组5只。将各组处于对数生长期的细胞密度调至每毫升1×107个,分别取0.2 mL细胞悬液接种于裸鼠腋下。观察接种后裸鼠进食、饮水、毛发、精神、活动等情况。每隔7天测量移植瘤大小(长径和短径),计算肿瘤体积(V),V=ab2/2,以每组裸鼠移植瘤体积的平均值,综合测量数据绘制移植瘤生长曲线。实验70天时麻醉处死裸鼠,在超净工作台上完整剥离肿瘤,称移植瘤重量,计算瘤重抑瘤率:瘤重抑瘤率=(1-高表达瘤重/对照组瘤重)×100%。移植瘤组织固定于10%中性福尔马林中。
1.8 免疫组化 免疫组化染色采用MaxVision法,一抗室温60 min,4 ℃过夜,PBS洗3 min×3次,滴加即用型MaxVision试剂,室温下15 min,PBS洗5 min×3次。DAB显色,自来水冲洗,苏木精复染,脱水、透明、封固、镜检。
2 结果
2.1 相差显微镜观察 相差显微镜显示,MGC803细胞大小不一,大部分呈长梭形,异型性明显,RORα高表达细胞大小较一致,呈圆形或椭圆形,异型性显著降低(图1)。这表明RORα高表达可促进MGC803细胞向上皮转化。

AB
图1 RORα高表达对MGC803细胞形态的影响:A.MGC803;B.RORα/MGC803
2.2 RORα高表达对MGC803细胞EMT相关分子的影响 Western blot检测结果显示,RORα高表达可明显下调MGC803细胞Snail蛋白表达(P<0.05,图2)。并且,RT-PCR与Western blot检测结果显示,RORα高表达可下调vimentin和上调E-cadherin mRNA与蛋白表达(P<0.05,图3、4)。

图2 RORα高表达对MGC803细胞Snail蛋白表达的影响1.MGC803;2.vector/MGC803;3.RORα/MGC803*P<0.05

图3 RORα高表达对MGC803细胞vimentin表达的影响1.MGC803;2.vector/MGC803;3.RORα/MGC803*P<0.05

图4 RORα高表达对MGC803细胞E-cadherin表达的影响1.MGC803;2.vector/MGC803;3.RORα/MGC803*P<0.05
2.3 细胞免疫荧光检测RORα高表达对EMT相关蛋白表达的影响 免疫荧光检测结果显示,Snail蛋白定位胞核,vimentin与E-cadherin蛋白定位于胞质。RORα高表达组细胞Snail与vimentin阳性信号较对照组明显减弱,E-cadherin阳性信号显著增强,与Western blot检测结果一致(图5)。
2.4 RORα高表达对MGC803细胞裸鼠移植瘤生长的影响 随着时间的延长,移植瘤体积逐渐增大,而RORα高表达组较对照组生长减慢(P<0.05,图6)。RORα高表达组移植瘤瘤重(3.90±0.33)较对照组(5.31±0.37)明显降低,抑瘤率为26.55%(P<0.05,图7),表明RORα可在体内抑制MGC803细胞移植瘤的形成。
2.5 RORα高表达对裸鼠移植瘤组织EMT相关蛋白表达的影响 HE染色可见,对照组移植瘤细胞核大深染,核质比大,核分裂较多,异型性明显;RORα高表达细胞异型性降低,核染色变浅,可见腺样结构。免疫组化检测结果显示,RORα高表达组较对照组的Ki-67、CD34与vimentin蛋白表达均明显减弱,E-cadherin蛋白表达明显增强(图8)。

图5 RORα高表达对EMT相关蛋白表达的影响

图6 RORα高表达对裸鼠移植瘤生长的影响
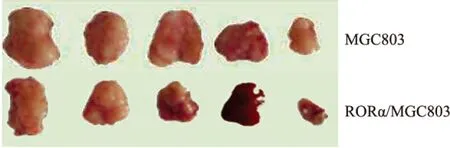
图7 RORα高表达对MGC803细胞裸鼠移植瘤生长的影响
3 讨论
研究认为,RORα在肿瘤中起着抑癌基因的作用。RORα在胃癌、结肠癌、食管癌、胰腺癌、肝癌、乳腺癌、子宫颈癌、卵巢癌、前列腺癌、膀胱癌、头颈部癌、白血病等多种肿瘤中表达下调,恢复RORα表达可体内外抑制乳腺癌细胞增殖与侵袭等恶性表型,RORα通过经典与非经典的核受体途径调控乳腺癌细胞增殖、凋亡与侵袭等功能,提示RORα可能是肿瘤治疗靶点[4]。研究结果显示,RORα在乳腺癌组织与细胞中表达下调,RORα和SEMA3F的mRNA水平减少与不良预后有关。恢复RORα表达可抑制乳腺癌细胞侵袭能力与裸鼠移植瘤生长和SEMA3F表达上调。表明RORα是潜在的肿瘤抑制基因[7]。研究发现,RORα在肝癌组织中表达明显下调,与血清AFP、病理分级、肿瘤复发、血管侵袭和预后密切相关,并且,RORα高表达可减少肝癌细胞需氧糖酵解和下调生物合成途径,上调p21,抑制PDK2表达和磷酸化[8,9]。但是,RORα抑制肿瘤细胞迁移侵袭与转移是否与EMT有关,尚不清楚。
众所周知,肿瘤细胞获得迁移和侵袭能力是肿瘤转移起始的重要步骤,而EMT是肿瘤细胞获得迁移和侵袭能力的关键。EMT是指在多种细胞因子的共同调节下,具有极性的上皮细胞通过特定程序转化为具有活动能力间质表型细胞的过程。上皮源性肿瘤细胞通过EMT获得侵袭和转移的能力,除发生形态学改变外,细胞与基膜的连接等上皮表型,获得较高的迁移与侵袭、抗凋亡和降解细胞外基质的能力等间质表型,如上皮标志物E-cadherin、ZO-1等表达下调,间质标志物vimentin、α-SMA、N-cadherin等上调以及Snail、Slug、Twist等转录因子活性增强。此时,肿瘤细胞间的连接变得疏松,细胞骨架蛋白发生重组,细胞黏附能力下降,迁移能力增强,更易于离开原有位置发生侵袭与转移。因此,肿瘤细胞出现EMT是启动肿瘤发生侵袭与转移的关键所在,阻止EMT已经成为抑制恶性肿瘤转移的新治疗策略[10,11]。 本组实验在RORα高表达抑制人胃癌细胞迁移与侵袭的基础上[6],进一步探讨RORα高表达对胃癌细胞EMT的影响。相差显微镜显示,RORα高表达细胞较MGC803细胞大小较一致,呈圆形或椭圆形,异型性降低。基于Snail、E-cadherin 与vimentin是肿瘤EMT的关键分子[12,13],Ki-67是肿瘤增殖能力的重要指标[14],CD34是血管形成的标志[15]。本组Western blot检测结果显示,RORα高表达可明显下调MGC803细胞Snail与vimentin和上调E-cadherin表达。免疫荧光检测结果与Western blot结果一致。体内实验结果显示,RORα高表达组移植瘤较对照组生长减慢,体重明显降低,癌细胞异型性降低,Ki-67、CD34与vimentin阳性均明显降低,E-cadherin阳性表达明显增强。上述结果证明RORα高表达通过下调Snail与vimentin和上调E-cadherin表达可体内外抑制人胃癌细胞EMT。

图8 RORα高表达对移植瘤EMT相关蛋白表达的影响,SP法
研究表明,RORα可通过Wnt5a/PKC、p53-dependent、Hypoxia/Angiogenesis、NF-κB等多种信号途径调控肿瘤细胞增殖、迁移与侵袭[5]。Lee等报道,RORα通过Wnt5a与PKC依赖方式负调控Wnt/β-catenin通路,抑制β-catenin介导转录激活Wnt/β-catenin靶基因功能。RORα可通过丝氨酸35残基磷酸化,竞争结合β-catenin,抑制Wnt/β-catenin靶基因cyclin D1、c-myc、Axin,从而调控细胞增殖与肿瘤进展[16]。此外,RORα可依赖PGE2/PKCα途径磷酸化减弱结肠癌细胞Wnt靶基因表达[17]。然而,RORα抑制人胃癌细胞EMT是否通过Wnt/β-catenin途径调控的详细分子机制尚待深入研究。
[1] Chen W, Zheng R, Baade P D,etal. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] Orditura M, Galizia G, Sforza V,etal. Treatment of gastric cancer[J]. World J Gastroenterol, 2014,20(7):1635-1649.
[3] 赵晓红, 苏 琦. 维甲酸相关孤核受体α与Wnt信号途径及肿瘤的关系[J]. 国际病理科学与临床杂志, 2011,31(3):234-237.
[4] Du J, Xu R. RORα, a potential tumor suppressor and therapeutic target of breast cancer[J]. Int J Mol Sci, 2012,13(12):15755-15766.
[5] 石 莺, 黄建军, 苏 坚, 等. RORα蛋白在胃癌中的表达及临床病理意义[J]. 临床与实验病理学杂志, 2012,28(3):270-273.
[6] 赵晓红, 刘 芳, 向姝霖, 等. RORα高表达对人胃癌MGC803细胞增殖与迁移侵袭的影响[J]. 肿瘤防治研究, 2016,43(11):926-932.
[7] Xiong G, Wang C, Evers B M,etal. RORα suppresses breast tumor invasion by inducing SEMA3F expression[J]. Cancer Res, 2012,72(7):1728-1739.
[8] Fu R D, Qiu C H, Chen H A,etal. Retinoic acid receptor-related receptor alpha (RORalpha) is a prognostic marker for hepatocellular carcinoma[J]. Tumour Biol, 2014,35(8):7603-7610.
[9] Byun J K, Choi Y K, Kang Y N,etal. Retinoic acid-related orphan receptor alpha reprograms glucose metabolism in glutamine-deficient hepatoma cells[J]. Hepatology, 2015,61(3):953-964.
[10] Gomes L R, Terra L F, Sogayar M C,etal. Epithelial-mesenchymal transition: implications in cancer progression and metastasis[J]. Curr Pharm Biotechnol, 2011,12(11):1881-1890.
[11] Wu Y, Liu Q, Yan X,etal. Podoplanin-mediated TGF-β-induced epithelial-mesenchymal transition and its correlation with bHLH transcription factor DEC in TE-11 cells[J]. Int J Oncol, 2016,48(6):2310-2320.
[12] Abouhashem N S, Ibrahim D A, Mohamed A M. Prognostic implications of epithelial to mesenchymal transitionrelated proteins (E-cadherin, Snail) and hypoxia inducible factor 1α in endometrioid endometrial carcinoma[J]. Ann Diagn Pathol, 2016,22:1-11.
[13] Lazarova D L, Bordonaro M. Vimentin, colon cancer progression and resistance to butyrate and other HDACis[J]. J Cell Mol Med, 2016,20(6):989-993.
[14] Lee W S, Park Y L, Kim N,etal. Myeloid cell leukemia-1 regulates the cell growth and predicts prognosis in gastric cancer[J]. Int J Oncol, 2015,46(5):2154-2162.
[15] Lee O, Choi M R, Christov K,etal. Progesterone receptor antagonism inhibits progestogen-related carcinogenesis and suppresses tumor cell proliferation[J]. Cancer Lett, 2016,376(2):310-317.
[16] Lee J M, Kim I S, Kim H,etal. RORalpha attenuates Wnt/beta-catenin signaling by PKCalpha-dependent phosphorylation in colon cancer[J]. Mol Cell, 2010,37(2):183-195.
[17] Shin D, Kim I S, Lee J M,etal. The hidden switches underlying RORα-mediated circuits that critically regulate uncontrolled cell proliferation[J]. J Mol Cell Biol, 2014,6(4):338-348.
Overexpression of RORα inhibits epithelial-mesenchymal transformation in human gastric cancer MGC803 cells
SU Jian1,2, ZHAO Xiao-hong2,3, LIU Fang2, XIA Hong2, SU Bo2, LING Hui2, ZENG Xi2, SU Qi2
(1DepartmentofPathology,theSecondAffiliatedHospital,UniversityofSouthChina,Hengyang421001,China;2CancerResearchInstitute,CenterforGastricCancerResearchofHunanProvince,KeyLaboratoryofCancerCellularandMolecularPathologyofHunanProvincialUniversity,UniversityofSouthChina,Hengyang421001,China;3DepartmentofObstetricsandGynecology,theHainanMaternalandChildHealthHospital,Haikou570206,China)
Purpose To investigate the influence of RORα overexpression on theepithelial-mesenchymal transformation (EMT) underlying construction of human gastric cancer MGC803 cells of RORα overexpression. Methods The morphological effect of MGC803 cells in the overexpression of RORα was observed by phase-microscope. The correlative molecules with EMT were detected by RT-PCR, Western blot, immunofluorescence and immunohistochemistry. The influence of xenograft tumor growth in athymic mice was observed on the overexpression of RORα. Results Phase-microscopy showed that MGC803 cells were size unification, round or ellipse and heteromorphism degrade in the overexpression of RORα. Western blot exhibited obviously the downregulation of Snail protein in the overexpression of RORα (P<0.05). RT-PCR and Western blot disclosed that the overexpression of RORα downregulated notably the expression of vimentin and upregulated E-cadherin mRNA and proteins (P<0.05). Immunofluorescence disclosed that the positive signal of Snail and vimentin protein was attenuate, but E-cadherin was strengthened in MGC803 cells of RORα overexpressiongroup. The xenograft tumor growth was markedly decreased , body weight of transplantation tumor visibly reduced and a inhibition ratio 26.55% (P<0.05) compared with that of the control group. And the protein expression of Ki-67, CD34 and vimentin was obviously decreased and the expression of E-cadherin increased in the RORα overexpression group. Conclusion The overexpression of RORα can remarkably inhibit EMT in MGC803 cellsinvivoandinvitro.
stomach neoplasms; RORα; human gastric cancer MGC803 cells; epithelial-mesenchymal transformation
时间:2017-2-27 10:14
http://kns.cnki.net/kcms/detail/34.1073.R.20170227.1014.014.html
国家自然科学基金(81374013、81102854)
1南华大学附属第二医院病理科,衡阳 4210012南华大学肿瘤研究所/湖南省胃癌研究中心/湖南省高校肿瘤细胞与分子病理学重点实验室,衡阳 4210013海南省妇幼保健院妇产科,海口 570206
苏 坚,男,硕士,副主任医师。E-mail: sj5929@163.com 苏 琦,男,博士生导师,教授,通讯作者。E-mail: suqi1945@163.com
R 735.2
A
1001-7399(2017)02-0143-06
10.13315/j.cnki.cjcep.2017.02.006
接受日期:2016-12-16
