Raptor、Rictor与结直肠癌血管生成的相关性及其临床意义
2017-04-14李欣焱吴淑华孙晨博李扬扬高向前
李欣焱,吴淑华,孙晨博,李扬扬,高向前,何 双
Raptor、Rictor与结直肠癌血管生成的相关性及其临床意义
李欣焱,吴淑华,孙晨博,李扬扬,高向前,何 双
目的 检测Raptor、Rictor与血管生成相关因子HIF-1α、HIF-2α以及VEGF在结直肠癌中的表达,探讨Raptor、Rictor与结直肠癌血管生成的相关性及其临床意义。方法 采用免疫组化、Western blot、RT-PCR法检测120例结直肠癌组织及60例正常结直肠黏膜组织中Raptor、Rictor及HIF-1α、HIF-2α、VEGF的表达及其差异;CD34标记微血管密度(microvascular density, MVD);分析各指标间的相关性以及与结直肠癌临床病理特征的关系。结果 Raptor、Rictor、HIF-1α、HIF-2α和VEGF蛋白在结直肠癌中的阳性率均明显高于正常结直肠黏膜组织(P<0.05)。Raptor、Rictor在中、低分化结直肠癌中的表达高于高分化结直肠癌(P<0.05),同时在淋巴结转移组的表达高于无淋巴结转移组(P<0.05);HIF-1α、HIF-2α和VEGF在淋巴结转移组的表达高于无淋巴结转移组(P<0.05);Raptor、Rictor阳性的结直肠癌组织中MVD明显高于Raptor、Rictor阴性的结直肠癌组织(P<0.05);Raptor与HIF-1α、VEGF在结直肠癌中表达呈正相关(P<0.01),Rictor与HIF-2α、VEGF表达呈正相关(P<0.01),Raptor与Rictor在结直肠癌中表达呈负相关(P<0.01)。结论 mTOR核心分子Raptor、Rictor与结直肠癌的发生、发展及血管生成密切相关,两者以不同途径协同促进结直肠癌的血管生成。
结直肠肿瘤;Raptor;Rictor;HIF-1α;HIF-2α;VEGF
血管生成是肿瘤赖以生存的基础,并与肿瘤转移、浸润密切相关;干预肿瘤血管生成已成为肿瘤靶向治疗的重要手段之一,如贝伐单抗等。然而,临床研究和应用结果表明[1],抗肿瘤血管生成药物的疗效没有临床前研究中预期的好,常因肿瘤产生耐药性导致治疗失败。因此,进一步探索阻断肿瘤血管形成的途径和靶点具有重要意义。众所周知,肿瘤血管形成机制复杂,始于诸多血管生成因子和抗血管生成因子平衡的打破,并且许多细胞信号通路参与调控并影响肿瘤血管形成[2]。研究表明,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是PI3K/AKT/mTOR通路中的关键分子,在调控细胞增殖、凋亡、迁徙以及肿瘤血管的生成过程中发挥重要作用[3]。本实验通过检测结直肠癌标本中mTOR的核心分子Raptor、Rictor与缺氧诱导因子(hypoxia inducible facter, HIF)家族成员HIF-1α、HIF-2α、血管内皮生长因子(vascular endothelial growth factor, VEGF)表达以及肿瘤微血管密度(microvascular density, MVD)的相关性,观察结直肠癌中Raptor、Rictor与血管生成的关系及意义,旨在进一步明确结直肠癌血管生成机制,为以阻断血管治疗策略的结直肠癌个性化治疗提供新思路。
1 材料与方法
1.1 材料 选取滨州医学院附属医院2013年1月~2015年7月手术切除的120例结直肠癌标本,其中男性63例,女性57例;年龄28~84岁,中位年龄58岁;肿瘤直径≥5 cm者52例,<5 cm者68例;结肠49例,直肠71例;高分化74例,中分化27例,低分化19例;浸润深度:黏膜及黏膜下层60例,肌层17例,浆膜或外膜43例;有淋巴结转移者33例,无淋巴转移者87例。所有病例均为首次发现,术前均未行任何放、化疗,术后均进行了联合化疗。选取60例正常结直肠黏膜组织(距病变边缘>5 cm)作为对照。所有标本均分别及时放入液氮中冻存和经用甲醛固定、石蜡包埋。根据WHO(2010)消化系统肿瘤分类标准,由两位以上资深病理专家经双盲法重新阅片。
1.2 试剂 鼠抗人VEGF(ab1316)抗体、兔抗人Raptor(ab40768)、Rictor(ab104838)、HIF-1α(ab51608)及HIF-2α(ab199)抗体均购自Abcam公司;鼠抗人CD34抗体及免疫组化试剂盒均购自北京中杉金桥公司;Western blot实验相关试剂购自碧云天公司;RT-PCR实验所需的RNAiso Plus、RT试剂盒及PCR试剂盒均购自Takara公司,Raptor、Rictor、HIF-1α、HIF-2α及VEGF特异性引物序列由Takara公司合成。
1.3 方法
1.3.1 免疫组化及结果判定 采用免疫组化EnVision法染色,石蜡标本切片、脱蜡、水化,3%H2O2孵育30 min,高压热修复抗原,滴加一抗(Raptor、Rictor、HIF-1α、HIF-2α、VEFG均以1 ∶100浓度配比)4 ℃过夜,加二抗37 ℃孵育30 min,DAB显色,苏木精复染,1%盐酸乙醇分化,返蓝,脱水,透明,封固。HIF-1α、HIF-2α、VEGF用已知结直肠癌的阳性切片作为阳性对照,Raptor、Rictor用睾丸癌切片作为阳性对照,均用PBS代替一抗作为阴性对照。Rictor、HIF-2α及VEGF表达于细胞质,Raptor、HIF-1α表达于细胞质/核,以出现棕黄色颗粒为阳性标志,每张切片随机选取10个高倍(×400)视野,每个视野计数100个细胞,根据细胞染色强度和阳性细胞比例评判实验结果。(1)按细胞染色强度评分:无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。(2)按阳性细胞比例评分:阳性细胞数≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。将两项得分结果相乘:≥4分为阳性,<4分为阴性。
1.3.2 结直肠癌组织中MVD计数 采用免疫组化EnVision法染色,以CD34标记血管内皮细胞,胞质棕黄色视为阳性。MVD的判定标准参照Weidner法[4]:将单个内皮细胞、内皮细胞簇和围成管腔者以及含有1~2层平滑肌的血管视为微血管进行计数;低倍镜下(×40)选择微血管分布最高密度区即“热点”区,计数5个高倍镜视野(×200)内的微血管数,取其平均值,即该例的MVD值。
1.3.3 Western blot法检测及结果判定 冰上提取组织蛋白,经BCA法蛋白定量后上样,SDS-PAGE电泳分离蛋白质,PVDF转膜1.5 h,5%脱脂奶粉溶液封闭1.5 h,加一抗(Raptor、Rictor、HIF-2α均以1 ∶1 000浓度配比; VEFG、HIF-1α均以1 ∶500浓度配比)4 ℃过夜,加二抗(羊抗兔IgG 1 ∶5 000)37 ℃孵育1.5 h,PBST洗膜,暗室曝光、显影、定影,室温晾干、扫描。用Quantity One软件分析目的蛋白和β-actin的吸光度值,以目的蛋白与β-actin吸光度值的比值作为目的蛋白的相对表达值。
1.3.4 RT-PCR检测及结果判定 按照Trizol试剂盒说明书提取组织RNA并检测其浓度,在37 ℃ 15 min,85 ℃ 5 s条件下将RNA逆转录成cDNA。PCR反应采用SYBR Green相对定量PCR法,按照说明书配置25 μL体系反应液,在CFX96T RT-PCR Detection System C1000上进行扩增,反应条件:95 ℃ 30 s GOTO 39(共40个循环),95 ℃ 5 s,60 ℃ 30 s。用系统软件分析实验结果:采用ΔΔCt法检测,样品相对表达量用2-△△Ct表示,ΔΔCt=结直肠癌ΔCt-正常结直肠黏膜组织ΔCt,ΔCt=目的基因Ct值-GAPDH Ct值。实验重复3次,结果取其平均值。

2 结果
2.1 结直肠癌中Raptor、Rictor、HIF-1α、HIF-2α和VEGF的表达 免疫组化结果显示:Raptor、Rictor、HIF-1α、HIF-2α和VEGF主要表达于结直肠癌细胞质或细胞核中,其阳性率分别为52.50%、60.00%、69.17%、48.33%和74.17%,均明显高于正常结直肠黏膜组织,其差异有统计学意义(P<0.05,图1)。Western blot检测结果显示:Raptor、Rictor、HIF-1α、HIF-2α和VEGF蛋白在结直肠癌组织和正常结直肠黏膜组织中的相对表达量显著不同,其差异有显著性(P<0.05,图2)。RT-PCR检测结果显示:结直肠癌中Raptor、Rictor、HIF-1α、HIF-2α和VEGF的相对表达量均高于正常黏膜组,差异有统计学意义(P<0.05,图3)。
2.2 Raptor、Rictor、HIF-1α、HIF-2α和VEGF蛋白表达与结直肠癌临床病理特征的相关性 结直肠癌标本中Raptor、Rictor、HIF-1α、HIF-2α和VEGF蛋白表达水平与患者年龄、性别、肿瘤大小、肿瘤部位和浸润深度均无相关性。Raptor、Rictor蛋白表达与结直肠癌的分化程度和淋巴结转移具有相关性,Raptor、Rictor蛋白在中、低分化结直肠癌组织中的表达明显高于高分化结直肠癌组织,差异有统计学意义(P<0.05),在伴有淋巴结转移的结直肠癌组织中的表达明显高于无淋巴结转移组,差异有显著性(P<0.05);HIF-1α、HIF-2α和VEGF蛋白表达与淋巴结转移有关,HIF-1α、HIF-2α和VEGF在伴有淋巴结转移的结直肠癌组织的表达明显高于无淋巴结转移组(P<0.05,表1)。
2.3 结直肠癌组织中Raptor、Rictor表达与MVD的相关性 免疫组化标记CD34来表示肿瘤组织内微血管并计数,结果显示:结直肠癌中CD34标记阳 性微血管数目Rictor、Raptor平均在 25.24±6.34~41.32±9.56之间;Raptor、Rictor阳性的结直肠癌组织中MVD(41.32±9.56、33.47±7.38)高于Raptor、Rictor阴性者(29.73±6.63、25.24±6.34),其差异有统计学意义(P<0.05)。Spearman相关性分析显示,结直肠癌中Raptor、Rictor均与MVD呈正相关(rs=0.432,P<0.05;rs=0.313,P<0.05),即随着Raptor、Rictor表达的增强,MVD随之升高(表2)。

表1 Raptor、Rictor、HIF-1α、HIF-2α和VEGF表达与结直肠癌临床病理特征的关系
*P<0.05

图1 结直肠癌中Raptor、Rictor、HIF-1α、HIF-2α、VEGF和CD34的表达:A.Raptor在结直肠癌细胞胞质中呈强阳性;B.Rictor在结直肠癌细胞胞质中呈强阳性;C.HIF-1α在结直肠癌细胞胞核与胞质中呈强阳性;D.HIF-2α在结直肠癌细胞胞质呈强阳性;E.VEGF在结直肠癌细胞胞质中呈强阳性;F.结直肠癌组织内CD34阳性微血管,EnVision法
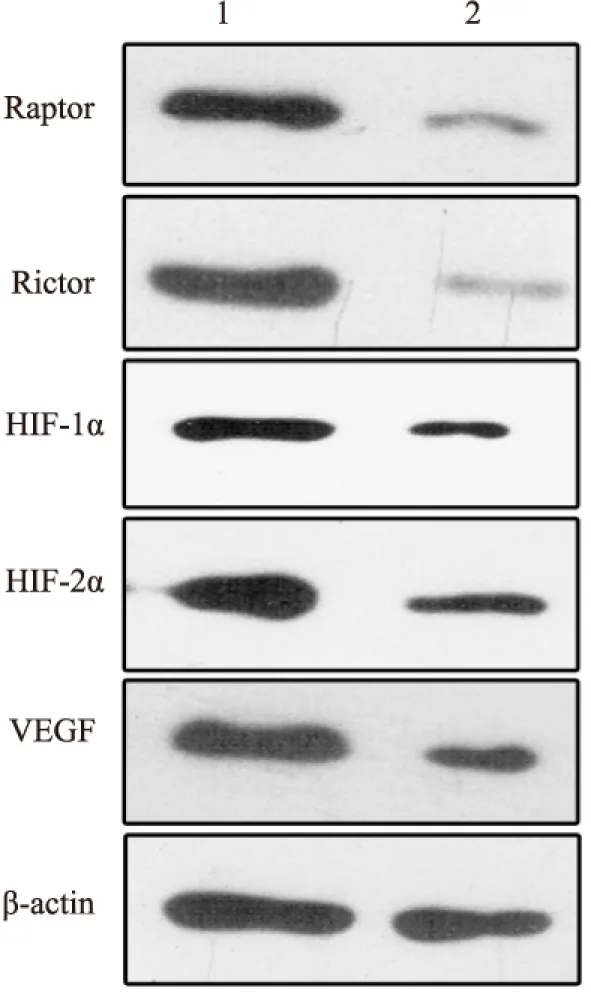
图2 Western blot法检测Raptor、Rictor、HIF-1α、HIF-2α和VEGF蛋白在结直肠癌和正常结直肠黏膜组织中的表达

图3 RT-PCR检测Raptor、Rictor、HIF-1α、HIF-2α、VEGF mRNA在结直肠癌和正常结直肠黏膜组织中的表达
2.4 结直肠癌组织中Raptor、Rictor与HIF-1α、HIF-2α和VEGF蛋白表达的相关性 Spearman相关性分析显示:结直肠癌中Raptor与HIF-1α的表达呈正相关(rs=0.557,P<0.05),而与HIF-2α无明显相关性(rs=0.085,P>0.05)。Rictor与HIF-2α的表达呈正相关(rs=0.551,P<0.05),而与HIF-1α无明显相关性(rs=-0.177,P>0.05,表2)。Raptor、Rictor的表达与VEGF表达均具有明显正相关性(rs=0.233,P<0.05;rs=0.248,P<0.05)。Raptor与Rictor两者表达呈负相关(rs=-0.402,P<0.05)。
3 讨论
结直肠癌的发展过程可分为无血管和有血管两个阶段。无血管阶段时,结直肠癌细胞主要依靠临近血管系统的简单物理弥散,其生长缓慢、凋亡率高,肿瘤体积一般不超过2~3 mm3。一旦进入有血管阶段,肿瘤体积快速增大并可发生转移。由此可见,血管生成直接影响结直肠癌的生长、侵袭和转移。因而,肿瘤血管生成关键因子及其调控机制成为研究肿瘤靶向治疗的热点之一。研究表明,PI3K/AKT/mTOR信号通路与肿瘤血管生成密切相关。Miyazawa等[5]发现,PI3K/AKT/mTOR信号通路是调控血管生成的重要通路,有“血管生成调节中心”之称,活化的PI3K可磷酸化下游的AKT而促进其激活,从而激活其下游调控血管生成的关键分子mTOR,并进一步磷酸化p70S6K和4E-BP1,从而增加HIF的表达,继而上调VEGF的表达,最终促进血管生成。因此,以雷帕霉素、渥蔓青霉素为代表的mTOR阻断剂的临床应用研究倍受关注,然而其疗效不佳。

表2 结直肠癌中Raptor、Rictor与HIF-1α、HIF-2α、VEGF表达及MVD的相关性
*P<0.05
研究发现,mTOR为大分子复合物,其中mTORC1和mTORC2为主要发挥作用的两个亚型,分别在调控蛋白质合成、代谢以及细胞增殖、血管生成和自噬等过程中发挥作用[6-7]。mTORC1复合物由mTOR、mLST8、PRAS40和Raptor组成,在多种肿瘤中发挥促进肿瘤血管内皮细胞增生、生长的作用[8]。而mTORC2复合物由mTOR、mLST8和Rictor组成,可通过调控内皮细胞骨架改变、血管内皮迁移,促进肿瘤血管形成[9]。新近研究证实,Raptor和Rictor分别是mTORC1和mTORC2的核心分子,对于保持其分子的完整性和功能必不可少,两者的表达水平可以直观反映mTORC1和mTORC2的生物学活性,并且其特异性和敏感性高于复合分子[10-11]。但两者与结直肠癌以及肿瘤血管生成的相关性研究鲜见报道。本组实验结果显示,结直肠癌中Raptor和Rictor的阳性率分别为52.50%、63.33%,均明显高于正常结直肠黏膜组织,并且与MVD呈正相关;两者与结直肠癌临床病理特征的相关性分析显示,Raptor、Rictor过表达与结直肠癌的分化、淋巴结转移有关,提示Raptor、Rictor不仅与肿瘤血管形成密切相关,并且结直肠癌的发生、发展、侵袭、转移及预后有关。
HIF家族成员HIF-1α、HIF-2α是PI3K/AKT/mTOR信号通路下游重要的靶基因[5,12],是调节细胞缺氧应答反应的重要因子,可有效激活其下游VEGF的表达,促进血管生成进而缓解局部组织缺氧。Sun等[13]的研究结果证实激活mTORC1可上调血管肉瘤细胞中HIF-1α的表达,从而增加其血管生成。Cejka等[14]研究结果证实,抑制胃癌细胞mTORC1的表达可以下调HIF-1α的水平,从而减少胃癌细胞血管生成。Ilhan等[15]研究结果证实,在神经母细胞瘤中通过mTORC2调控HIF-2α的表达,进而调节其血管生成。然而,有关mTORC1、mTORC2的核心分子Raptor、Rictor与HIF-1α、HIF-2α在肿瘤中的相互关系研究较少。本实验同步检测了Raptor、Rictor与HIF-1α、HIF-2α和VEGF以及MVD在结直肠癌中表达,并分析其相关性。结果显示,Raptor、Rictor在结直肠癌中的表达均与VEGF的表达呈正相关,但Raptor仅与HIF-1α表达呈正相关,与HIF-2α表达无相关性;Rictor则与HIF-2α表达呈正相关,与HIF-1α表达无相关性,提示Raptor、Rictor通过不同途径参与调控肿瘤血管生成。作者认为,Raptor通过上调HIF-1α,进而增加VEGF的表达,从而促进血管内皮细胞的生长和增殖;而Rictor则可上调HIF-2α的表达,参与细胞骨架的改建,促进内皮细胞增殖、迁移,并同时上调VEGF,最终促进血管生成。
大量研究结果表明[16],肿瘤血管生成有多种方式,包括肿瘤性毛细血管内皮细胞芽生、血管生成拟态、脉管共同选择等形式。结直肠癌中影响血管生成最主要的方式是肿瘤性毛细血管内皮细胞芽生,并受多种因子调控,其中VEGF是最有效的促血管生长因子。本组实验结果显示,在结直肠癌中VEGF呈高表达,并且与Raptor和Rictor的表达以及肿瘤MVD呈正相关,而Raptor与Rictor两者的表达则呈负相关。新近研究表明[17],在PI3K/AKT/mTOR信号通路中Raptor与Rictor的功能和作用位点不同,两者之间存在负反馈调节环路。Raptor负向调控Rictor的活性,当Raptor被阻断时,Rictor可被激活,并通过负反馈通路激活上游的AKT,继而重新激活其下游的Raptor。因此,作者认为,在肿瘤缺血、缺氧启动血管生成的过程中,Raptor与Rictor两者相互协调、互为调控。Raptor高表达可促进血管生成,而当Raptor受到抑制时,则可激活Rictor,进而上调HIF-2α的表达,促进血管生成,缓解缺氧。同时Rictor通过负反馈通路可重新激活Raptor,继而上调HIF-1α及VEGF的表达,重新促进血管生成。本组实验结果提示,在PI3K/AKT/mTOR信号通路中Raptor与Rictor同为mTOR的核心分子,两者在肿瘤血管生成中互为调控,协同促进结直肠癌的血管生成。针对Raptor与Rictor的不同功能,探索新的靶点阻断剂和治疗方案,可成为研发肿瘤血管生成阻断剂的新思路。
综上所述,Raptor、Rictor在结直肠癌中呈高表达,并且与HIF-1α、HIF-2α、VEGF密切相关,是调控结直肠癌血管生成的重要基因,同时与结直肠癌的分化、淋巴结转移等临床病理特征相关。因此,联合检测Raptor、Rictor在结直肠癌中的表达有助于评估病变进展及合理选择个性化治疗方案,对于提高抗肿瘤血管药物的临床疗效具有重要价值。
[1] Iwai T, Sugimoto M, Harada S,etal. Continuous administration of bevacizumab plus capecitabine, even after acquired resistance to bevacizumab, restored anti-angiogenic and antitumor effect in a human colorectal cancer xenograft model[J]. Oncol Rep, 2016,36(2):626-632.
[2] Karar J, Cerniglia G, Lindsten T,etal. Dual PI3K/mTOR inhibitor NVP-BEZ235 suppresses hypoxia-inducible factor (HIF)-1α expression by blocking protein translation and increases cell death under hypoxia[J]. Landes Bioscience, 2012,13(11):1102-1111.
[3] 吴淑华, 胡金龙, 何 双, 等. 大肠癌中Beclin1、LC3和mTOR的表达及意义[J]. 临床与实验病理学杂志, 2014,30(12):1333-1338.
[4] 胡仲翔, 李德群, 岳喜成, 等. 乳腺癌中高危型人乳头瘤病毒感染及其与微血管密度的相关性[J]. 临床与实验病理学杂志, 2014,30(3):261-264.
[5] Miyazawa M, Yasuda M, Fujita M,etal. Granulosa cell tumor with activated mTOR-HIF-1a-VEGF pathway[J]. J Obstet Gynaecol Res, 2010,36(2):448-453.
[6] Wu X, Schneider N, Platen A,etal. In situ characterization of the mTORC1 during adipogenesis of human adult stem cells on chip[J]. Proc Natl Acad Sci USA, 2016,113(29):E4143-E4150.
[7] Kajiwara M, Masuda S. Role of mTOR inhibitors in kidney disease[J]. Int J Mol Sci, 2016,17(6):1-12.
[8] Tsuji-Tamura K, Ogawa M. Inhibition of the PI3K/Akt and mTORC1 signaling pathways promotes the elongation of vascular endothelial cells[J]. J Cell Sci, 2016,129(6):1165-1178.
[9] Maru S, Ishigaki Y, Shinohara N,etal. Inhibition of mTORC2 but not mTORC1 up-regulates E-cadherin expression and inhibits cell motility by blocking HIF-2α expression in human renal cell carcinoma[J]. J Urol, 2013,189(5):1921-1929.
[10] Liu D M, Zhao L, Liu T T,etal. Rictor/mTORC2 loss in osteoblasts impairs bone mass and strength[J]. Bone, 2016,90:50-58.
[11] Wang S, Amato K R, Song W,etal. Regulation of endothelial cell proliferation and vascular assembly through distinct mTORC2 signaling pathways[J]. Mol Cell Biol, 2015,35(7):1299-1313.
[12] Loboda A, Jozkowicz A, Dulak J. HIF-1 versus HIF-2--is one more important than the other?[J]. Vascul Pharmacol, 2012,56(5-6):245-251.
[13] Sun S, Chen S, Liu F,etal. Constitutive activation of mTORC1 in endothelial cells leads to the development and progression of lymphangiosarcoma through VEGF autocrine signaling[J]. Cancer Cell, 2015,28(6):758-772.
[14] Cejka D, Preusser M, Woehrer A,etal. Everolimus (RAD001) and anti-angiogenic cyclophosphamide show long-term control of gastric cancer growthinvivo[J]. Cancer Biol Ther, 2008,7(9):1377-1385.
[15] Ilhan N, Gungor H, Gul H F,etal. PI3K-mTORC2 but not PI3K-mTORC1 regulates transcription of HIF2A/EPAS1 and vascularization in neuroblastoma[J]. Cancer Res, 2015,75(21):4617-4628.
[16] 阎锡蕴. 肿瘤新生血管及分子靶向治疗新策略[J]. 生物物理学报, 2010,30:180-193.
[17] Shuhua W, Chenbo S, Yangyang L,etal. Autophagy-related genes Raptor, Rictor, and Beclin1 expression and relationship with multidrug resistance in colorectal carcinoma[J]. Hum Pathol, 2015,46(11):1752-1759.
Relationships of Raptor and Rictor expression with angiogenesis in colorectal cancer and their clinical significance
LI Xin-yan, WU Shu-hua, SUN Chen-bo, LI Yang-yang, GAO Xiang-qian, HE Shuang
(DepartmentofPathology,BinzhouMedicalUniversityHospital,Binzhou256603,China)
Purpose To detect the expression of Raptor, Rictor, angiogenesis-related factors HIF-1α, HIF-2α and VEGF and to investigate their relationship and significance in colorectal cancer (CRC). Methods Immunohistochemistry, Western blot and RT-PCR were employed to detect the expression of Raptor, Rictor, HIF-1α, HIF-2α and VEGF in 120 cases of CRC and 60 cases of normal colorectal mucosa. CD34 labeled microvascular density (MVD) was also observed. The correlations between Raptor, Rictor, HIF-1α, HIF-2α, VEGF expression and the patients’ clinicopathological features were analyzed. Results The positive rates of Raptor, Rictor, HIF-1α, HIF-2α and VEGF in CRC were significantly higher than those in normal colorectal mucosa (P<0.05). Raptor and Rictor expression was correlated with the degree of tumor differentiation and lymph node metastasis, respectively. The expression of HIF-1α, HIF-2α and VEGF was higher in patients with lymph node metastasis than those in patients without lymph node metastasis (P<0.05). The MVD was higher in patients with Raptor or Rictor positive than that in patients with Raptor or Rictor negative (P<0.05). The expression of Raptor was positively correlated with HIF-1α and VEGF (P<0.01), the expression of Rictor was positively correlated with HIF-2α and VEGF (P<0.01), but the expression of Raptor was negatively correlated with Rictor (P<0.01). Conclusion The expression of mTOR core molecules Raptor and Rictor is related to the initiation and development of colorectal cancer and angiogenesis, and they promote angiogenesis in colorectal cancer by different ways.
colorectal neoplasms; Raptor; Rictor; HIF-1α; HIF-2α; VEGF
时间:2017-2-27 10:14
http://kns.cnki.net/kcms/detail/34.1073.R.20170227.1014.008.html
山东省科技发展计划(2010GSF10259)
滨州医学院附属医院病理科,滨州 256603
李欣焱,女,硕士研究生。Tel: (0543)3258654,E-mail: lixinyan0528@126.com 吴淑华,女,教授,硕士生导师,通讯作者。E-mail:wsh6108@126.com
R 735.3
A
1001-7399(2017)02-0129-06
10.13315/j.cnki.cjcep.2017.02.003
接受日期:2016-12-16
