固相萃取/液相色谱-串联质谱法测定食品中二甲基黄
2017-04-10徐敦明伊雄海盛永刚时逸吟赵善贞邓晓军
李 优, 徐敦明, 伊雄海*, 盛永刚, 时逸吟, 赵善贞, 邓晓军
(1. 上海出入境检验检疫局, 上海 200135; 2. 厦门出入境检验检疫局, 福建 厦门 361026)
研究论文
固相萃取/液相色谱-串联质谱法测定食品中二甲基黄
李 优1, 徐敦明2, 伊雄海1*, 盛永刚1, 时逸吟1, 赵善贞1, 邓晓军1
(1. 上海出入境检验检疫局, 上海 200135; 2. 厦门出入境检验检疫局, 福建 厦门 361026)
建立了液相色谱-串联质谱(LC-MS/MS)测定食品中二甲基黄(DMY)的分析方法。样品经乙酸乙酯提取,二甲基黄专用固相萃取小柱(ProElut DMY SPE)净化,XDB-C18色谱柱(50 mm×4.6 mm, 1.8 μm)分离,并以5 mmol/L乙酸铵水溶液(含0.1%(v/v)甲酸)-乙腈(含0.1%(v/v)甲酸)为流动相,梯度洗脱,电喷雾正离子模式(ESI+)电离,多反应监测模式(MRM)检测,内标法定量。结果表明,DMY在0~50 μg/L范围内线性关系良好,相关系数(r2)均大于0.999。方法的检出限(LOD,S/N>3)和定量限(LOQ,S/N>10)分别为2 μg/kg和10 μg/kg。不同食品基质中,DMY在10、20和100 μg/kg的添加水平下的平均加标回收率为93.3%~98.9%,相对标准偏差为1.6%~3.9%(n=6)。该方法有效补偿了液相色谱-串联质谱检测过程中的离子化抑制效应,灵敏度和准确度高,适用于腐乳、辣椒酱、禽蛋、豆干、糖果和火腿中DMY的测定。
液相色谱-串联质谱;固相萃取;内标法;基质效应;二甲基黄;食品
二甲基黄(dimethyl yellow, DMY)又称苏丹黄、奶油黄,是脂溶性偶氮染料,通常作为工业染剂添加于汽油、蜡油、塑料等物质中,是诸多国家公认的禁用食品添加剂[1-5]。该物质被人体摄入后,在代谢过程中可与蛋白质、DNA等结合,会对皮肤、肝脏和膀胱产生毒性,大量动物实验表明,长期低剂量摄入DMY可诱发肝癌、膀胱癌和肺癌[6]。国际癌症研究机构(IARC)早在1987年就已将DMY列为人体可能的致癌物[7]。2014~2015年,我国香港、台湾地区多次曝出不法商贩为改善食品色泽在腐乳、豆干中大量非法添加DMY的事件,对人们的食品安全造成了严重威胁。因此,建立多种食品基质中DMY的检测方法,对保障食品安全、进出口食品质量具有重要意义。 目前国内外报道的检测食品中DMY的方法主要有LC法[8-11]、LC-MS/MS法[12-17]、GC-MS法[18]和GC-MS/MS法[19]。其中,LC-MS/MS法因其技术成熟、灵敏度和准确性高,已被广泛应用于食品中禁用色素的检测。目前报道的LC-MS/MS法测定DMY时多采用外标法定量,在质谱分析过程中也普遍存在基质干扰、定量准确度低、仅适用于1~2种食品基质的问题。范素芳等[13]采用基质匹配标准溶液消除基质效应,但适用的基质类型单一、操作繁琐、试剂消耗量大,不能满足日常大规模、多类型样品的检测需求。同位素内标法操作简单,不仅能一次性消除多种食品基质中的基质效应,还能校正样品前处理过程中目标化合物损失带来的误差,提高定量准确性,现已被广泛用于质谱分析,但未见采用该定量方法测定食品中DMY的报道。
本文采用DMY专用SPE柱,建立了LC-MS/MS测定腐乳、辣椒酱、禽蛋、豆干、糖果和火腿中DMY含量的分析方法。同时对测定过程中产生的基质效应进行考察,通过添加同位素内标有效补偿了检测过程中所有食品基质的离子化抑制效应,提高了定量准确度,同时扩大了方法的适用范围。
1 实验部分
1.1 仪器、试剂与材料
液相色谱-串联质谱联用仪(美国Agilent公司); Centrifuge 5810R离心机(德国Eppendorf公司); KMC-1300V触式振荡器(韩国Vision公司);固相萃取装置(美国Superlco公司); ProElut DMY SPE柱(300 mg/3 mL,北京迪马科技有限公司); Milli-Q超纯水系统(美国Millipore公司)。
DMY标准品(纯度>98%)购自德国Dr. Ehrensorfer公司;D5-DMY标准品(纯度>99%)购自加拿大CDN公司;甲醇、乙腈和乙酸乙酯(色谱纯)均购自德国CNW公司;甲酸购自美国Sigma-Aldrich公司;氯化钠、氨水、无水乙酸铵、盐酸(分析纯)均购自国药集团化学试剂有限公司。实验用水由Milli-Q超纯水系统制得。
分别准确称取适量DMY和D5-DMY标准品,用乙腈溶解并定容,配制质量浓度为100 mg/L的标准储备液,于-18 ℃避光保存;移取各标准储备液,根据需要用乙腈逐级稀释,并配制适当浓度的标准工作液,现用现配。
1.2 样品前处理
试样:豆干、熟禽蛋和火腿用粉碎机捣碎;糖果置于研钵中研细;腐乳和辣椒酱直接使用。称取1 g试样(精确至0.01 g)于50 mL离心管中,加入2 mL水、50 μL 1 mg/L的D5-DMY标准工作溶液,于25 ℃水浴超声10 min后,加入1 g氯化钠和10 mL乙酸乙酯,涡旋混合5 min,以4 000 r/min离心5 min,吸取2.5 mL上清液至15 mL离心管中,待净化。
用3 mL乙酸乙酯活化ProElut DMY SPE柱;将待净化液转移至DMY SPE柱中,用3 mL乙酸乙酯以1 mL/min的流速淋洗,弃去淋洗液,于负压下抽干SPE小柱,用5 mL氨水-甲醇(1∶9, v/v)以1 mL/min的流速洗脱,收集洗脱液于15 mL离心管中,于40 ℃下氮吹至干,加入2 mL乙腈超声2 min,振荡2 min,过0.22 μm滤膜,供LC-MS/MS测定。
1.3 LC-MS/MS条件
色谱柱:Agilent XDB-C18 (50 mm×4.6 mm, 1.8 μm);流动相A:含0.1%(v/v)甲酸的5 mmol/L乙酸铵水溶液,流动相B:含0.1%(v/v)甲酸的乙腈溶液;流速:0.4 mL/min;进样量:10 μL。梯度洗脱程序:0~4.0 min, 20%B; 4.0~14.0 min, 80%B; 14.0~16.5 min, 20%B。
离子源:电喷雾离子(ESI)源;扫描方式:正离子扫描;监测模式:多反应监测(MRM)。DMY和D5-DMY的保留时间、定性离子、定量离子及碎裂电压、碰撞能量(CE)等质谱参数见表1。

表 1 DMY和D5-DMY的保留时间、母离子、子离子及其他质谱参数
CE: collision energy; DMY: dimethyl yellow; D5-DMY: D5-dimethyl yellow; * Quantitative ion.

图 2 DMY和D5-DMY标准溶液(10 μg/L)在MRM模式下的色谱图Fig. 2 Chromatograms of DMY and D5-DMY standard solutions (10 μg/L) under MRM modea. quantitative ion of DMY; b. qualitative ion of DMY; c. quantitative ion of D5-DMY.
2 结果与讨论
2.1 质谱条件的优化
分别取1 mL 1 mg/L的DMY和D5-DMY标准工作液,在正离子模式下进行母离子全扫描,得到DMY母离子[M+H]+(m/z225.5)(见图1a)和D5-DMY母离子[M+H]+(m/z230.5)(见图1b)。对上述母离子施加不同的碰撞能量,对产生的子离子进行全扫描,得到相对丰度较高的DMY子离子[C6H5]+(m/z76.9)、[C8H10N]+(m/z120.0)、[C7H7N3]+(m/z132.8)(见图1c)和D5-DMY子离子[C6D5]+(m/z82.0)、[C8H10N]+(m/z120.0)、[C7H7N3]+(m/z132.8)(见图1d)。实验中分别选择基质干扰少、选择性高的两对子离子作为定量、定性离子,再以MRM模式优化各质谱参数,优化后的质谱参数见表1。在优化的质谱条件下,对质量浓度为10 μg/L的DMY及D5-DMY标准工作液进行分析,其MRM色谱图见图2。
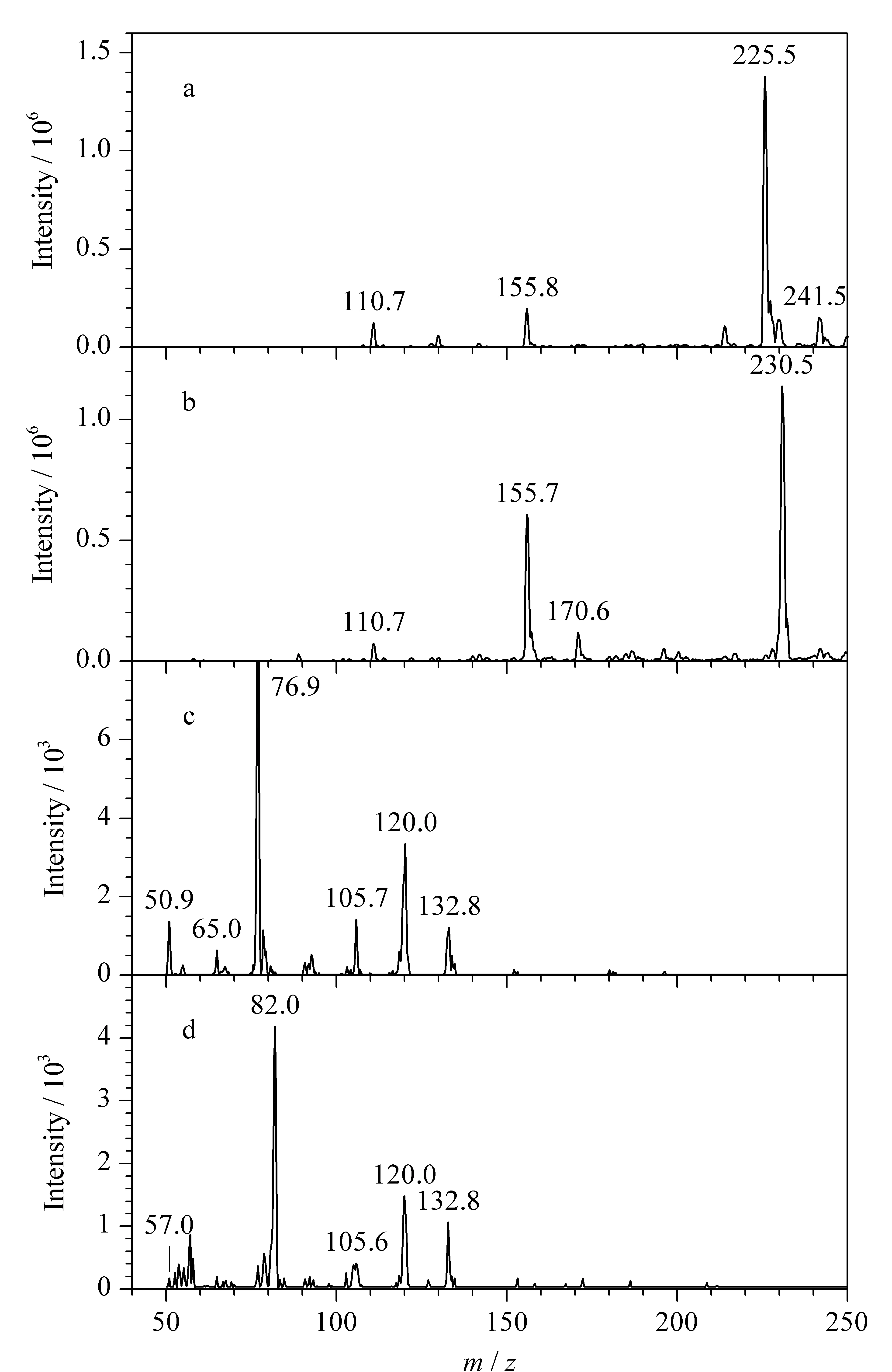
图 1 DMY和D5-DMY的母离子和子离子全扫描质谱图Fig. 1 Full scan MS spectra of precursor ions and precursor ions of DMY and D5-DMY a. precursor ion of DMY; b. precursor ion of D5-DMY; c. product ion of DMY; d. product ion of D5-DMY.
2.2 前处理条件的优化
2.2.1 提取溶剂的选择
DMY为脂溶性色素,根据其结构特性和化学性质,分别用乙腈、丙酮、乙腈-乙酸乙酯(1∶1, v/v)、乙酸乙酯和正己烷对腐乳、辣椒酱、豆干、禽蛋、糖果和火腿进行提取,随后将提取液吹干,用乙腈溶解后直接进行仪器分析,考察不同的提取溶剂对提取效率的影响(见图3)。结果表明,采用乙腈和丙酮时,目标分析物的回收率较低,回收率仅为30%~50%;采用正己烷提取时,回收率最高,但提取液混浊、油脂杂质多,对净化过程造成困难;采用乙酸乙酯提取时,回收率较好,且杂质含量相对较少。因此最终选择乙酸乙酯作为提取溶剂。

图 3 不同提取溶剂对DMY回收率的影响Fig. 3 Effect of the different extraction solvents on the recoveries of DMY
2.2.2 净化方法的选择

图 4 不同净化方法对DMY回收率的影响Fig. 4 Effect of the different clean up methods on the recoveries of DMY WCX: weak cation exchange; SCX: strong cation exchange; Alumina-N: neutral alumina; GPC: gel permeation chromatography.
目前报道的净化DMY的方法主要有固相萃取法[11,20-22]、QuEChERS法[13,14]和凝胶渗透色谱法(GPC)[9,12,17,18]。其中,用于净化DMY的固相萃取小柱有弱阳离子交换柱(WCX)、中性氧化铝柱(alumina-N)、强阳离子交换柱(SCX)和DMY专用柱(ProElut DMY SPE)。分别采用上述净化方法对加标10 μg/kg DMY的腐乳、辣椒酱、豆干、禽蛋、糖果和火腿的乙酸乙酯提取液进行净化,考察不同净化方法对DMY回收率的影响(见图4)。结果表明,采用WCX柱时,DMY的保留较弱,回收率小于10%;采用中性氧化铝柱和QuEChERS法时,对含油量高的样品(辣椒酱)的净化效果较差,净化液颜色较深,回收率较低;采用SCX柱时,净化效果一般、样品回收率较低;采用GPC法时,DMY的净化效果最好,回收率最高,但是试剂消耗量大、净化时间长,对人体危害大;采用DMY专用柱时,DMY的回收率和采用GPC法时接近,但试剂消耗少、净化时间短、前处理效率高。综合考虑净化效果、分析效率和分析成本,本方法选择ProElut DMY SPE柱对DMY进行净化。
2.2.3 固相萃取条件的优化
研究比较了不同pH值的上样液和淋洗液对DMY吸附效率的影响(见图5)。结果表明,上样液和淋洗液的pH值在2.0~7.0时,DMY的回收率无明显波动,且回收率均>80%。因此,本研究不调节上样液和淋洗液的pH值,直接采用乙酸乙酯提取液上样,并用乙酸乙酯淋洗。

图 5 上样液和淋洗液的pH值对DMY回收率的影响Fig. 5 Effect of pH values of sample solution and rinse solution on the recoveries of DMY
吸取1 mg/L 的DMY标准工作液溶于乙酸乙酯中,配制成3 mL上样液,先用3 mL乙酸乙酯淋洗,再用10 mL氨水-甲醇(1∶9, v/v)洗脱,每1 mL收集一次洗脱液,测定DMY的回收率,其洗脱曲线见图6。可以看出,当洗脱液用量超过4 mL时,DMY的回收率为0,说明洗脱液中已没有DMY。为保证洗脱完全,本实验选用5 mL洗脱液进行洗脱。

图 6 采用氨水-甲醇(1∶ 9, v/v)洗脱时DMY的洗脱曲线Fig. 6 Elution curve of DMY with the eluent of ammonia solution-methanol (1∶ 9, v/v)
2.3 方法验证
2.3.1 基质效应
基质效应(ME)在LC-MS/MS分析中普遍存在,且随仪器、试剂和样品基质的不同而表现不同,对ESI源具有明显的离子化抑制作用,影响检测灵敏度、准确度与精密度。目前,主要通过优化前处理条件、添加同位素内标、优化色谱分离条件、修正质谱分析参数等方法来消除基质效应[23-25]。
本实验对DMY在腐乳、辣椒酱、豆干、禽蛋、糖果和火腿中的基质效应进行了考察。用上述试样按1.2节制备空白样品溶液,并向空白样品溶液添加DMY,配制质量浓度为10、20和100 μg/L的基质匹配标准溶液,同时配制相同质量浓度的试剂标准溶液,并按下列公式计算ME[23]:
其中,A、B、C分别为试剂标准溶液、基质匹配标准溶液和空白基质样品中DMY的含量(μg/L)。当ME大于100%时,表明存在离子化增强效应;当ME小于100%时,表明存在离子化抑制效应。具体计算结果见表2。
另外,分别以外标法和内标法对添加含量为10、20和100 μg/kg DMY的腐乳、辣椒酱、豆干、禽蛋、糖果和火腿进行定量分析,并对结果进行比较,结果见表2。
以配备ESI源的LC-MS/MS法测定腐乳、辣椒酱、豆干、禽蛋、糖果和火腿中的DMY,离子化抑制效应明显存在,并且在不同食品基质中的基质效应差异较大。若以试剂标准溶液进行外标法定量,回收率仅为51.8%~67.3%,无法满足检测要求;采用D5-DMY作为同位素内标对定量结果进行校正,能有效补偿离子化抑制效应,改善回收率(93.3%~98.9%),提高定量准确性。该法与基质匹配标准曲线法相比,操作简便,因此选为本文的定量方法。
2.3.2 检出限和线性关系
在空白腐乳、辣椒酱、豆干、禽蛋、糖果和火腿基质中添加目标化合物,以S/N>3和S/N>10确定DMY的检出限(LOD)和定量限(LOQ),分别为2 μg/kg和10 μg/kg。

表 2 内标法和外标法定量时DMY的基质效应(ME)和回收率(n=6)
对DMY质量浓度分别为0、1.25、2.5、6.25、12.5、25和50 μg/L、D5-DMY质量浓度为6.25 μg/L的系列混合标准工作液进行测定,以DMY定量离子和D5-DMY定量离子峰面积的比值为纵坐标(Y)、对应质量浓度的比值(X)为横坐标,绘制标准曲线,回归方程为Y=1.09X+0.02,DMY在0~50 μg/L范围内线性关系良好,相关系数(r2)>0.999。
2.3.3 准确度和精密度
在腐乳、辣椒酱、豆干、禽蛋、糖果和火腿基质中添加10、20和100 μg/kg的DMY标准品,按1.2节进行前处理,进行加标回收率试验(n=6)。结果表明,方法的平均加标回收率为93.3%~98.9%, RSD为1.6%~3.9%(见表3)。空白腐乳样品和添加10 μg/kg DMY腐乳样品的选择性离子色谱图分别见图7和图8。结果显示,腐乳样品中(见图8)DMY的色谱峰峰形良好、基质干扰少。说明该方法准确、稳定、精密度高,符合DMY的检测要求。
2.4 实际样品检测
采用本文建立的方法对当地超市购得的20份腐乳、辣椒酱、豆干、禽蛋、糖果和火腿样品进行测定,结果均未测出DMY。

表 3 食品中DMY的平均加标回收率和相对标准偏差(n=6)

图 7 空白腐乳样品中DMY和D5-DMY(50 μg/kg)的选择性离子色谱图Fig. 7 Selected ion chromatograms of DMY and D5-DMY (50 μg/kg) in a blank sufu samplea. quantitative ion of DMY; b. qualitative ion of DMY; c quantitative ion of D5-DMY.

图 8 加标腐乳样品中DMY(10 μg/kg)和D5-DMY(50 μg/kg)的选择性离子色谱图Fig. 8 Selected ion chromatograms of DMY (10 μg/kg) and D5-DMY (50 μg/kg) spiked in a sufu samplea. quantitative ion of DMY; b. qualitative ion of DMY; c. quantitative ion of D5-DMY.
3 结论
本研究建立了液相色谱-串联质谱测定腐乳、辣椒酱、禽蛋、豆干、糖果和火腿中二甲基黄含量的分析方法。采用二甲基黄专用固相萃取小柱进行净化,对多种食品基质的净化效果良好。通过同位素内标法定量可同时补偿所有食品基质中的基质效应,有效提高定量的准确性,扩大方法的适用范围。方法的检出限、回收率、精密度等均满足我国对食品中二甲基黄含量的检测要求,可作为分析确证的储备方法。
[1] Food and Drug Administration. Compliance Program Guidance, Chapter 09-Food and Color Additives. (2016-02-22) [2017-02-27]. http://www.fda.gov/downloads/Food/ComplianceEnforcement/ucm073305.pdf
[2] European Commission. Questions and Answers on Food Additives. (2011-11-14) [2017-02-27]. http://europa.eu/rapid/press-release_MEMO-11-783_en.htm
[3] Ministry of Health, Labour and Welfare. Food Additives. [2017-02-27]. http://www.mhlw.go.jp/english/topics/foodsafety/foodadditives/index.html
[4] Center of Food Safety of Hong Kong Government. Colouring Matter in Food Regulations. (2007-08-10) [2017-02-27]. http://www.cfs.gov.hk/english/food_leg/food_leg_colour.html
香港特别行政区政府食物安全中心. 食物内染色料规例. (2007-08-10) [2017-02-27]. http://www.cfs.gov.hk/sc_chi/food_leg/food_leg_colour.html
[5] National People’s Congress Standing Committee. Food Safety Law of the People’s Republic of China. Beijing: China Legal Publishing House, 2015: 13
全国人民代表大会常务委员会. 中华人民共和国食品安全法. 北京: 中国法制出版社, 2015: 13
[6] Thakore K N. Reference Module in Biomedical Sciences Encyclopedia of Toxicology. 3rd ed. Amsterdam: Elsevier, 2014: 573
[7] Patnaik P. Appendix B: International Agency for Research on Cancer (IARC) List of Carcinogenic Agents (Update 2006), A Comprehensive Guide to the Hazardous Properties of Chemical Substances. (2006-11-02) [2017-02-27]. http://xueshu.baidu.com/s?wd=paperuri%3A%28b31c60535ba09 0d10d8adc3a0da5339a%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_vurl=http%3A%2F%2Fonline library.wiley.com%2Fdoi%2F10.1002%2F9780470134955.app 2%2Fsummary&ie=utf-8&sc_us=8876927550978352257
[8] Ding A B, Shi Z H, Lu L X, et al. Cereals and Oils Processing (Electronic Version), 2015(11): 53
丁安帮, 施祖灝, 陆利霞, 等. 粮油加工(电子版), 2015(11): 53
[9] Ma Y S, Li W, Ai L F, et al. Journal of Instrumental Analysis, 2014, 33(1): 93
马育松, 李玮, 艾连峰, 等. 分析测试学报, 2014, 33(1): 93
[10] Li W, Ai L F, Wei X X, et al. Journal of Analytical Science, 2015, 31(6): 820
李玮, 艾连峰, 魏欣欣, 等. 分析科学学报, 2015, 31(6): 820
[11] Zhu Y H, Zhao B, Xiao R Q, et al. Food Chem, 2014, 145: 956
[12] Li J, Ding X M, Zheng J X, et al. J Sep Sci, 2014, 37(17): 2439
[13] Fan S F, Li Q, Ma J M, et al. Chinese Journal of Chromatography, 2015, 33(6): 657
范素芳, 李强, 马俊美, 等. 色谱, 2015, 33(6): 657
[14] Lin Z H, Zhou Q Q, Zeng X, et al. Food Science, 2016, 37(8): 217
林子豪, 周庆琼, 曾羲, 等. 食品科学, 2016, 37(8): 217
[15] Tsai C F, Kuo C H, Shih Y C, et al. J Food Drug Anal, 2015, 23(3): 453
[16] Zhao S, Yin J, Zhang J, et al. Food Anal Methods, 2012, 5(5): 1018
[17] Walker M J, Colwell P, Biesenbruch S, et al. Food Anal Methods, 2013, 6(2): 395
[18] Li G S, Chen G Q, Yang G, et al. Chinese Journal of Analysis Laboratory, 2015, 34(12): 1399
李桂生, 陈桂琴, 杨戈, 等. 分析实验室, 2015, 34(12): 1399
[19] Xia D, Ding A B, Shi Z H, et al. Cereals and Oils Processing (Electronic Version), 2015(8): 56
夏栋, 丁安帮, 施祖灝, 等. 粮油加工(电子版), 2015(8): 56
[20] Wang K, Zhao H J, Zhang Y. Yunnan Chemical Technology, 2015, 42(1): 38 王坤, 赵浩军, 张燕. 云南化工, 2015, 42(1): 38
[21] Xiao X, Cheng X H, Wang Q G. Bulletin of Disease Control and Prevention, 2015, 30(6): 57
肖潇, 程晓华, 王庆国. 疾病预防控制通报, 2015, 30(6): 57
[22] Feng H, Ma B G, Shi G H, et al. Modern Agricultural Science and Technology, 2015(14): 291
冯辉, 马柏根, 施国红, 等. 现代农业科技, 2015(14): 291
[23] Fan S F, Wang X P, Li P W, et al. J Sep Sci, 2011, 34(6): 640
[24] Eeckhaut A V, Lanckmans K, Sarre S, et al. J Chromatogr B, 2009, 877(23): 2198
[25] Xiang P, Shen M, Zhuo X Y. Journal of Instrumental Analysis, 2009, 28(6): 753
向平, 沈敏, 卓先义. 分析测试学报, 2009, 28(6): 753
Determination of dimethyl yellow in foods by liquid chromatography-tandem mass spectrometry coupled with solid phase extraction
LI You1, XU Dunming2, YI Xionghai1*, SHENG Yonggang1, SHI Yiyin1,ZHAO Shanzhen1, DENG Xiaojun1
(1.ShanghaiEntry-ExitInspectionandQuarantineBureau,Shanghai200135,China;2.XiamenEntry-ExitInspectionandQuarantineBureau,Xiamen361026,China)
A liquid chromatography-tandem mass spectrometry (LC-MS/MS) was established for the determination of dimethyl yellow (DMY) in foods. The samples spiked with D5-dimethyl yellow (D5-DMY) as the internal standard were extracted with ethyl acetate, cleaned up by a ProElut DMY SPE column. The separation was performed on an XDB-C18 column (50 mm×4.6 mm, 1.8 μm) with the mobile phases of 5 mmol/L ammonium acetate aqueous solution containing 0.1% (v/v) formic acid and acetonitrile containing 0.1% (v/v) formic acid. The identification and quantitation of DMY was performed by MS/MS in positive electrospray ionization (ESI+) and multiple reaction monitoring (MRM) mode. The quantitative analysis was carried out by internal standard method. A good linear relationship, with the correlation coefficient (r2) greater than 0.999, was found in the mass concentration range of 0-50 μg/L. The limit of detection (LOD,S/N>3) and the limit of quantitation (LOQ,S/N>10) were 2 μg/kg and 10 μg/kg, respectively. The recoveries of DMY in foods spiked with 10, 20 and 100 μg/kg varied from 93.3% to 98.9%, and the relative standard deviations (RSDs) were between 1.6% and 3.9% (n=6). The method can effectively correct the ionization suppression, and it is sensitive, accurate and suitable for the monitoring of DMY in sufu, chili sauce, egg, dried bean curd, candy and ham.
liquid chromatography-tandem mass spectrometry (LC-MS/MS); solid phase extraction (SPE); internal standard method; matrix effect (ME); dimethyl yellow (DMY); foods
10.3724/SP.J.1123.2016.10042
2016-10-19
国家重大科学仪器设备开发专项(2013YQ15055705);上海市技术性贸易措施应对专项(14TBT006,15TBT004,15TBT005);上海市科委技术标准专项(15DZ0503201);长三角科技合作项目(15395810100).
Foundation item: National Key Scientific Instrument Development Project (No. 2013YQ15055705); Shanghai Technical Barrier Trade Item (Nos. 14TBT006, 15TBT004, 15TBT005); Technical Standard Item of Shanghai Science and Technology Commission (No. 15DZ0503201); Yangtze River Delta Science and Technology Cooperation Project (No. 15395810100).
O658
A
1000-8713(2017)04-0398-07
* 通讯联系人.Tel:(021)38620517,E-mail:yixh@shciq.gov.cn.
