产气肠杆菌携带基因blaNDM-1的质粒特征及基因环境分析
2017-04-10肖伟强许青霞李铁鹏王智中姚新伟常彦敏孙明月
肖伟强,许青霞,李铁鹏,王智中,潘 军,姚新伟,常彦敏,孙明月
(郑州大学附属肿瘤医院,河南 郑州 450000)
·论著·
产气肠杆菌携带基因blaNDM-1的质粒特征及基因环境分析
肖伟强,许青霞,李铁鹏,王智中,潘 军,姚新伟,常彦敏,孙明月
(郑州大学附属肿瘤医院,河南 郑州 450000)
目的 了解产气肠杆菌携带blaNDM-1质粒的转移性、复制子分型及周围环境。方法 产气肠杆菌HN-NDM0711为实验菌株,利用接合实验研究其质粒的转移性,对接合子进行稳定性试验,采用质粒复制子分型法对质粒进行分型,利用染色体步移技术对基因blaNDM-1上下游进行测序,使用BLASTN和BLASTP对基因组序列进行比对,使用Vector NTI 11.5.1注释并生成序列管道图,序列通过软件Banklt递交至Genbank。结果 产气肠杆菌HN-NDM0711接合实验阳性,阳性接合子稳定传代4 d后,所有克隆株对亚胺培南和美罗培南的最低抑菌浓度(MIC)均未发生变化,基因blaNDM-1均为阳性。质粒复制子为IncA/C型;基因blaNDM-1位于不常见的插入序列ISAba14和IS91之间,在blaNDM-1的上游出现一个Tn3转座子和I型整合子,整合子上含有一个由庞大镶嵌序列构成的少见耐药基因盒。 结论 IncA/C型质粒pHN-NDM0711携带基因blaNDM-1及耐药基因盒,可能源于不同抗菌药物选择压力下的基因重组,建议严格控制临床、工业和农业抗菌药物的使用,从源头上减少此类细菌的产生。
产气肠杆菌; NDM-1; 接合实验; 质粒复制子分型; β-内酰胺酶
[Chin J Infect Control,2017,16(3):195-198]
耐碳青霉烯类革兰阴性杆菌的出现和传播成为全球公共健康的重大威胁,其中获得性金属类β-内酰胺酶,如新德里金属β-内酰胺酶基因(New Delhi metallo-β-lactamase-1,NDM-1)也可造成碳青霉烯类抗生素耐药[1-2]。研究[2-3]表明,基因NDM-1多发现于大肠埃希菌和肺炎克雷伯菌等细菌中,常存在于IncA/C、IncF、IncFII等不同类型的质粒上,该基因周围存在不同的基因环境。在前期的实验中,本课题组发现了3株因交叉感染而引起传播的产气肠杆菌[4],均表现为多重耐药,金属酶表型实验和聚合酶链反应(PCR)方法均证实携带基因NDM-1,脉冲场凝胶电泳实验证实为同一型别,但尚不清楚其携带blaNDM-1质粒的转移性、复制子分型及基因环境等特征,且较少文献报道产气肠杆菌携带blaNDM-1的基因周围环境,故对此进行研究,现将结果报告如下。
1 对象与方法
1.1 菌株及来源 本院有3株具有同源性的产气肠杆菌(均携带NDM-1基因)引起的交叉感染,取其中1株产气肠杆菌0711(HN-NDM0711),该菌株仅对多粘菌素、左氧氟沙星和环丙沙星敏感,对碳青霉烯类、头孢菌素类、喹诺酮类、单环β-内酰胺类等抗菌药物全部耐药,菌株及患者信息见文献[4]。质控菌株为大肠埃希菌ATCC 25922,耐叠氮钠大肠埃希菌J53由河南农业大学杜向党教授提供。
1.2 仪器与试剂 全自动细菌鉴定仪Phenix-100为美国BD公司产品,PCR扩增仪购自美国ABI公司,凝胶成像系统为美国Bio-Rad公司产品。质粒DNA提取试剂盒购自德国QIAGEN公司,叠氮钠和美罗培南均购自Sigma公司,DNA Marker和2×PCR Premix购自大连宝生物公司,引物合成及测序由上海生工技术有限公司完成。
1.3 接合试验 产气肠杆菌HN-NDM0711为供体菌,大肠埃希菌J53为受体菌,取两种细菌对数生长期菌液各1 mL,加入100 mL的营养肉汤中,37℃静置过夜,取200 μL均匀涂布于筛选平板上(含100 μg/mL叠氮钠和2 μg/mL美罗培南),培养12~24 h,并用琼脂稀释法测定接合子的亚胺培南和美罗培南最小抑菌浓度(minimal inhibitory concentration,MIC)。试剂盒提取接合子质粒DNA,命名为pHN-NDM0711,PCR方法检测blaNDM-1基因[4]。
1.4 接合子稳定性试验[5]挑取阳性接合子接种于不含抗菌药物的LB肉汤培养基中,37 ℃ 300 r/min震荡过夜,使用LB肉汤培养基稀释至103CFU/mL,继续震荡过夜,用同样方法连续稀释震荡培养4 d,分别在第2、3和4 天取0.1 mL的培养液,用0.9 mL的生理盐水稀释,倾注于营养琼脂平板,37 ℃培养过夜,挑10个菌落(共30个菌落)测定亚胺培南和美罗培南的MIC,并提取质粒DNA检测blaNDM-1基因。
1.5 质粒复制子分型(PCR-based replicon typing,PBRT分型) 提取的质粒DNA作为模板,利用18对引物,使用5次多重PCR和3次单一PCR扩增FIA、FIB、FIC、HI1、HI2、I1-Iγ、L/M、N、P、W、T、A/C、K、B/O、X、Y、F和FIIA等质粒复制子类型,PCR反应条件和结果判读均参照相关文献[6]。
1.6blaNDM-1基因周围序列测序 提取的质粒DNA送交上海生工项目部,采用DNA步移技术对目的基因blaNDM-1周围序列测序,blaNDM-1基因号:KJ577744[4]。
1.7 DNA序列注释和递交 使用GeneMark软件进行基因预测,并通过软件BLASTN 和软件BLASTP双向比对基因的相似性,使用Vector NTI 11.5.1注释并生成序列管道图,序列通过软件Banklt递交到Genbank获得序列号为KU764665。
2 结果
2.1 接合实验和blaNDM-1基因扩增结果 筛选平板培养12 h有细小菌落,24 h有明显单个菌落,鉴定为大肠埃希菌,测定亚胺培南和美罗培南的MIC分别为4、8 μg/mL,blaNDM-1基因检测阳性。
2.2 接合子稳定性试验结果 阳性接合子稳定传代4 d后,所有克隆株对亚胺培南和美罗培南的MIC均未发生变化,blaNDM-1均为阳性。
2.3 PBRT分型结果 使用A/C的正反向引物扩增,在400 bp附近(目的基因为465 bp)处有清晰条带,证明供体菌和阳性接合子的质粒均为IncA/C型。见图1。
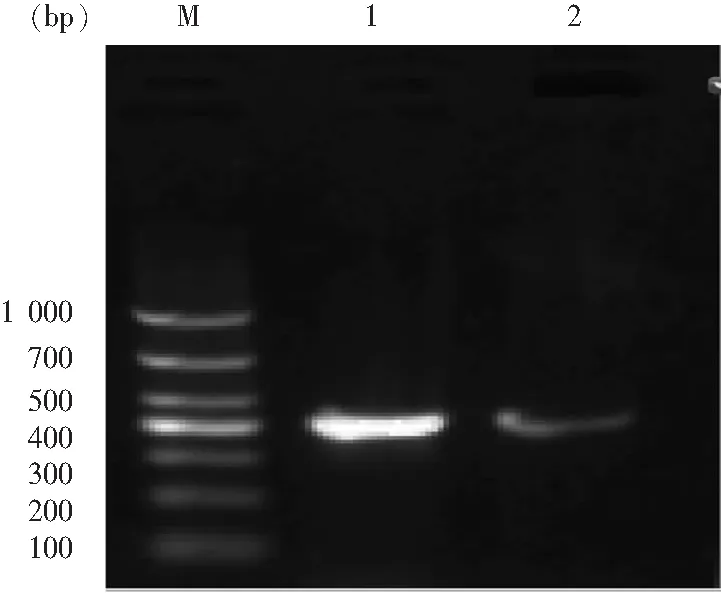
M:DL1000 DNA Marker,1:阳性接合子,2:产气肠杆菌0711
图1 阳性接合子和产气肠杆菌0711质粒的PBRT分型电泳图
Figure 1 PBRT map of positive conjugant andE.aerogenes0711 plasmid
2.4 基因环境分析 测序获得一段18 621 bp的DNA序列,共包含17个核心编码序列(coding sequences,CDS)。blaNDM-1位于IS91和ISAba14之间,下游为ISAba125,上游为bleo、trpF和dsbC;紧接此序列是I型整合子,除携带实现其自身功能的整合酶基因(int I1)外,还携带由一个由dfrA14、arr-2、cmlA7、blaOXA-10、aadA1、qacEdelta1、sul I构成的庞大耐药基因盒。在I型整合子的上游,含有一个Tn3的转座子,同时携带有实现其自身功能的转座酶和解旋酶。比对发现序列上游(1~13 099 bp)与来自于肺炎克雷伯NDM-1基因阴性的pHM881QN(LC055503)和IncA/C-LS6(JX442976)具有高度相似性(>99%),而下游携带blaNDM-1(13 100~18 621 bp)序列与来自鲍曼不动杆菌GB661的质粒(KP009590)具有高度的相似性(>99%),但方向相反。见图2。
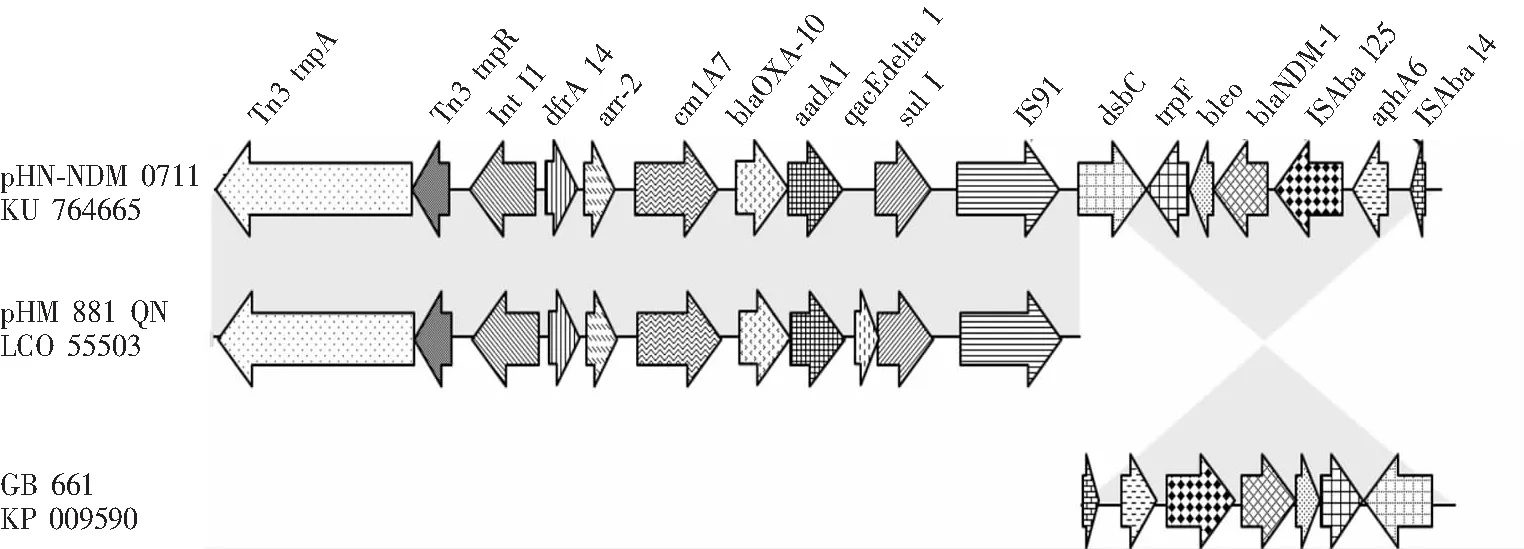
注:箭头代表转录方向,灰色表示一致性序列。基因名称、编码蛋白分别为Tn3 tnpA(Tn3转座酶)、Tn3 tnpR(Tn3 解旋酶)、IntI1(Int I型整合酶)、dfrA14(二氢叶酸还原酶,磺胺类增效剂耐药)、arr-2(利福平ADP-核糖基化转移酶)、cmlA7(氯霉素耐药蛋白)、blaOXA-10(β-内酰胺酶)、aadA1(氨基糖苷乙酰转移酶)、qacEdelta1(季铵盐类外排泵)、sulI(二氢蝶酸合成酶,磺胺类耐药)、IS91(插入序列元件)、dsbC(二硫键异构酶)、trpF[ N -(5’-磷酸核糖基)邻氨基苯甲酸异构酶]、bleo(博来霉素耐药蛋白)、NDM-1(金属β-内酰胺酶)、aphA6(氨基糖苷类3'磷酸转移酶)、Isba14(插入序列元件)
图2blaNDM-1的基因环境示意图
Figure 2 Diagram of genetic environment ofblaNDM-1
3 讨论
本文接合实验及PBRT分型表明,产气肠杆菌携带blaNDM-1基因的质粒为可转移性IncA/C质粒。blaNDM-1位于IS91和ISAba14之间,为一段保守的序列[7-8],IncA/C型质粒是携带blaNDM-1的重要载体[2-3, 8],该质粒能介导多重耐药,其宿主广泛,普遍存在于人和家禽的肠道菌群中,IncA/C型质粒也是携带超广谱β-内酰胺酶和Ampc酶等碳青霉烯酶的重要载体。近几年引起人们的关注,IncA/C型质粒上常存在可转移性的基因元件,如转座子、I型整合子和ISCRs类插入序列,使其携带耐药基因易发生转移[8-9]。
接合子稳定性试验表明,阳性接合子的多重耐药特征可稳定传代,符合IncA/C质粒的特征,与文献[2, 7-8]报道一致。文献[10]报道,来自鲍曼不动杆菌产NDM-1的质粒导入大肠埃希菌J53后,接合子质粒不稳定,容易丢失,因此,转移性IncA/C型质粒引起的潜在传播方式应引起更多的关注。
基因测序获得了一段18 621 bp的序列,比对发现序列上游(1~13 099 bp)与来自于肺炎克雷伯NDM-1基因阴性的pHM881QN(LC055503)和IncA/C-LS6(JX442976)具有高度相似性(>99%),而下游携带blaNDM-1(13 100~18 621 bp)序列与来自鲍曼不动杆菌GB661的质粒(KP009590)具有高度的相似性(>99%),但方向相反;进一步分析发现除blaNDM-1上下游保守序列外,还存在ISAba14及IS91,与通常插入序列(如ISCR1[11]或IS26[12])不同,推测类似pHM881QN的质粒通过ISAba14及IS91作用发生了DNA反向重组[13]。
blaNDM-1基因的上游序列(1~13 099 bp )含有Tn3转座子、I型整合子及其携带的“镶嵌拼接区(mosaic plasmid structure)”,此区域除了含有实现其自身功能的转座酶、解旋酶和整合酶外,还含有一个高达7个耐药基因的庞大基因盒(dfrA14-arr-2-cmlA7-blaOXA-10-aadA1-qacEdelta1-sulI),分别介导对磺胺类、氨基糖苷类、利福平、季铵盐类、窄谱头孢菌素等耐药。通常blaNDM-1的上游类似区域整合子携带的基因盒多为2~5个[8, 11-12],而本组结果高达7个,说明此区域的高度可变性,可能此区域内发生多次DNA重组。携带耐药基因的细菌所耐抗菌药物中,部分药物虽与临床有关,但更多的药物与家禽养殖和环境消毒有关,如季铵盐类并不是临床使用的抗菌药物,仅用于食品工业和环境消毒,因其选择性压力,造成在零售的肉类等食品中检出率很高[14];氯霉素、氨基糖苷类、利福平也是兽药的常见成分,推测本研究发现的由I型整合酶携带的超级耐药基因盒可能与食品工业和环境消毒滥用抗菌药物/消毒剂有关。
总之,产气肠杆菌HN-NDM0711多重耐药的原因是IncA/C型可转移性质粒携带的blaNDM-1及一个庞大的耐药基因盒,此质粒可能来源于临床、农业和环境所使用的不同抗菌药物/消毒剂压力下的基因重组,因此,减少细菌耐药不仅要加强临床合理使用抗菌药物的管理,也应加强对工农业使用抗菌药物的控制,从源头上减少此类“超级细菌”的产生。
[1] King AM, Reid-Yu SA, Wang W, et al. Aspergillomarasmine A overcomes metallo-β-lactamase antibiotic resistance[J]. Nature, 2014, 510(7506): 503-506.
[2] Johnson AP and Woodford N. Global spread of antibiotic resistance: the example of New Delhi metallo-beta-lactamase (NDM)-mediated carbapenem resistance[J]. J Med Microbiol, 2013, 62(Pt 4): 499-513.
[3] Poirel L, Dortet L, Bernabeu S, et al. Genetic features ofblaNDM-1-positive Enterobacteriaceae[J]. Antimicrob Agents Chemother, 2011, 55(11): 5403-5407.
[4] 肖伟强,沈勇,潘军,等. 交叉感染引起的3株产Ⅰ型新德里金属β-内酰胺酶产气肠杆菌同源性检测 [J]. 中华传染病杂志, 2014,32(11):670-672.
[5] Wang M, Tran JH, Jacoby GA, et al. Plasmid-mediated quinolone resistance in clinical isolates ofEscherichiacolifrom Shanghai, China[J]. Antimicrob Agents Chemother, 2003, 47(7): 2242-2248.
[6] Carattoli A, Bertini A, Villa L, et al. Identification of plasmids by PCR-based replicon typing[J]. J Microbiol Methods, 2005, 63(3): 219-228.
[7] Fu Y, Du X, Ji J, et al. Epidemiological characteristics and genetic structure ofblaNDM-1in non-baumanniiAcinetobacterspp. in China[J]. J Antimicrob Chemother, 2012, 67(9): 2114-2122.
[8] Du H, Chen L, Chavda KD, et al. Genomic characterization ofEnterobactercloacaeisolates from China that co-produce KPC-3 and NDM-1 carbapenemases[J]. Antimicrob Agents Chemother, 2016, 60(4): 2519-2523.
[9] Doublet B, Boyd D, Douard G, et al. Complete nucleotide sequence of the multidrug resistance IncA/C plasmid pR55 fromKlebsiellapneumoniaeisolated in 1969[J]. J Antimicrob Chemother, 2012, 67(10): 2354-2360.
[10] Chen Y, Zhou Z, Jiang Y, et al. Emergence of NDM-1-producingAcinetobacterbaumanniiin China[J]. J Antimicrob Chemother, 2011, 66(6): 1255-1259.
[11] Sarkar A, Pazhani GP, Chowdhury G, et al. Attributes of carbapenemase encoding conjugative plasmid pNDM-SAL from an extensively drug-resistantSalmonellaentericaSerovar Senftenberg[J]. Front Microbiol, 2015, 15(6): 969-979.
[12] Mataseje LF, Boyd DA, Lefebvre B, et al. Complete sequences of a novelblaNDM-1-harbouring plasmid fromProvidenciarettgeriand an FII-type plasmid fromKlebsiellapneumoniaeidentified in Canada[J]. J Antimicrob Chemother, 2014, 69(3): 637-642.
[13] Lewin B. GeneⅧ[M]. Oxford University Press, 2004.
[14] Zou L, Meng J, McDermott PF, et al. Presence of disinfectant resistance genes inEscherichiacoliisolated from retail meats in the USA[J]. J Antimicrob Chemother, 2014, 69(10): 2644-2649.
(本文编辑:豆清娅)
Characteristics andblaNDM-1genetic environment of plasmid fromEnterobacteraerogenes
XIAOWei-qiang,XUQing-xia,LITie-peng,WANGZhi-zhong,PANJun,YAOXin-wei,CHANGYan-min,SUNMing-yue
(AffiliatedCancerHospitalofZhengzhouUniversity,Zhengzhou450000,China)
Objective To study plasmid-mediated transfer, plasmid replicon typing, and genetic environment ofblaNDM-1gene inEnterobacteraerogenes(E.aerogenes).MethodsE.aerogenesHN-NDM0711 was used as the subject of this research, the transferable properties of plasmid were analyzed by conjugation testing, conjugant was performed stability testing, plasmid type was determined by PCR-based replicon typing (PBRT), downstream and upstream ofblaNDM-1were sequenced using chromosome walking method, genetic context was analyzed by BLASTN and BALSTP, as well as annotated using Vector NTI 11.5.1 software, sequence pipeline graph was made, the sequence was submitted to Genbank through software Banklt.Results The conjugation testing ofE.aerogenespHN-NDM0711 was positive, after positive conjugant was conducted 4-day passage, minimal inhibitory concentrations (MICs) of imipenem and meropenem to all the cloned strains didn’t change,blaNDM-1were all positive. The replicon type was IncA/C;blaNDM-1gene was localized between ISAba14 and IS91, at upstream of theblaNDM-1, class 1 integron and Tn3 transposon were identified, class 1 integron contained a new mosaic structure of a drug-resistant resistance gene cassette.ConclusionE.aerogenespHN-NDM0711, bearingblaNDM-1gene in IncA/C plasmid, derived from gene recombination under different antimicrobial selection pressure. Antimicrobial use in clinical, industrial and agricultural area should be strictly controlled, so as to reduce the emergence of such bacteria.
Enterobacteraerogenes; NDM-1; conjugation testing; plasmid replicon typing; β- lactamase
2016-05-05
河南省卫生厅科技攻关项目(201503192)
肖伟强(1975-),男(汉族),河南省郑州市人,主管技师,主要从事细菌耐药机制研究。
许青霞 E-mail:xiaowq126@126.com
10.3969/j.issn.1671-9638.2017.03.001
R378.2
A
1671-9638(2017)03-0195-04
