复合诱变PenicilliumpurpurogenumLi-3选育高产红色素及其生物活性研究
2017-04-07牛玉静曹红黄晓林童军茂隋佳慧杨雨鑫
牛玉静,曹红,黄晓林,童军茂*,隋佳慧,杨雨鑫
(1.石河子大学食品学院,新疆石河子832003;2.嘉兴学院生物与化学工程学院,浙江嘉兴314001;3.浙江师范大学物理化学研究所,浙江金华321004)
复合诱变PenicilliumpurpurogenumLi-3选育高产红色素及其生物活性研究
牛玉静1,曹红2,黄晓林3,童军茂1*,隋佳慧2,杨雨鑫2
(1.石河子大学食品学院,新疆石河子832003;2.嘉兴学院生物与化学工程学院,浙江嘉兴314001;3.浙江师范大学物理化学研究所,浙江金华321004)
以产紫青霉菌(Penicillium purpurogenum)Li-3为出发菌株,采用紫外-氯化锂复合诱变方法选育高产红色素菌株;并对红色素进行生物活性研究,选取1,1-二苯基-2-苦肼基(DPPH)体系评价抗氧化活性;采用滤纸片扩散法研究产紫青霉菌突变株红色素对金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)的抑制作用。结果表明,最佳紫外照射时间为120 s,最佳氯化锂质量分数为0.28%,筛选得到一株高产菌株P.purpurogenumLi-3-9,接种于液体发酵培养基中,32℃、150 r/min培养168 h后,测定其红色素色价最高值达到3.28 U/mL,比出发菌株提高了83%。且该菌株连续传代5次,其遗传稳定性较好。P.purpurogenumLi-3-9代谢产生的红色素具有较好的DPPH自由基清除能力和抑制金黄色葡萄球菌的能力。
产紫青霉菌;复合诱变;红色素;生物活性
由于消费者对健康、营养、药理作用的重视,天然色素因无毒害作用已经被越来越多地应用为添加剂、染色剂、抗氧化剂及抗生素[1]。天然色素可以从植物、动物、微生物中提取,而利用微生物生产天然色素可以不受环境制约、易于培养、降低生产成本[2],因此,微生物色素成为了研究开发热点。
自然界中真菌种类的多样性,使其成为研究各种天然色素的重要资源库。大多数真菌产生的色素属于醌类,类黄酮,聚酮类和嗜氮酮类[3],并且真菌色素具有着色性好、稳定性强、生物活性高等作用[4-5]。如今,已有研究学者发现,Monascusspp.、Epicoccumspp.、Paecilomycesspp.、Penicilliumspp.等[6]多种属的丝状真菌能产种类丰富的天然色素,其中,一些不产真菌毒素的种属,如产紫青霉菌(Penicillium purpurogenum)和附球菌(Epicoccum)具有生产安全性好的食品级色素的潜力。青霉属和其相近的种属,如黄曲霉(Talaromyces)能产生类红曲霉色素,并且不产生真菌毒素。MÉNDEZA等[7]以产紫青霉菌(P.purpurogenum)GH2菌株为试验菌株,从其发酵液中分离获得一种水溶性红色素,产色素量达到(2.46g/L)。SANTOS-EBINUMAVC等[8]报道,产紫青霉菌(P.purpurogenum)DPUA 1275有生产一种具有抗菌活性的天然色素的潜力且不生产真菌毒素。
因产紫青霉菌(P.purpurogenum)合成色素产量低不能直接用于工业化生产。目前,提高色素产量的措施主要通过培养条件的优化、诱变选育、构建基因工程菌等方法实现[9]。在产紫青霉合成色素机制尚未清晰之前,对其进行定向改造存在较大难度。针对提高产紫青霉菌色素产量的研究主要集中在培养条件的优化[10-12],而诱变育种也是提高色素产量的重要方法之一[13-15],且操作简单、速度快。因此,本研究采用紫外(ultraviolet,UV)-氯化锂(LiCl)复合诱变选育产紫青霉高产菌(P.purpurogenum),并考察红色素对1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力及对大肠杆菌、金黄色葡萄球菌的抑菌活性,为该天然来源的真菌红色素在食品、保健品、化妆品、医药等领域的应用提供参考。
1 材料与方法
1.1 材料与方法
1.1.1 菌株与试剂
产紫青霉菌(P.purpurogenum)Li-3、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus):本实验室保存;葡萄糖、K2HPO4、MgSO4·7H2O、KCl、FeSO4·7H2O、氯化锂和乙醇等均为国产分析纯。
1.1.2 培养基
种子培养基:葡萄糖2g/L,NH4NO33g/L,K2HPO41g/L,MgSO4·7H2O 0.5 g/L,KCl 0.5 g/L,FeSO4·7H2O 0.01 g/L,蒸馏水1 L。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:将300 g马铃薯切成小块并熬成汁,把马铃薯汁与20 g葡萄糖溶于1 L水中,加入17 g琼脂。
马铃薯葡萄糖液态发酵培养基:土豆200 g/L,葡萄糖20 g/L,K2HPO41 g/L,MgSO4·7H2O 0.5 g/L,KCl 0.5 g/L,FeSO4·7H2O 0.01 g/L,蒸馏水1 L。
上述培养基121℃灭菌20 min,冷却至室温使用。
1.2 仪器与设备
Agilent Carry60型紫外可见分光光度计:美国安捷伦科技有限公司;SKY-211B型恒温摇床:苏州赛恩斯仪器有限公司;VD-850型超净工作台:苏州净化设备有限公司;LGJ-18A冷冻干燥机:上海百典仪器设备有限公司;DSX-280B型手提式压力蒸气灭菌器:上海申安医疗器械公司。
1.3 试验方法
1.3.1 菌悬液的制备
将保藏的菌株接种到种子培养基32℃恒温培养72 h,取对数生长期菌液5 mL,5 000 r/min离心10 min,用无菌生理盐水洗涤菌体两次后,再用生理盐水重悬后适当稀释,即得菌悬液。
1.3.2 紫外诱变
打开自制紫外诱变箱,预热20 min稳定波长。分别取5 mL菌悬液于无菌培养皿(9 cm)中,在磁力搅拌器上低速搅拌,置于20 W紫外灯下15 cm处分别照射0、30 s、60 s、90 s、120 s、150 s、180 s、210 s、240 s、270 s、300 s,以未进行紫外照射为对照组。黑暗条件下,将处理的菌悬液稀释,取10-3、10-4、10-5稀释液100 μL涂布PDA培养基,每个梯度3个平行。32℃条件下避光倒置培养4 d后计数,统计平板中菌落数。计算其致死率,确定最佳紫外照射时间。

1.3.3 氯化锂诱变
吸取经最佳紫外照射时间诱变且等梯度稀释过的菌悬液100 μL涂布于氯化锂质量分数分别为0、0.12%、0.16%、0.20%、0.24%、0.28%、0.32%、0.36%、0.40%的平板上,以未加氯化锂作为对照组。每个处理3次重复。倒置于培养箱中32℃恒温避光培养4 d。待平板长出菌落后计数,计算其致死率,确定最佳氯化锂诱变浓度。
1.3.4 紫外-氯化锂复合诱变
在最佳紫外照射时间对菌悬液诱变,涂布于最佳氯化锂浓度平板上,32℃恒温避光培养4 d。
1.3.5 筛选方法
经过紫外-氯化锂复合诱变后的菌悬液于32℃恒温培养箱中倒置培养4 d,待菌落长出。选取菌落生长较快、直径大且颜色较深的单菌落,挑取菌丝接种于种子培养基中(装液量100 mL/250 mL),32℃、150 r/min条件下培养3 d。将培养好的种子按1%接种量接种于液体发酵培养基中(装液量75 mL/250 mL),32℃、150 r/min培养50 h后,温度调至20℃培养118 h[10]。发酵完成后在波长500 nm处测定其吸光度值。与出发菌株的红色素含量进行比较,选取红色素含量高于出发菌株的诱变菌斜面低温保存。
1.3.6 红色素色价的测定
取5 mL红色素发酵液,加入5 mL体积分数为95%乙醇溶液,加塞置于摇床32℃,150 r/min萃取30 min,7 000 r/min离心10min,上清液经定性滤纸过滤,稀释适当倍数,用分光光度计在波长500nm处测定吸光度值,红色素色价(U/mL)计算公式如下[16]:
红色素色价(U/mL)=OD500nm×稀释倍数
1.3.7 突变株遗传性鉴定
将正突变株连续传代5次,每代进行摇瓶发酵试验,并检测其发酵液中产色素能力,以确定正突变株的遗传稳定性。
1.3.8 红色素生物活性实验
(1)色素粗品的制备
待液态发酵培养结束后,采用减压抽滤的方式,实现菌丝与滤液的分离。将收集的红色发酵液冷冻干燥后于干燥器中保存,备用。
(2)红色素抗氧化活性实验
取0.1 mmol/LDPPH乙醇溶液4.0 mL,加入质量浓度为0.2 mg/mL、0.5 mg/mL、1.0 mg/mL、2.0 mg/mL、4.0 mg/mL的样品溶液1.0mL,室温放置30min,在517nm波长条件下,以无水乙醇为参比,测定吸光度值(Ai);另取0.1 mmol/L DPPH乙醇溶液4.0 mL,加入无水乙醇1.0 mL,室温放置30 min,测其吸光度值(A0);取无水乙醇4.0 mL加入不同浓度样品溶液1.0mL,室温放置30min,测其吸光度值(Aj)。以抗坏血酸(vitamin C,VC)作为对照[17],考察红色素对DPPH自由基的清除率,其计算公式如下:
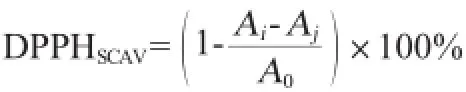
(3)红色素抑菌性实验
选取革兰氏阴性菌大肠杆菌(E.coli)、革兰氏阳性菌金黄色葡萄球菌(S.aureus)两种菌作为供试菌株,供试菌在蛋白胨牛肉膏培养基中37℃恒温培养24 h,菌浓度为108CFU/mL。选取6 mm滤纸片[18]用4 mg/mL的红色素粗品溶液浸泡24 h,滤干后进行平板抑菌实验。以蒸馏水作为对照,记录抑菌圈直径。
2 结果与分析
2.1 紫外诱变最佳条件的确定
P.purpurogenumLi-3菌悬液经紫外分别照射不同时间后,统计培养皿中菌落数,计算其致死率。由图1紫外诱变致死曲线可知,随着紫外照射时间的增加,菌体致死率逐渐增高,成正相关关系。在0~150 s时,菌体致死率急剧上升;在150~275 s时,菌体致死率增长速率减缓。根据文献报道[13,19],一般选取致死率在80%左右作为紫外诱变最佳时间。紫外照射时间为120 s时致死率为79%,因此选取120 s为紫外诱变的最佳照射时间。
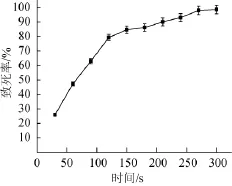
图1 菌株紫外诱变致死曲线Fig.1 Lethal curves of strains by ultraviolet mutagenesis
2.2 氯化锂质量分数的确定
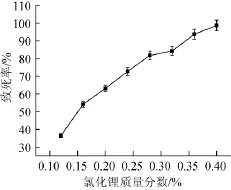
图2 菌株氯化锂诱变致死曲线Fig.2 Lethal curves of strains by LiCl mutagenesis
P.purpurogenumLi-3菌悬液经最佳紫外照射时间处理后,于不同含量氯化锂的PDA培养基中涂布后避光培养4d,统计培养皿中菌落数。得到氯化锂诱变致死率曲线。如图2所示,随着氯化锂质量分数的增加,致死率逐渐增加。当氯化锂质量分数为0.4%时,致死率为98%。当氯化锂质量分数为0.28%时对P.purpurogenumLi-3菌悬液的致死率在80%左右。
2.3 复合诱变筛选P.purpurogenumLi-3高产菌
P.purpurogenumLi-3菌悬液经紫外线照射120 s后涂布于含0.28%氯化锂的PDA培养基上进行复合诱变,培养4 d结束。挑选20株颜色较深、生长较快的单菌落,按上述1.3.5方法进行摇瓶发酵,结果如图3所示。经过复合诱变后,筛选到的P.purpurogenumLi-3突变株在生长速度、色素产量方面都存在一定差异,其中一部分产生负变异。通过紫外照射、氯化锂复合诱变后,20个突变株中发酵液色价明显高于出发菌株的有:P5、P8、P9,其中菌株P9的发酵液色价值最高,达到了3.09 U/mL。经最佳紫外照射时间和最佳氯化锂浓度复合诱变后,色素产量比出发菌株提高了72%。因此,通过对P.purpurogenumLi-3进行诱变选育后,突变株P9效果较好,被命名为P.purpurogenumLi-3-9。
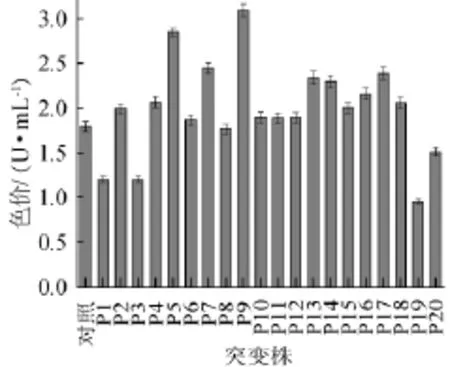
图3 复合诱变突变株产色素比较Fig.3 Comparison of pigments produced by compound mutagenese mutant strains
2.4 稳定性检测
由表1可知,在5次传代中,P.purpurogenumLi-3-9液态发酵产红色素最高色价达到了3.28 U/mL,与文献中其他青霉属液态发酵产红色素水平相比相对较高[12,20]。表明经过复合诱变后得到的产紫青霉菌突变株P.purpurogenum Li-3-9产红色素的遗传稳定性较好,有望作为工业生产菌株来发酵生产紫霉菌红色素。

表1 突变株P.purpurogenumLi-3-9遗传稳定性实验结果Table 1 Results of genetic stability experiments of mutant strain P.purpurogenumLi-3-9
2.5 出发菌株与突变株P.purpurogenumLi-3-9的比较
把产紫青霉出发菌株P.purpurogenumLi-3和经复合诱变突变株P.purpurogenumLi-3-9分别接种到PDA培养基上,培养4 d结束后,其菌落形态如图4所示。由图4可知,突变株菌落直径比出发菌株要大,菌落底部颜色明显高于出发菌株,并且随着培养时间的延长,红色素产量越来越大。
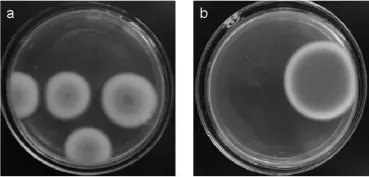
图4 出发菌株(a)与突变株(b)菌落形态比较Fig.4 Comparison of colony morphology of original strain(a)and mutant strain(b)
将P.purpurogenumLi-3和P.purpurogenumLi-3-9发酵液分别稀释相同倍数,使用分光光度计进行紫外-可见光谱吸收峰的扫描,结果见图5。由图5可知,在波长500 nm处诱变株的吸光度值大于出发菌株,表明诱变后红色素产量明显增加。
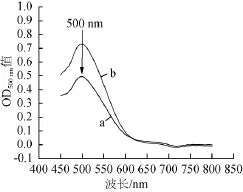
图5 出发菌株(a)与突变株(b)色素产量比较Fig.5 Comparison of pigment yield of original strain(a)and mutant strain(b)
2.6 P.purpurogenumLi-3-9红色素生物活性研究
2.6.1 抗氧化实验
本实验通过清除DPPH自由基法来考察红色素的抗氧化性。由图6可知,红色素溶液中DPPH自由基清除能力随着色素质量浓度的增大而增大,说明P.purpurogenumLi-3-9红色素具有给电子的能力,即DPPH自由基清除的能力。样品中含有的抗氧化物质能终止自由基链之间相互反应,最终形成稳定的化合物,从而防止细胞受到自由基和脂质过氧化反应的损害。结果表明,P.purpurogenumLi-3-9红色素的半抑制浓度(halfmaximalinhibitoryconcentration,IC50)为1.83 mg/mL,并且P.purpurogenumLi-3-9红色素质量浓度为4.0mg/mL时,DPPH自由基清除能力达(92.50±2.58)%。在红色素质量浓度为4.0 mg/mL时,红色素溶液对DPPH自由基的清除能力与VC基本一致。屈炯等[21]测定了从红曲中分离得到的13个色素组分的抗氧化活性,发现其中红色色素组份和橙色色素组份具有较高的抗氧化活性。
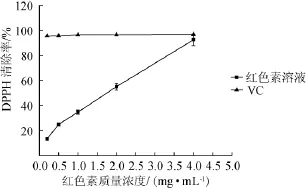
图6 P.purpurogenumLi-3-9产红色素对DPPH自由基清除能力Fig.6 Scavenging ability of red pigment produced by P.purpurogenumLi-3-9 on DPPH free radical
2.6.2 抑菌实验
采用滤纸片扩散法测试了P.purpurogenumLi-3-9红色素质量浓度为4 mg/mL时对大肠杆菌、金黄色葡萄球菌的体外抑菌作用,结果见图7。由图7可知,P.purpurogenum Li-3-9红色素对金黄色葡萄球菌具有一定程度的抑制作用(抑菌圈达到10 mm),对大肠杆菌抑制作用较弱(无明显抑菌圈)。MUKHERJEE G等[22]从紫红曲霉发酵液中分离纯化出一种新的色素,经过结构鉴定发现,它的波谱数据与红曲色素中红斑胺和红曲红胺的波谱数据很吻合,抑菌实验表明,该色素对革兰氏阳性菌有较强的抑菌性。P.purpurogenumLi-3-9红色素抑菌实验结果与其相符。产紫青霉红色素对不同菌种的抑菌现象的不同,与革兰氏阴(阳)性菌细胞壁中脂多糖的结构、电荷密度及细胞质脂质成分的不同有关[23-24],同时,P.purpurogenumLi-3-9红色素对微生物生长的抑制作用还取决于色素与细胞表面之间可能有特异性反应发生,从而破坏细菌的细胞壁达到抑菌目的[25]。
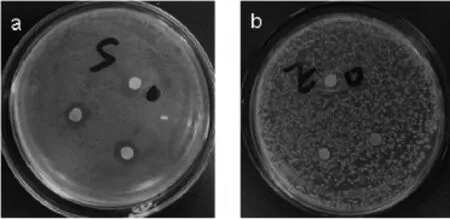
图7 P.purpurogenumLi-3-9红色素对大肠杆菌(a)和金黄色葡萄球菌(b)的抑菌效果Fig.7 Inhibition effect of red pigment produced byP.purpurogenum Li-3-9 onS.aureus(a)andE.coli(b)
3 结论
通过对P.purpurogenumLi-3进行紫外-氯化锂复合诱变,在紫外照射时间为120 s,氯化锂添加质量分数为0.28%条件下处理P.purpurogenumLi-3,经筛选得到一株高产红色素突变株P.purpurogenumLi-3-9,其红色素最高色价达到了3.28 U/mL;经传代培养该菌株具有较好的遗传稳定性。产紫青霉菌红色素生物活性实验结果表明,该红色素具有一定的DPPH自由基清除能力和抑制金黄色葡萄球菌的能力。因此,该色素在新型抗氧化药物和抑菌剂的开发方面表现出潜在的应用前景。
[1]VELMURUGAN P,HUR H,BALACHANDAR V,et al.Monascus,pigment production by solid-state fermentation with corn cob substrate[J].J Biosci Bioeng,2011,112(6):590-594.
[2]DUFOSSÉ L,FOUILLAUD M,CARO Y,et al.Filamentous fungi are large-scale producers of pigments and colorants for the food industry[J]. Curr Opin Biotech,2014,26(26):56-61.
[3]PASTRE R,MARINHO A M R,RODRIGUES-FILHO E,et al.Diversity of polyketides produced byPenicilliumspecies isolated fromMelia azedarachandMurraya paniculata[J].Quím Nova,2007,30(8):1867-1871.
[4]MAPARI S A,MEYER A S,THRANE U.Photostability of natural orange-red and yellow fungal pigments in liquid food model systems[J].J Agr Food Chem,2009,57(14):6253-61.
[5]CHENG M J,WU M D,YUAN G F,et al.Secondary metabolites produced by the fungusMonascus pilosus,and their anti-inflammatory activity[J].Phytochem Lett,2012,5(3):567-571.
[6]MANCHAND P S,WHALLEY W,CHEN F C.Isolation and structure of ankaflavin:A new pigment fromMonascus anka[J].Phytochemistry, 1973,12(10):2531-2532.
[7]MÉNDEZ A,PÉREZ C,MONTA■ÉZ J C,et al.Red pigment production byPenicillium purpurogenumGH2 is influenced by pH and temperature [J].J Zhejiang U Sci B,2011,12(12):961-968.
[8]SANTOS-EBINUMAVC,ROBERTOIC,SIMASTMF,etal.Improving of red colorants production by a newPenicillium purpurogenumstrain in submerged culture and the effect of different parameters in their stability [J].Biotechnol Progr,2013,29(3):778-785.
[9]王君,张宝善.微生物生产天然色素的研究进展[J].微生物学通报,2007,34(3):580-583.
[10]SANTOSEBINUMA V C,TEIXEIRA M F,JR P A.Submerged culture conditions for the production of alternative natural colorants by a new isolatedPenicillium purpurogenumDPUA 1275[J].J Microbiol Biotechnol,2013,23(6):802-810
[11]GUNASEKARAN S,POORNIAMMAL R.Optimization of fermentation conditions for red pigment production fromPenicilliumsp.under submerged cultivation[J].Afr J Biotechnol,2008,7(12):1894-1898.
[12]SANTOSEBINUMA V C,ROBERTO I C,TEIXEIRA M F,et al.Improvement of submerged culture conditions to produce colorants by Penicillium purpurogenum[J].Braz J Microbiol,2014,45(2):731-742.
[13]周波,王菊芳,吴振强,等.高产红曲黄色素菌株的选育[J].微生物学通报,2008,12:1909-1914.
[14]EL-BIALY H A,EL-NOUR S A A.Physical and chemical stress on Serratia marcescens and studies on prodigiosin pigment production[J].Ann Microbiol,2015,65(1):59-68.
[15]顾鹏飞,李萌,朱瑞宇,等.双缺陷型毕赤酵母X33突变株的诱变育种[J].食品与生物技术学报,2016,35(2):129-135.
[16]张馨,曹红,李春,等.产紫青霉菌的发酵条件及色素稳定性、安全性的研究[J].中国食品添加剂,2016(2):68-74.
[17]SHIMADA K,FUJIKAWA K,YAHARA K,et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J].J Agr Food Chem,1992,40(6):945-948.
[18]DEENA M J,THOPPIL J E.Antimicrobial activity of the essential oil ofLantana camara[J].Fitoterapia,2000,71(4):453-455.
[19]胡向东,潘玲燕,章祺,等.复合诱变选育高产虾青素的红法夫酵母菌株[J].食品与发酵工业,2014,40(10):58-62,68.
[20]屈炯,王斌,吴佳佳,等.红曲色素组份分离及其抗氧化活性研究[J].现代食品科技,2008,24(6):527-531
[21]MÉNDEZ A,PÉREZ C,MONTA ÉZ J C,et al.Red pigment production byPenicillium purpurogenumGH2 is influenced by pH and temperature [J].J Zhejiang U Sci B,2011,12(12):961-968.
[22]MUKHERJEE G,SINGH S K.Purification and characterization of a new red pigment fromMonascus purpureusin submerged fermentation [J].Process Biochem,2011,46(1):188-192.
[23]DEVINE D A,HANCOCK R E W.Cationic peptides:distribution and mechanisms of resistance[J].Curr Pharm Design,2002,8(9):703-714.
[24]SINGH D,RAMESH K,VANDNA M,et al.Synthesis and characterization of complexes of cyclohexadeca-6,8,14,16-tetraene and their biological screening[J].Transit Metal Chem,2007,32(8):1051-1055.
[25]KIM C,JUNG H,KIM J H,et al.Effect of monascus pigment derivatives on the electrophoretic mobility of bacteria,and the cell adsorption and antibacterial activities of pigments[J].Colloid Surface B,2006,47 (2):153-159.
Screening of high red pigment-producingPenicillium purpurogenumLi-3 by compound mutagenese and its biological activity
NIU Yujing1,CAO Hong2,HUANG Xiaolin3,TONG Junmao1*,SUI Jiahui2,YANG Yuxin2
(1.College of Food Science,Shihezi University,Shihezi 832003,China;2.College of Biology,and Chemical Engineering, Jiaxing University,Jiaxing 314001,China;3.Institute of Physical Chemistry,Zhejiang Normal University,Jinhua 321004,China)
UsingPenicillium purpurogenumLi-3 as original strain,the strain with high red pigment-producing ability was screened by ultraviolet(UV)-LiCl compound mutagenesis,and the biological activities of red pigment were researched and evaluated by 2,2-diphenyl-1-picrylhydrazyl(DPPH) system.The inhibitory effects of red pigment produced by mutant strain onStaphylococcus aureusandEscherichia coliwere studied by filter paper diffusion method.The results showed that optimal UV radiation time was 120 s and the optimal concentration of LiCl was 0.28%,theP.purpurogenumLi-3-9 with high red pigment-producing was obtained,inoculated into liquid fermentation medium and cultured at 32℃,150 r/min for 168 h. The color value of red pigment reached the maximum value 3.28 U/ml,which was 83%higher than that of the original strain.After subculture of 5 successive generations,the strain had good genetic stability.The red pigment produced byP.purpurogenumLi-3-9 had better DPPH free radical scavenging capacity and inhibiting ability onS.aureus.
Penicillium purpurogenum;compound mutagenesis;red pigment;biological activity
Q815
0254-5071(2017)03-0030-05
10.11882/j.issn.0254-5071.2017.03.007
2017-01-10
国家自然科学基金资助项目(21266029);浙江省自然科学基金资助项目(LY17B060011)
牛玉静(1990-),女,硕士研究生,研究方向为农产品加工及果蔬贮藏。
*通讯作者:童军茂(1963-),男,教授,硕士,研究方向为农产品加工及果蔬贮藏。
