紫茎泽兰种群空间遗传结构研究
2017-03-31杨林秀陈金龙王亚婷
杨林秀+陈金龙+王亚婷

摘要:选取云南省境内怒江流域北段作为研究区域,采用SSR分子标记技术,对研究区域内的22个紫茎泽兰种群的遗传多样性和种群遗传结构进行了实验分析。实验从60对SSR引物中筛选出3对多态性引物进行扩增,采用0/1法读取条带。3对SSR引物一共扩增出136个条带,共检测到38个特异性条带,每对SSR引物检测出的多态性条带平均为12.6。采用GenAlEx 6.2、Structure2.3.3、NTSYS-PC软件进行分析,得出:22个紫茎泽兰种群间遗传多样性较高,种群水平上的多态位点百分率(P)为71.21% ,Shannon信息指数(I)为0.280,Nei基因多样性指数(H)为0.176,等位基因数(Na)为1.712,有效等位基因数(Ne)为1.280。通过UPGMA聚类和贝叶斯聚类分析均显示出三个区域的种群遗传差异。
关键词:紫茎泽兰;遗传结构;怒江;微卫星标记
中图分类号:S451
文献标识码:A文章编号:16749944(2017)05000905
1引言
紫茎泽兰(Ageratina adenophora R.M.King & H.Robinson),英文名Crofton weed,俗称解放草、霸王草、破坏草等,菊科(Compositae)紫茎泽兰属(Ageratina Spach)[《中国植物志》(第76卷第1分册)中曾置于泽兰属(Eupatorium Lin.),学名为Eupatorium coelestinum Lin.]的一种多年生丛生状亚灌木草本植物(King & Robinson,1970)[1,2]。紫茎泽兰是一种危害严重的世界性恶性杂草[3],20世纪中期该杂草由中缅边境传入我国云南南部,之后迅速扩散至西南及华南地区,并仍以每年几十公里的速度向内陆蔓延扩散,成为我国最为严重的入侵物种之一。
空间遗传结构决定了种群的适应能力和进化潜力[4],植物种群生存环境的差异导致了种群的特定空间遗传结构[5,6]。不同地区温度、湿度等条件不同,对植物产生的选择压力也将不同,这是导致植物遗传结构随地区变化的主要原因。由于在怒江流域所采集的紫茎泽兰种群是沿怒江河谷从南至北的纬度梯度和沿高黎贡山及碧罗雪山从低到高的海拔梯度分布的,不同纬度梯度和不同海拔梯度下环境因素有所差异,不断地对紫茎泽兰产生选择压力。同时,高黎贡山和碧罗雪山的地理屏障阻碍了两侧山面间种群的扩散,一定程度上阻碍了基因交流。然而,怒江河谷的水流、茶马古道以及道路的修建等人类活动却促进了紫茎泽兰种群间的基因交流,并扩大了种群的扩散范围。以上这些环境因素和人为干扰都会影响怒江河谷内和高黎贡山及碧罗雪山紫茎泽兰种群的空间遗传结构。因此,对于紫茎泽兰入侵种群遗传结构的研究有助于了解紫茎泽兰对环境的适应性以及其传播途径和传播方式,并为紫茎泽兰的防控提供一定的科学依据。
2材料和方法
2.1材料
紫茎泽兰于2013年4月采集于怒江河谷(10个种群)以及高黎贡山百花岭(6个种群)和碧罗雪山知子罗(6个种群),共22个种群。在野外,沿着怒江河谷和河谷东西两座山(高黎贡山、碧罗雪山)不同海拔梯度采样。河谷内按县区域大小每个县设置1~2个采样点,海拔每间隔100~200 m为一个采样点,每个采样点设为一个种群,每个种群取24个个体单株间相距约50 m,将整株紫茎泽兰连根拔起,剪掉植株上部的茎叶,并尽量保留根部土壤,编号单株保存,同时每个对应的植株采集5~10片新叶,密封后用变色硅胶干燥处理,根部带回来后迅速转移到温室中及时进行定植。采样时利用GPS定位系统定位,同时记录每一个采样点的经纬度、海拔、生境以及分布情况。
将上述22个种群的紫茎泽兰硅胶干燥样作为预实验材料,根茎在温室中建立实验种群,每个盆种植一个植株,定期浇水,待萌发出新叶即可采集提取DNA。
2.2方法
本研究采用改进的CTAB法(参照Doyle(1987)[7]CTAB法)提取紫茎泽兰DNA,用琼脂糖凝胶电泳对所有样品的基因组DNA进行检测。紫茎泽兰SSR-PCR选择性扩增采用20 μL的反应体系:dNTP(0.2 mM)1.6 μL,MgCl2 1.6 μL,10×Buffer 2 μL,引物1和引物2(10 μM)各为0.5 μL,Taq DNA聚合酶(5.0 U/μL )0.1 μL,DNA 模板(60 ng/μL )1 μL,ddH2O 12.7 μL。单个位点的反应程序为:94 ℃预变性5 min;94 ℃变性30 s,50~60 ℃退火30 s,72 ℃延伸5 min,共35个循环后72 ℃延伸5 min,4 ℃保温。扩增结束,进行PAGE(聚丙烯酰胺)凝胶电泳检测,凝胶成像,然后通过0/1法读取聚丙烯酰胺凝胶电泳的检测结果。
2.3数据分析
在特定的SSR位点上,测定每一供试样品的等位基因组成,电泳资料采用0/1二维数据矩阵的方法录入电脑,有带记录为1,无带记为0。
利用GenAlEx 6.2软件获取评价种群遗传多样性的参数,包括多态性位点百分率(P%)、观测等位基因数(Na)、有效等位基因数(Ne)、期望杂合度(h)、观测杂合度(uh)、Neis 基因多样性指数(H)、Shannons 信息指数(I)及反映种群遗传结构指标,包括种群间分化系数(Fst)、基因流(Nm)、Neis 标准遗传距离(GD)和遗传一致度(GI)。用Wright统计量( Fst,杂合性基因多样度比率) 基因分化系数(Gst)来间接测量基因流,估算种群群间的遗传分化。利用GenAlEx 6.2软件分子方差分析(AMOVA)估测遗传变异在种群间和种群内的分布及种群遗传分化显著性检验,进行遗传距离与地理距离的相关性分析,以检验种群间遗传距离和地理距离的相关性。用Structure2.3.3進行类别推断和模型聚类分析,NTSYS-PC进行种群间的聚类分析。
3结果与分析
3.1紫茎泽兰种群间遗传多样性
利用3对SSR引物(表1)对紫茎泽兰分布于怒江河谷、高黎贡山和碧罗雪山的22个种群、480个个体进行分析。不同引物扩增出来的条带特异性差异大,所有引物一共扩增出136个条带,每对引物平均扩增出45.3条多态性带。不同区域种群多态性带的检出率分别为,高黎贡山百花岭44.44%、碧罗雪山知子罗100.00%、怒江河谷70.00%,总体平均为71.21%。
Wright(1931,1969)提出的基因流(Nm)与种群间的固定指数Fst之间存在下列关系Nm=(1-Fst)/4Fst,Nm是种群每代的迁移数。因此可以根据Fst来测定基因流。也有人用基因分化系数Gst来代替Fst计算Nm。Wright(1931)[8]认为,当Nm>1时,基因流可以防止由遗传漂变引起的种群间遗传分化。因此,往往当Nm值升高时,Gst降低。利用GenAlEx 6.2软件统计分析,发现物种水平上紫茎泽兰总遗传多样性为0.280(Hsp),种群内的遗传多样性分别为0.155(高黎贡山)、0.474(碧罗雪山)、0.239(怒江河谷)(Hpop)。
紫茎泽兰22个种群的AMOVA分析结果表明,种群间基因分化系数Gst为0.21,即种群间的遗传变异占总变异的21%,而总变异中有71%的变异存在于种群内。不同区域之间的遗传变异占8%。种群间和种群内的变异均较为明显(P<0.05)。其中,高黎贡山百花岭6个紫茎泽兰种群的AMOVA分析结果表明,种群间基因分化系数Gst为0.15,即种群间的遗传变异占总变异的15%,而总变异中有85%的变异存在于种群内。种群间和种群内的变异均较为明显(P<0.05)。碧罗雪山知子罗6个紫茎泽兰种群的AMOVA分析结果表明,种群间基因分化系数Gst为0.37,即总变异中有63%的变异存在于种群内,种群间的遗传变异占总变异的37%,种群间和种群内的变异均较为明显(P<0.05)。怒江河谷10个紫茎泽兰种群的AMOVA分析结果表明,种群间基因分化系数Gst为0.04,即总变异中有96%的变异存在于种群内,种群间的遗传变异占总变异的4%,种群内的变异较为明显(P<0.01)。
通过以上的AMOVA分析,发现紫茎泽兰22个种群间的遗传结构,在海拔梯度间种群遗传分化明显,在怒江河谷下部沿江两岸种群间遗传分化不明显。河谷空间对紫茎泽兰遗传结构有显著的影响。
3.2种群空间遗传结构
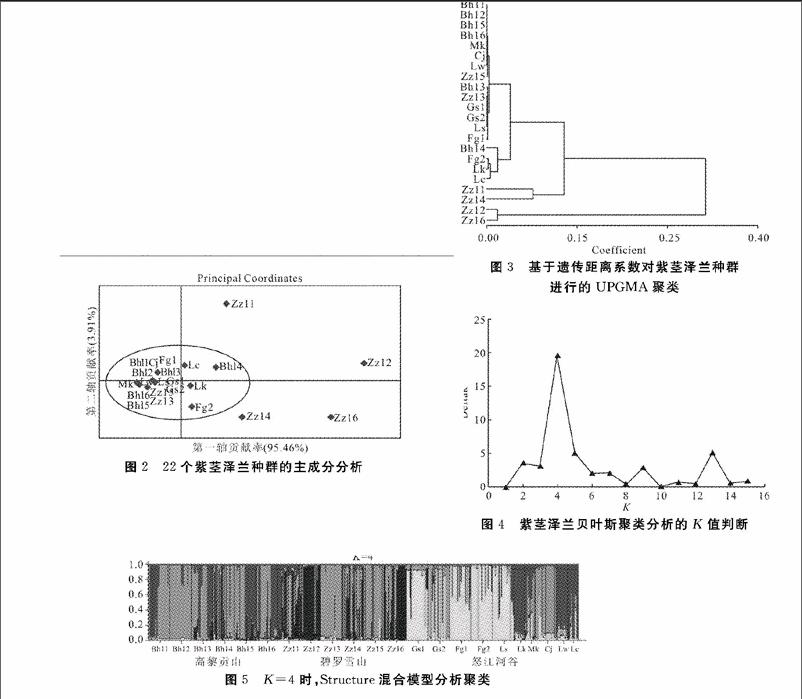
通过GenAlex6.2软件的分析,按照Nei(1972)[9]的方法计算出紫茎泽兰种群间的遗传距离和遗传相似度。结果显示,22个紫茎泽兰种群间的遗传相似度在0.456~1.000 范围间,其中种群Bhl1与Bhl2,种群Bhl1、Bhl2与种群Bhl5、Bhl6、Mk、Cj、Lw之间的遗传相似度最高(均为1.000),种群之间遗传距离最近。种群Zzl2与Bhl6(0.464)、Mk、Cj、Lw(均为0.456)之间遗传相似度最低,种群Zzl2与种群Bhl6、Mk、Cj、Lw之间遗传距离最远。利用GenAlEx6.5软件对22个紫茎泽兰种群间遗传距离与地理距离作相关性分析(图1),结果显示,随着海拔梯度变化,对于高黎贡山6个种群(Bhl1-Bhl6)种群遗传距离与地理距离间相关性不明显;碧罗雪山5个种群(Zzl1-Zzl5)间的遗传距离与地理距离相关性呈先增后减的趋势;怒江河谷的10个种群遗传距离与地理距离间相关性不明显。
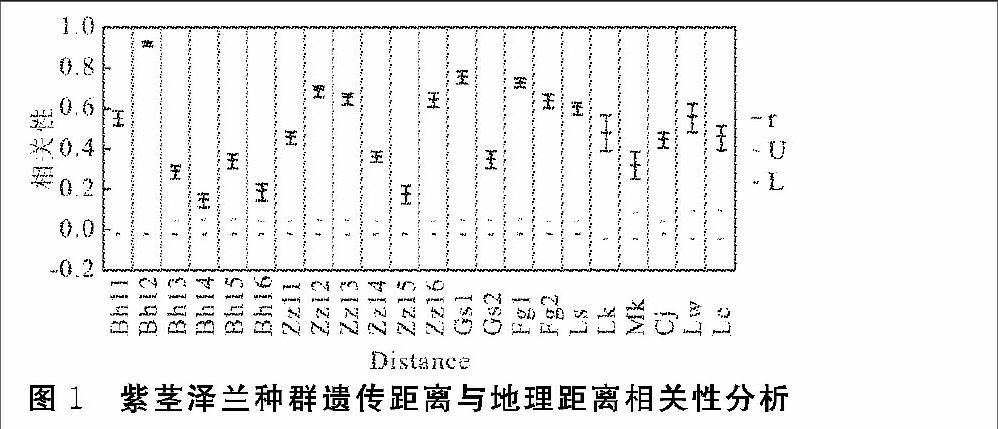
利用GenAlex6.2软件对紫茎泽兰22个种群进行种群间的PCA分析,结果见图2,图中两点之间的距离越近,说明两个种群之间的遗传距离越近。从结果中可以明显看出,22个种群之间有明显的分化。除碧罗雪山知子罗的4个种群(Zzl1,Zzl2,Zzl4,Zzl6)外,其他18个种群集中聚集,即遗传距离较近。PCA分析中,第一轴的贡献率为95.46%,第二轴的贡献率为3.91%。
基于遗传距离系数的UPGMA聚类图见图3,来自相似或相邻生境的紫茎泽兰种群在聚类分析时大多聚集在同一个聚类群或相邻的聚类群中。从聚类图的联结上可以看出,22个紫茎泽兰种群基本上可分为两大亚群5个聚类群。UPGMA聚类图的上半部分为第一大亚群(包含第1~4聚类群),第1个聚类群包括高黎贡山百花岭的4个种群(Bhl1、Bhl2、Bhl5、Bhl6)和怒江河谷的3个种群芒宽、漕涧、老窝(Mk、Cj、Lw);第2个聚类群为贡山的2个种群(Gs1、Gs2),福贡1个种群(Fg1),泸水(Ls)以及百花岭(Bhl3)和知子罗(Zzl3)各1个种群;第3个聚类群为百花岭1个种群(Bhl4),怒江河谷的3个种群福贡、六库和澜沧(Fg2、Lk、Lc);第4个聚类群为知子罗的2个种群(Zzl1、Zzl4)。第二大亚群,即第6个聚类群包括的种群为知子罗的2个种群(Zzl2、Zzl6)。
利用Structure程序对22个紫茎泽兰种群的480个个体进行类别数的推断,根据不同分组评价标准所决定的22个种群的贝叶斯聚类分析结果显示,22个种群的最优分组为 :即以ΔK值为评定标准,当K=4时,ΔK的值为显著的最大值(ΔK=19.80613)。
Structure分组结果等于4,相应的聚类图如图5和图6,结果显示22个紫茎泽兰种群间存在明显的分化,
两个海拔梯度种群:碧落雪山知子罗和高黎贡山百花岭种群间具有显著相关性,种群主要聚成三种聚类,怒江沿江种群和两个海拔梯度种群具有显著差异,含有两个海拔梯度都没有的黄色聚类,而Cj、Lw、Lc是澜沧江经分水岭进入怒江河谷的,与怒江河谷沿江种群有很大区别,但也存在一定的联系。
4讨论
4.1紫茎泽兰遗传分化水平
SSR标记具有多态性高、共显性、重复性好等优点,能够检测到较多的等位基因,是一种有效的植物种群遗传多样性研究分子标记。本研究基于SSR分子遗传标记技术,利用3对SSR引物对怒江地区22个紫茎泽兰种群进行遗传多样性检测,研究结果显示:所有引物一共扩增出136个条带,每对引物平均检测到45.3个多态位点,种群水平上的多态位点百分率(%P)为71.21% ,Shannon信息指数(I)为0.280,Nei基因多样性指数(h)为0.176,即22个紫茎泽兰种群间的遗传多样性高。种群内的遗传多样性,高黎贡山百花岭为0.155,碧罗雪山知子罗为0.474,怒江河谷为0.239,其中百花嶺的种群Bhl4和知子罗的3个种群Zzl1、Zzl2、Zzl3种群内的遗传多样性较高。
种群内和种群间遗传变异的分布格局即遗传分化。利用AMOVA分析得到高黎贡山百花岭、碧罗雪山知子罗和怒江河谷的紫茎泽兰存在于种群间的遗传变异分别为15%、37%和4%。对应地,存在于种群内的遗传变异分别为85%、63%和96%,即紫茎泽兰的遗传变异主要存在于种群内,但种群间也出现了一定的遗传分化,分化系数(Gst)分别为0.15、0.37、0.04,据Wright(1978)得出三个地区紫茎泽兰种群的分化程度,碧罗雪山知子罗的紫茎泽兰种群遗传分化程度极大(Gst>0.25),高黎贡山百花岭的紫茎泽兰种群间存在一定程度的分化(Gst=0.15),而怒江河谷的紫茎泽兰种群遗传分化不是很明显(Gst<0.05)。
紫茎泽兰种群的AMOVA分析表明,在海拔梯度间种群遗传分化明显,在怒江河谷下部沿江两岸种群间遗传分化不明显。河谷空间对紫茎泽兰遗传结构有显著的影响。相应地,三个地区(高黎贡山百花岭、碧罗雪山知子罗、怒江河谷)的基因流(Nm)分别为1.417、0.426、6.000,由此看出高黎贡山百花岭和怒江河谷的基因流(Nm)大于1,据Wright(1951),基因流(Nm)大于1的情况下,基因流主要发挥均质化作用,从其他种群流入的基因阻止种群间的局部分化(王崇云,2008),所以高黎贡山百花岭紫茎泽兰种群的遗传分化程度较低,怒江河谷紫茎泽兰种群的遗传分化不明显。高黎贡山百花岭紫茎泽兰种群间的基因流如前面所述,可能是由于旅游业的发展导致。怒江河谷紫茎泽兰种群间的基因流很可能是由于S228省道沿途的人为干扰,以及怒江水流对紫茎泽兰种子及繁殖体的传播,增加了种群间的杂交,频繁的基因流,均质化作用明显使得种群间的遗传分化程度低,其结论与AMOVA分析一致。碧罗雪山知子罗紫茎泽兰种群,其基因流(Nm)为0.426,小于1,种群遗传分化程度高,原因可能是1986年在州政府搬迁后知子罗被边缘化,交通要塞地位不复存在,人为干扰作用因此降低。
4.2紫茎泽兰种群空间遗传结构
4.2.1基于遗传距离指数的UPGMA聚类分析
遗传距离是研究植物种群遗传多样性的基础,反映了植物群体的系统进化,基于遗传距离构建的聚类图被广泛用来描述植物群体遗傳结构的差异(屠云洁等,2006)。22个紫茎泽兰种群基本上可分为两大亚群5个聚类群。UPGMA聚类图的上半部分为第一大亚群(包含第1~4聚类群),第1个聚类群包括高黎贡山百花岭的4个种群(Bhl1、Bhl2、Bhl5、Bhl6)和怒江河谷的3个种群芒宽、漕涧、老窝(Mk、Cj、Lw);第2个聚类群为贡山的2个种群(Gs1、Gs2),福贡1个种群(Fg1),泸水(Ls)以及百花岭(Bhl3)和知子罗(Zzl3)各1个种群;第3个聚类群为百花岭1个种群(Bhl4),怒江河谷的3个种群福贡、六库和澜沧(Fg2、Lk、Lc);第4个聚类群为知子罗的2个种群(Zzl1、Zzl4)。第二大亚群,即第5个聚类群包括的种群为知子罗的2个种群(Zzl2、Zzl6)。对比紫茎泽兰UPGMA聚类图与PCA分析图发现,UPGMA聚类图上的第一大亚群的前3个聚类群在PCA分析图(图2)上也是距离最近的,第一大亚群的第4聚类群和第二大亚群在PCA分析图与其他种群距离较远,即两者结论相一致。
4.2.2基于Structure程序的类别推断和模型聚类分析
Structure模型聚类结论与UPGMA聚类基本一致,最终将紫茎泽兰的22个种群480个个体划分为4个类别,怒江河谷的Gs2种群和下游种群(Mk、Cj、Lw)以及碧罗雪山知子罗的Zzl3和Zzl5种群中明显可以看出有高黎贡山百花岭个体的存在,而高黎贡山百花岭的中海拔处的种群(Bhl3、Bhl4)中有碧罗雪山知子罗低海拔(Zzl1、Zzl2)和高海拔(Zzl5、Zzl6)个体的存在。22个紫茎泽兰种群间存在明显的分化:高黎贡山百花岭和怒江河谷紫茎泽兰的种群遗传分化程度低于碧落雪上知子罗。怒江沿江种群和上下都不相同,Cj、Lw、Lc是澜沧江经分水岭进入怒江河谷的,和怒江河谷沿江种群有很大区别,但有联系。这里可以大致推测,怒江河谷的入侵过程,与澜沧江种群有关,和百花岭不太相关。因此百花岭的种群可能是早先马帮带去的。
参考文献:
[1]石铸,傅国勋.中国植物志[M].北京:科学出版社,1983:56.
[2]吴征益,庄旋旋.云南植物志[M].北京:科学出版社,2004:42~44.
[3]尹芳,黄梅,徐锐,等.紫茎泽兰的危害及其综合利用进展分析[J].灾害学,2009,24(4):63~67.
[4]Millar Constance I,Libby,William J.Strategies for conserving clinal,ecotypic,and disjunct population diversity in widespread species.Genetics and conservation of rare plants[M].New York:Oxford University Press,1991:149~170.
[5]Hamrick JL.Isozymes and the analysis of genetic structure in plant populations[J].Isozymes in plant biology.Springer Netherlands,1989:87~105.
[6]Hamrick JL,Loveless MD.The genetic structure of tropical tree populations:association with reproductive biology[M].Boulder:Westview Press,1989:129~146.
[7]Doyle JJ.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochem bull,1987(19):11~15.
[8]Wright S.Evolution in Mendelian populations[J].Genetics,1931,16(2):97.
[9]Nei,M.Genetic distance between populations[J].American naturalist,1972.
