闵行地区PRRSV的分离鉴定及N基因序列分析
2017-03-28邢涛郁星星张峻周光胜张红飞朱爱
邢涛 郁星星 张峻 周光胜 张红飞 朱爱军

摘要:采集闵行地区规模猪场疑似PRRS阳性病料,在Marc-145细胞上进行病毒分离,采用RT-PCR扩增PRRSV高度保守的N基因并测序。结果表明,成功分离到6株PRRSV,为研究闵行地区PRRSV流行株分子变异和致病机理提供了良好的生物素材。
关键词:猪繁殖与呼吸综合征病毒;N基因;分离与鉴定;序列分析
中图分类号:S828 文献标识码:A 文章编号:0439-8114(2017)04-0704-03
猪繁殖与呼吸综合征(PRRS)又称猪蓝耳病,是由猪繁殖与呼吸综合征病毒(PRRSV)引起的猪的烈性传染病,是全球养猪行业最重要的疾病[1,2]。研究表明,ORF7编码的核衣壳N蛋白在同型的不同毒株中最为保守,是PRRSV免疫原性最强的结构蛋白[3,4],Lee等[5]研究表明N蛋白的核定位与病毒的持续感染或选择变异具有一定相关性,在病毒的免疫逃避中扮演着重要角色,因此,N蛋白以其高度的保守性和强大的免疫原性成为诊断PRRS的首选蛋白。本研究克隆并测序其相对保守的N基因,通过序列分析软件与国内外参考毒株进行推导氨基酸序列比较以及同源比对分析,探讨闵行地区PRRSV优势流行毒株的类型,以期为科学预防PRRS提供参考依据。
1 材料与方法
1.1 材料
1.1.1 病料 试验样品为2015年采集闵行地区正义牧场(疫苗株Ingelvac PRRS MLV)、中南牧场(疫苗株TJM-F92)两个规模猪场发生高热、咳喘、繁殖障碍等猪繁殖与呼吸综合征疑似病猪的肺脏、脾、扁桃体。
1.1.2 主要试剂 DMEM培养基为Gibeo公司产品;Trizol、dNTPs、pMD18-T、限制性内切酶、DNA Marker均为宝生物工程(大连)有限公司产品;胶回收试剂盒为Fermentas公司产品;M-MLV Reverse Transcriptase为Promega公司产品。
1.1.3 引物 根据李鹏等[6]的研究设计1对特异性引物,由宝生物工程(大连)有限公司合成,引物序列为:上游引物P1:5-GCGGATCCCCAAATAACAAC GGCAAGC-3,下游引物P2:5-GCAAGCTTCACCA TGCTGAGGGTGATG-3,预期扩增基因片段为372 bp。
1.2 方法
1.2.1 总RNA提取 按照Trizol reagent试剂盒说明书提取病毒RNA,加入20 μL DEPC水溶解RNA,同时设未接种病毒的细胞作阴性对照。
1.2.2 N基因的RT-PCR扩增 按照One Step RT-PCR Kit说明进行cDNA合成,以合成的cDNA为模板扩增目的片段,反应体系为cDNA 0.5 μL,上、下游引物各0.5 μL,rTaq酶0.5 μL,10×PCR Buffer 2.5 μL,dNTPs 2 μL,ddH2O 18.5 μL。反应条件为94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共进行35个循环;最后72 ℃延伸10 min。
1.2.3 目的基因克隆、鉴定与测序 PCR扩增产物按Fermentas胶回收试剂盒说明书进行回收纯化,与pMD18-T载体连接,碱裂解法提取质粒,BamH Ⅰ+Hind Ⅲ酶切鉴定后由宝生物工程(大连)有限公司进行序列测定。
1.2.4 序列分析 对测序得到的基因序列利用MegAlign软件进行分析[7],与国内第一分离株CH-1a、河北分离株HB-2、美洲型参考毒株JXA1、美洲型经典株VR-2332及欧洲经典株LV进行氨基酸序列比对,并与参考毒株进行同源性分析。
2 结果与分析
2.1 RT-PCR扩增与重组质粒酶切鉴定结果
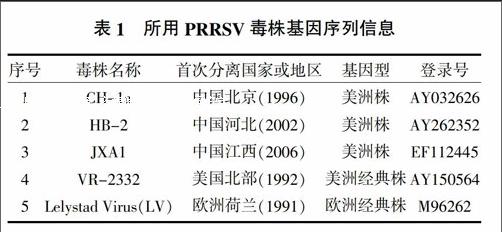
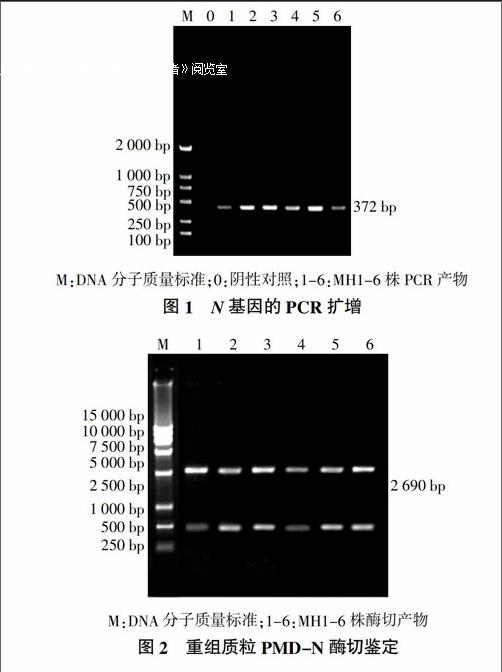
PCR扩增产物电泳后出现与预期片段大小相符的条带,约372 bp(图1), 阳性质粒经BamH Ⅰ和Hind Ⅲ双酶切鉴定后,得到预期大小372和2 690 bp的条带(图2)。
2.2 基因序列测定
将含有N基因的阳性质粒送至宝生物工程(大连)有限公司进行序列测定,结果表明,测序序列确为PRRSV核蛋白N基因序列,该基因全长372 bp,不存在缺失现象,编码123位氨基酸,将其命名为MH1、MH2、MH3、MH4、MH5和MH6株。
2.3 氨基酸序列分析
ORF7编码的N蛋白基因是PRRSV所有基因中最高度保守的[8],但通过对N基因推导氨基酸序列分析表明,MH1-6株与JXA1株N基因氨基酸序列完全一致,与VR-2332株相比发生的氨基酸位点突变为:11R→K、15D→N、46K→R、91T→A、109H→Q、117V→A与CH-1a株相比发生了6个氨基酸位点的点突变:9R→Q、46K→R、49S→N、91T→A、109H→Q、117V→A与HB-2株相比发生了10个氨基酸位点的突变:11R→Q、15D→N、46N→R、48R→K、49S→N、61E→D、91S→A、101A→T、109H→Q、117V→A(图3)。
2.4 同源比对分析
运用DNAMAN软件对已获得的6个N基因序列与其他参考毒株进行同源性分析。结果表明,MH1、MH2、MH3、MH4、MH5和MH6株之间同源性高达100%,说明各分离株之间N基因高度同源。MH1-6株与VR2332、CH-1a、HB-2株的同源性为91.9%~95.1%,与JXA1株的同源性高达100%,而与欧洲型代表株LV株的同源性为43.7%,表明闵行地区分离到的6株PRRSV毒株与JXA1变异株高度同源。
3 小结与讨论
序列分析表明,闵行地区PRRSV毒株N基因编码的氨基酸序列与国内分离的PRRSV非变异株(CH-1a和HB-2)氨基酸序列相比存在着一定的共同点突变,这种一致性的共同点突变为46K(N)→R、91T(S)→A、109H→Q、117V→A,然而这种一致性的点突变差异是否与闵行地区PRRSV毒株的毒力有关还有待进一步驗证。
同源分析表明,6株闵行分离株N基因序列之间同源性高达100%,提示闵行地区分离到的PRRSV毒株遗传关系很近,很可能处于同一遗传进化分支。MH1-6株与美洲型参考毒株JXA1变异株同源性高达100%,而与欧洲型经典株LV株的同源性仅为43.7%,提示闵行分离株可能为美洲型HP-PRRSV变异毒株,因此,对闵行地区进行PRRSV分子流行病学监测对PRRS防控具有重要意义[9]。
从闵行地区分离到的MH1、MH2、MH3、MH4、MH5和MH6毒株在猪繁殖与呼吸综合征研究中具有一定的代表作用,本研究得到了6株毒株N基因序列,不仅进一步丰富中国PRRSV序列数据库,而且可以通过与其他分离株进行比较来发现病毒的变异机制,找出与毒力相关的基因特征,从而为闵行地区PRRS的诊断和防制提供理论依据[10,11]。
参考文献:
[1] ZHOU L,YANG X,TIAN Y,et al. Genetic diversity analysis of Genotype 2 porcine reproductive and respiratory syndrome viruses emerging in recent years in China[J].Biomed Res Int, doi:10.1155/2014/748068.
[2] ROBINSON S R,LI J,NELSON E A,et al. Broadly neutralizing antibodies against the rapidly evolving porcine reproductive and respiratory syndrome virus[J].Virus Res,2015,203:56-65.
[3] DEA S,GAGNON C A,MARDASSI H,et al. Current knowledge on the structural proteins of porcine reproductive and respiratory syndrome(PRRS) virus:Comparison of the North American and European isolates[J].Archives of virology,2000,145:659-688.
[4] KIM W I,KIM J J,CHA S H,et al. Different biological characteristics of wild-type porcine reproductive and respiratory syndrome viruses and vaccine viruses and identification of the corresponding genetic determinants[J].J Clin Microbiol,2008, 46(5):1758-68.
[5] LEE C,HODGINS D,CALVERT J G,et al. Mutations within the nuclear localization signal of the porcine reproductive and respiratory syndrome virus nucleocapsid protein attenuate virus replication[J].Virology,2006,346(1):238-250.
[6] 李 鵬,郑其升,李 斐,等.猪繁殖与呼吸综合征病毒河北地方株GF1107株ORF7基因的克隆与表达[J].中国兽医学报,2006, 26(5):468-470.
[7] 黄梅清,车勇良,陈少莺,等.2株猪繁殖与呼吸综合征病毒欧洲型分离株ORF4~7基因的克隆与序列分析[J].中国兽医学报,2013,33(11):1623-1626.
[8] 鲁韦韦,姜 平,唐泰山,等.猪繁殖与呼吸综合征病毒ORF7基因的遗传变异分析[J].动物医学进展,2007,28(11):26-30.
[9] 周 磊,杨汉春,姜 平,等.猪繁殖与呼吸综合征综合防控技术与应用[J].中国畜牧杂志,2015,51(6):62-67.
[10] 李桃梅,赖 志,崔 立.猪繁殖与呼吸综合征病毒垂直传播及其危害研究进展[J].中国畜牧兽医,2015,42(5):1311-1317.
[11] 杨汉春.2014年猪病流行情况与2015年流行趋势及防控对策[J].猪业科学,2015,32(2):38-40.
