基于脂质组学的高脂血症小鼠血清脂肪酸研究
2017-03-06刘佩莉曹兴奋王晓辉刘洪斌
刘佩莉,关 鑫,李 楠,曹兴奋,杨 萍,王晓辉,刘洪斌
基于脂质组学的高脂血症小鼠血清脂肪酸研究
刘佩莉1,关 鑫2,李 楠1,曹兴奋1,杨 萍1,王晓辉1,刘洪斌1
目的:应用高效液相色谱串联四极杆飞行时间质谱(LC-Q-TOF-MS)技术对高脂血症小鼠的血清脂肪酸类成分及生物标志物进行分析。方法:将20只小鼠随机分为正常对照组和模型组,建立高脂模型,灌胃给药,1次/d,持续15 d。末次给药后1 h,经目内眦取血。血清进行处理后应用LC-Q-TOF-MS技术,采用负谱模式扫描样品,结合偏最小二乘法(PLS-DA)研究两组血清脂肪酸类成分差异。结果:与对照组相比,模型组小鼠血清中TG[(1.037±0.393)vs(0.810±0.412)]、TC[(3.776± 0.821)vs(3.002±0.648)]、HDL-C[(2.282±0.544)vs(1.896±0.326)]、LDL-C[(0.405±0.148)vs(0.128±0.072)]水平有显著性差异。分析方法精密度RSD为9.25%,发现了16个潜在生物标志物。结论:基于LC-Q-TOF-MS技术研究了高脂血症小鼠血清中脂肪酸类成分的代谢物特征,可以将高脂血症模型组与对照组进行区分,是发现生物标志物的有效手段。
高脂血症;脂质组学;脂肪酸;生物标志物
高脂血症是指各种原因导致的血浆中胆固醇、胆固醇脂、甘油三脂、磷脂、β-脂蛋白、未脂化的脂酸等代谢异常的疾病[1],是中老年的常见病、多发病,是冠心病、脑中风等心脑血管疾病的危险因素。而脂代谢紊乱的发病机制[2]仍不十分清楚,现已公认是由多基因、多因素导致的一类复杂性病理过程。当前生物标志物甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇,缺乏必要的特异性和敏感性,只有严重的血脂异常才显著增加,因此高脂血症的诊断需要更为敏感的生物标志物[3]。已证实游离脂肪酸,尤其是不饱和脂肪酸与很多系统疾病[4-5]的发生发展有关。脂肪酸属于脂质的一类,脂质组学[6-7]是研究脂质代谢调控的新学科,用于检测存在于生物基质中的全部脂质,以及各种刺激或干预对脂质的响应,明确其对疾病诊断和治疗的作用。本研究应用LC-Q-TOF-MS技术对高脂血症小鼠血清脂肪酸进行分析,从整体代谢角度探讨高脂血症小鼠血清脂肪酸体内代谢特征,试图寻找具有临床诊断特异性的血清生物标志物,以期提高对高脂血症疾病风险预测的能力。
1 材料和方法
1.1 动物及分组 昆明小鼠20只,雌雄各半,体质量(20±2)g,由北京维通利华实验动物技术有限公司提供。自由进食、饮水。
1.2 试剂与仪器 试剂:肉豆蔻酸对照品(批号M3128,规格5 g,Sigma公司);正十七酸(批号K1325026,规格5 g,aladdin公司);硬脂酸对照品(批号190032-201202,规格 200 mg);棕榈酸(批号190029-201202,规格 200 mg);亚油酸(批号111622-201203,规 格 0.2 mL);油 酸 (批 号111621-201205,规 格 0.2 mL);月 桂酸 (批 号111774-200701,规格20 mg)均由中国食品药品检定研究院提供;氯仿(批号2015年7月29日,规格500 mL,天津市化学试剂供销公司);甲醇(批号R141036,规格4 L,迪马科技有限公司);水为超纯水。
仪器:Bruker microTOF-QⅡ飞行时间质谱仪,配置电喷雾离子源,Hystar3.2操作软件;DIONEX U3000高效液相色谱系统,包括:在线脱气机,二元输液泵,自动进样器,柱温箱,紫外检测器;色谱柱:dionex C182.1 mm×250 mm,5 μm,120 A。
1.3 动物模型的建立 造模:高脂饲料喂养法制备小鼠高脂血症模型。高脂饲料由北京科澳饲料有限公司制备,配方为基础饲料加蔗糖、炼猪油混合而成,蔗糖20%、猪油20%、胆固醇2%、胆盐0.3%,喂养14 d,采血预试高脂血症是否成立。分组:按照甘油三酯水平随机分为2组[8],分别为正常对照组(n= 11)和高脂血症模型组(n=9)。给药:高脂模型成立后,灌胃给药,1次/d,持续灌胃15 d。
1.4 样品采集与制备 标准溶液的配制:分别称取肉豆蔻酸、硬脂酸、亚油酸、油酸、月桂酸、正十七酸对照品0.6 mg、0.8 mg、1.15 mg、1.54 mg、0.91 mg、1.47 mg于10 mL量瓶中,棕榈酸对照品1.38 mg于25 mL量瓶中,用二氯甲烷:甲醇(2∶1)溶解,并定容至刻度,分别得到储备液60、80、115、154、91、147、 55.2 μg/mL。用甲醇进行逐级稀释至浓度分别为60、80、115、15.4、9.1、14.7、55.2 ng/mL。
样品采集:末次给药后1 h,经目内眦取血。经离心分离血清,冷冻保存。
样品制备:取小鼠空白血清30 μL加入1.5 mL离心管中,加入内标液十七碳酸(1.47 μg/mL)20 μL,加入氯仿和甲醇混合液(1:2)600 μL,涡旋5 min,10 000 r/min离心10 min后,取上清液500 μL,空气吹干,以500 μL乙腈复溶,涡旋30 s,用0.45 μm微孔滤膜过滤后测定。
1.5 血清生化指标检测 采用全自动生化仪测定甘油三酯(TG)、胆固醇(TC)、低密度脂蛋白胆固醇(HDL-C)、高密度脂蛋白胆固醇(HDL-C)。
1.6 液质联用方法 (1)液相色谱条件。色谱柱:dionex C182.1 mm×250 mm,5 μm,120 A;流动相:乙腈∶水=90∶10;流速:0.3 mL/min;进样量:5 μL;柱温:30℃。(2)飞行时间质谱条件。离子源为电喷雾离子化源负离子模式,源参数及质谱参数见表1。
1.7 精密度实验 按“样品制备方法”,取小鼠空白血清30 μL加入1.5 mL离心管中,加入内标液十七碳酸(1.47 μg/mL)20 μL,加入氯仿和甲醇混合液(1∶2)600 μL,涡旋5 min,10 000 r/min离心10 min后,取上清液500 μL,空气吹干,以500 μL乙腈复溶,涡旋30 s,用0.45 μm微孔滤膜过滤后,连续分析6针。色谱图结果见图1。

图1 小鼠高脂血症血清HPLC-Q-TOF测定总离子谱图
1.8 数据处理 使用SPSS 16.0软件进行统计分析,计量资料采用()表示。对数据进行正态分布检验及方差齐性检验,对非正态分布数据采用非参数检验[8],P>0.05资料服从正态分布。两组均数比较采用t检验,P<0.05为具有显著性差异。
2 结果
2.1 血清生化指标 与对照组相比,模型组小鼠血清中TG、TC、HDL-C、LDL-C水平有显著性差异,表明高脂血症小鼠模型成立。见表2。
表2 2组小鼠血清生化指标检测结果比较(,mmol/L)

表2 2组小鼠血清生化指标检测结果比较(,mmol/L)
注:与对照组比较,aP<0.05
组别对照组模型组TG 0.810±0.412 1.037±0.393aTC 3.002±0.648 3.776±0.821aHDL-C 1.896±0.326 2.282±0.544aLDL-C 0.128±0.072 0.405±0.148a
2.2 精密度实验 通过进样分析,计算内标峰面积相对标准偏差(RSD),RSD为9.25%,表明此方法重复性良好。见表3。
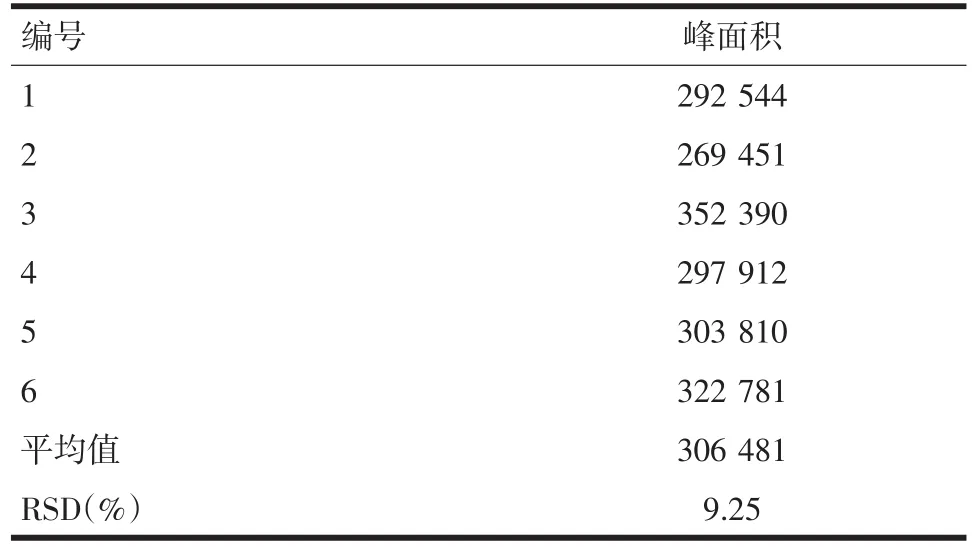
表3 小鼠高脂血症模型血清脂质组学分析方法精密度
2.3 数据分析 通过LC-MS-ESI-TOF分析,得到小鼠血清脂质代谢谱图数据,应用BRUKER自带软件Profile Analyst对上述数据进行峰对齐后归一降维处理,导出数据,应用SIMCA-P11.5进行偏最小二乘法分析(PLS-DA),模型组与正常对照组得到良好的区分,见图2。应用Profile Analyst对实验组和对照组数据进行分组处理,结果以点阵的方式将数据分别显示出来,每个点代表一个分子量的信息,差异成分分布在四周,距离密集中心越远的点说明差异越大,见图3。结合高脂血症疾病特点,找出最有可能的物质成分,提取主要差异物见表4。

图2 PLS模型矩阵(▲对照组□模型组)
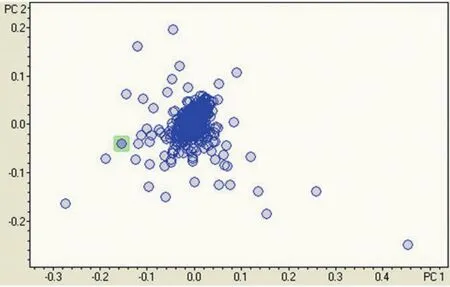
图3 小鼠高脂血症血清脂质组学差异图谱
3 讨论
高脂血症是体内脂质代谢异常引起的血脂水平发生异常的疾病,发病率高,是动脉硬化性心脑血管疾病发病的危险因素,其发病机制复杂。脂质组学是代谢组学的一个分支,应用此方法研究疾病的发病机理已成为目前的研究热点[9]。该技术的关键是找出疾病的代谢差异性物质,因此对方法的可靠性要求较高。四极杆飞行时间质谱是采用四极杆作为质量过滤器,TOF作为质量分析器,优势在于可以在宽质量范围内实现高分辨,得到物质准确分子量[10]。本研究采用高脂饲料建立小鼠高脂血症模型,此模型可重复率高,造模方法可靠,建立了LC-MS-ESITOF分析方法,并对其精密度进行了考察,从数据可知RSD<10%,重复性良好。
代谢组学研究检测到的是海量多维的数据。分析这些数据,需要借助专门的数理统计和生物信息学软件,从而快速、高效地呈现可视化的分析结果。目前,代谢组学常用的软件[11]可大致分为两类:一类是开放性软件,包括MATLAB(matrix laboratory)、SAS(statistics analysis system)、SIMCA(soft independent modeling of class analogy)-P、R软件、XCMS等;另一类是仪器自带软件,包括MarkerLynx(waters)、MassHunter(agilent)、MarkerView(applied biosystems/ MDSSCIEX)、Bruker Profile Analysis(bruker)等。本研究采用BRUKER自带软件Profile Analyst进行数据处理后,再用SIMCA-P11.5进行分析。代谢组学研究中的数据分析[12]包括无监督模式识别方法和有监督模式识别方法,其中无监督模式识别方法主要包括主成分分析(principal component analysis,PCA)、分层聚类分析(hierarchical cluster analysis,HCA)等;有监督识别模式方法主要包括偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA)、正交信号校正技术偏最小二乘分析(orthogonal signal correction partial least square,OPLS)、正交信号校正技术偏最小二乘判别分析(orthogonal signal correction partial least squares-discriminant analysis,OPLS-DA)、随机森林分析(random forests,RF)等。其中,PCA、PLS-DA、OPLS-DA使用最广泛。本实验采用有监督模式的PLS-DA分析,在明确样品分类的情况下,使不同类别样品尽可能地分开,它的分类效果要比PCA更好。本实验的模型组与正常对照组得到良好的区分,表明小鼠高脂血症模型组与对照组血清成分有明显差别。应用ProfileAnalyst对模型组和对照组数据进行进一步分析处理,结果以点阵的方式将数据分别显示出来,每个点代表一个分子量的信息,差异成分分布在四周,距离密集中心越远的点说明差异越大,结果进一步证实模型组与对照组血清成分有明显差异。经过数据提取,得到一系列差异物质,再结合高脂血症疾病特点,找出最有可能的物质成分。然后将这些物质的谱图与如LIPID MAPS、Lipid Bank、Cyber Lipids和LIPIDAT等数据库[13-14]进行比对,进而找到潜在的生物标志物。
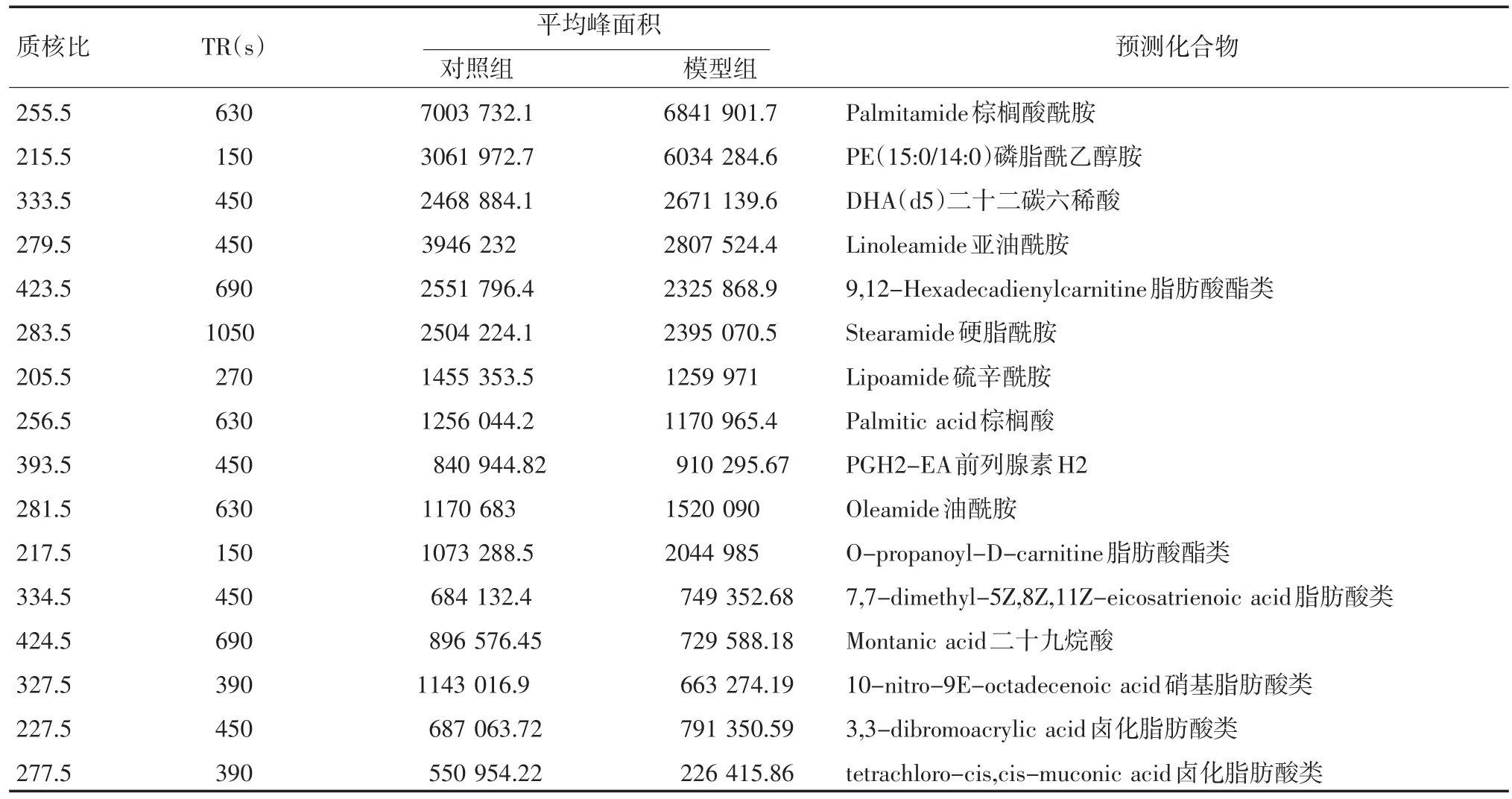
表4 小鼠高脂血症模型血清脂质组学分析差异物
目前对脂质组学数据分析还极具挑战性,LIPID MAPS[15]是专门研究脂质的数据库。本实验借助于此数据库和代谢组学常用数据库HMDB对分子量进行搜索,综合分析找出最有可能的差异物成分。最终发现,差异代谢物成分共16个,主要为脂肪酸酰胺类5个、脂肪酸酯类2个和硝基、卤化脂肪酸类9个,这些物质在高脂血症的发生发展过程中可能起到重要作用,它们的结构确认有待于进一步的深入研究。本研究应用脂质组学技术建立的小鼠血清脂肪酸分析方法精密度符合要求,并用该方法发现了小鼠高脂血症造模后血清中脂质成分的代谢物变化,为高脂血症的深入研究提供了有效手段,同时也能够为高脂血症发病机理及临床诊断、用药提供研究基础。
[1]张宁仔,李兰苏.实用心血管内科学手册[M].北京:人民军医出版社,1997:834-839.
[2]张沛然,郭改会.高脂血症的发病机制及分类[J].中国临床医生,2012,40(3):18-20.
[3]Chen H,Miao H,Feng YL,et al.Metabolomics in Dyslipidemia[J]. Adv Clin Chem,2014,66(10):101-119.
[4]楼大钧,朱麒钱,尤巧英,等.代谢综合征合并糖尿病患者血清磷脂脂肪酸谱与超敏C反应蛋白相关性研究[J].中华内分泌代谢杂志,2010,26(3):211-213.
[5]丁芳,王峰磊,杨波,等.高血压患者血清脂肪酸与血压的相关性研究[J].浙江预防医学,2015,27(6):551-555.
[6]Zhang YP,He CY,Qiu L,et al.Serum Unsaturated Free Fatty Acids:A Potential Biomarker Panel for Early-Stage Detection of Colorectal Cancer[J].J Cancer,2016,7(4):477-483.
[7]Kenwood BM,Merrill Jr.AH.Lipidomics[J].Ency Cell Biol,2016, 1(8):147-159.
[8]徐叔云,卞如濂,陈修.药理实验方法学[M].第3版.北京:人民卫生出版社,2002:200-210.
[9]Hyötyläinen T,Oresic M.Analytical Lipidomics in Metabolic and Clinical Research[J].Trends Endocrin Met,2015,26(12):671-673.
[10]陈耀祖,凃亚平.有机质谱原理及应用[M].北京:科学出版社,2000:23-25.
[11]Krawetz S.Bioinformatics for Systems Biology[M].New York:Humana Press,2009:581-599.
[12]Arranza IM,Mayoa R,Cormenzanaa MP,et al.Enhancing metabolomics research through data mining[J].J Proteomics,2015,127(8): 275-288.
[13]Wang M,Wang CY,Han RH,et al.Novel advances in shotgun lipidomics for biology and medicine[J].Prog Lipid Res,2016,61(1):83-108.
[14]Li N,Song YP,Tang HR,et al.Recent developments in sample preparation and data pre-treatment in metabonomics research[J]. Arch Biochem Biophys,2016,589(1):4-9.
[15]Quehenberger O,Armando AM,Brown AH,et al.Lipidomics reveals a remarkable diversity of lipids in human plasma[J].J Lipid Res,2010,51(11):3299-3305.
(收稿:2016-03-02 修回:2016-10-28)
(责任编辑 王 丰)
Serum Fatty Acids of Hyperlipidemia Mice Based on Lipidomics
LIU Pei-li,GUAN Xin,LI Nan,et al.Tianjin Institute of Pharmaceutical Science,Tianjin(300020),China
ObjectiveTo investigate the serum fatty acids composition and biomarkers in hyperlipidemia mice using high performance liquid chromatography(LC-Q-TOF-MS)technique.MethodsTotal 20 mice were randomly divided into normal control group and model group.Hyperlipidemia model was established after intragastric administration once a day,continuously intragastric administration at the end of 15 days.One hour after the last administration,the blood was taken from inner canthus.After centrifuge extraction,samples were assayed by LC-Q-TOF-MS technology in negative mode.Data were analyzed by partial least squares(PLS-DA)of two groups of serum fatty acids composition differences.ResultsCompared with the control group,serum TG (1.037±0.393 vs 0.810±0.412),TC(3.776±0.821 vs 3.002±0.648),HDL-C(2.282±0.544 vs 1.896±0.326)and LDL-C(0.405±0.148 vs 0.128±0.072)levels in model group were significantly higher.Analysis of the precision RSD was 9.25%.The results showed 16 potential biomarkers.ConclusionMetabolic characteristics of the serum fatty acids components in hyperlipidemia mice were studied by LC-Q-TOF-MS technology.It could distinguish the hyperlipidemia model group and the control group.It was an effective pathway to find unknown biological markers.
Hyperlipidemia;lipidomics;fatty acids;biological markers
Q95-33;R589.2
A
1007-6948(2017)01-0065-05
10.3969/j.issn.1007-6948.2017.01.018
1.天津市医药科学研究所(天津 300020)
2.天津市南开医院中西医结合急腹症研究所(天津300100)
刘佩莉,E-mail:lplyys@163.com
