作物抗旱基因研究进展及在马铃薯抗旱种质创新中的应用
2017-03-02王晓斌胡开明范阿琪赵锋张俊莲王蒂白江平
王晓斌,胡开明,范阿琪,赵锋,张俊莲,王蒂,白江平
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃省干旱生境作物学重点实验室,甘肃兰州730070;2.甘肃农业大学农学院,甘肃兰州730070;3.甘肃农业大学园艺学院,甘肃兰州730070)
作物抗旱基因研究进展及在马铃薯抗旱种质创新中的应用
王晓斌1,2,胡开明1,2,范阿琪1,2,赵锋1,2,张俊莲1,3,王蒂1,2,白江平1,2
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃省干旱生境作物学重点实验室,甘肃兰州730070;2.甘肃农业大学农学院,甘肃兰州730070;3.甘肃农业大学园艺学院,甘肃兰州730070)
整理并分析了近年来已经公开发表的68个抗旱相关基因,其中包括转录因子,以及提高渗透物质积累,具有解毒和抗氧化胁迫,控制作物生物大分子合成的基因,并对这些基因在作物抗旱中的作用机理及应用进展进行了分析。得出转录因子主要是通过激活或者抑制下游与干旱相关基因的表达,与渗透调节相关的基因主要是维持细胞内外渗透平衡,具有解毒和抗氧化胁迫的基因主要是通过清除活性氧的积累,与生物大分子合成有关的基因主要在逆境中可以产生一些逆境蛋白,从而提高作物耐逆性。同时整理并分析了利用基因工程改良马铃薯种质的发展现状与存在问题。
作物;抗旱基因;功能基因;马铃薯;种质
作物生长发育会受到各种生物胁迫与非生物胁迫的影响,生长发育受到抑制以及导致产量下降[1-2]。植物在长期进化过程中,产生了以适应或抵御生物与非生物胁迫对植物体所造成伤害的能力,如通过脯氨酸和可溶性糖含量积累来响应渗透性胁迫[1]。近年来,伴随着分子生物学和生物技术的发展,植物抗旱机制的研究也不断深入,已在水分代谢、物质代谢、渗透调节和活性氧清除等方面取得了一定成果。尤其是随着基因芯片和转录组学的发展,与植物干旱应答响应相关的基因已被大量发现,包括一些调控基因和可以提高渗透物质积累、增加生物大分子的合成、能够增强活性氧清除能力以及可以增强与植物抗旱有关酶合成的功能基因。
随着全球气温升高和降雨量的减少,要求作物品种必须适应干旱和高温的生长条件,选育具有良好抗旱能力的作物新品种已变得十分重要。作物抗旱品种选育一般有两条途径:一是通过传统育种方法选育;二是通过直接导入抗旱基因来提高抗旱性,进而选育抗旱品种。目前已经有大量与抗旱有关的信号分子、转录因子和功能基因已成功转入到植物中,并提高了植物的耐旱性。
马铃薯作为世界第四大作物,也是我国北方地区的主要栽培作物,近年来马铃薯的种植面积和区域有增加的趋势,但是主要集中在干旱和半干旱地区,而这些地区降雨量少,水资源短缺,蒸发量大,因此干旱已成为该区马铃薯生产的主要限制因素,所以加强马铃薯抗旱性研究、选育抗旱品种成为该区马铃薯研究的重要方向之一。
本文整理并分析了近年来已发表的并通过转化验证的可以提高植物抗旱性的功能基因以及转录因子,如提高渗透物质积累、具有解毒和抗氧化胁迫及控制植物生物大分子合成的功能基因等及其应用现状,为今后创制适于半干旱地区生产应用的马铃薯抗旱新材料和新品种选育提供科学依据。
1 植物抗旱有关基因的研究现状
根据Abraham Blum[3]的报道,目前已经在487种植物中发现了104个与植物抗旱有关的基因,而通过转化实验验证,在拟南芥和主要农作物中与抗旱有关的基因有68个(表1)。
在拟南芥中现已证实可以提高抗旱的基因有15种,其中绝大数是转录因子,属于功能基因的较少。水稻中可以增强抗旱能力的基因有14个,其中转录因子5个,其余为功能基因,Yuka Kitomi等[4]研究表明,干旱胁迫可诱导DRO1功能基因的表达,使得水稻根系伸长和根在地下的空间分布变大,也可诱导ZFP252[5]功能基因的表达,可以消除活性氧积累,使水稻抗旱性增强;小麦中与抗旱有关的基因有9个,其中4个为DREB类和NAC类转录因子,其余为功能基因;大麦中发现HvCBF4可以提高其抗旱能力[6];玉米中找到与植物抗旱有关的基因7个,ZmbZIP72[7]和ZmDREB2A[8]属于转录因子,其余为功能基因,主要与ABA途径有关;棉花中主要与抗旱有关的基因是DREB类转录因子和MPK(促分裂原蛋白激酶)类基因;大豆中可以提高其抗旱能力的基因主要是转录因子类和GST(谷胱甘肽S-转移酶)等功能基因;目前,在马铃薯中发现与抗旱有关的基因仅有SnRK2、WRKY1和DREB1,相对而言,花生、番茄、辣椒和西瓜等作物抗旱基因的发掘还比较少。

表1 拟南芥与主要农作物中与抗旱有关的基因Table 1 The drought tolerantgene in Arɑbidopsis thɑliɑnɑand crops
2 植物抗旱基因的分类与作用机理
根据抗旱基因在植物体中发挥的作用不同,可以将抗旱基因分为功能基因和调控基因,其中功能基因主要包括渗透调节基因、具有解毒和抗氧化胁迫的基因和生物大分子合成基因以及激活蛋白激酶活性的功能基因,调控基因包括MYC/MYB、DREB、WRKY、bZIP和NAC类调控因子。
2.1 植物抗旱基因的聚类分析
通过聚类分析可以推测未知基因的功能,为抗旱基因的挖掘以及抗旱品种的选育提供科学依据。Abraham Blum等[3]收集整理,目前已在拟南芥和主要作物中发现78个基因可以增强植物抗旱性,根据这些基因的作用机理,可将其分为两大类,即功能基因和调控基因,功能基因编码的蛋白质对逆境中的植物直接起保护作用,调控基因编码的蛋白质在信号传导途径和对逆境胁迫基因表达过程中起调控作用。利用MEGA5.05对68个调控基因和功能基因的编码序列分别进行聚类分析(图1,图2)。

图1 植物抗旱相关调控基因的聚类分析Fig.1 Cluster analysis of plant drought-tolerant related regulatory genes
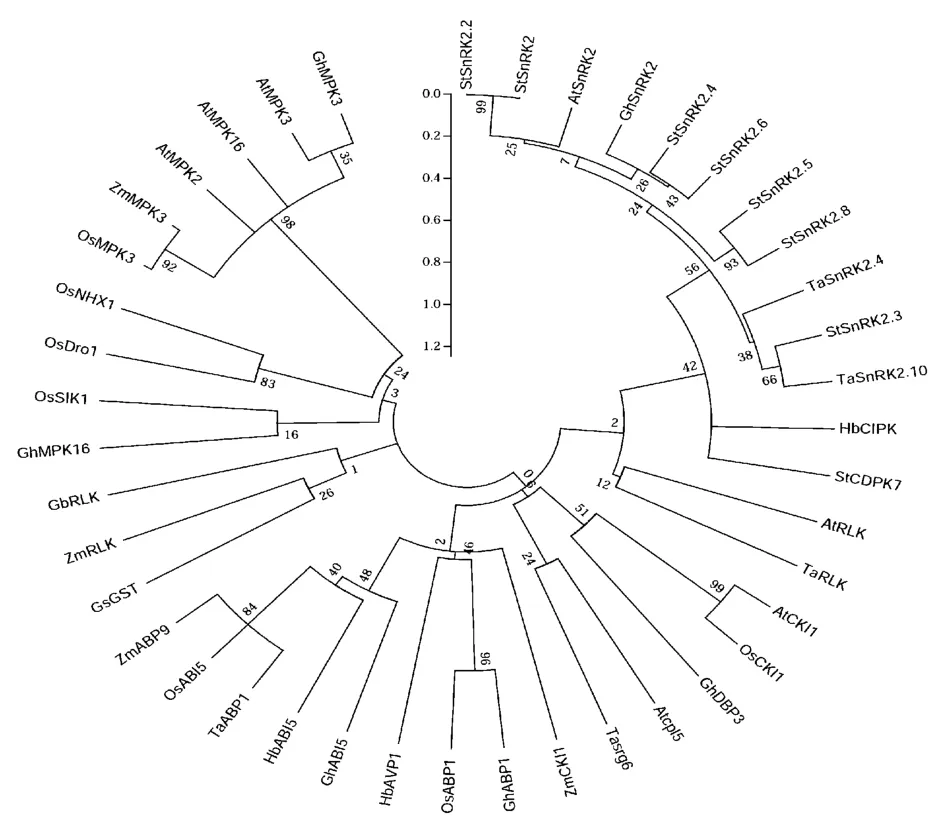
图2 与植物抗旱相关功能基因的聚类分析Fig.2 Cluster analysis of plant drought-tolerant function gene
聚类结果(图1)表明,这些调控基因可以聚为两大类(顺时针方向),第一大类调控基因主要是三大转录因子家族NAC、AP2/ERF和TFIIIA-type zinc finger和bZIP家族,其中AP2/ERF占绝大数。又可以分为4个小类,即AtNAC6到TɑNAC6;TɑDREB3到ZmCBF3;GmDREB2到TɑDREB3C;GhDREB3到StCBF3;以及OsNAC69、ZmbZIP72、OsWRKY11、Os-ZFP252、TɑDREB2和AtDREB3。其中,NAC家族属于ABA依赖型,主要控制气孔关闭,调节细胞膜内外渗透压相对平衡以及诱导生物大分子的合成;AP2/ERF家族主要调控气孔的关闭和脯氨酸含量的积累;TFIIIA-type zinc finger家族的调控基因主要是诱导脯氨酸和可溶性糖含量的积累;bZIP家族属于ABA依赖型,然而bZIP72和ZFP252属于bZIP家族的调控因子,ZFP252主要是通过调控脯氨酸和可溶性糖的积累来增强植物的抗旱能力。第二大类主要包括AREB、WRKY和MYB家族的调控基因,其功能主要是通过减少叶片的萎蔫和水分的丢失,以及增加气孔的密度和调节气孔的开闭提高植物的耐受性。
图2显示提高植物抗旱能力的功能基因可以聚为五大类(从顺时针方向看),即第一类StSnRK2.2到TɑRLK;第二类AtCKI1到Tɑsrg6;第三类ZmCKI1到ZmABP9;第四类GsGST到GbRLK;第五类GhMPK16到GhMPK3。第一类主要是拟南芥、马铃薯和棉花中的SnRK2家族基因,该家族的基因主要通过减少叶片水分散失,增加叶片的相对含水量,从而提升植物细胞对逆境的忍受能力;而该类中CDPK家族的基因主要是通过下游的调节途径,增加植物对冷、干旱的忍受能力;第二类主要是拟南芥、水稻、小麦和棉花中的可以提高抗旱能力的功能基因,可以被ABA和干旱所诱导;第三类主要是ABP和ABI5类基因,与bZIP调控因子有着密切联系。ABP(abscisic acid(ABA)-responsive element binding protein)主要是通过根系伸长和气孔关闭促进植物保水能力的提高,ABI5(ABA-insensitive 5)属于ABA非敏感性基因,在逆境胁迫中起到负调控作用;第四类主要是RLK(receptor-like protein kinases)和GST(glutathione S-transferase)二类基因,RLK主要是通过ABA途径减少植物体内水分丢失,从而增强植物的抗旱能力,GST通过激活谷胱甘肽S-转移酶的活性,促使植物根系的伸长和延缓生长发育来提高植物的耐受性;最后一类主要是MPK(mitogen-activated protein kinase)基因,通过增加抗氧化酶的活性,减少或清除活性氧的积累,增加脯氨酸含量和减少水分的丢失来增强植物的耐旱性。
2.2 植物抗旱基因的作用机理分析
植物受到干旱胁迫会诱导产生多种不良反应,如渗透压的改变,活性氧的积累,因此植物体必须迅速启动对这些不良反应的应答才能存活下来。根据徐立明,Yang[62]等的研究,植物对干旱胁迫应答主要是通过渗透调节、活性氧清除、生物大分子物质的合成以及新陈代谢的改变来实现(图3)。渗透调节主要是通过增加细胞溶质浓度,降低渗透势,保持膨压,维持细胞中的水分平衡和细胞各种生理活动的正常进行;干旱胁迫会引起植物细胞膜及内膜系统在结构和功能上发生显著改变,导致植物体内积累大量的活性氧,植物在长期进化过程中形成可以清除活性氧积累的小分子物质;植物生长在水分短缺的环境中,体内生物大分子蛋白合成和合成速率减少,体内原有的一些蛋白质的合成受到抑制,与此同时植物体会合成一些新蛋白质(即逆境诱导蛋白),如胚胎发育晚期丰富蛋白、水通道蛋白和渗调蛋白,逆境诱导蛋白对处于逆境中的植物起保护作用,可以提高植物耐逆境的能力;干旱胁迫对植物新陈代谢的影响主要是影响植物体的光合作用和气孔开闭和密度。

图3 干旱胁迫下的遗传路径Fig.3 A genetic pathway under drought stress
2.2.1 调控基因转录因子又称反式作用因子(Trans-acting factor)是指可以结合在某基因上游特异核苷酸序列上的蛋白质,从而调控基因转录。转录因子根据其表达特点的不同可以分为两种,一种是组成型转录因子,在任何时候都可以表达;另一种是诱导型转录因子,只有逆境胁迫才可诱导其表达,进而诱导其下游功能基因的表达。干旱胁迫可以诱导植物体内的组成型转录因子被磷酸化所激活,通过信号传导以及蛋白激酶磷酸化和去磷酸化的级联反应进而诱导下游基因的表达,提高植物的耐旱性。转录因子在植物干旱胁迫中发挥极其重要作用,植物体内含有大量的转录因子。目前研究发现可以响应并提高植物抗旱性相关的转录因子有MYC/MYB、DREB、WRKY、bZIP和NAC。
(1)MYB/MYC类转录因子
MYB/MYC类转录因子是植物转录因子中最大一个家族,是一类主要依赖于ABA调控系统的转录因子[63]。现已报道MYB/MYC能够广泛参与植物的多种反应,如植物的次生代谢、生长发育、细胞形态发生、植物生长的信号转导、生物和非生物胁迫应答,但MYB/MYC类转录因子与植物抗逆相关性研究较少。水稻MYB3R-2基因的表达可以增强拟南芥对于干旱的适应性[64],而拟南芥中的AtMYB60和AtMYB44[9]可以提高抗旱基因的表达,能够有效调节气孔的运动,减小气孔开放和水分散失。
(2)DREB类转录因子
DREB(dehydration response element block)类转录因子是AP2/ERF类基因家族中的一员,是一类对干旱起应答反应的结合蛋白,在干旱胁迫下可以调控多个与抗旱有关基因表达。对于DREB类转录因子研究最早的是Stockinger[65],他们从拟南芥的cDNA文库中分离得到可以编码DREB蛋白的CBF1和DREB1A。到目前为止对于DREB研究已深入到小麦、水稻、玉米、马铃薯等多种作物中,其中拟南芥的DREB1在水稻中超量表达可以增加水稻的抗旱能力;大豆的GmDREB2[17]在拟南芥中也可以得到表达,并且可以通过增加叶片中脯氨酸含量来增强植物对于干旱的适应性。拟南芥的DREB2A、棉花的GhDREB[19]可以在转基因小麦中表达并改善小麦对于逆境的适应;小麦中的TɑDREB2和TɑDREB3[16]可以避免逆境对植物的损害;玉米的ZmDREB2A[8]基因主要是通过控制与LEA合成有关基因来提高植物抗旱性。
(3)WRKY类转录因子
WRKY类转录因子是目前研究最多的一类转录因子,主要通过控制WRKY蛋白与启动子W-Box区域的特异性结合来调控基因表达,生物胁迫和非生物胁迫可以诱导WRKY类转录因子的表达调控,目前对于WRKY类转录因子的研究主要集中在对植物生长发育过程中调控以及在生物与非生物胁迫下的调控作用[66]。现已报道多个WRKY类转录因子参与了植物的抗旱响应,在水稻中热处理可以诱导OsWRKY11基因的过量表达使得水稻萎蔫的叶片慢慢变绿,可以减少叶片水分丢失,增强抗旱性,存活率提高[21];Luo等[67]将野生大豆中的GsWRKY20基因导入到拟南芥中,其主要是通过控制气孔的闭合和气孔的密度来提高植株对干旱的耐受性;Okay等[68]研究发现在小麦中存在着多个WRKY的基因,包括TɑWRKY16、Tɑ-WRKY17、TɑWRKY19-C、TɑWRKY24、TɑWRKY59、TɑWRKY61和TɑWRKY82,这些基因都与小麦抗旱等多种抗逆性有着密切联系。
(4)bZIP类转录因子
碱性亮氨酸拉链(basic region/leucine zippermotif,bZIP)类转录因子是目前研究最多的转录因子基因之一,在植物抗病、抗旱、抗寒和抗盐等发面发挥着重要的作用。Ying等[69]发现玉米的ZmbZIP72基因主要是通过减少叶片水分丢失,增加脯氨酸积累,减少渗透物质外渗以及增加植物在逆境下的存活率来提高拟南芥的抗旱性,同时在水稻中也发现bZIP72[70]可提高水稻干旱的耐受力;Gao等[71]研究发现大豆GmbZIP1基因可以提高大豆的抗旱性,主要是通过控制ABA和气孔的开闭来实现。
(5)NAC类转录因子
NAC类转录因子是植物所特有的一类转录因子,在植物生长发育、侧根和分生组织形成,激素调节和抵抗逆境胁迫等方面发挥着重要作用。现已研究表明,NAC类转录因子参与干旱、高盐应答基因表达,在植物抗旱、高盐等非生物胁迫中发挥重要作用[72]。目前已报道在水稻中含有3个与抗旱相关的基因OsNAC6/SNAC2[5]和ONAC045[73];Xue等[31]证实TɑNAC69基因可以增加小麦的抗旱性。
2.2.2 功能基因植物在受到逆境胁迫时通过诱导一些可以改变细胞内外渗透压,清除活性氧积累以及合成一些可以提高植物抗旱能力的生物大分子功能基因的表达以及激活蛋白激酶基因的表达。
(1)渗透调节相关基因
植物体在受到干旱胁迫时,可诱导渗透调节相关基因的表达,参与植物主要渗透调节物质脯氨酸、可溶性糖、甜菜碱和甘露醇含量的增加。
①脯氨酸合成酶相关基因
植物长期处于干旱胁迫环境中,会引起体内脯氨酸含量的增加。脯氨酸含量的积累不仅对植物质膜起到保护性作用,而且脯氨酸的偶极性可以保护膜蛋白结构的完整性,从而减少植物体内水分丢失。截至当前发现能够增加脯氨酸含量的基因包括P5CS[74]、hrf1[44]、以及MtCɑMP1[75],它们具有相似的功能,都能够在干旱胁迫下促进脯氨酸的积累,从而达到抗旱目的。
②可溶性糖合成酶相关基因
植物处于干旱胁迫时,体内可溶性糖含量会大量积累。可溶性糖的积累可以降低细胞的渗透势,对细胞内酶活性起到一定保护作用。AtCBF4是促进植物体内可溶性糖含量积累和增强植物抗旱性的主要基因。AtCBF4是在拟南芥中发现,并将其成功地转入到大豆中,发现大豆植株在受到干旱胁迫时细胞中可溶性糖含量明显增加[76];何美敬等[77]在花生中研究发现AhSuSy(蔗糖合酶)可以增加根中的蔗糖含量,从而能够增强植物的抗旱性。
③甜菜碱合成相关基因
甜菜碱作为一种小分子渗透物质,植物处于干旱胁迫时,植物体内甜菜碱会出现大量积累,甜菜碱积累有助于保持细胞内外渗透势平衡,同时甜菜碱大量积累也有助于蛋白质四级结构的稳定。甜菜碱生物合成受到胆碱单加氧酶和甜菜碱醛脱氢酶活性的影响,因此对于生物体内控制渗透物质甜菜碱含量的基因,一般是通过控制这两种酶的活性来控制甜菜碱积累。现已研究表明,控制这两种酶活性的基因有CMO基因和BADH基因。Luo D等[78]发现水稻中含有CMO和BADH基因。目前对于甜菜碱醛脱氢酶的研究虽有相关报道,但主要集中于对耐盐性的研究,对抗旱机理的研究相对较少。
④甘露醇合成有关基因
与甘露醇生物合成相关基因1-磷酸甘露醇脱氢酶(mtl D)来源于烟草。Abebe等研究发现转入mtl D基因的小麦植株与野生型的小麦相比体内甘露醇的含量明显增加,并且对干旱和耐盐性的耐受力明显增强。
(2)具有解毒和抗氧化胁迫的基因
干旱胁迫对植物影响是多方面的,其中氧化损伤是很重要的一个负面影响。研究发现,植物受到干旱胁迫时植物体内活性氧(reactive oxygen species,ROS)会出现积累的情况,比如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等大量的积累,能够有效抵抗氧化损伤所引起的伤害。现已证实可以清除活性氧以避免或减轻对植物损害的基因包括ABP9[53]、GbMPK3[79]以及ZFP245(锌指蛋白245)[80]。ABP9是在玉米中发现在拟南芥中得到表达,ABP9可以对活性氧积累起到一定的清除作用,从而减少活性氧的积累;GbMPK3是在烟草中发现的促分裂原蛋白激酶,可以增加抗氧化酶的活性,从而可以减少活性氧的积累;ZFP245(锌指蛋白245)可以清除活性氧的积累,从而增强植物对干旱的忍受能力。
(3)生物大分子合成相关基因
植物对干旱胁迫响应主要通过一些蛋白质的含量变化来适应,这些蛋白质主要包括胚胎发育晚期丰富蛋白(Late embryogenesis abundant protein,LEA)、水通道蛋白(Aquaporin,AQP)和渗调蛋白(OSM),这些蛋白质在植物抗逆生理中发挥着极其重要作用。
胚胎发育晚期丰富蛋白(LEA)与植物抗旱关系最为密切,主要在植物胚胎发育后期产生,并随着种子成熟其含量逐渐增加。植物在干旱和渗透胁迫条件下,胚胎发育晚期丰富蛋白得以丰富表达,可以增强植物的抗旱性。
水通道蛋白(AQP)是植物体内一系列分子量为26~34 kD、具有强选择性和能够高效转运水分子的膜蛋白,也是一种对胁迫起保护作用的膜蛋白。
渗调蛋白(OSM)属于一种阳离子蛋白,最早是在烟草悬浮细胞中获得,随后在番茄和马铃薯等茄科类作物中发现,其在生物胁迫和非生物胁迫下都可以诱导与渗调蛋白相关基因的表达。
(4)蛋白激酶
蛋白激酶在逆境胁迫下主要激活不同的磷酸化途径介导外界环境信号感知和传递,调控下游基因表达,启动相应生理生化过程来提高植物耐受性。截至目前,参与植物逆境胁迫相关的蛋白激酶主要有GUDK(Growth under drought kinase)、MAPK(Mitogen-activated protein kinase)、RLK(Receptor-like kinase)、CDPK(Calcium and calmodulin-dependent protein kinase dependent和SnRK(Sucrose non-fermenting-1-related protein kinase)五类。
①受体类胞质激酶
受体类胞质激酶是一类受干旱诱导的蛋白激酶,Niu等[81]研究发现GUDK主要通过磷酸化来激活Os-AP37基因的表达,提高水稻的耐旱性,实现了在干旱条件下水稻产量的提高。
②促分裂素原活化蛋白激酶
MAPK是蛋白激酶中的一个大家族,属于丝氨酸/苏氨酸蛋白激酶。MAPK家族包括分裂素原活化蛋白激酶(MAPK)、分裂原激活蛋白激酶激酶(MAPK kinase,MAPKK)和分裂原激活蛋白激酶激酶激酶(MAPK kinase,MAPKKK)。Xiong等[82]研究发现水稻中OsMAPK5蛋白激酶能够正向调节逆境的耐受性。
③受体蛋白激酶
受体蛋白激酶是一类跨膜蛋白激酶,在非生物胁迫和植物的生长、发育过程中发挥着极其重要作用。根据Chen等[83]的研究结果水稻的OsSIK2受体蛋白激酶可以明显增强转基因株系抗旱能力;Yang L等[84]研究证实大豆GsCBRLK主要是通过诱导蛋白表达水平或激活蛋白酶活性来提高植物的耐受性,Yang等从野生大豆中筛选出新的受体蛋白激酶GsLRPK,将其成功地导入到拟南芥中并证实拟南芥的抗旱力明显提高,Sun X等[85]也得到同样的结果。
④钙依赖而钙调素不依赖的蛋白激酶
钙依赖而钙调素不依赖的蛋白激酶参与植物非生物胁迫应答调控过程主要是通过磷酸化激活或者抑制下游蛋白活性。Zou J J等[86]研究发现干旱胁迫能够诱导拟南芥AtCPK8的过量表达,过表达AtCPK8转基因株系与野生型相比具有更强的耐旱能力;Wei S等[87]研究发现水稻中过表达OsCPK9主要是通过促进气孔关闭提高水稻的抗旱性。
⑤蔗糖非酵解蛋白激酶
植物SnRK参与调控干旱、高盐、低温、疾病和碳代谢过程。Umezawa等[40]研究发现转基因拟南芥SnRK与野生型相比抗旱性明显增强;Wang等[49]研究发现TɑSnRK2.10过表达可以提高小麦的耐受性,主要是通过减少植物水分的丢失,提高小麦在干旱条件下的产量;Babatunde Bello[58]研究发现SnRK2过表达可以增强棉花的耐旱性,主要是通过减少水分流失,调节膨压,提高相对含水量实现的;可以提高植物的耐逆性已经被Mao等[61]在马铃薯研究中得以证实。
3 马铃薯抗旱相关基因的挖掘与利用前景
马铃薯是一种典型的温带气候性作物,其对干旱胁迫反映十分敏感,因此干旱是影响马铃薯产量和品质的主要环境因子,随着分子生物学和现代生物技术的快速发展,国内外研究者对马铃薯抗旱性研究也越来越多,主要是利用现代生物技术手段以及利用基因芯片技术和转录组学来提高马铃薯的抗旱性。
根据现有的研究结果,可以增强马铃薯抗旱能力的基因主要分为调控基因和功能基因两大类。第一类调控基因包括:(1)MYB类转录因子MYB1R-1[88],利用反向Northern杂交分析证实StMYB1R-1过表达可以提高马铃薯的抗旱能力,但是对其它农艺性状没有显著的影响;(2)DREB类转录因子DREB1A、DREB1B[89],过表达DREB1的甜马铃薯与野生型相比根明显伸长,抗旱性有显著地提高,主要是干旱胁迫诱导DREB1基因的表达促使马铃薯根系伸长;利用PCR方法成功从拟南芥中克隆获得了转录因子DREB1A[89]基因以及诱导性启动子rd29A,通过DNA重组技术构建载体并通过农杆菌介导法对马铃薯进行遗传转化,结果表明转入DREB1A基因的马铃薯品种“陇薯10号”的抗旱性明显增强;以烟草花叶病毒35S作为启动子并通过农杆菌介导法对马铃薯进行遗传转化,过表达的DREB1B[90]马铃薯与野生型相比抗旱抗寒性明显增强,主要是与增加了脯氨酸的含量以及减少了马铃薯体内的水分丢失、提高相对含水量有关;(3)NAC类转录因子NAC2[91],StNAC2基因在马铃薯叶、茎、块茎、花和根均有表达,NAC2不仅可以被创伤、盐和干旱所诱导,而且也可以被马铃薯晚疫病致病因子所诱导。
第二类功能基因包括:(1)渗透调节相关基因脯氨酸合成基因P5CS(二氢吡咯-5-羧化物合成酶)[92],利用农杆菌介导法对“东农303”马铃薯微型薯进行遗传转化,与野生型马铃薯微型薯相比脯氨酸含量有显著提高,抗旱和抗盐能力有明显提高;甜菜碱合成基因BADH[93-94],通过根癌农杆菌介导法将甜菜碱醛脱氢酶(BADH)基因导入马铃薯栽培品种“甘农薯2号”中,经PCR、Southern和Northern杂交证明BADH基因已整合到马铃薯基因组中并在转基因植株中转录和表达,与野生型相比马铃薯栽培种“甘农薯2号”相比BADH酶活性显著提高;(2)蛋白激酶MIPS1(肌醇-1-磷酸合酶)[95],MIPS1是肌醇生物合成的限速酶,通过实时定量PCR表明过表达的MIPS1提高了甜马铃薯的抗旱能力;利用PCR和DNA重组技术,克隆AtCDPK1[96],构建载体,利用农杆菌介导法进行遗传转化马铃薯微型薯‘费乌瑞它’,通过RT-PCR分析证实,该基因在‘费乌瑞它’的植株中均可以正常表达;毛娟等[73]通过实验证实SnRK2在不同的处理和不同的马铃薯品种中的表达是有差异的。
如上所述,截至目前提高马铃薯抗旱能力的基因主要集中在DREB类的转录因子、渗透调节相关基因和蛋白激酶这些植物内部分子机制的研究上,而干旱对植物形态的影响研究较少,尤其是对根系的研究。根系是植物吸收水分、营养的直接器官,其发达与否对提高植物耐旱性有至关重要的作用,因此加强植物根系的研究对于提高植物的抗旱能力有极其重要的作用。同时,马铃薯是以收获块茎为主的农作物,培育具有发达根系的马铃薯新品种是提高马铃薯产量的前提。根据现有的研究结果(表1)干旱胁迫下可以使植物根系伸长的基因有HARDY[4]、ATHB6[44]和Dro1[53],拟南芥HARDY基因在水稻中过表达后通过根系体积的变大和根系数量的增多,增强转基因水稻对干旱和高盐胁迫的抗性,使转基因植株水分利用效率提高、光合作用增加和蒸腾减弱;ATHB6在根中主要是通过控制主根和侧根的细胞分裂来增强植物抗旱能力,转入ATHB6基因的拟南芥与野生型相比耐受性明显增强;Dro1的过表达可使水稻根系发达和根系空间结构变大,有利于水稻吸收更多的水分,转入Dro1基因的水稻与野生型相比抗旱能力明显增强。
马铃薯是一种主要以收获块茎为主的作物,因此选育根系发达的马铃薯品系是培育高产马铃薯品种的首要条件,HARDY、ATHB6和Dro1功能基因在改变植物根系的长度、数量、空间结构和根系发达程度方面有着重要的作用,其在马铃薯中的功能值得进一步研究,为培育具有发达根系和抗旱能力的马铃薯新品种提供有效途径。植物耐旱性机理的深入研究和基因资源将为马铃薯抗旱育种与种质创新提供新的支撑点,相信不久的将来会有大量的抗旱基因将应用到马铃薯生产实践中。
[1]王尊欣,张树珍.作物抗旱性及抗旱育种研究进展[J].作物杂志,2014,(2):26-32.
[2]程媛媛,苏孝良.植物抗旱机制研究进展[J].贵州师范大学学报(自然科学版),2014,12(2):113-120.
[3]Blum A.Genomics for drought resistance-getting down to earth[J].Functional Plant Biology,2014,41(10):1191-1198.
[4]Kitomi Y,Kanno.N QTLs underlying natural variation of root growth angle among rice cultivarswith the same functional allele of DEEPER ROOTING 1[J].Rice,2015,8(1):8-16.
[5]Xu D Q,Huang J.Overexpression of a TFIIIA-type zinc finger protein gene ZFP252 enhances drought and salt tolerance in rice(Oryzɑ sɑtivɑL.)[J].FEBSLetters,2008,582(7):1037-1043.
[6]Louren T,Saibo N,Oliveira M M,et al.Inducible and constitutive expression of HvCBF4 in rice leads to differential gene expression and drought tolerance[J].Biologia Plantarum,2011,55(4):653-663.
[7]Ying S,Zhang D F,Li Y,et al.Cloning and characterization of a maize bZIP transcription factor,ZmbZIP72,confers drought and salt tolerance in transgenic[J].Arabidopsis Planta,2012,235(2):253-266.
[8]Qin F,Kakimoto M,Kazuko Y S,et al.Regulation and functional analysis of ZmDREB2A in response to droughtand heat stresses in Zeɑ mɑys[J].The Plant Journal,2007,50(1):54-69.
[9]Jung C,Shim JS.Non-specific phytohormonal induction of AtMYB44 and suppression of jasmonate-responsive gene activation in arabidopsis thaliana[J].Mol.Cells,2010,29(1):71-76.
[10]Hemm M R,Herrmann K,Chapple C,etal.AtMYB4:a transcription factor general in the battle against UV[J].Plant Science,6(4):135-136.
[11]Yu L,H X,Li L,et al.AtMYB2 transcription factor can interact with the CMO promoter and regulate its downstream gene expression[J].Biotechnology Letters,2012,34(9):1749-1755.
[12]Dai X Y,Xu Y Y,Chong K,et al.Overexpression of an R1R2R3 MYB gene,OsMYB3R-2,increases tolerance to freezing,drought,and salt stress in transgenic arabidopsis[J].Plant Physiology,2007,143(4):1739-1751.
[13]Amanda PR,Josirley FC,Alexandre LN,et al.Phenotyping soybean plants transformed with rd29A:AtDREB1A for drought tolerance in the greenhouse and field[J].Transgenic Res,2014,23(1):75-87.
[14]Yoshida T,Sakuma Y,Yamaguchi-Shinozaki K,et al.Functional analysis ofan Arabidopsisheat-shock transcription factor HsfA3 in the transcriptional cascade downstream of the REB2A stress-regulatory system[J].Biochemical and Biophysical Research Communications,2008,368:515-521.
[15]Joseph G,Dubouzet,Sakuma Y.OsDREB genes in rice,OryzɑsɑtivɑL.,encode transcription activators that function in drought-,high-salt-and cold-responsive gene expression[J].The Plant Journal,2003,33(4):751-763.
[16]Morran S,OmidEini.Improvement of stress tolerance of wheat and barley bymodulation of expression of DREB/CBF factors[J].Plant Biotechnology Journal,2011,9(2):230-249.
[17]Chen M,Wang Q Y,Cheng X G,et al.GmDREB2,a soybean DRE-binding transcription factor,conferred drought and high-salt tolerance in transgenic plants[J].Biochemical and Biophysical Research Communications,2007,353(2):299-305.
[18]Chen M,Xu Z,Ma Y J,et al.Cold-induced modulation and functional analyses of the DRE-binding transcription factor gene,Gm-DREB3,in soybean(Glycinemɑx L.)[J].Journal of Experimental Botany,2009,60(1):121-135.
[19]Gao SQ,Chen M,Xia LQ,et al.A cotton(Gossypium hirsutum)DRE-binding transcription factor gene,GhDREB,confersenhanced tolerance to drought,high salt,and freezing stresses in transgenic wheat[J].Plant Cell Rep,2009,28(2):301-311.
[20]Bihani P,Char B,Bhargava S.et al.Transgenic expression of sorghum DREB2 in rice improves tolerance and yield underwater limitation[J].The Journal of Agricultural Science,2011,149(1):95-101.
[21]Kim Y,Yang K S,Sun H R,et al.Molecular characterization of a cDNA encoding DR EB-binding transcription factor from dehydration treated fibrous root s of sweet potato[J].Plant Physiology and Biochemistry,2007,46:196-204.
[22]Tian Z,He Q,Xie C,et al.The potato ERF transcription factor StERF3 negatively regulates resistance to phytophthora infestans and salt tolerance in potato[J].Plantand Cell Physiology,2015,56(5):992-1005.
[23]Luo X,Bai X.Expression ofwild soybean WRKY20 in Arabidopsis enhances drought tolerance and regulates ABA signaling[J].Journal of Experimental Botany,2013,66(8):2155-2169.
[24]Jin H X,Xu GL,Deyue,etal.GmNAC5,a NAC transcription factor,is a transient response regulator induced by abiotic stress in soybean[J].ScientificWorld Journal,2013,2013:768972.
[25]Moon S J,Han S Y,Byun M O,et al.Ectopic expression ofCɑWRKY1,a pepper transcription factor,enhances drought tolerance in transgenic potato plants[J].Journal of Plant Biology,2014,57(3):198-207.
[26]Yoshida T,Fujita Y.AREB1,AREB2,and ABF3 aremaster transcription factors that cooperatively regulate ABRE-dependent ABA signaling involved in drought stress tolerance and require ABA for full activation[J].The Plant Journal,2010,61(4):672-685.
[27]Xiang Y,Tang N.Characterization of OsbZIP23 as a key player of the basic leucine zipper transcription factor family for conferring abscisic acid sensitivity and salinity and drought tolerance in rice[J].Plant Physiology,2008,148(4):1938-1952.
[28]Song SH,Chen Y,Chen J,etal.Physiologicalmechanisms underlying OsNAC5-dependent tolerance of rice plants to abiotic stress[J].Planta,2011,234:331-345.
[29]Tang YM,Liu M Y,Chen X P,etal.Molecular characterization of novel TɑNAC genes in wheat and overexpression of TaNAC2a confers drought tolerance in tobacco[J].Physiologia Plantarum,2012,144(2):210-224.
[30]Xuea G P,Heather M,Wa ya,et al.Overexpression of TɑNAC69 leads to enhanced transcript levels of stress up-regulated genes and dehydration tolerance in bread wheat[J].Molecular Plant,2011,4(4):1-16.
[31]Lu M,Ying S,Li Y,et al.A maize stress-responsive NAC transcription factor,ZmSNAC1,confers enhanced tolerance to dehydration in transgenic Arɑbidopsis[J].Plant Cell Reports,2012,31(9):1701-1711.
[32]Reis P A,Fontes E P.N-rich protein(NRP)-mediated cell death signaling:a new branch of the ER stress response with implications for plant biotechnology[J].Plant Signaling and Behavior,2012,7(6):628-632.
[33]Meng CM,Cai C P,Wang Z,et al.Characterization of six novel NAC genesand their responses to abiotic stresses in Gossypium hirsutum L[J].Plant Science,2009,176(3):352-359.
[34]Jin YM,Jung JW.AtCPL5,a novel Ser-2-specific RNA polymerase IIC-terminal domain phosphatase,positively regulates ABA and drought responses in Arabidopsis[J].New Phytologist,2011,190:57-74.
[35]Zhou B,Zhao X,L Y H,et al.Transient expression of a foreign geneby direct incorporation of DNA into intact plant tissue through vacuum infiltration[J].Biotechnology Letters,2009,31(11):1811-1815.
[36]Umezawa T,Sugiyama N,Shinozaki K,etal.Geneticsand phosphoproteomics reveal a protein phosphorylation network in the abscisic acid signaling pathway in Arɑbidopsis thɑliɑnɑ[J].Science Signaling,2013,6(270):1-8.
[37]Karaba A,DixitS.Improvementofwater useefficiency in riceby expression of HARDY,an Arabidopsis drought and salt tolerance gene[J].PNAS,2007,104(39):15270-15275.
[38]Söderman E,Hjellstrom M,Engström P,et al.The HD-Zip gene ATHB6 in Arabidopsis is expressed in developing leaves,roots and carpels and up-regulated bywater deficit conditions[J].PlantMolecular Biology,1999,40(6):1073-1083.
[39]Szekely G,Abraham E,Szabados L,et al.Duplicated P5CS genes of Arɑbidopsis play distinct roles in stress regulation and developmental control of proline biosynthesis[J].The Plant Journal,2008,53(1):1-28.
[40]Umezawa A,Yoshida R,Shinozaki K,etal.SRK2C,a SNF1-related protein kinase2,improves drought tolerance by controlling stress-responsive gene expression in Arɑbidopsis thɑliɑnɑ[J].PNAS,101(49):17306-17311.
[41]Ouyang SQ,Liu Y F,Liu P,et al.Receptor-like kinase OsSIK1 improves drought and salt stress tolerance in rice(Oryzɑsɑtivɑ)plants[J].The Plant Journal,2010,62(2):316-329.
[42]Zhang SW,Li CH.Altered architecture and enhanced drought tolerance in rice via the down-regulation of Indole-3-Acetic Acid by TLD1/OsGH3.13 Activation[J].Plant Physiology,2009,(151):1889-1901.
[43]Park G,Park J J.A RING finger E3 ligase gene,Oryza sativa delayed seed germination 1(OsDSG1),controls seed germination and stress responses in rice[J].Plant MolBiol,2010,74(4):467-478.
[44]Zhang L,Xiao SS.Overexpression of a Harpin-encoding gene hrf1 in rice enhances drought tolerance[J].Journal of Experimental Botany,2011,62(12):1-10.
[45]Huang X Y,Chao D Y.A previously unknown zinc finger protein,DST,regulates droughtand salt tolerance in rice via stomatal aperture control[J].Genes Dev,2009,23(15):1805-1817.
[46]Shen H S,Liu C T,Wang X P,et al.OsWRKY30 is activated by MAP kinases to confer drought tolerance in rice[J].Plant Molecular Biology,2012,80(3):241-253.
[47]Xiang Y,Huang Y M.Characterization of stress-responsive CIPK genes in rice for stress tolerance improvement[J].Plant Physiology,2007,144(3):1416-1428.
[48]Mao X G,Zhang H Y.TaSnRK2.4,an SNF1-type serine/threonine protein kinase of wheat(Triticumɑestivum L.),confers enhancedmultistress tolerance in Arɑbidopsis[J].Journalof Experimental Botany,2010,61(3):683-696.
[49]王倩,毛新国,昌小平,等.小麦TɑSnRK2.10的多态性及与农艺性状的关联[J].中国农业科学,2014,47(10):1865-1877.
[50]Zhou SY,HuW,He G Y,etal.Overexpression of thewheataquaporin gene,TɑAQP7,enhances drought tolerance in transgenic tobacco[J].PlosOne,2012,7(12):e52439,
[51]Tong SM,Ni Z F.Ectopic overexpression of wheat TɑSrg6 gene confers water stress tolerance in Arabidopsis[J].Plant Science,2007,172(6):1079-1086.
[52]Zhou H B,Li S F,Zhang X Q,et al.Molecular analysis of three new receptor-like kinase genes from hexaploid wheatand evidence for their participation in the wheat hypersensitive response to stripe rust fungus infection[J].The Plant Journal,2007,52(3):420-434.
[53]Zhang X,Wang L,Zhao J,etal.Maize ABP9 enhances tolerance to multiple stresses in transgenic arabidopsis bymodulating ABA signaling and cellular levelsof reactive oxygen species[J].PlantMol Biol,2011,75(5):365-378.
[54]Liu L X,Hu X L,LiDQ,etal.Over-expression ofa Zeɑmɑys L.protein phosphatase 2C gene(ZmPP2C)in Arɑbidopsis thɑliɑnɑdecreases tolerance to saltand drought[J].Journal of Plant Physiology,2009,166(5):531-542.
[55]Huai JL,Wang M,Wang G Y,et al.Cloning and characterization of the SnRK2 gene family from Zeɑmɑys[J].PlantCell Rep,2008,27(12):1861-1868.
[56]Wang JX,Ding H D,Jiang M Y,et al.A novelmitogen-activated protein kinase gene inmaize(Zeɑmɑys),ZmMPK3,is involved in response to diverse environmental cues[J].Journal of Integrative Plant Biology,2010,52(5):442-452.
[57]JiW,Zhu Y M,Li Y,et al.Over-expression of a glutathione S-transferase gene,GsGST,from wild soybean(Glycine sojɑ)enhances drought and salt tolerance in transgenic tobacco[J].Biotechnol Lett,2010,32(8):1173-1179.
[58]Zhang L,Xi D M,Li SW,et al.A cotton group CMAP kinase gene,GhMPK2,positively regulates saltand drought tolerance in tobacco[J].PlantMol Biol,2011,77(2):17-31.
[59]Shi J,Zhang L,An H L,et al.GhMPK16,a novel stress-responsive group DMAPK gene from cotton,is involved in disease resistance and drought sensitivity[J].BMCMolecular Biology,2011,12(22):22-28.
[60]Bello B,Zhang X Y,Li FG,et al.Cloning of gossypium hirsutum sucrose non-fermenting 1-related protein kinase 2 Gene(GhSnRK2)and itsoverexpression in transgenic Arɑbidopsis escalates drought and low temperature toleranc[J].PLoSONE,2014,9(11):e112269.
[61]毛娟,白江平,张俊莲,等.水分胁迫下马铃薯SnRK2基因的表达模式与生理响应[J].中国沙漠,2014,34(2):481-487.
[62]Yang S J,Barbara,Huang Y F,et al.Norrowing down the targets:towards successful genetic engineering of drought-tolerant crops[J].Molecular Plant,2010,3(2):469-490.
[63]唐益苗,赵昌平,高世庆,等.植物抗旱相关基因研究进展[J].麦类作物学报,2009,29(1):166-173.
[64]Dai X Y,Xu Y Y,Chong K,et al.Overexpression of an R1R2R3 MYB gene,OsMYB3R-2,increases tolerance to freezing,drought,and salt stress in transgenic Arɑbidopsis[J].Plant Physiology,2007,143(2):1739-1751.
[65]Stockinger E J,Gilmour S J,Thomashow M F,et al.Arɑbidopsis thɑliɑnɑCBF1 encodesan AP2 domain-containing transcriptionalactivator thatbinds to the C-repeat/DRE,a cis acting temperature:differences and cross talk between two tress signaling pathways[J].Current Opinion Plant Biology,3(3):217-223.
[66]李岢,周春江.植物WRKY转录因子的研究进展[J].植物生理学报,2014,50(9):1329-1335.
[67]Luo X,BaiX,Hu M,etal.Expression ofwild soybeanWRKY20 in Arɑbidopsis enhances drought tolerance and regulates ABA signaling[J].JExp Bot,2013,64(8):2155-2169.
[68]Okay S,Derelli E,Unver T,etal.Transcriptome-wide identification of bread wheat WRKY transcription factors in response to drought stress[J].Molecular genetics and genomics,2014,5(289):765-781.
[69]Ying H,Zhang D F,Li Y,et al.Cloning and characterization of a maize bZIP transcription factor,ZmbZIP72,confers drought and salt tolerance in transgenic Arɑbidopsis[J].Planta,2012,235(2):253-266.
[70]Lu G J,Gao C X,Han B,et al.Identification of OsbZIP72 as a positive regulator of ABA response and drought tolerance in rice[J].Planta,2009,229(3):605-615.
[71]Gao SQ,Chen M,Ma Y Z,etal.The soybean GmbZIP1 transcription factor enhances multiple abiotic stress tolerances in transgenic plants[J].PlantMolBiol,2011,75(6):537-553.
[72]孙利军,李大勇,宋凤鸣,等.NAC转录因子在植物抗病和抗非生物胁迫反应中的作用[J].遗传,2012,34(8):993-1002.
[73]Zheng X N,Chen B,Han B,et al.Overexpression of a NAC transcription factor enhances rice drought and salt tolerance[J].Biochemical and Biophysical Research Communications,2009,379(4):985-989.
[74]Gyongyi Szekely,Edit Abraham,Agnes Cseplo,et al.Duplicated P5CS genes of arabidopsis play distinct roles in stress regulation and developmental control of proline biosynthesis[J].The Plant Journal,2008,53(1):11-28.
[75]Wang TZ,Zhang JL,ZhangW H,etal.Amedicago truncatula EF-hand family gene,MtCɑMP1,is involved in droughtand salt stress tolerance[J].PLOSONE,2013,8(5):1-9.
[76]王兴宇,魏崃,王伟威,等.转AtCBF4基因大豆株系的抗旱性评价[J].大豆科学,2014,33(3):365-370.
[77]何美敬,刘立峰,穆国俊,等.花生蔗糖合酶基因AhSuSy的克隆和干旱胁迫表达分析[J].作物学报,2012,38(12):2139-2146.
[78]Luo D,Niu X,Yu J,et al.Rice cholinemonooxygenase(OsCMO)protein functions in enhancing glycine betaine biosynthesis in transgenic tobacco but does not accumulate in rice(OryzɑsɑtivɑL.ssp.japonica)[J].Plant Cell Rep,2012,31(9):1625-1635.
[79]Long L,GaoW,Zhu L F,etal.GbMPK3,amitogen-activated protein kinase from cotton,enhances drought and oxidative stress tolerance in tobacco[J].Plant Cell Tiss Organ Cult,2014,116(2):153-162.
[80]Huang J,Sun SJ,Juan H,etal.Tang Increased toleranceof rice to cold,droughtand oxidative stressesmediated by the overexpression of a gene that encodes the zinc finger protein ZFP245[J].Biochemical and Biophysical Research Communications,2009,389(3):556-561.
[81]Niu N N,Liang X Q,Yang X J,et al.EAT1 promotes tapetal cell death by regulating aspartic proteases duringmale reproductive development in rice[J].Nat Commun,2012,4:1445.
[82]Xiong LZ,Yang Y N.Disease resistance and abiotic stress tolerance in rice are inverselymodulated by an abscisic acid-induciblemitogenactivated protein kinase[J].The Plant Cell,2003,15(3):745-759.
[83]Chen L J,Wu R Y,Zhang Y Q,et al.An s-domain receptor-like kinase,OsSIK2,confersabiotic stress toleranceand delaysdark-Induced leaf senescence in rice[J].Plant Physiology,2013,163(4):1752-1765.
[84]Yang L,Wu K C,Wu Z J,et al.GsLRPK,a novel cold-activated leucine-rich repeat receptor-like protein kinase from Glycinesojɑ,isa positive regulator to cold stress tolerance[J].Plant Science,2014,215/216:19-28.
[85]Sun X,Ang S,Sun M,et al.A novel Glycine soja cysteine proteinase inhibitor GsCPI14,interacting with the calcium/calmodulinbinding receptor-like kinase GsCBRLK,regulated plant tolerance to alkali stress[J].Plant Mol Biol,2014,85(1/2):33-48.
[86]Zou JJ,Li X D,Wu W H,et al.Arɑbidopsis calcium-dependentprotein KINASE8 and CATALASE3 function in abscisic acid-mediated signaling and H2O2homeostasis in stomatal guard cells under drought stress[J].Plant Cell,2015,27(3):1445-1460.
[87]Wei S,Hu W,Zhou S,et al.A rice calcium-dependent protein kinase OsCPK9 positively regulates drought stress tolerance and spikelet fertility[J].BMC Plant Biol,2014,14(1):133-146.
[88]Shin D JMoon SJ,Kim BG,et al.Expression of StMYB1R-1,a novel potato single MYB-Like domain transcription factor increases drought tolerance[J].Plant Physiology,2011,155(1):421-432.
[89]贾小霞,恩芳,胡新元,等.转录因子DREB1A基因和Bɑr基因双价植物表达载体的构建及对马铃薯遗传转化的研究[J].草业学报,2015,23(3):110-117.
[90]Movahedi S,SayedTabatabaei B E,Khaksar G,et al.Constitutive expression of Arɑbidopsis DREB1B in transgenic potato enhances drought and freezing tolerance[J].Biologia Plantarum,2012,56(1):37-42.
[91]Xu Q F,He Q,Tian Z D,et al.Molecular characterization of StNAC2 in potato and itsoverexpression confersdroughtand salt tolerance[J].Acta Physiologiae Plantarum,2014,36(6):1841-1851.
[92]李葵花,高玉亮,吴京姬,等.转P5CS基因马铃薯“东农303”耐盐、抗旱性研究[J].江苏农业科学,2014,42(11):131-133.
[93]张宁,司怀军,王帝,等.转甜菜碱醛脱氢酶基因马铃薯的抗旱耐盐性[J].作物学报,2006,35(6):1146-1150.
[94]Zhang N,SIH J,Wang D,etal.Enhanced droughtand salinity tolerance in transgenic potato plants with a BADH gene from spinach[J].Plant Biotechnology Reports,2011,5(1):71-77.
[95]Zhai H,Wang F,Liu Q,et al.A myo-inositol-1-phosphate synthase gene,IbMIPS1,enhances salt and drought tolerance and stem nematode resistance in transgenic sweet potato[J].Plant Biotechnol,2016,14(2):592-602.
[96]聂利珍,于肖夏,李国婧,等.拟南芥AtCDPK71基因克隆与转化马铃薯的研究[J].西北植物学报,2015,35(3):447-450.
Progress of crop drought tolerant genem ining and the potential application of developing drought-tolerant potato breeding
WANG Xiao-bin1,2,HU Kai-ming1,2,FAN A-qi1,2,ZHAO Feng1,2,ZHANG Jun-lian1,3,WANG Di1,2,BAIJiang-ping1,2
(1.Gɑnsu Key Lɑb of Crop Improvement&Germplɑsm Enhɑncement-Gɑnsu Provinciɑl Key Lɑb of Aridlɑnd Crop Science,Lɑnzhou,Gɑnsu 730070,Chinɑ;2.College of Agronomy,Gɑnsu Agriculturɑl University,Lɑnzhou,Gɑnsu 730070,Chinɑ;3.College of Horticulture,Gɑnsu Agriculturɑl University,Lɑnzhou,Gɑnsu 730070,Chinɑ)
This paper reviewed the function of68 drought-tolerantgenes reported that could enhance the osmotic accumulation,detoxification and antioxidant,bio-molecule.The results showed that the function of transcription factor mainly by activating or inhibiting the expression of downstream drought genes;osmotic genesmainlymaintained cell inside and outside osmotic balance;detoxification and antioxidantgenesmainly eliminated the accumulation of reactive oxygen species;the genes involved in biologicalmacromolecular synthesis can produce some adversity protein and enhanced crop resistance.In addition,existing problems are listed in order to provide a theoretical basis for the future in arid and semi-arid areas autopolyploid potato breeding drought-resistant crops.
crop;drought resistance gene;functional genes;potato;germplasm
S943.2;S532
:A
1000-7601(2017)01-0248-10
10.7606/j.issn.1000-7601.2017.01.37
2016-01-05
国家自然科学基金(31460369);甘肃科技基金(1308RJZA131,1308RJIA005);中科院西部之光项目;兰州科技研究项目(2013-4-156)
王晓斌(1990—),男,甘肃天水人,硕士,研究方向为作物遗传育种。
白江平(1978—),男,甘肃天水人,副教授,硕士生导师,主要从事作物遗传育种方面的研究。E-mail:baijp@gsau.edu.cn。
