碘[131I]爱克妥昔单抗注射液免疫反应活性的分析方法
2017-03-01贾莹莹崔海平沈振芳冉宇靓王晓静
贾莹莹,崔海平,沈振芳,冉宇靓,王晓静,*
碘[131I]爱克妥昔单抗注射液免疫反应活性的分析方法
贾莹莹1,崔海平1,沈振芳1,冉宇靓2,王晓静1,*
研究建立了碘[131I]爱克妥昔单抗注射液免疫反应活性检验分析方法。用活细胞结合百分数法,对细胞选择、反应时间、反应温度和分离方法进行研究,并应用该方法分析爱克妥昔单抗注射液免疫活性的稳定性及批间变异系数。结果表明:选择CEA表达阳性的LS180活细胞,反应时间为16 h,反应温度为4 ℃,分离方法为直接分离法。该方法批间变异系数小于10%,重复性好,可以用于分析碘[131I]爱克妥昔单抗注射液的免疫反应活性。
131I;单克隆抗体;免疫反应活性
单克隆抗体类药物一般包括两类[1-2]:(1) 抗肿瘤单抗,即未与药物或放射性核素偶联的裸抗体,包括抗体及其片段,具有两种功能,一是与靶分子特异性结合的结合功能;二是杀伤肿瘤细胞的效应功能,即主要是通过依赖补体的细胞毒性和抗体依赖细胞介导的细胞毒作用两种免疫机制实现;(2) 抗肿瘤单抗偶联物,或称免疫偶联物,它由单抗与“弹头”两部分构成,可用作“弹头”的物质主要有3类,放射性核素、药物和毒素,与单抗连接分别构成放射免疫偶联物、化学免疫偶联物和免疫毒素;单克隆抗体与上述“弹头”结合,可加强对肿瘤靶细胞的杀伤作用[3]。
碘[131I]标记的单克隆抗体注射液在治疗肺癌、肝癌等恶性疾病的治疗上有一定的疗效[4-7],目前国内碘标记单克隆抗体有利卡汀和唯美生。利卡汀是以HAb18 单克隆抗体的F(ab′)2片段为导向载体,将放射性核素131I有选择性和针对性地带到肝癌部位,利用其发出的β射线有效杀死癌细胞,但全身其它器官无放射性药物的蓄积。唯美生又名为肿瘤坏死靶向治疗单抗(tumor necrosis therapy),是一种特异性结合肿瘤坏死区细胞核从而导向治疗实体瘤的新型单抗[8-10]。现针对癌胚抗原表达阳性的大肠癌开发出新的碘[131I]爱克妥昔单抗注射液,用含有高效表达的重组嵌合抗癌胚抗原(CEA)单克隆抗体基因的中国仓鼠卵巢(CHO)细胞[11],经细胞培养,高度纯化并标记碘[131I]后加入适量人血白蛋白稳定剂制成的放射性液体制剂,主要用于治疗癌胚抗原表达阳性的大肠癌。其中免疫反应活性是碘[131I]爱克妥昔单抗注射液的质量指标之一,因此对免疫反应活性分析方法进行研究十分必要。
目前标记抗体均采用一种细胞浓度(即单一的抗原浓度)来评价标记抗体的结合百分比,这种单一抗原浓度计算的结合百分比十分不稳定,随着细胞数量的误差、细胞培养状态导致的细胞表面抗原分子表达密度的不同、加入标记抗体浓度的不同或误差,该法均能产生较大的误差;并且单一浓度细胞法测定的并不是真正的免疫结合百分比例,它只保证了真正的免疫结合百分比例不低于所测定的值,因此不能详细地了解标记抗体的实际结合活性。
本工作拟采用活的人肿瘤细胞最大程度地模拟标记抗体在病人体内将要结合的靶细胞,采用低温下反应避免活细胞的新陈代谢活动对抗原抗体结合的影响,同时采用过夜反应来使抗原抗体结合免疫反应充分到达平衡,保证所检测结果的真实性,并且采用多个浓度的测定值外推,可以克服上述误差大的缺点,并可以计算实际的免疫结合百分比。
1 实验原理
采用活细胞结合百分数法[12]测量免疫反应活性。供试品标记抗体中保留有活性的抗体能与细胞表面的CEA分子结合,采用大大过量的CEA阳性的活细胞作为固相化抗原,在此反应体系中加入一定量的标记抗体孵育一定时间,这时大部分仍保持有活性的标记抗体应结合于细胞表面,通过洗涤除去未结合的以及丧失活性的标记抗体,最后计算残留的放射剂量,并外推至抗原数量无穷大,即可获得供试品碘[131I]标记抗体的免疫反应活性,并判断供试品的免疫反应活性是否符合规定,具体计算方法如下式。
A=N/Ntot
其中:A,直接结合百分数;N,特异性结合的计数率,min-1;Ntot,总计数率,min-1。
以Ntot/N为纵坐标,相应的细胞浓度(3.2×107、1.6×107、0.8×107、0.4×107、0.2×107/mL)的倒数为横坐标,制作曲线图,在EXCEL软件中做直线拟合,外推至细胞浓度无穷大(x=0),求出此时的y值,计算供试品碘[131I]爱克妥昔单抗注射液的免疫反应活性=1/y×100%。测量的供试品免疫反应活性应不小于50%,以此判断所测定供试品是否合格。
2 实验方法
2.1 材料与仪器
碘[131I]爱克妥昔单抗注射液,由原子高科股份有限公司提供;CEA阳性的人结肠癌细胞LS180,细胞活度大于95%,购自美国ATCC(在血清培养状态下测定)。
氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾,分析纯(AR),国药集团化学试剂有限公司;牛血清蛋白(BSA),AR,北京海天生物科技有限公司;乙二胺四乙酸(EDTA),常州海丰化工有限公司。
TDL-40B型离心机,上海安亭仪器厂; KK25V61T1型冰箱,海尔公司;WH-986型混漩仪,上海医科大学仪器厂;GAMMA-C12 γ计数器,DPC公司。
2.2 细胞的选择
CEA是一个有价值的肿瘤标志,有大量的相关抗原。CEA分子特征可以转化到不同来源的细胞,如黑色素瘤、结肠腺癌、神经母细胞瘤、肺癌、乳腺癌、胰腺癌、白血病与前列腺肿瘤的抗原,这种仅限于在肿瘤细胞膜表达的分子特征,可用于鉴别人肿瘤细胞、正常胚胎和成人组织交叉反应[13]。故只有细胞膜表面的CEA分子的结合才是与治疗效果相关的有效结合,选用CEA表达阳性的活细胞作为模拟肿瘤宿主细胞与单抗注射液反应。LS180不仅是结肠癌细胞,而且在细胞膜表面高表达靶抗原CEA,其表达强度在目前已知的结肠癌细胞中几乎是最高的几种细胞系之一,符合免疫结合活性测定的细胞的要求,且较LS174T细胞更易培养,操作时实用性较强。
细胞准备:取约1.7×108个活细胞,用PBS洗涤细胞2次,再用适量EDTA的消化液消化细胞,然后加入适量含血清的完全培养基终止消化,吹散成单个细胞状态,采用台盼蓝染色法计数细胞数量和活度。1 000 g离心5 min收获细胞,再用40 mL不含血清的培养基重悬细胞至每毫升3.52×107个细胞。
2.3 反应时间的选择
由于其他单抗注射液的测定免疫反应活性时细胞浓度单一化,免疫反应活性不够精确,故设定梯度细胞浓度分别与标记抗体在4 ℃反应,反应时间设为1、2、4、8、16、20 h。
2.4 反应温度的选择
确定了细胞浓度外推法和最佳反应时间以后,设定不同的反应温度4 ℃与37 ℃,观察免疫反应活性的改变。
2.5 分离方法的选择
分别用直接离心法、葡聚糖凝胶层析法[14](尖底)、葡聚糖凝胶层析法(圆底)进行洗脱,测定计数率,确定合适的分离方法。
3 结果和讨论
3.1 方法学建立
3.1.1 反应时间的确定 不同浓度细胞分别与标记抗体在4 ℃反应,设定不同反应时间,得到的放射性检测结果列入表1。由表1可知:随着细胞浓度降低,Ntot/N逐渐增加,但在1、2、4、8 h时,Ntot/N增加幅度过大,无法求出当细胞浓度无限大时的Ntot/N值。反应16 h和20 h细胞浓度的倒数对直接结合百分数倒数的线性拟合图示于图1。由图1可知:16 h和20 h细胞免疫反应活性分别约为75%和79%,均达到合格标准;当反应时间达到16 h以上时,才可能将抗原数量外推至无穷大,获得稳定的免疫反应活性。因此本实验选择16 h作为反应时间。

表1 不同反应时间的计数率Table 1 Counting rate of different reaction time
注:t=4 ℃;A-1=Ntot/N=总计数率/(各组细胞浓度计数率-本底对照计数率)(下同);括号内数据为总计数率

图1 反应16 h(a)和20 h(b)细胞浓度的倒数对直接结合百分数倒数的线性拟合图Fig.1 Reciprocal cell concentration-combined with the reciprocal of the percentage chart reacting for 16 h(a) and 20 h(b)
3.1.2 反应温度的确定 4 ℃与37 ℃各细胞浓度的计数率比较列入表2。由表2可知,在37 ℃下各个细胞浓度的计数率均低于4 ℃下各个细胞浓度的值,同时由于在37 ℃时,LS180活细胞会不断分泌出可溶性CEA分子,很难控制反应时的抗原浓度,故选择较短的时间进行免疫反应。由表2还可知,37 ℃下免疫反应不充分,所以选择4 ℃作为反应温度。细胞浓度的倒数对直接结合百分数倒数的线性拟合示于图2。由图2可知,在4 ℃反应16 h,细胞免疫反应活性约为76%,达到合格标准。
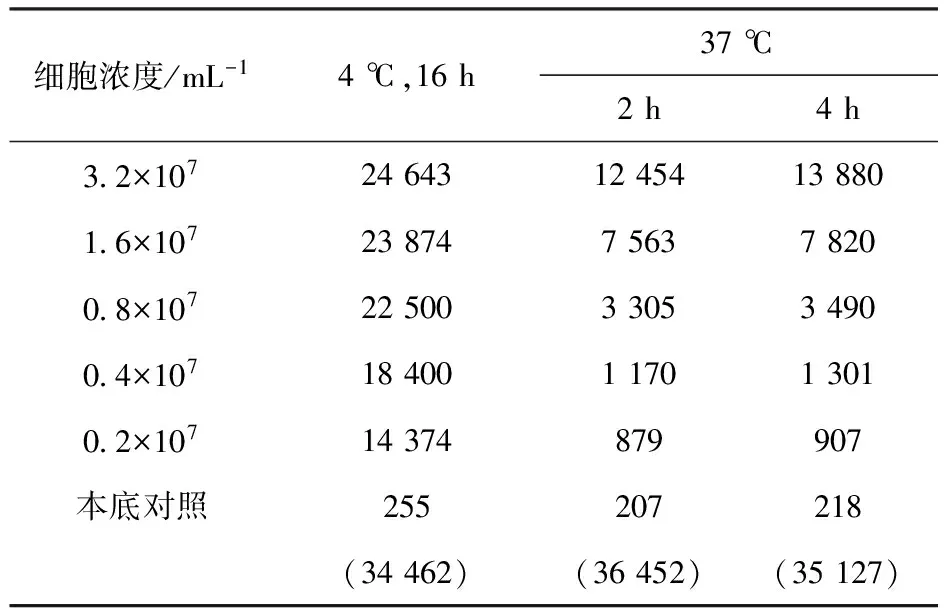
表2 4 ℃与37 ℃各细胞浓度的计数率Table 2 Counting rate of each cell concentration at 4 ℃ and 37 ℃ min-1
注:括号内数据为总计数率
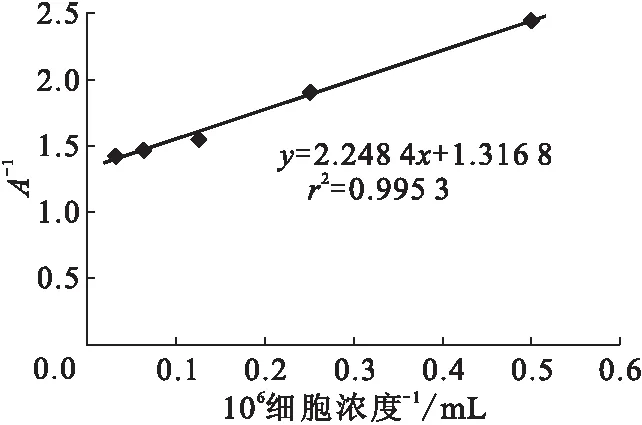
4 ℃反应16 h图2 细胞浓度的倒数对直接结合百分数倒数的线性拟合图Fig.2 Reciprocal cell concentration-combined with the reciprocal of the percentage chart
3.1.3 分离方法的确定 将直接离心法、葡聚糖凝胶层析法[14](尖底)、葡聚糖凝胶层析法(圆底)测定的放射性计数率列入表3。由表3可知,直接离心法与凝胶柱法(圆底)测得的数据比较准确。但由于凝胶柱法(圆底)需要剪掉底部软管,容易造成未结合抗体回流至柱芯,得到的放射性计数率不能准确表示免疫反应活性;而直接离心法更加简单、快速,易于操作,故选择直接离心法。

表3 不同分离方法测定的计数率Table 3 Counting rate of different separation methods min-1
3.2 方法学验证
本实验建立碘[131I]爱克妥昔单抗注射液免疫反应活性检测方法后,共做三批样品发货的免疫反应活性分析,而后每天取出一件-20 ℃冷冻保存的碘[131I]爱克妥昔单抗注射液进行48、72、96 h检测,共计12次,实验结果列入表4。由表4可知,三批样品直接结合百分数的标准偏差(s)最大为5.017%,批间变异系数(CV)最大为7.81%,反应了本方法检测碘[131I]爱克妥昔单抗注射液免疫反应活性有较高的精密度,随机误差相对小,这是一种准确性高的测定方法。
3.3 碘[131I]爱克妥昔单抗注射液免疫反应活性的质量稳定性
由表4中三批数据绘制成免疫反应活性变化曲线示于图3。由图3可知,碘[131I]爱克妥昔单抗注射液在5 d内直接结合百分数随时间的推移而逐渐降低,免疫反应活性均大于50%,达到实验要求。
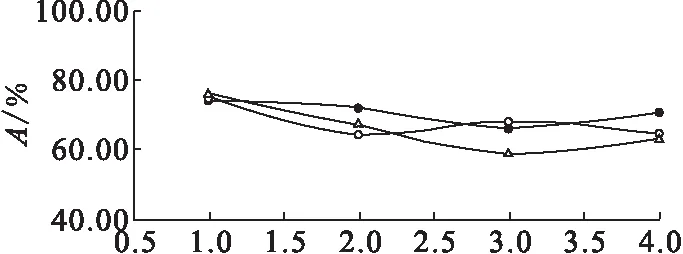
●——样品1,○——样品2,△——样品3图3 免疫反应活性变化曲线图Fig.3 Immune activity change curves
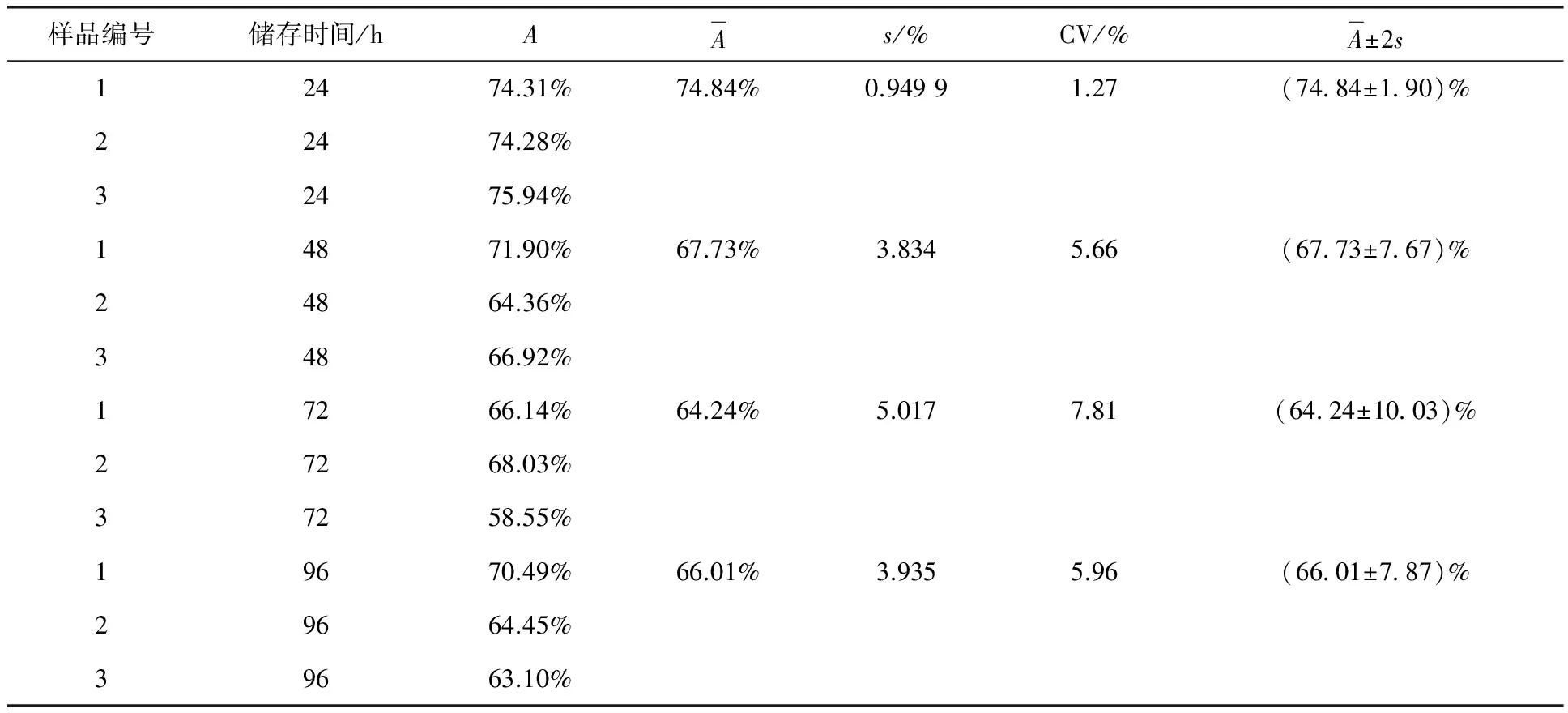
样品编号储存时间/hAAs/%CV/%A±2s12474.31%74.84%0.94991.27(74 84±1 90)%22474.28%32475.94%14871.90%67.73%3.8345.66(67 73±7 67)%24864.36%34866.92%17266.14%64.24%5.0177.81(64 24±10 03)%27268.03%37258.55%19670.49%66.01%3.9355.96(66 01±7 87)%29664.45%39663.10%
4 结 论
通过采用活细胞结合百分数法,选择CEA表达阳性的LS180活细胞,反应时间为16 h,反应温度为4 ℃,分离方法为直接分离法,该方法批间变异系数小于10%,能够较准确地测出爱克妥昔单抗注射液的免疫反应活性,提高了检测的准确性。
[1] Admas G P, Weiner L M. Monoclonal antibody therapy of cancer[J]. Nat Biothechnol, 2005, 23(9): 1147-1157.
[2] 甄永苏.抗肿瘤抗生素与癌症靶向治疗[J].中国抗生素杂志,2006,31(2):65-68.
[3] 张浩然.131I-chTNT靶向治疗分化型甲状腺癌肺转移瘤的临床应用研究[D].吉林:吉林大学中日联谊医院,2010.
[4] 于华,柳炳吉,郑飞波,等.131I-chTNT治疗恶性肿瘤并发骨转移瘤的初步研究[J].青岛大学医学院学报,2012,48(5):416-417.
[5] 刘雪辉,谭建.131I-chTNT放射免疫治疗晚期肺癌的研究进展[J].生物医学工程与临床,2008,12(2):159-162.
[6] 谭艳,肖恩华.利卡汀治疗原发性肝细胞癌的最新进展[J].中南药学,2008,6(5):632-634.
[7] 杜阳峰,罗荣城,李贵平,等.抗乙型肝炎表面抗原Fab片段联合抗细胞核单抗为载体的肝癌放射免疫治疗实验研究[J].南方医科大学学报,2008,28(3):460-462.
[8] Sun L Q, Vogel C A, Milimanoff R O, et al. Timing effects of combine radioimmunotherapy and radiotherapy on a human solid tumor in nude mice[J]. Cancer Res, 1997, 57(7): 1312-1319.
[9] 陈绍亮,孙小光,修雁,等.131I-chTNT在荷人肝癌裸鼠动物模型中的定位研究[J].中华核医学杂志,1998,18:215-217.
[10]Epstein A L, Chen F M, Taylor C R. A novel method for the detection of necrotic lesions in human cancers[J]. Cancer Res, 1988, 48(20): 5842-5848.
[11]罗先富,章斌,马鸿冰,等.抗人CD40mAb5H6的125I标记及其卵巢癌细胞株HO8910体外结合的生物学特性[J].细胞与分子免疫学杂志,2008,24(6):591-593.
[12]许元生,熊东生,范冬梅,等.125I标记抗CD20HI47F(ab′)2性质研究[J].放射免疫学杂志,2004,17(3):161-162.
[13]吴敏,臧仁杰,唐思伦.抗癌胚抗原单克隆抗体-抗原表位分析及其它应用[J].国外医学分子生物学分册,1987,9:201-205.
[14]冯强,米力,边惠洁,等.131I-肝癌单抗片段HAb18F(ab′)2注射液药盒的制备[J].同位素,2002,15(3):137-140.
1.原子高科股份有限公司,北京 102413;2.中国医学科学院 北京协和医学院 肿瘤医院 分子肿瘤学国家重点实验室,北京 100021
New Method to Inspection Immune Activity of Iodine[131I] Aiketuoxi Monoclonal Antibody Injection
JIA Ying-ying1, CUI Hai-ping1, SHEN Zhen-fang1, RAN Yu-liang2, WANG Xiao-jing1,*
1.Atom-Hitech Company, Beijing 102413, China;2.State Key Laboratory of Molecular Oncology, Cancer Hospital, Chinese Academy of Medical Sciences(CAMS)&Peking Union Medical College, Beijing 100021, China
A method for identifying the immuneactivity of iodine [131I]aiketuoxi monoclonal antibody injection was developed. The paper reported the method of percentage of living cells. Cell selection, the effect of temperature, time and separation method were studied, and as well as the stability of the product and the coefficient of variation were analysed by the method. The cell line was CEA expression positive LS180 cell, reaction time was 16 h, reaction temperature was 4 ℃, and it used a direct separation method. The variation coefficient of the method was less than 10%. The method has good reproducibility and can be used for analysis the immuneactivity of iodine [131I]aiketuoxi monoclonal antibody injection.
131I; monoclonal antibody; immunoreactivity
2015-11-16;
2016-01-15;
时间:2017-01-03
贾莹莹(1984—),女,安徽含山人,硕士,工程师,放射性同位素技术专业
*通信联系人:王晓静(1970—),女,辽宁锦州人,研究员,主要从事放射性药物研究工作,E-mail: wangxj70@163.com
R811
A
0253-9950(2017)01-0121-05
10.7538/hhx.2016.YX.2015100
