红树林淡紫拟青霉胞外多糖对小鼠DCs表型成熟的影响①
2017-02-27胡海岩王华民林英姿常彩红王永霞
胡海岩 王华民 林英姿 常彩红 杨 文 王永霞
(海南医学院临床学院,海口571109)
红树林淡紫拟青霉胞外多糖对小鼠DCs表型成熟的影响①
胡海岩 王华民②林英姿②常彩红②杨 文②王永霞②
(海南医学院临床学院,海口571109)
目的:探讨红树林来源的淡紫拟青霉胞外多糖对小鼠骨髓源性树突状细胞(DCs)表型成熟的影响。方法:从小鼠骨髓腔中分离获得单核细胞,加入细胞因子rmGM-CSF、rmIL-4 诱导分化为未成熟DCs并用不同浓度淡紫拟青霉胞外多糖干预,流式细胞术检测成熟DCs的表面标志CD11c、MHCⅡ、CD80、CD86分子的表达及吞噬FITC-dextran 的能力,ELISA检测该多糖对DCs分泌IL-12的影响;MTT法检测该多糖对DCs刺激T细胞增殖的影响。结果:经400 μg/ml多糖作用48 h后DCs 表面分子CD11c、MHCⅡ、CD80、CD86的表达显著上调,与空白对照组相比P<0.01,与LPS组相比P>0.05;经该多糖作用后DCs吞噬FITC-dextran的能力下降,尤其300 μg/ml 、400 μg/ml的多糖作用效果最明显,与空白对照组相比P<0.05;该多糖还可刺激DCs分泌IL-12,尤其100~400 μg/ml的多糖刺激作用较强,与空白对照组相比P<0.05;另外,经该多糖处理的DCs还可刺激T细胞增殖,将不同比例刺激细胞与T作用后均可见T细胞增殖,与空白对照组相比P<0.05。结论:淡紫拟青霉胞外多糖可上调DCs表面 CD11c、MHCⅡ、CD80和CD86分子表达,降低其吞噬能力,促进其分泌IL-12,还可刺激T细胞增殖,初步表明该多糖可刺激DCs分化成熟。
胞外多糖;淡紫拟青霉;树突状细胞;表型;成熟
树突状细胞(Dendritic cells,DCs)作为功能最强的抗原提呈细胞,其最大特点是能够显著刺激初始T细胞活化,启动适应性免疫应答[1-3],人和动物体内的DCs包括成熟和未成熟两种状态,未成熟DC由于高表达Toll样受体(Toll-like receptors,TLRs)等抗原识别受体[4],摄取抗原的能力强,但活化T细胞的能力弱;病原体或其他刺激可活化DCs,使其分化成熟,成熟DCs摄取抗原能力减弱,但由于高表达MHCⅡ、CD86、CD80等分子,提呈抗原的能力及活化T细胞的能力增强[5,6]。因此,通过调控体内DCs的成熟状况,可改变机体的免疫功能状态,达到预防或治疗疾病的目的。
课题组前期从海南红树林中分离鉴定出一株淡紫拟青霉,其产生的胞外多糖体外实验证实有较好的免疫调节作用,可促进小鼠吞噬细胞的吞噬功能及T淋巴细胞分泌细胞因子的作用[7]。本研究在前期研究的基础上探讨淡紫拟青霉胞外多糖对以小鼠骨髓源性DCs成熟及功能的影响。
1 材料与方法
1.1 材料
1.1.1 动物 6~8周龄BALB/c小鼠,雄性,由本校实验动物中心提供。
1.1.2 试剂及药物 淡紫拟青霉胞外多糖由本室获得,用双蒸水配成20 g/L母液,0.22 μm微孔滤膜过滤除菌,分装,-20℃保存。APC标记的抗小鼠CD11c单克隆抗体、PE标记的抗小鼠MHCⅡ单克隆抗体、PE标记的抗小鼠CD80单克隆抗体、FITC标记的抗小鼠CD86单克隆抗体及FITC-dextran购自美国Ebioscience公司。RPMI1640 培养基购自Hyclone公司,胎牛血清购自杭州四季青公司,阳性对照多糖为脂多糖,购自Sigma公司,丝裂霉素C,购自上海生工生物工程有限公司。
1.1.3 流式细胞仪 FACScan(BD 公司),生物安全柜(SG403A-HE,美国),酶联免疫检测仪(上海天美科学仪器有限公司),CO2培养箱(NU-4750E,美国),倒置显微镜(深圳拓天仪器设备有限公司),电子分析天平(赛多利斯科学仪器有限公司),低速台式离心机(上海安亭科学仪器厂),细胞培养板(Corning,美国)等。
1.2 方法
1.2.1 小鼠骨髓来源DCs体外诱导及培养 取6~8周龄BALB/c雄性小鼠40只,SPF级,颈椎脱臼处死,于75%酒精中浸泡10~15 min,无菌手术取出股骨和胫骨,PBS反复冲洗骨髓腔,收集细胞悬液,离心,弃上清。红细胞裂解液破坏红细胞,PBS洗3遍后用含10%胎牛血清的RPMI1640完全培养液(含10 ng/ml rmGM-CSF和10 ng/ml rmIL-4)调整细胞浓度至2×106个/ml,以3 ml/孔加入6孔板,37℃、5%CO2培养箱培养,吸附3 h后去除未贴壁细胞,重新加入完全培养液,隔日半量换液,第6天收集未成熟DCs进行后续实验。
1.2.2 淡紫拟青霉胞外多糖对DCs表型的影响 收集未成熟DCs 用RPMI1640维持液配成1×106ml-1细胞悬液,接种12孔板,每孔2 ml。加入不同浓度淡紫拟青霉胞外多糖,终浓度分别为50、100、200、300 μg/ml,每一浓度设4个复孔,以RPMI1640为阴性对照,继续培养48 h,隔天换液并观察细胞形态。收集细胞,洗涤3次,调整细胞浓度为1×106ml-1,加入APC-CD11c、PE-MHCⅡ和PE-CD80、FITC-CD86,4℃染色标记 30 min,洗涤3次,上机检测。
1.2.3 淡紫拟青霉胞外多糖对DCs吞噬能力的影响 收集未成熟DCs,调整细胞浓度为1×106ml-1,加入12孔细胞培养板中,每孔2 ml,加入终浓度分别为50、100、200、300、400 μg/ml淡紫拟青霉胞外多糖,37℃、5%CO2培养箱培养48 h,收集细胞置37℃孵育30 min,加入FITC-dextran,终浓度为1 mg/ml,37℃孵育4 h,4℃作用1 h,流式细胞仪检测阳性细胞的百分比。
1.2.4 淡紫拟青霉胞外多糖对DCs分泌细胞因子的影响 无血清培养基将未成熟DCs 配成1×106ml-1细胞悬液,接种于24孔板中,每孔1 ml。加入终浓度分别为50、100、200、300、400 μg/ml多糖,每一浓度设6个复孔,以RPMI1640为阴性对照,37℃、5%CO2培养箱培养,隔天换液并观察细胞形态,于72 h收集各组上清液,3 000 r/min 10 min去除颗粒和聚合物。采用酶联免疫吸附试验(ELISA)测定上清液中IL-12水平。具体操作按照试剂盒说明书进行。
1.2.5 淡紫拟青霉胞外多糖对DCs刺激T细胞增殖能力的影响
1.2.5.1 反应性T细胞的制备 取6~8周龄BALB/c小鼠,脱臼处死,无菌操作取小鼠脾脏,研磨制备脾细胞悬液,用200目细胞筛过滤,收集细胞悬液,离心,弃上清,加入红细胞裂解液充分裂解红细胞,加入无血清1640培养液终止反应,离心洗涤两次。用含10%小牛血清的培养液(含IL-2 5 ng/ml)调整细胞浓度至1×107ml-1。置37℃、5%CO2培养箱中培养6 h后收集未贴壁细胞作为T细胞备用。
1.2.5.2 刺激细胞的制备 将1×106ml-1未成熟DCs接种于24孔板中,每孔1 ml。加入终浓度分别为50、100、200、300、400 μg/ml淡紫拟青霉胞外多糖,每一浓度设4个复孔,37℃、5%CO2培养箱培养3 d,收集各组细胞为刺激细胞,加入终浓度为25 μg/ml 的丝裂霉素C,37℃、5%CO2培养箱培养30 min,PBS洗2遍,1 500 r/min离心5 min,调整细胞浓度为1×106个/ml。
1.2.5.3 DC与T淋巴细胞的混合培养 将制备好的刺激细胞加入96孔板,每孔100 μl,加入经丝裂霉素C灭活的DCs,T细胞与DCs的比例分别为1∶5、1∶10、1∶20、1∶40,每孔终体积为200 μl,每一浓度设6个复孔,同时设单一T细胞对照和空白对照,37℃、5%CO2培养箱培养72 h,吸弃上清。每孔加20 μl MTT(5 mg/ml),继续培养4 h,每孔加150 μl DMSO震荡10 min,等待结晶物全部溶解后,用酶标仪测570 nm处光密度值(OD)。T细胞增殖率=(实验孔OD-对照孔OD)/对照孔OD×100%。
2 结果
2.1 小鼠骨髓来源DCs体外诱导及培养 弃除悬浮细胞并更换含有细胞因子的完全培养基后,可见贴壁细胞大小均匀,呈圆形。培养24 h后,出现悬浮细胞,细胞形态未发生明显变化。培养第3天,可见疏松黏附与贴壁细胞的集落产生,细胞体积变大,形状不规则。培养第5天,可见细胞集落增多,细胞多呈星状、蝌蚪状,有明显突起。
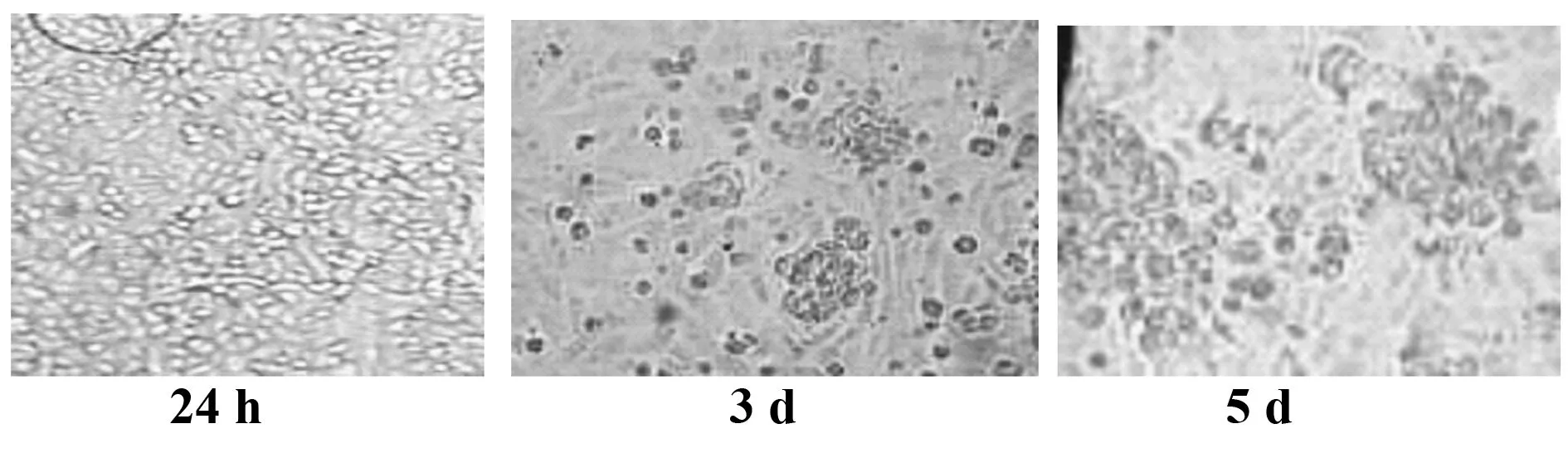
图1 倒置显微镜下不同时间DCs形态变化Fig.1 Morphologic feature of DCs was photographed in different phases
2.2 淡紫拟青霉胞外多糖对DCs表型的影响 将不同浓度多糖作用于未成熟DCs 48 h后流式细胞仪检测表面分子表达情况,发现不同浓度多糖均可刺激DCs CD11c、MHCⅡ、CD80和CD86分子表达,且在所用浓度范围内呈剂量依赖性。多糖终浓度为50、100、200 μg/ml时,CD11c、MHCⅡ双阳性细胞百分率分别为(24.4±1.2)%、(27.1±2.0)%、(33.9±3.5)%,与空白对照组(23.5±0.16)%相比,差异无统计学意义(P>0.05),与LPS组(53.1±1.5)%相比,差异有统计学意义(P<0.01),而当多糖终浓度达300、400 μg/ml时CD11c、MHCⅡ双阳性细胞百分率分别为(42.8±2.6)%、(50.4±1.3)%,与空白对照组相比,差异有统计学意义(P<0.01),与LPS组相比,差异无统计学意义(P>0.05);不同浓度多糖亦可促进DCs CD80和CD86共刺激分子的表达,多糖终浓度为50、100、200、300、400 μg/ml时CD80、CD86双阳性细胞百分率分别为(29.8±3.1)%、(32.1±1.7)%、(40.3±1.5%)、(50.7±2.4)%、(61.0±0.5)%,其中多糖终浓度300、400 μg/ml 作用下的DCs双阳性细胞百分率与空白对照组(27.9±1.2)%相比,差异有统计学意义(P<0.01),400 μg/ml多糖作用下的DCs双阳性细胞百分率与LPS组(70.2±2.5)%相比,差异无统计学意义(P>0.05)。说明多糖终浓度在400 μg/ml时对DCs分化成熟的刺激作用最好,部分流式结果见图2。
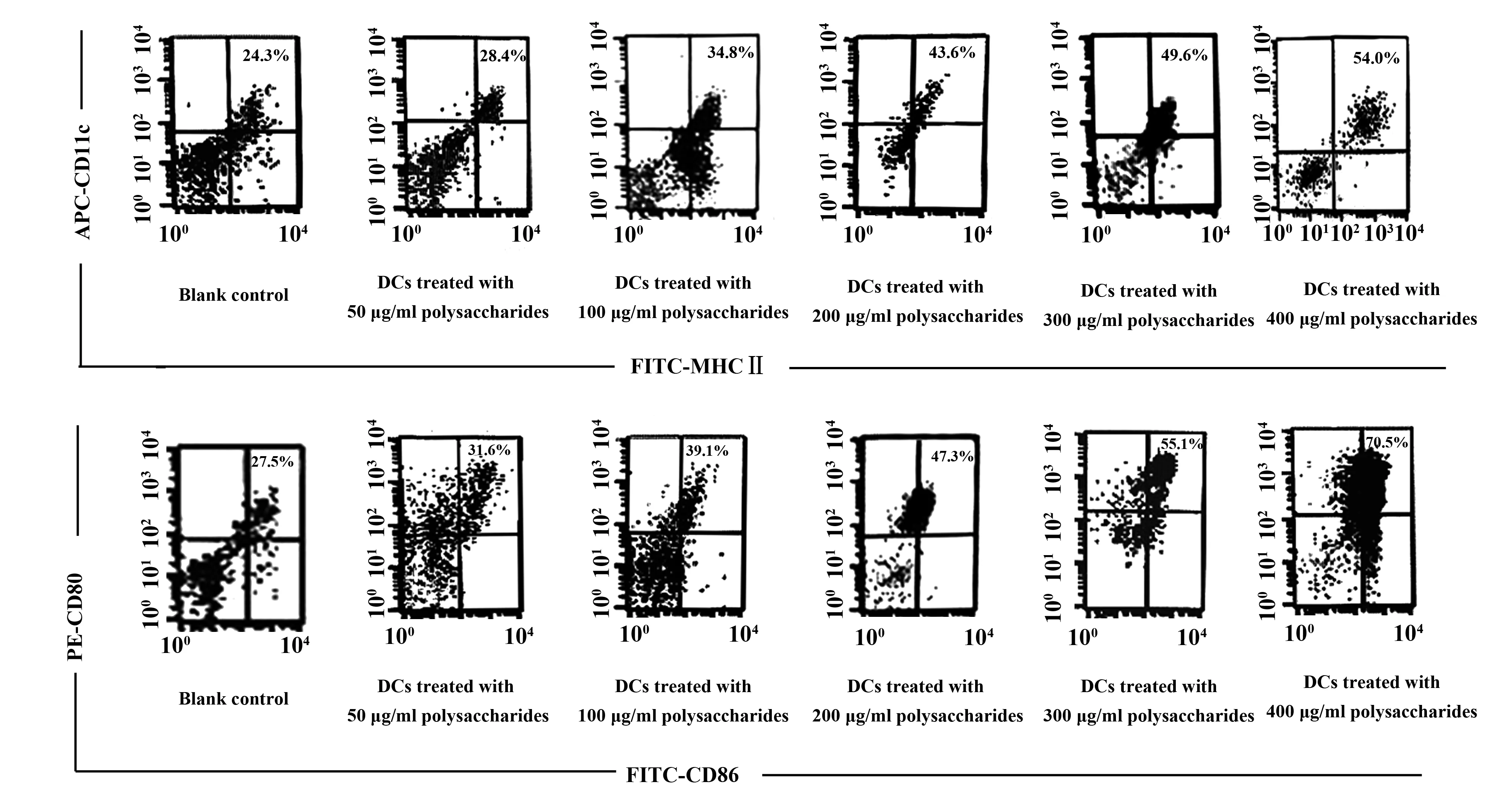
图2 淡紫拟青霉胞外多糖对DCs 表达CD11c、MHCⅡ、CD80和CD86分子的影响Fig.2 Expression level of CD11c,MHCⅡ,CD80 and CD86 on DCs treated by polysaccharides

图3 淡紫拟青霉胞外多糖对DCs吞噬能力的影响流式图Fig.3 Influence of polysaccharides on DCs phagocytotic ability by flow cytometry
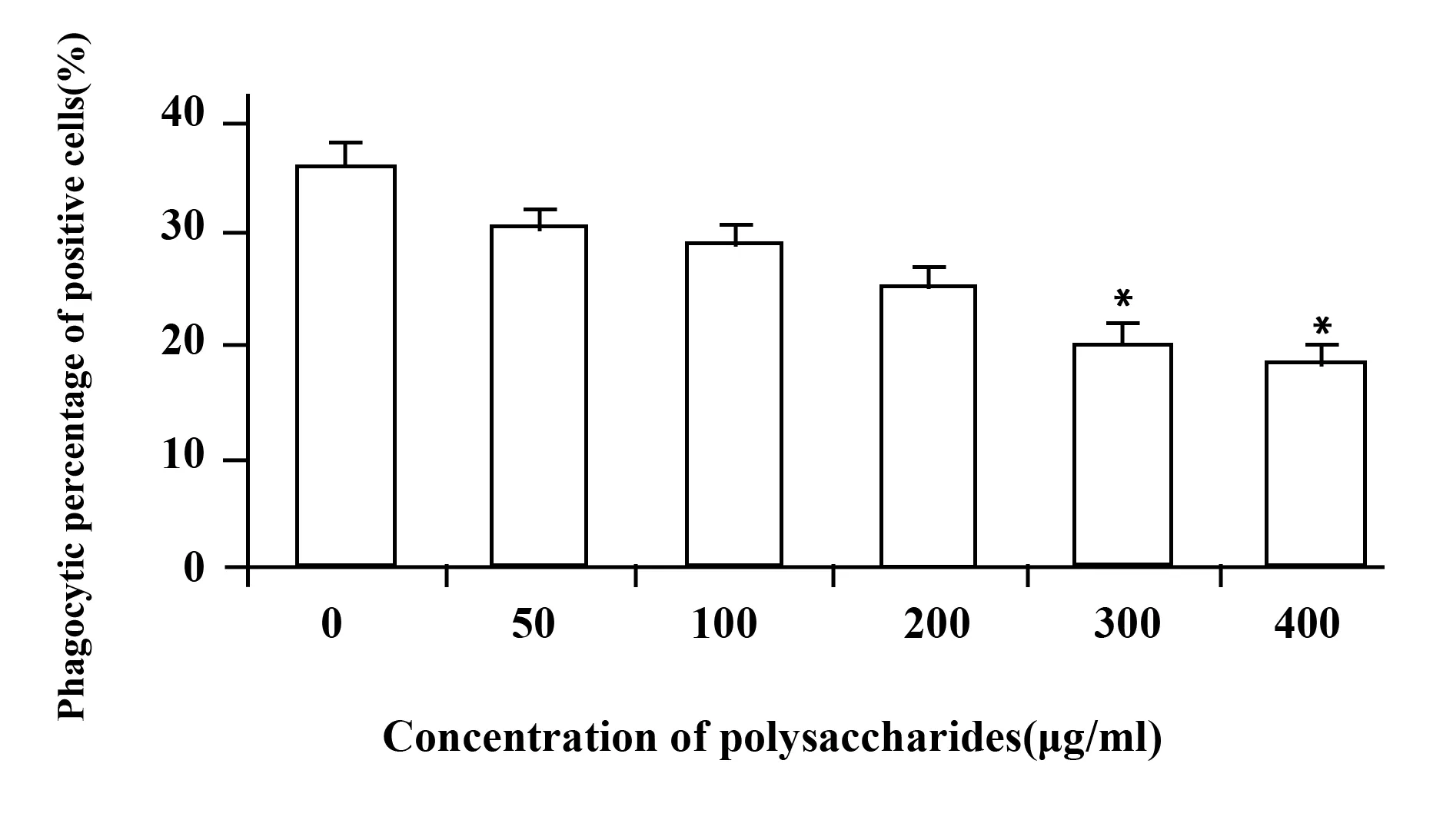
图4 淡紫拟青霉胞外多糖对DCs吞噬能力的影响±s)Fig.4 Effect of polysaccharides on phagocytosis of Note: Compared with blank control group,*.P<0.05.
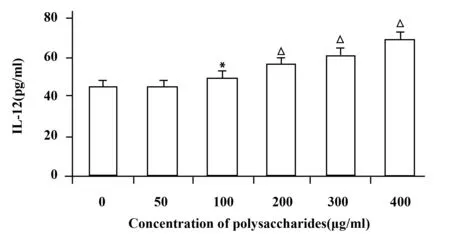
图5 淡紫拟青霉胞外多糖对IL-12分泌的影响±s)Fig.5 Effects of IL-2 production in culture supernatants treated with different concentration ±s)Note: Compared with blank control group,*.P<0.05;△.P<0.01.
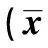
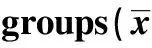
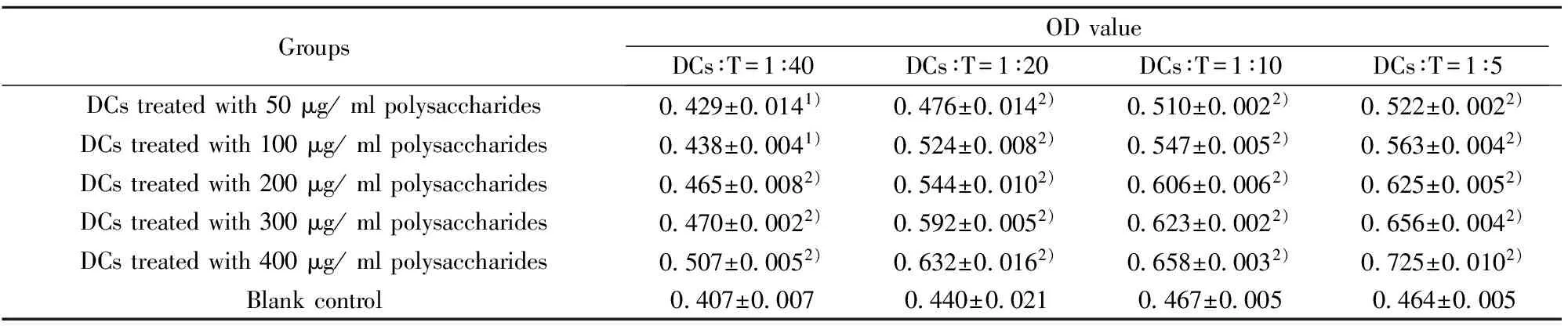
GroupsODvalueDCs∶T=1∶40DCs∶T=1∶20DCs∶T=1∶10DCs∶T=1∶5DCstreatedwith50μg/mlpolysaccharides0429±00141)0476±00142)0510±00022)0522±00022)DCstreatedwith100μg/mlpolysaccharides0438±00041)0524±00082)0547±00052)0563±00042)DCstreatedwith200μg/mlpolysaccharides0465±00082)0544±00102)0606±00062)0625±00052)DCstreatedwith300μg/mlpolysaccharides0470±00022)0592±00052)0623±00022)0656±00042)DCstreatedwith400μg/mlpolysaccharides0507±00052)0632±00162)0658±00032)0725±00102)Blankcontrol0407±00070440±00210467±00050464±0005
Note:Compared with blank control group,1)P<0.05;2)P<0.01.
2.3 淡紫拟青霉胞外多糖对DCs吞噬能力的影响 未成熟DC经过不同浓度淡紫拟青霉胞外多糖处理48 h后,吞噬FITC-dextran的能力逐渐降低,呈剂量依赖性,部分流式结果见图3,50、100和200 μg/ml多糖浓度时阳性吞噬细胞百分率分别为(30.5±1.9)%、(28.6±1.4)%和(25.0±1.5)%,与空白对照组(35.8±1.1)%相比,差异无统计学意义(P>0.05);当糖浓度达300 μg/ml及400 μg/ml时阳性吞噬细胞百分率分别为(20.0±2.0)%、(18.1±1.7)%,与空白对照组相比明显降低,差异有统计学意义(P<0.05),说明300 μg/ml和400 μg/ml的多糖对DCs成熟的刺激作用较强,结果见图4。
2.4 淡紫拟青霉胞外多糖对DCs分泌细胞因子的影响 将不同浓度淡紫拟青霉胞外多糖作用于DCs 72 h后,收集上清液,ELISA法检测IL-12分泌水平,结果如图5,不同浓度该多糖对DCs分泌IL-12的刺激能力不同,刺激作用呈剂量依赖性,50 μg/ml浓度多糖作用下DCs分泌IL-12的量最少,为(44.2±3.6)pg/ml,与空白对照组相比,差异无统计学意义(P>0.05),多糖为100 μg/ml时IL-12的分泌量为(49.3±2.1)pg/ml,与空白对照组相比,差异有统计学意义(P<0.05),随多糖浓度增加DCs分泌IL-12的量亦逐渐升高,与空白对照组相比,差异具有统计学意义(P<0.01),见图5。
2.5 淡紫拟青霉胞外多糖对DCs刺激T细胞增殖能力的影响 将不同浓度淡紫拟青霉胞外多糖处理的DCs作为刺激细胞刺激T细胞,发现不同比例的刺激细胞与T细胞混合孵育后均可见T细胞增殖,与空白对照组相比,经50 μg/ml和100 μg/ml多糖处理的DCs与T细胞比例为1∶40时,差异有统计学意义(P<0.05),其余组与空白对照组相比,差异有显著性(P<0.01),说明多糖处理过的DCs具有一定的刺激T细胞增殖能力,见表1。
3 讨论
多糖类化合物具有良好的生物活性,早在1943年便开始作为药物使用。红树林真菌是生活在红树林生态系统中的第二大微生物资源[8],长期生活在寡营养、弱碱性的含盐海洋环境中,形成了独特的耐饥、耐碱和耐盐等生存机制,可产生出完全不同于陆生真菌的多糖类生物活性物质[9,10]。研究表明,红树林真菌胞外多糖主要为杂多糖,具有良好的抗病毒、抗肿瘤及免疫调节等生物活性[11,12]。
本研究用不同浓度淡紫拟青霉胞外多糖处理小鼠骨髓源性未成熟DCs,观察其对DCs功能成熟的影响,发现在所用多糖浓度范围内均可刺激未成熟DCs 向成熟状态分化,可促进DCs 表面CD11c 、MHCⅡ、CD80和CD86分子表达,尤其终浓度为400 μg/ml 的多糖刺激作用较强,CD11c、MHCⅡ双阳性细胞和CD80、CD86双阳性细胞百分率与空白对照组相比,差异有统计学意义(P<0.05),与LPS组相比,差异无统计学意义(P>0.05),CD11c 为DCs特征性标志,MHCⅡ参与对T细胞抗原肽的提呈并诱导免疫应答的发生,CD80、CD86为协同刺激分子,可为T 细胞的活化提供第二信号,DCs成熟时显著上调MHCⅡ、CD80、CD86分子的表达,说明400 μg/ml多糖对DCs分化成熟的刺激作用较强,与LPS作用相似。经该多糖刺激的DCs吞噬FITC-dextran的能力亦逐渐降低,尤其经300、400 μg/ml多糖处理的DCs吞噬率与空白对照组相比,差异有统计学意义(P<0.05),说明300、400 μg/ml的多糖可显著促进DCs成熟。该多糖还对DCs分泌IL-12具有一定刺激作用,100~400 μg/ml的多糖刺激作用较强,与空白对照组相比,差异有统计学意义(P<0.05),IL-12为促使Th0向Th1分化的关键细胞因子,在诱发细胞免疫应答中起着重要作用。另外,该多糖处理的DCs还具有刺激T细胞增殖的作用,将不同浓度多糖处理的DCs刺激T细胞,发现不同比例的DCs与T细胞混合孵育后均见T细胞增殖,增殖率与空白对照组相比,差异有统计学意义(P<0.05),说明多糖处理过的DCs具有一定的刺激T细胞增殖的能力。
总之,红树林来源的淡紫拟青霉胞外多糖可在一定程度上刺激小鼠骨髓源性DCs分化成熟,具有表现在可刺激DCs 表面CD11c、MHCⅡ、CD80和CD86等分子的表达,下调其吞噬作用,促进IL-12分泌,刺激T细胞增殖,但具体机制需进一步研究。
[1] Banchereau J,Steinman RM.Dendritic cells and the control of immunity[J].Nature,1998,392(19): 245-252.
[2] Nicoletti C,Regoli M,Bertelli E.Dendritic cells in the gut: to sample and to exclude?[J].Mucos Immunol,2009,2(5): 462-463.
[3] Klechevsky E,Kato H,Sponaas AM.Dendritic cells star in Vancouver[J].J Exp Med,2005,202: 5-10.
[4] Yoon YD,Han SB,Kang JS,etal.Toll-like receptor 4-dependent activation of macrophages by polysaccharide isolated from the radix of Platycodon grandiorum[J].Int Immuno-pharmacol,2003,3(13/14): 1873-1882.
[5] Sandor F,Buc M.Toll-like receptors.Structure,function and their ligands[J].Folia Biol(Praha),2005,51(5):148-157.
[6] Gianotti L,Sargenti M,Galbiati F,etal.Phenotype and function of dendritic cells and T-lymphocyte polarization in the human colonic mucosa and adenocarcinoma[J].Eur J Surg,Oncol,2008,34(8):883-889.
[7] 饶朗毓,陈政良,裴 华,等.一株具免疫增强活性红树林真菌的筛选及鉴定[J].中国热带医学,2011,11(6):683-685.
[8] Chen YL,Mao WJ,Tao HW,etal.Preparation and characterization of a novel extracellular polysaccharide with antioxidant activity,from the mangrove-associated fungus fusarium oxysporum[J].Marine Biotechnol,2015,17(2):219-228.
[9] Chi ZM,Fang Y.Exopolysaccharides from marine bacteria[J].J Ocean Uni China,2005,4(1):67-74.
[10] Al-Sayed HA,Ghanem EH,Saleh KM.Bacterial community and some physico-chemical characteristics in a subtropical mangrove environment in Bahrain[J].Marine Pollution Bulletin,2005,50:147-155.
[11] Kumaran S,Ramaprasanna D,Murugaiyan K.Production and characterization of exopoly- saccharides (EPS) from mangrove filamentous fungus,Syncephalastrum sp[J].African J Microbiol Res,2014,8(21):2155-2161.
[12] Yan M,Mao W,Chen C,etal.Structural elucidation of the exopolysaccharide produced by the mangrove fungus Penicillium solitum[J].Carbohydrate Polymers,2014,111C(1):485-491.
[收稿2016-08-12]
(编辑 张晓舟)
Effects of extracellular polysaccharides from Paecilomyces Lilacinuson on function of mouse bone marrow-derived dendritic cells
HUHai-Yan,WANGHua-Min,LINYing-Zi,CHANGCai-Hong,YANGWen,WANGYong-Xia.
ClinicalMedicalCollege,HainanMedicalUniversity,Haikou571109,China
Objective:To investigate the effects of the Paecilomyces Lilacinuson extracellular polysaccharides on the phenotypic and maturation of murine dendritic cells.Methods: Imature DCs were induced in vitro from the murine bone marrow cells in the presence of rmGM-CSF and rmIL-4,and then they were cultured with different dosage of the extracellular polysaccharides.The morphological characterization was analyzed under microscopy.The expressions of the DCs surface costimulating factors and phagocytic function to FITC-dextran were detected by flow cytometry.The level of IL-12 secreted by DCs was observed by ELISA.At the same time the influence of DCs on the proliferation of T cells was determined by MTT.Results: Treating with the polysaccharides for 48 h could up-regulate the expression of DCs surface molecules,such as CD11c,MHCⅡ,CD80 and CD86,and the 400 μg/ml was the optimal dose,comparing with the blank control group, the difference was significant (P<0.01), contrast to LPS control group that was not different (P<0.05).The uptaking FITC-dextran ability of the DCs treated with 300 μg/ml and 400 μg/ml polysaccharides was significant lower than the unstimulated DCs(P<0.05).At the same time the extract at different concentration could distinctly enhance the proliferation of T cells by DCs too.Conclusion: The extracellular polysaccharides could stimulate the maturation of dendritic cells and induce the production of mature dendritic cells.
Extracellular polysaccharides;Paecilomyces Lilacinuson;Dendritic cells;Phenotype;Maturation
10.3969/j.issn.1000-484X.2017.02.010
①本文为国家自然科学基金项目(31260225)、海南省自然科学基金项目(813248)和科研培育基金项目(HY2014-05)。
胡海岩(1979年-),男,讲师,主要从事感染免疫及免疫调节研究,E-mail:34171599@qq.com。通讯作者及指导教师:王永霞(1971年-),女,硕士,副教授,主要从事感染与免疫研究,E-mail: 492608405@qq.com。
R392.9
A
1000-484X(2017)02-0212-05
②海南医学院热带医学与检验学院,海口571109。
