胫骨近端肿瘤型假体置换术中伸膝装置重建的研究进展
2017-02-27孙扬牛晓辉
孙扬 牛晓辉
. 综述 Review .
胫骨近端肿瘤型假体置换术中伸膝装置重建的研究进展
孙扬 牛晓辉
胫骨;骨肿瘤;关节成形术,置换,膝;骨重建
胫骨近端是骨原发恶性肿瘤最常见的发病部位之一,胫骨近端瘤段截除肿瘤型假体置换最棘手的问题就在于术中伸膝装置的重建。现对胫骨近端肿瘤型假体置换术中伸膝装置的重建方式进行文献复习与探讨。
随着影像诊断、辅助治疗及手术技术的发展,保肢手术已成为肢体恶性骨肿瘤手术的第一选择[1-4]。胫骨近端是骨恶性肿瘤第二常见的发病部位[5-7],仅次于股骨远端,相比肢体其它部位,胫骨近端恶性肿瘤保肢术后功能偏差,且并发症发生率偏高[8-11],这与胫骨近端邻近血管、神经,缺乏软组织覆盖以及术中损失髌韧带附丽有关[2,4,7,12],其中对术后功能影响最大也是最棘手的问题在于伸膝装置止点-髌韧带附丽的重建[13-14]。异体骨或异体骨-人工假体复合物虽可为髌韧带提供生物学附丽,但由于其较高的并发症发生率:感染、异体骨骨折、不愈合、关节面塌陷等[7,9,12,15-20],应用范围远不如人工假体广泛,人工假体的优势在于术后的早期负重和活动,但假体本身无法提供生物学附丽点。
目前文献报道胫骨近端肿瘤型假体置换术中伸膝装置的重建方式很多,并无公认的最佳选择。
伸膝装置重建成功与否取决于残存髌腱与假体之间是否能实现有效的固定,而有效的固定是由稳定牢固的接触界面决定的[6,12-15],根据接触界面的数量和类型,可以将重建方式分为以下几类:单一界面:髌腱-假体;双重界面:根据界面类型分型:髌腱-人工材料-假体;髌腱-自体松质骨-假体;髌腱-腓骨-残存胫骨。通过主被动伸膝度差,MSTS 评分和髌腱撕脱的发生率,对重建方式的效果进行评价。
一、髌腱-假体直接固定
根据固定方式又可分为缝线缝合、Dacron 带固定和铆钉固定。Mavrogenis 等[4]报道了 225 例,其中 185 例患者的髌腱以不可吸收线与假体预制孔直接连接,术后支具固定 1 个月,部分负重,4 个月起完全负重,平均随访86 个月,平均主被动伸膝度差 10° ( 0°~60° ),MSTS 评分72% ( 27%~100% ),6 例出现髌腱撕脱。
Abboud 等[21]报道了 22 例,髌韧带以 2~0 不可吸收线与假体预制孔隙直接缝合固定,术后伸膝位支具固定6 周。最终 11 例获随访,平均随访 38.6 个月,平均主被动伸膝度差 7.5° ( 5°~30° ),其中 1 例>20°,MSTS 评分92% ( 85%~99% ),2 例 ( 10.5% ) 出现髌腱撕脱,分别出现在术后 1 年和 3 年,均发生在髌腱-假体界面,予缝线重新缝合后支具固定 10 周,至报道时未见再次撕脱。
Malawer 等[1-2]报道了 13 例,髌韧带以 Dacron 带与假体预制环直接固定,术后长腿石膏固定 3 周,平均随访 42 个月,主被动伸膝度差 ( 0°~30° ),平均 MSTS 评分70%,最终有 2 例因机械失败接受了再次手术,但未说明是否为髌腱撕脱。
Jeon 等[22]报道了 40 例,髌韧带以铆钉直接固定在胫骨假体前方的多孔钛衬垫上,最终 25 例获随访,平均随访 78 个月,主被动伸膝度差 0°~20° 者 14 例,>20° 者11 例,MSTS 评分 76%,4 例出现髌腱撕脱,2 例行手术修复。Mavrogenis 等[4]报道的 225 例中,14 例采取铆钉直接固定,平均随访 120 个月,主被动伸膝度差平均 16° ( 0°~60° ),MSTS 评分 71% ( 33%~90% )。
Jeon 等[22]指出髌腱与金属的直接固定无法实现最终的愈合,髌腱-假体界面间持续强大的张力导致髌腱撕脱的风险较大。Mavrogenis 等[4]也认为,髌腱与假体的直接固定可为伸膝装置提供初期的稳定,因此术后初期的伸膝功能较理想,但长期随访主被动伸膝度差会逐渐增加,髌腱撕脱的发生率较高,他还指出,尽管随访中有些患者的主被动伸膝度差逐年增加,但 MSTS 评分却随时间而逐渐改善,因此作者在文中特别强调了不扶拐行走、完全负重和稳定关节对功能的重要性。Rempel 等[23]通过实验证明铆钉固定因压迫减少了髌腱的血运及供氧,不适用于固定髌腱。Abboud 等[21]则特别强调伸膝位支具固定在伸膝装置重建中的作用,认为此举有利于髌腱的瘢痕愈合,文献报道中一般固定 4~8 周不等。
二、髌腱-自体松质骨-假体
Bickels 等[24]报道了 55 例,髌腱以 Dacron 带与假体预制环固定,在髌腱与假体间植入自体松质骨以加强界面强度,术后伸直位制动 6 周,术后 1 周允许部分负重,所有患者至少随访 2 年,中位 75.5 个月,主被动伸膝度差( 0°~20° ) 者 44 例,( 20°~30° ) 者 10 例,仅 1 例>40°,MSTS 评分>70% 者 48 例,50%~59% 者 6 例,<50% 者1 例,所有主被动伸膝度差<20° 者 MSTS 评分均>70%,8 例出现髌腱撕脱。
Bickels 等[24]认为髌腱与自体松质骨之间早期可通过Dacron 带直接固定获得即刻的稳定,后期可通过瘢痕长入形成生物愈合;而自体松质骨与多孔金属界面的愈合尚存争议,现有文献支持均限于假体的非水泥型髓内固定,二者区别在于:界面间非压力作用而是牵张力,髓外环境较髓内环境血运有限,界面接触面积有限,为解决这些问题,Bickels 等[24]同时加用腓肠肌内侧头覆盖以增加局部血运并加强髌腱,但仍有部分患者出现了髌腱撕脱。Urban 等[25]通过实验指出松质骨与多孔金属的愈合的实质是纤维长入而非骨长入,强度有限。因此自体松质骨与假体金属之间仍存在一定的撕脱风险。
三、髌腱-人工材料-假体
髌腱-人工材料界面主要通过直接缝合固定,根据人工材料-假体界面的固定方式,又可分为:
1. 人工材料与假体上预制孔 / 环固定:Shimose 等[26]采用 Leeds-Keio 人工韧带将髌腱固定于假体预制孔上,术后支具固定 3 周,8 周起部分负重,共 7 例,平均随访32 个月,超过 1 年者 5 例,主被动伸膝度差 25° ( 0°~60° ),其中 2 例>20°。作者同时测量了髌骨的 Insall-Salvati 值,术前平均为 1.08,术后平均为 0.72,但术后18 个月又恢复至术前水平,证明尽管术中将髌腱与假体紧密连接,但术后髌骨仍会逐渐出现上移,这提示在恢复膝关节主动活动后,髌腱及人工韧带持续受牵拉而出现有效长度变化[27-29],这一变化会进一步影响伸膝力量和主动伸膝角度。
Dominkus 等[30]报道了 11 例,采用 LARS 韧带将髌腱固定于假体的胫骨结节水平,术后部分负重、限制膝关节活动 6 周,平均随访 44 个月,主被动伸膝度差<5° 5 例,( 5°~20° ) 2 例,( 20°~40° ) 2 例,>40° 2 例,MSTS 评分平均 81% ( 69%~92% ),3 例出现髌腱撕脱。
Dominkus 等[30]通过组织学证明 LARS 韧带具有较强的诱导结缔组织长入及瘢痕形成的潜能,髌腱-人工韧带界面可通过瘢痕形成提供可靠的应力支持。人工韧带-假体界面模仿了髌韧带的生物学附丽位置,但应力集中在人工韧带与假体预制孔之间的接触点上,随访中撕脱病例并不少见。人工韧带具有一定的延展性,长期反复牵拉后其有效长度可能出现改变,影响伸膝力量及主动伸膝角度,长期随访主被动伸膝度差可能会变大。
2. 人工材料包绕假体固定:Ozaki 等[31]报道了 3 例,采用双层 Marlex 补片包绕胫骨假体,髌腱与包绕假体的补片缝合固定,术后石膏固定 3 周,6 周开始部分负重,平均随访 25 个月,主被动伸膝度差 0° 2 例,5° 1 例,平均MSTS 评分 77% ( 73%~80% ),3 例均未出现髌腱撕脱。
Gosheger 等[32]报道了 7 例,采用 Trevira 管包绕胫骨假体,髌腱与包绕假体的 Trevira 管缝合固定,平均随访 31.6 个月,平均主被动伸膝度差 7.5° ( 0°~30° ),平均MSTS 评分 78.2%,7 例均未出现髌腱撕脱。在后续的报道中,Gosheger 等[33]将病例数扩大到 42 例,重建方法不变,术后支具制动 4 周,平均随访 45 个月,平均主被动伸膝度差 5° ( 0°~20° ),平均 MSTS 评分 83%,仅 1 例术后制动不足 4 周的患者出现髌腱撕脱,该方法重建伸膝装置整体功能较满意,同时也强调了术后制动的重要性。
徐海荣等[34]分析因复发而截肢的组织标本,组织病理学证实结缔组织和胶原纤维可向人工补片纤维内长入,实现瘢痕愈合,未见大量炎细胞浸润,说明补片的组织相容性良好,生物力学实验证实髌腱-补片界面的最大抗拉载负荷能够满足伸膝功能[15,35]。Gosheger 等[32-33]通过组织切片证实髌腱-Trevira 管也能形成类似的牢固界面。人工材料-假体界面通过双层包绕缝合固定,将人工材料与假体金属之间的应力转化为二者之间的摩擦力,避免了应力集中造成的局部磨损,且随瘢痕组织形成摩擦力逐渐增大,实现该界面的长期坚强固定。由于在两个界面间均实现了较为坚强稳固的固定,长期随访中主被动伸膝度差较理想,髌腱撕脱报道罕见。
四、髌腱-腓骨-残存胫骨
Coombs 等[36]报道 1 例,游离带血管蒂的腓骨近端,与残存胫骨固定,残存髌腱与腓骨近端的残存二头肌腱缝合固定,术后支具固定,免负重 6 周,随访 12 个月,患者主被动伸膝度差 0°,未见髌腱撕脱。
Petschnig 等[37]报道 12 例,采取类似 Coombs 的重建方式,支具固定 6 周,后部分负重,术后 3 个月完全负重,平均随访 60 个月,平均主被动伸膝度差 7.5° ( 0°~15° ),MSTS 评分优:7 例,良:5 例,未见髌腱撕脱。Ogihara 等[38]指出该重建方式仅限于化疗效果好,有条件保留腓骨近端的患者。
该重建方法两个界面均为生物学重建,固定可靠,远期功能好,并发症少,未见髌腱撕脱报道。但手术操作复杂,受肿瘤切除范围制约,应用范围有限,在恶性肿瘤中的应用尚存争议。
五、髌腱加强
除重建界面外,伸膝装置重建还存在不同的髌腱加强方式,加强的目的在于增加界面的接触面积和髌腱的度。根据加强方式可分为:生物学加强、生物学+人工材料加强 ( 表1 )。
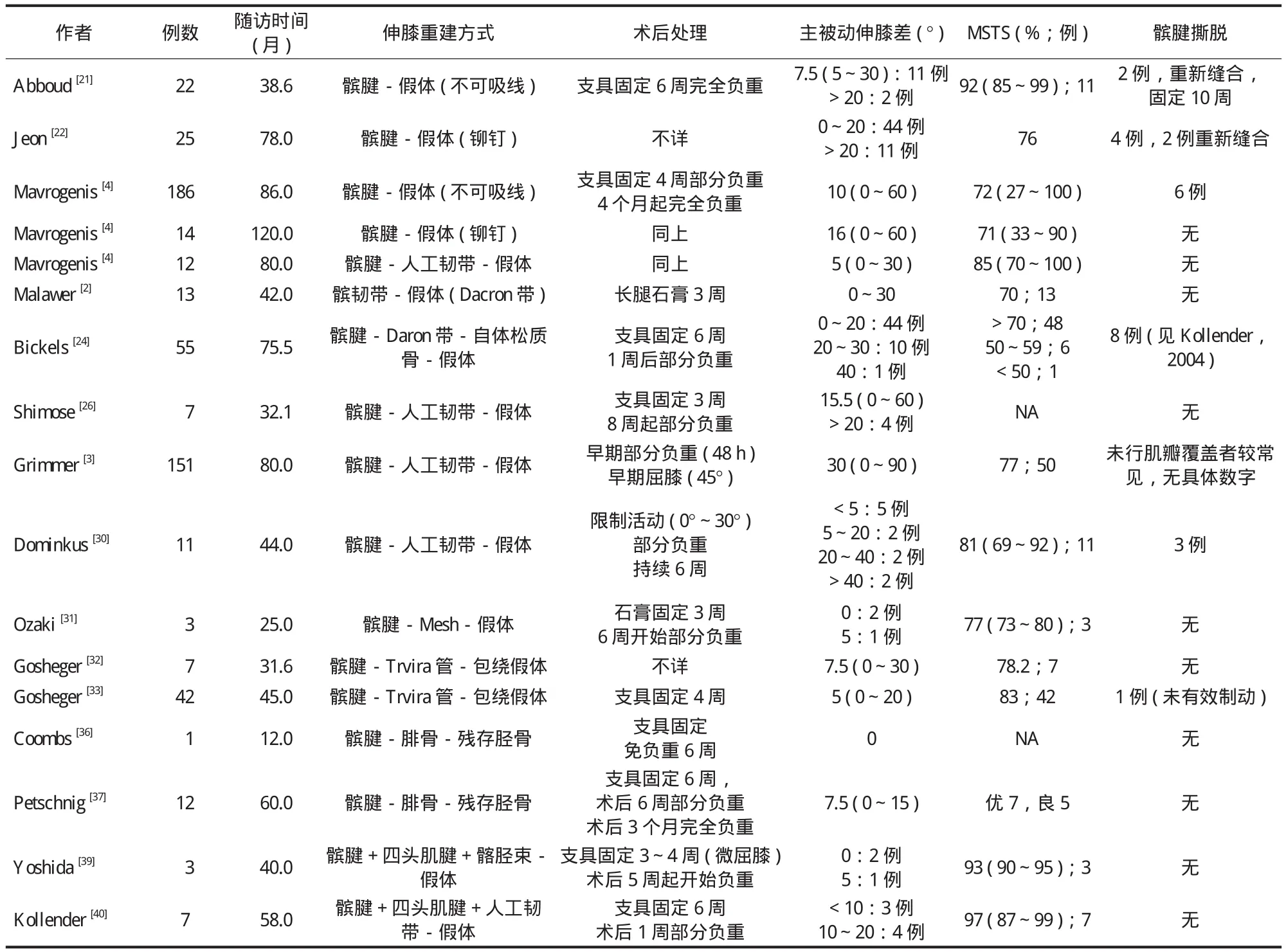
表1 已发表文章的胫骨近端假体伸膝装置重建方式Tab.1 Reconstruction of extensor apparatus in proximal tibial prosthetic replacement from published articles
Yoshida 等[39]报道 3 例,采取四头肌腱+髂胫束联合加强髌腱后直接固定于假体预制环,术后支具固定 3~4 周,5 周起开始负重,平均随访 40 个月,主被动伸膝度差 0° 2 例,5° 1 例,平均 MSTS 评分 93% ( 90%~95% ),未出现髌腱撕脱。
Bickels 采取髌腱-自体松质骨-假体重建的 55 例中有 8 例出现髌腱撕脱,Kollender 等[40]采取部分四头肌腱翻转加 Gore-Tex 带对其中的 7 例进行髌腱加强,术后支具固定 6 周,术后 1 周部分负重,平均随访 58 ( 29~83 ) 个月,主被动伸膝度差 ( 0°~10° ) 者 3 例,( 10°~20° ) 者 4 例,MSTS 评分 87%~100%,未出现髌腱撕脱。
单纯的髌腱加强并未改变髌腱与假体之间界面的性质,理论上可与其它重建方式联合应用,但多涉及生物学加强,重建材料的选择受肿瘤切除范围限制,操作较复杂,在恶性肿瘤中的应用尚存争议,因此报道例数较少。
伸膝装置重建成功与否取决于残存髌腱与假体之间是否能实现有效的固定,有效的固定是由稳定牢固的接触界面决定的,单一界面 ( 髌腱-假体 ) 无法实现最终的愈合;双重界面重建中,髌腱与自体骨、人工材料界面均可实现有效的固定,自体骨、人工材料再通过瘢痕形成与假体界面固定;生物学重建和加强方法,固定可靠,远期功能好,并发症少,未见髌腱撕脱,但受肿瘤切除范围制约,操作较复杂,难以标准化,应用范围有限。总结上述重建方式可以看出,目前伸膝装置重建尚无理想的解决方案,双重界面重建方式理论上可能在两个界面间均实现较为坚强的固定,可以作为伸膝装置重建的一种选择。
[1] Malawer MM, McHale KA. Limb-sparing surgery for high-grade malignant tumors of the proximal tibia. Surgical technique and a method of extensor mechanism reconstruction[J]. Clin Orthop Relat Res, 1989, 239(239): 231-248.
[2] Malawer MM, Chou LB. Prosthetic survival and clinical results with use of large-segment replacements in the treatment of high-grade bone sarcomas[J]. J Bone Joint Surg Am, 1995, 77(8):1154-1165.
[3] Grimer RJ, Carter SR, Tillman RM, et al. Endoprosthetic replacement of the proximal tibia[J]. J Bone Joint Surg Br, 1999, 81(3):488-494.
[4] Mavrogenis AF, Pala E, Angelini A, et al. Proximal tibial resections and reconstructions: clinical outcome of 225 patients[J]. J Surg Oncol, 2013, 107(4):335-342.
[5] Krishnamoorthy VP, Inja DB, Roy AC. Knee extensor loss and proximal tibial soft tissue defect managed successfully with simultaneous medial gastrocnemius flap, saphenous fasciocutaneous flap and medial hemisoleus flap: a case report[J]. J Med Case Rep, 2013, 7(1):76.
[6] Ek EW, Rozen WM, Ek ET, et al. Surgical options for reconstruction of the extensor mechanism of the knee after limb-sparing sarcoma surgery: an evidence-based review[J]. Arch Orthop Trauma Surg, 2011, 131(4):487-495.
[7] Capanna R, Scoccianti G, Campanacci DA, et al. Surgical technique: extraarticular knee resection with prosthesisproximal tibia-extensor apparatus allograft for tumors invading the knee[J]. Clin Orthop Relat Res, 2011, 469(10):2905-2914.
[8] Wittig JC, Villalobos CE, Hayden BL, et al. Osteosarcoma of the proximal tibia: limb-sparing resection and reconstruction with a modular segmental proximal tibia tumor prosthesis[J]. Ann Surg Oncol, 2010, 17(11):3021.
[9] Zhang Y, Yang Z, Li X, et al. Custom prosthetic reconstruction for proximal tibial osteosarcoma with proximal tibiofibular joint involved[J]. Surg Oncol, 2008, 17(2):87-95.
[10] Myers GJ, Abudu AT, Carter SR, et al. The long-term results of endoprosthetic replacement of the proximal tibia for bone tumours[J]. J Bone Joint Surg Br, 2007, 89(12):1632-1637.
[11] Oddy MJ, Pendegrass CJ, Goodship AE, et al. Extensor mechanism reconstruction after proximal tibial replacement[J]. J Bone Joint Surg Br, 2005, 87(6):873-878.
[12] Mavrogenis AF, Angelini A, Pala E, et al. Reconstruction of the extensor mechanism after major knee resection[J]. Orthopedics, 2012, 35(5):e672-680.
[13] Sundar S, Pendegrass CJ, Oddy MJ, et al. Tendon reattachment to metal prostheses in an in vivo animal model using demineralised bone matrix[J]. J Bone Joint Surg Br, 2009, 91(9):1257-1262.
[14] Pendegrass CJ, Sundar S, Oddy MJ, et al. A comparison of augmentation techniques for reconstruction of the extensor mechanism following proximal tibial replacement in an experimental animal model[J]. J Bone Joint Surg Br, 2008, 90(4):535-541.
[15] Browne JA, Hanssen AD. Reconstruction of patellar tendon disruption after total knee arthroplasty: results of a new technique utilizing synthetic mesh[J]. J Bone Joint Surg Am, 2011, 93(12):1137-1143.
[16] Muscolo DL, Ayerza MA, Farfalli G, et al. Proximal tibia osteoarticular allografts in tumor limb salvage surgery[J]. Clin Orthop Relat Res, 2010, 468(5):1396-1404.
[17] Gilbert NF, Yasko AW, Oates SD, et al. Allograft-prosthetic composite reconstruction of the proximal part of the tibia. An analysis of the early results[J]. J Bone Joint Surg Am, 2009, 91(7):1646-1656.
[18] Higuera CA, Inoue N, Lim JS, et al. Tendon reattachment to a metallic implant using an allogenic bone plate augmented with rhOP-1 vs. autogenous cancellous bone and marrow in a canine model[J]. J Orthop Res, 2005, 23(5):1091-1099.
[19] Zeegen EN, Aponte-Tinao LA, Hornicek FJ, et al. Survivorship analysis of 141 modular metallic endoprostheses at early followup[J]. Clin Orthop Relat Res, 2004, 420(420):239-250.
[20] Wunder JS, Leitch K, Griffin AM, et al. Comparison of two methods of reconstruction for primary malignant tumors at the knee: a sequential cohort study[J]. J Surg Oncol, 2001, 77(2):89-99.
[21] Abboud JA, Patel RV, Donthineni-Rao R, et al. Proximal tibial segmental prosthetic replacement without the use of muscle f aps[J]. Clin Orthop Relat Res, 2003, 414(414):189-196.
[22] Jeon DG, Kawai A, Boland P, et al. Algorithm for the surgical treatment of malignant lesions of the proximal tibia[J]. Clin Orthop Relat Res, 1999, 358(358):15-26.
[23] Rempel D, Abrahamsson SO. The effects of reduced oxygen tension on cell proliferation and matrix synthesis in synovium and tendon explants from the rabbit carpal tunnel: an experimental study in vitro[J]. J Orthop Res, 2001, 19(1): 143-148.
[24] Bickels J, Wittig JC, Kollender Y, et al. Reconstruction of the extensor mechanism after proximal tibia endoprosthetic replacement[J]. J Arthroplasty, 2001, 16(7):856-862.
[25] Urban RM, Jacobs JJ, Sumner DR, et al. The bone-implant interface of femoral stems with non-circumferential porous coating[J]. J Bone Joint Surg Am, 1996, 78(7):1068-1081.
[26] Shimose S, Sugita T, Kubo T, et al. Reconstructed patellar tendon length after proximal tibia prosthetic replacement[J]. Clin Orthop Relat Res, 2005, 439(439):176-180.
[27] Osanai T, Tsuchiya T, Sugawara M. Histologic examination of Leeds-Keio artificial ligament implanted on the surface of a tumor endoprosthesis[J]. J Arthroplasty, 2009, 24(1):e5-7.
[28] Sherief TI, Naguib AM, Sefton GK. Use of Leeds-Keio connective tissue prosthesis (L-K CTP) for reconstruction of def cient extensor mechanism with total knee replacement[J]. Knee, 2005, 12(4):319-322.
[29] Fujikawa K, Ohtani T, Matsumoto H, et al. Reconstruction of the extensor apparatus of the knee with the Leeds-Keio ligament[J]. J Bone Joint Surg Br, 1994, 76(2):200-203.
[30] Dominkus M, Sabeti M, Toma C, et al. Reconstructing the extensor apparatus with a new polyester ligament[J]. Clin Orthop Relat Res, 2006, 453:328-334.
[31] Ozaki T, Kunisada T, Kawai A, et al. Insertion of the patella tendon after prosthetic replacement of the proximal tibia[J]. Acta Orthop Scand, 1999, 70(5):527-529.
[32] Gosheger G, Hillmann A, Lindner N, et al. Soft tissue reconstruction of megaprostheses using a trevira tube[J]. Clin Orthop Relat Res, 2001, 393(393):264-271.
[33] Gosheger G, Gebert C, Ahrens H, et al. Endoprosthetic reconstruction in 250 patients with sarcoma[J]. Clin Orthop Relat Res, 2006, 450(450):164-171.
[34] 徐海荣, 牛晓辉, 张清, 等. 人工补片用于胫骨假体近端重建髌韧带附丽的生物力学特点和组织学表现[J]. 中国骨与关节杂志, 2012, 5(6):627-630.
[35] Pendegrass CJ, Oddy MJ, Sundar S, et al. The novel use of resorbable Vicryl mesh for in vivo tendon reconstruction to a metal prosthesis[J]. J Bone Joint Surg Br, 2006, 88(9): 1245-1251.
[36] Coombs CJ, O’Sullivan M, Theile R, et al. Method of quadriceps attachment following upper tibial resection[J]. Microsurgery, 2006, 26(2):106-110.
[37] Petschnig R, Baron R, Kotz R, et al. Muscle function after endoprosthetic replacement of the proximal tibia. Different techniques for extensor reconstruction in 17 tumor patients[J]. Acta Orthop Scand, 1995, 66(3):266-270.
[38] Ogihara Y, Sudo A, Fujinami S, et al. Limb salvage for bone sarcoma of the proximal tibia[J]. Int Orthop, 1991, 15(4): 377-379.
[39] Yoshida Y, Osaka S, Ryu J. Reconstruction of the knee extensor mechanism in patients with a malignant bone tumor of the proximal tibia[J]. Surg Today, 2010, 40(7):646-649.
[40] Kollender Y, Bender B, Weinbroum AA, et al. Secondary reconstruction of the extensor mechanism using part of the quadriceps tendon, patellar retinaculum, and Gore-Tex strips after proximal tibial resection[J]. J Arthroplasty, 2004, 19(3): 354-360.
( 本文编辑:裴艳宏 )
Research progress on reconstruction of extensor apparatus in proximal tibial prosthetic replacement
SUN Yang,NIU Xiao-hui. Department of Orthopedic Oncology, Beijing Jishuitan Hospital, Beijing, 100035, China
NIU Xiao-hui, Email: niuxiaohui@263.net
ObjectiveTo explore the reconstruction of extensor apparatus in proximal tibial prosthetic replacement.MethodsAccording to the number and type of contact surfaces, the reconstruction methods are divided into the following categories: ( 1 ) Single interface: patellar tendon-prosthesis; ( 2 ) Dual interface: according to the type of interfaces: patellar tendon-artif cial material-prosthesis; patellar tendon-cancellous bone-prosthesis; patellar tendonf bula-residual tibia. The difference in degree of active and passive knee extension, Musculoskeletal Tumor Society ( MSTS ) score and incidence of patellar tendon avulsion are used to evaluate the effects of reconstruction.ResultsThe successful reconstruction of extensor apparatus depends on the effective f xation between the remaining patellar tendon and the prosthesis. The effective f xation is determined by the stable contact interface. The single interface ( patellar tendon-prosthesis ) can’t achieve the f nal healing. The interface between the patellar tendon and the autogenous bone or the artif cial material can achieve effective healing, and the autogenous bone or the artif cial material can be f xed with the prosthesis through the scar formation. The biological reconstruction and strengthening method are reliable, and the patellar tendon avulsion rarely occurs. However, the operation is complicated and diff cult to be standardized, so the scope of application is limited.ConclusionsThere is no ideal solution for the reconstruction of extensor apparatus. Dual interface reconstruction may theoretically achieve effective healing between the 2 interfaces, and it can be used as an alternative for extensor apparatus reconstruction.
Tibia; Bone neoplasms; Arthroplasty, replacement, knee; Bone reconstruction
10.3969/j.issn.2095-252X.2017.02.014
R738.1, R687.3
100035 北京积水潭医院骨肿瘤科
牛晓辉,Email: niuxiaohui@263.net
2016-04-30 )
