六堡茶多糖理化性质、体外抗氧化及其对人脐静脉血管内皮细胞的保护作用
2017-02-22应乐潘越王岳飞徐平
应乐,潘越,王岳飞,徐平
六堡茶多糖理化性质、体外抗氧化及其对人脐静脉血管内皮细胞的保护作用
应乐,潘越,王岳飞,徐平*
浙江大学茶学系,浙江杭州 310058
以六堡茶为原料,利用水提醇沉法制得茶多糖粗品,经脱蛋白纯化后用30%、50%、70%的乙醇溶液进行分段,得到3种六堡茶多糖LTPS-30、LTPS-50和LTPS-70,并分析了其化学组成、分子量分布等理化性质;以自由基清除法(ABTS)和铁离子还原法(FRAP)评价其抗氧化活性;并以Na2S2O3损伤的人脐静脉血管内皮细胞(HUVEC)为模型,探讨了它们对HUVEC氧化损伤的保护作用。结果表明,3种六堡茶多糖样品均为主要含有2个组分的非均一酸性多糖,平均分子量和总糖含量均为LTPS-70<LTPS-50<LTPS-30;而在蛋白质和总酚含量及两种抗氧化体系下的抗氧化活力均为LTPS-70>LTPS-50>LTPS-30,且LTPS-70表现出最强的细胞保护作用。说明茶多糖粗品经70%乙醇纯化后具有较强的生物活性,具有良好的应用前景。
六堡茶;茶多糖;抗氧化活性;人脐静脉血管内皮细胞
茶多糖是一类结构复杂的杂多糖及其复合物,是茶叶中除茶多酚外的主要活性物质。研究表明茶多糖具有多种生物活性[1],如降血糖、预防糖尿病、降血脂、抗动脉粥样硬化、降血压、抗凝血、抗血栓、防治心血管疾病等[2],是一种很有前景的天然产物[3]。目前有关茶多糖的研究中,关于其化学成分、分子量、单糖组成的报道较不一致,被认为与提取茶多糖所用的茶叶原料与提取分离方法有关[3]。六堡茶是我国的历史名茶,因原产于广西梧州六堡乡(现为六堡镇)而得名[4],为黑茶的一种,属后发酵茶。六堡茶以梧州大叶毛茶为原料,经潮水归堆、渥堆发酵、干燥、蒸压、晾置陈化等工序制成[5],成茶品质“红、浓、陈、醇”,具有解腻消滞、清热利湿、助消化等功能[6]。在民间陈年六堡茶常被用作防病治病的良药。然而,目前有关六堡茶尤其是六堡茶多糖的内容鲜有报道。
血管是组成人体的重要部分。血管内皮细胞损伤导致的功能障碍与多种心血管疾病的发生密切相关,保护血管内皮功能是防治相关疾病的关键环节[7]。在进行血管内皮细胞实验时,通常选用人脐静脉血管内皮细胞(HUVEC)作为体外的细胞模型,以研究血管功能与疾病,对疾病防治与药物开发有着重要意义。Chen等[8]研究证明,绿茶多糖复合物对高糖造成的HUVEC损伤具有保护作用,认为从低档绿茶中提取制备得到的3种茶多糖复合物具有开发治疗糖尿病血管并发症的无毒副作用的药剂的潜力。王岳飞等[9]以对Na2S2O3损伤的HUVEC的保护作用作为评价普洱茶提取物的指标之一。Na2S2O3损伤模型能较好地模拟细胞缺氧状态,便于分析研究细胞损伤后的恢复过程及药物的保护作用[10]。目前,六堡茶多糖对HUVEC的保护作用尚未见报道。
茶多糖的分离提取方法目前主要有热酚法、水提法、水提醇沉法、酶提法、微波提取和超临界萃取法等[11-13],而目前最常用的为水提醇沉法。多糖的纯化工艺一般分为两步,第一步是脱蛋白和脱色,一般通过Sevag法或者三氯乙酸来脱蛋白,通过离子交换法、金属络合法脱色;第二步是纯化,常见的方法有沉淀分级分离法、季胺盐沉淀法(CTAB)、超滤法、柱层析等[14]。
本文以六堡茶为原料,利用水提醇沉法制备六堡茶多糖,用不同体积分数的乙醇溶液(70%、50%、30%)分级提取六堡茶多糖,得到3种六堡茶多糖LTPS-70、LTPS-50和LTPS-30,对这3种六堡茶多糖的分子量分布、红外光谱及化学成分组成进行分析;通过测定ABTS自由基清除能力和FRAP铁离子还原能力,评价了3种六堡茶多糖的抗氧化活性;并以Na2S2O3损伤的HUVEC细胞为模型,初步探讨了3种六堡茶多糖对HUVEC氧化损伤的保护作用,以期对醇溶分段所得的3种六堡茶多糖形成较为系统的评价,探讨不同浓度乙醇溶解提取的茶多糖的生物活性,并为六堡茶的深度开发利用提供依据。
1 材料与方法
1.1 材料与试剂
六堡茶散茶购自广西梧州市纯好茶业有限公司,为春季采摘生产的双蒸型熟茶;透析袋(截留分子量为7 000 Da);考马斯亮蓝G-250及牛血清蛋白购自上海国药化学试剂有限公司;8种单糖标准品(L-鼠李糖、L-阿拉伯糖、D-阿拉伯糖、D-木糖、D-甘露糖、D-葡萄糖、D-半乳糖和半乳糖醛酸)、二叔丁基对甲酚(Butylated hydroxytoluene, BHT)、乙二胺四乙酸(Ethylenediaminetetraacetic acid, EDTA)、2,2′-azino-bis-(3-ethylbenzothiazoline- 6-sulphonic acid) diammonium salt(ABTS)、1,1-diphenyl-2-picrylhydrazyl(DPPH)及2,4,6-tripyridyl-s-triazine(TPTZ)均购自美国密苏里州化工有限公司;葡聚糖购自美国Sigma公司;1-苯基-3-甲基-5-吡唑啉酮(PMP)、咔唑购自上海阿拉丁公司;一级色谱纯乙腈、甲醇购自天津市四友精细化学品有限公司;人脐静脉血管内皮细胞(Human umbilical vascular endothelial cells, HUVEC)购自上海博谷生物科技有限公司;二甲基亚砜(DMSO)购自国药集团化学试剂有限公司;四甲基偶氮唑盐(3-(4,5-dimethylthiazol-2-yl)-2,4-diphenyltetrazolium bromide, MTT)购自凯基生物科技发展有限公司;胰蛋白酶、青霉素、链霉素购自杭州四季青试剂公司;DMEM培养基、胎牛血清购自GIBCO生物技术公司;其他试剂均为分析纯。
1.2 仪器设备
小宝XB-02多功能粉碎机;上海亚荣RE-5205旋转蒸发器;GZX-9246MBE数显鼓风干燥箱;常州澳华HH-6数显恒温水浴锅;德国CHRIST ALPHA 1-4LD plus冷冻干燥机;惠普8493紫外分光光度计;赛多利斯丹佛TP214电子天平;TGL-16M高速台式冷冻离心机;美国Waters-515型高效液相色谱仪;美国Waters-2410示差折光检测器;美国Thermo AVATAR370红外光谱分析仪;日本岛津高效液相色谱分析系统SPD20A、DGU、LC20AD;岛津C18色谱柱(4.6 mm×250 mm,5 μm);酶标仪(Thermal Lab System, Finland);日本Olympus倒置显微镜;Thermo二氧化碳培养箱;超净工作台。
1.3 茶多糖的提取、纯化与分段
取100 g六堡茶茶粉于锥形瓶中,加入1.0 L 80%乙醇溶液,静置24 h。抽滤后,取其滤渣并干燥后,于80℃水浴锅中热水萃取(料水比1∶10,/)2次,每次1 h。合并萃取液,用旋转蒸发仪浓缩至原体积的10%。向浓缩液中加入4倍体积的95%乙醇,在4℃恒温冰柜放置24 h,使多糖沉淀。在8 000 r·min-1、4℃条件下,多次离心收集沉淀。获得的沉淀依次用无水乙醇、丙酮、乙醚交替洗涤,反复3次,风干,即得到六堡茶多糖粗制品。将六堡茶多糖粗制品溶于80℃热水中。采用Sevage法去除游离蛋白。脱蛋白后的多糖溶液利用截留分子量为7 000 Da的透析袋透析48 h,去除粗多糖溶液中的有机试剂和小分子的成分。将透析后的六堡茶多糖溶液合并,用旋转蒸发仪蒸发浓缩,于真空冷冻干燥机下干燥72 h,冻干成粉。将得到的茶多糖先用70%乙醇溶解,静置后取上清液旋转蒸发去除乙醇,并冷冻干燥得样品LTPS-70,将剩余的茶多糖用50%的乙醇继续溶解,取上清液同上步骤得样品LTPS-50,再用30%的乙醇溶解剩余茶多糖,取上清液同上处理得样品LTPS-30。
1.4 茶多糖主要生化成分含量测定
样品中蛋白质含量采用考马斯亮蓝法测定,总酚含量采用福林酚法测定,总糖含量采用苯酚硫酸法测定,糖醛酸含量采用以半乳糖醛酸为标准的硫酸-咔唑法进行测定。分子量采用美国Waters 515型凝胶色谱仪系统,以HP高效凝胶色谱法分析,色谱条件为色谱柱:TOSOH BIOSEP G4000SWXL(7.8 mm× 300 mm),流动相为0.2 mol·L-1NaNO3溶液,流速0.8 mL·min-1,进样量50 μL,柱温40℃。检测器为美国Waters 2410示差折光检测器;标样为系列葡聚糖,平均分子量分别为413 000、76 900、43 500、10 500、5 000 Da。
单糖组成分析参考Lv等人[15]的方法,分别将20 mg干燥的LTPS-30、LTPS-50、LTPS-70粉末溶解于2 mL 3 mol·L-1三氟乙酸(TFA)中,充氮气封管,沸水浴水解8 h;冷却至室温,1 000 r·min-1下离心5 min数次,取上清液,冷冻干燥;向冻干后的样品中加入1 mL蒸馏水。单糖标准品制备:分别将各单糖标准品适量溶解于10%甲醇中,得到2.0 mmol·L-1的各单糖标准品溶液;取各单糖标准品溶液配制成混标溶液。PMP衍生化:取1 mL样品试液或标准品溶液,加入50 μL 0.3 mol·L-1NaOH和50 μL 0.5 mol·L-1PMP的甲醇溶液;摇匀,于70℃水浴中反应60 min;冷却至室温用50 μL 0.3 mol·L-1HCl中和;混匀后用1 mL三氯甲烷萃取,弃去下层有机相,如此重复操作3次;过0.45 μm微孔滤膜,备用。HPLC色谱条件:岛津C18色谱柱(4.6 mm×250 mm,5 μm),检测波长250 nm,流速0.8 mL·min-1,柱温35℃,进样量20 μL;流动相A:0.045% KH2PO4加0.05%三乙胺缓冲液(pH 7.0),流动相B:乙腈;梯度洗脱:0~5 min,20%~29% B;5~12 min,29% B;12~35 min,29%~70% B。红外光谱分析采用红外分光光度计在400~4 000 cm-1范围内进行扫描,观察峰谱情况。
1.5 茶多糖体外抗氧化能力测定
1.5.1 ABTS自由基清除能力测定
将100 μL待测液加入3 mL的ABTS应用液,充分混合,室温下避光反应6 min后,测定其在734 nm处的吸光度,记为A样品。以100 μL样品与3 mL蒸馏水的混合液作为空白组,测得吸光值记为A空白,以100 μL蒸馏水与3 mL ABTS应用液的混合液为对照组,测得吸光值记为A对照。ABTS自由基清除能力= [1-(A样品-A空白)/A对照]×100%。以BHT做阳性对照。
1.5.2 FRAP铁离子还原能力测定
吸取0.5 mL系列浓度为25、100、150、200、400、500、800、1 000、1 500 μmol·L-1的FeSO4溶液与0.5 mL 10 mmol·L-1TPTZ的HCl溶液和5 mL 300 mmol·L-1醋酸-醋酸钠缓冲液(pH=3.6)混合,于593 nm下读取吸光值。以FeSO4溶液的浓度为纵坐标,吸光值为横坐标绘制标准曲线。分别将待测样0.6 mL加入到4.5 mL FRAP工作液中,8 min后于593 nm处读取吸光值A反应后,0.6 mL蒸馏水与4.5 mL FRAP的混合液作为对照组,所测吸光值记为A反应前。由A反应后-A反应前的差值在标准曲线上获得抗氧化物质相应的FeSO4的浓度,定义为FRAP值。以BHT做阳性对照。
1.6 HUVEC损伤模型建立及细胞存活率测定
HUVEC用含10%胎牛血清、100 U·mL-1青霉素/链霉素的DMEM培养基,在37%、5% CO2培养箱中培养,用0.25%含EDTA的胰酶消化传代,取对数生长期细胞,调整细胞密度至每毫升1×105个细胞,每孔100 μL,接种于96孔板,用于实验研究。
损伤模型建立:细胞分空白组、对照组、Na2S2O3损伤组。空白组无细胞,加入100 μL培养液;对照组加入100 μL培养液;Na2S2O3损伤组加入100 μL不同浓度的Na2S2O3溶液,采用MTT法检测细胞的存活率,确定Na2S2O3最佳损伤浓度。
样品对Na2S2O3诱导的HUVEC的保护作用:样品处理组先加入50 μL样品,2 h后加入50 μL处理浓度的Na2S2O3溶液,以40 μg·mL-1的Na2S2O3诱导HUVEC受损。处理后的各组在37℃、5% CO2培养箱中培养24 h,用MTT法检测细胞的存活率。
MTT法检测细胞存活率:HUVEC细胞用不同样品处理24 h后,用PBS清洗1次,加50 μL的MTT后等待4 h,至蓝紫色结晶甲瓒完全溶解,小心吸出孔内培养液,每孔加入150 μL DMSO,将96孔板置于微孔板振荡器振荡10 min,使结晶溶解,在490 nm下用酶标仪检测吸光值。
细胞存活率=[(OD样品-OD空白)/(OD对照-OD空白)]×100%。
1.7 数据统计与分析
每次实验重复3次,取平均值,用JMP 10.0.0软件Turkey HSD检验法对样品多组间差异进行检验,两组间比较采用检验。利用SPSS16.0分析皮尔森相关系数。
2 结果与分析
2.1 六堡茶多糖主要化学成分
3种六堡茶多糖的总糖、蛋白质、糖醛酸、总酚含量如表1所示。分段浸提的乙醇溶液浓度越低,溶液极性越大,因此3种样品所含的主要生化成分也存在显著差异。实验结果显示,LTPS-30的总糖含量显著高于LTPS-50和LTPS-70,而3个样品的蛋白质含量变化趋势恰好与总糖含量趋势相反。测定结果显示,LTPS-30、LTPS-50、LTPS-70的糖醛酸含量分别为29.65%、24.46%、27.71%,测量值之间存在显著差异,但实验结果并未表现出乙醇溶液的浓度对所溶解茶多糖的糖醛酸含量影响的规律性。LTPS-70的总酚含量为26.91%,显著高于LTPS-30和LTPS-50的总酚含量。由此可见,较大极性的溶液可浸提出较多的总糖和糖醛酸,却得到较少的蛋白质和酚类物质;极性较小的溶液可浸提出较多的酚类物质和蛋白质,但却得到较少的糖类物质。
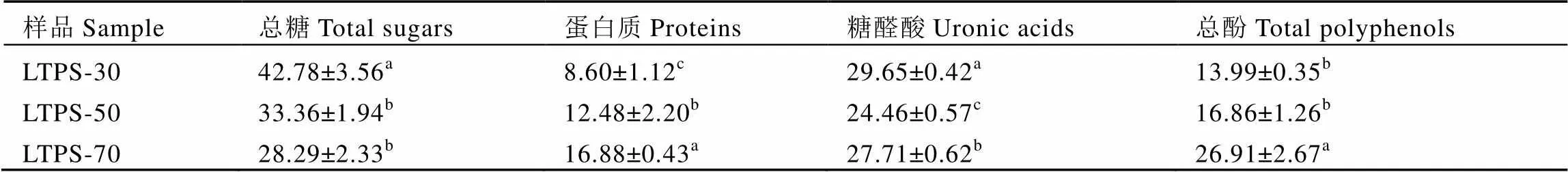
表1 六堡茶多糖样品的主要化学成分含量
注:此表为同一列中数据的显著性比较,字母相同表示无显著性差异,字母不同表示有显著性差异,<0.05。
Note: Data in the same row are compared by one way-ANOVA. The same letter indicates no significant difference and different letters indicate significant difference,<0.05.
2.2 分子量分布
经GPC软件处理,以标准葡聚糖分子量的对数(Log Mol Wt)对保留时间进行回归,葡聚糖系列标准品校正曲线方程为Log Mol Wt=9.75e-3.70e-1T(T为保留时间),相关系数R为0.997。3种六堡茶多糖样品分子量分布的分析结果如图1和表2所示。这3个样品均主要含有2个组分,为非均一多糖。LTPS-30的分子量为49.0 kDa(46.88%)和7.1 kDa(53.12%);LTPS-50的分子量为42.2 kDa(27.04%)和6.9 kDa(72.96%);LTPS-70的分子量为6.6 kDa(64.96%)和2.6 kDa(35.04%);并且平均分子量LTPS-30>LTPS-50>LTPS-70。分子量分布情况显示,随着乙醇浓度的降低,溶解在其中的茶多糖的分子量增大。这可能与茶多糖的极性有关,茶多糖的单糖基越多,所带羟基越多,其极性也越大,亲水性更强,在醇中的溶解度越小,因而分子量大的多糖较分子量小的的多糖在乙醇中的溶解度小。因此改变乙醇的浓度,可以初步分离得到不同分子量的多糖。
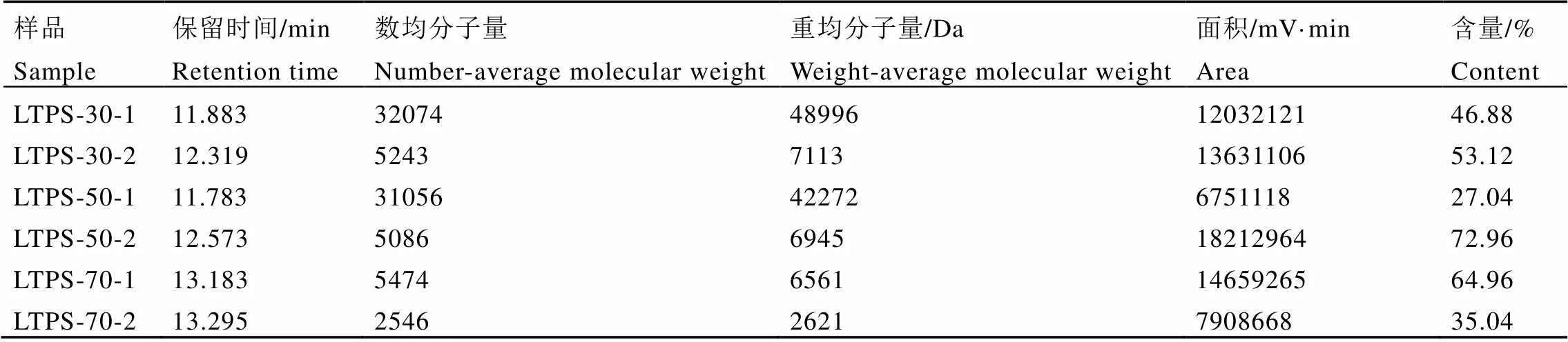
表2 六堡茶多糖高效凝胶色谱结果

注:A:LTPS-30;B:LTPS-50;C:LTPS-70。Note: A: LTPS-30, B: LTPS-50, C: LTPS-70.
2.3 单糖组成分析
通过PMP柱前衍生化HPLC高效液相色谱法测定3种六堡茶多糖样品的单糖组成(图2)。3种六堡茶多糖样品的单糖组成摩尔比见表3。结果表明,LTPS-30单糖组成以甘露糖、鼠李糖、半乳糖和半乳糖醛酸为主;LTPS-50单糖组成以甘露糖、半乳糖、阿拉伯糖和鼠李糖为主;LTPS-70单糖组成以半乳糖和阿拉伯糖为主,LTPS-70样品未检测到甘露糖与半乳糖醛酸。该结果说明乙醇浓度越小,溶液极性越大,其单糖组成也发生变化。
2.4 红外光谱分析
对3种六堡茶多糖进行红外光谱分析,所得结果如图3所示,LTPS-30、LTPS-50、LTPS-70的红外光谱图较为相似,说明它们的结构骨架是基本一致的,只是其相对分子量、单糖组成及各成分含量可能不同。由图可知,这3种六堡茶多糖在3 600~3 000 cm-1区间都出现一种O-H和N-H的伸缩振动宽峰,由于氢键的形成而使吸收峰变宽[16]。在2 930 cm-1附近都有一个相对较弱的吸收峰,为C-H的反对称伸缩振动峰,是糖类的特征吸收峰[17],1 400~1 200cm-1区间不太尖的吸收峰为C-H的变角振动。1 621~1 615 cm-1和1 445~1 417 cm-1处相对较强的吸收峰是羧基和羰基吸收峰[18]。1 200~1 000 cm-1间比较大的吸收峰是由两种C-O键伸缩振动所引起的,一种为C-O-H,另一种是糖环的C-O-C[16]。

注:A:LTPS-30;B:LTPS-50;C:LTPS-70。Note: A: LTPS-30, B: LTPS-50, C: LTPS-70.
2.5 对ABTS自由基的清除能力
LTPS-30、LTPS-50、LTPS-70对ABTS自由基清除能力结果如图4-A所示,3种茶多糖样品的ABTS自由基清除率都随着样品浓度的升高而升高。根据曲线计算得到BHT、LTPS-30、LTPS-50、LTPS-70的IC50值分别为98.9、484.4、399.4、209.9 μg·mL-1。ABTS自由基清除能力按强度排序依次为BHT>LTPS-70>LTPS-50>LTPS-30。
2.6 对FRAP铁离子的还原能力
LTPS-30、LTPS-50、LTPS-70对FRAP铁离子还原能力结果如图4-B所示,3种茶多糖样品的FRAP铁离子还原能力都随着样品浓度的升高而升高,且FRAP铁离子还原能力强度排序依次为LTPS-70>LTPS-50>LTPS-30,这与对ABTS自由基的清除能力结果相似,另与阳性对照BHT进行比较,LTPS-70的FRAP铁离子还原能力始终强于BHT,表明六堡茶多糖具有良好的铁离子还原能力,具有较好的抗氧化作用。
2.7 HUVEC损伤模型建立
如图5-A所示,本研究所用人脐静脉血管内皮细胞(HUVEC)正常贴壁生长时,细胞紧密镶嵌,呈“铺路石样”排列,为内皮细胞的典型特征[19]。图5-B为对照组正常细胞线粒体中的琥珀酸脱氢酶使MTT还原为蓝紫色结晶的图。图5-C为用40 μg·mL-1Na2S2O3损伤过的HUVEC的MTT染色结果。本研究使用Na2S2O3作为氧化剂建立HUVEC的氧化应激损伤模型,用质量浓度为1~500 μg·mL-1的Na2S2O3处理观察细胞损伤情况,结果如图6所示。Na2S2O3呈剂量依赖性地抑制了HUVEC的生长,细胞存活率随着Na2S2O3处理浓度的增加而逐渐降低。当处理质量浓度为40 μg·mL-1及更高时,这种损伤表现出显著性。确定在探讨六堡茶多糖对受损HUVEC保护作用时,以40 μg·mL-1的Na2S2O3诱导HUVEC损伤的发生。
2.8 六堡茶多糖对受损HUVEC的保护作用
用质量浓度为6.25~400 μg·mL-1的3种样品对40 μg·mL-Na2S2O3诱导损伤的HUVEC细胞的保护作用进行研究,结果如图7所示。当样品质量浓度在12.5~400 μg·mL-1区间范围时,LTPS-70、LTPS-50、LTPS-30均呈剂量效应地显著提高HUVEC的存活率(<0.05或<0.01),其中LTPS-70对HUVEC存活率的提高均达到极显著水平(<0.01)。比较同一处理浓度的3种六堡茶多糖对HUVEC的保护作用发现,LTPS-70在各处理浓度下对HUVEC存活率的提高均强于LTPS-50和LTPS-30,当质量浓度为12.5、25、50、400 μg·mL-1时,明显强于LTPS-50与LTPS-30。总之,12.5~400 μg·mL-1的LTPS-70、LTPS-50、LTPS-30均能明显提高40 μg·mL-1Na2S2O3损伤HUVEC的细胞活力,且LTPS-70表现出最强的保护作用。
2.9 相关性分析
用皮尔森系数对多糖的理化性质和其体外抗氧化性能(ABTS法和FRAP法两种体系),以及体外对HUVEC的保护作用的相关性,用SPSS软件进行皮尔森系数计算分析。结果(表4)显示,样品中的总糖含量与ABTS清除能力、FRAP还原能力、HUVEC保护作用均呈显著负相关,相关系数分别为-0.878、-0.864和-0.714。样品的总酚含量与其蛋白质含量、ABTS清除能力、FRAP还原能力,以及对HUVEC保护作用呈极其显著正相关(<0.01),相关系数分别为0.844、0.965、0.959和0.922,其中总酚含量高低与其体外抗氧化性能和对HUVEC保护作用的相关系数均高于0.9,说明样品中的酚类物质是主要的生物活性成分。另在本实验中,两种抗氧化体系的相关性系数高达0.998,且呈现极显著相关性(<0.01),说明ABTS法和FARP法在评价本实验样品中具有等价效应。而六堡茶多糖对HUVEC细胞的保护作用与样品的抗氧化性能(ABTS法和FRAP法)也有着非常显著的相关性(与ABTS法和FRAP法的相关系数分别为0.871和0.880)。

表4 皮尔森系数分析表
注:*:<0.05,**:<0.01。Note: *:<0.05, **<0.01.
3 总结与讨论
茶多糖提取后通常会进行纯化,使混合多糖纯化为相对均一的组分。分步沉淀法是分离纯化多糖较为常用的方法之一,基于多糖在低级醇或酮(常为乙醇或丙酮)中的溶解度不同而进行分离。与分子量小的多糖相比,分子量大的多糖在乙醇(或丙酮)中的溶解度小,因此多糖混合物的溶液中加大乙醇(或丙酮)的浓度可使分子量大的多糖先沉淀出来,而分子量相对小一些的多糖暂时留在溶液中,待乙醇(或丙酮)浓度进一步加大而以沉淀的形式析出[20]。本研究利用水提醇沉法制备得到六堡茶多糖,进而用70%、50%和30%的乙醇溶液依次对六堡茶多糖进行分离纯化,以溶解于70%、50%和30%乙醇溶液的茶多糖组分作为本研究分离纯化所得的3个样品LTPS-70、LTPS-50与LTPS-30,其原理与分步沉淀法相同,但具有避免共沉淀发生,乙醇用量合适等优势,目前使用该方法分离纯化多糖的研究较少。
茶多糖的分子量分布范围广,从几千到几百万不等。多糖的相对分子质量只代表相似链长的平均分布。本研究所得LTPS-70、LTPS-50、LTPS-30均为主要含有2个组分的非均一酸性多糖,且平均分子量LTPS-70<LTPS-50<LTPS-30,表现出随着乙醇浓度越高,分离出的茶多糖分子量越小的规律。3种六堡茶多糖的理化性质也存在差异,呈一定规律性。茶多糖的理化性质和生物活性与其相对分子量、化学组成等有关[1]。有研究表明,茶多糖中总糖含量对其抗氧化活性没有明显的影响[21]。另外,本研究中3种六堡茶多糖样品都检出了酚类物质。酚类物质对茶多糖复合物来说也是非常重要的组成部分,可能会影响茶多糖的抗氧化活性[22]。有文献表明,多糖的抗氧化活性与其相对分子质量密切相关,茶多糖中低分子量的组分含量越高,其表现出的生物活性也越高[23]。
氧化应激(Oxidative stress)是指机体或细胞内以氧自由基为代表的氧化性物质的产生与消除失衡,或外源性氧化物质的过量摄入,导致氧化性物质在细胞内蓄积进而可能引发氧化反应的状态。在以Na2S2O3为代表建立的HUVEC的氧化应激损伤模型中,LTPS-30、LTPS-50和LTPS-70对HUVEC的预处理在一定浓度范围内均可明显提高受损HUVEC的存活率,并呈现浓度依赖性。3种六堡茶多糖对受损HUVEC的保护程度不同,其中,LTPS-70的保护作用最为明显,这可能与它在三者中具有最强的抗氧化能力有关,但六堡茶多糖对氧化应激损伤HUVEC保护作用的相关机理仍待进一步的深入研究。
六堡茶多糖经过不同浓度乙醇溶解纯化分离得到的3种组分表现出不同的分子量、化学组成、抗氧化活性,及对受损HUVEC的保护作用。LTPS-70为六堡茶多糖用70%乙醇溶液分离出来的组分,在本研究中其分子量最小,总糖含量最小,蛋白含量和总酚含量最高,表现出最强的抗氧化活性和对受损HUVEC的保护作用。茶多糖这类复杂的分子,具有多种药理作用,但难以生物合成。以六堡茶或黑茶加工中产生的碎茶灰为原料,提取茶多糖,利用合理的手段可得到高纯度的茶多糖,进行系统深入的药理作用研究,应用于医药、保健食品等行业,具有良好的前景。
[1] 谢明勇, 聂少平. 茶叶多糖的研究进展[J]. 食品与生物技术学报, 2006, 25(2): 107-114.
[2] 周斌星, 孔令波, 陈军贤. 普洱茶多糖的提取及降血糖的研究[J]. 中国农学通报, 2009, 25(15): 55-59.
[3] 徐仲溪, 王坤波. 茶多糖化学及生物活性的研究[J]. 茶叶科学, 2004, 24(2): 75-81.
[4] 陈小强, 叶阳, 成浩, 等. 六堡茶的理化分析研究[J]. 中国农学通报, 2008, 24(7): 77-80.
[5] 刘小玲, 李颖, 姜元欣, 等. 广西六堡茶主要特征成分分析[J]. 北京工商大学学报: 自然科学版, 2012, 30(1): 46-50.
[6] 吴平, 张宏, 樊春燕, 等. 《六堡茶》广西地方标准的术语和定义介绍——兼谈对《茶叶感官审评术语》标准修订的建议[J]. 广东茶业, 2010(1): 46-49.
[7] 杜冠华. 血管内皮细胞损伤机制及保护药物的研究[J]. 基础医学与临床, 2004, 24(3): 258-263.
[8] Chen X Q, Wang Y F, Wu Y L, et al. Green tea polysaccharide-conjugates protect human umbilical vein endothelial cells against impairments triggered by high glucose [J]. International Journal of Biological Macromolecules, 2011, 49(1): 50-54.
[9] 王岳飞, 罗子华, 邬新荣. 普洱茶提取物抗氧化及其对Na2S2O3诱导[J]. 茶叶科学, 2010, 30(6): 475-481.
[10] 武冰峰, 杨娟, 谢红, 等. 党参多糖对神经干细胞硫代硫酸钠损伤的保护作用[J]. 时珍国医国药, 2008, 19(2): 280-281.
[11] 崔宏春, 余继忠, 黄海涛, 等. 茶多糖的提取及分离纯化研究进展[J]. 茶叶, 2011, 37(2): 67-71.
[12] 任小盈, 李静, 马存强, 等. 茶多糖的提取与分离纯化技术研究新进展[J]. 安徽农业科学, 2014, 42(23): 993-7995, 7999.
[13] 郑德勇, 杨江帆, 潘晓云, 等. 白茶多糖的提取与结构初探[J]. 茶叶科学, 2010, 30(S1): 551-555.
[14] 杨泱, 刘仲华, 黄建安. 茶多糖的提取、分离、纯化、组成研究概况[J]. 中国食物与营养, 2009(5): 47-49.
[15] Lv Y, Yang X, Zhao Y, et al. Separation and quantification of component monosaccharides of the tea polysaccharides fromby HPLC with indirect UV detection [J]. Food Chemistry, 2009, 112(3): 742-746.
[16] 张丽萍. 苹果多糖的分离纯化及其自由基消除活性与红外光谱分析 [D]. 咸阳:西北农林科技大学, 2007: 20-23.
[17] 谢亮亮, 蔡为荣, 张虹, 等. 茶多糖的分离纯化及其抗凝血活性[J]. 食品与发酵工业, 2012, 38(9): 191-195.
[18] 陈浩. 普洱茶多糖降血糖及抗氧化作用研究[D]. 杭州: 浙江大学, 2013: 35-40.
[19] 张竞之, 陈利国, 贾会欣, 等. 黄芪多糖对高血压病血瘀证患者血清损伤的人脐静脉内皮细胞形态学、活性的影响[J]. 中国实验方剂学杂志, 2010(16): 170-173.
[20] 方积年, 丁侃. 天然药物-多糖的主要生物活性及分离纯化方法[J]. 中国天然药物, 2007, 5(5): 338-347.
[21] Mao L, Shao S, Sun S, et al. Purification, physicochemical characterization, and bioactivities of polysaccharides from Puerh tea [J]. Journal of Food and Nutrition Research, 2014, 2(12): 1007-1014.
[22] Wang Y, Yang Z, Wei X. Antioxidant activities potential of tea polysaccharide fractions obtained by ultra filtration [J]. International Journal of Biological Macromolecules, 2012, 50(3): 558-564.
[23] Chen H, Qu Z, Fu L, et al. Physicochemical properties and antioxidant capacity of 3 polysaccharides from green tea, Oolong tea, and black tea [J]. Journal of Food Science, 2009, 74(6): C469-C474.
Physicochemical Properties,Antioxidant Activities and Protective Effects of Liubao Tea Polysaccharides on HUVEC
YING Le, PAN Yue, WANG Yuefei, XU Ping*
Department of Tea Science, Zhejiang University, Hangzhou 310058, China
Tea Polysaccharides were extracted and purified from Liubao tea. Three fractions of polysaccharides namely LTPS-30, LTPS-50 and LTPS-70 were then obtained from Liubao Tea Polysaccharides (LTPS) by 30%, 50% and 70% ethanol respectively. The main chemical compounds and monosaccharide compositions of these LTPS were investigated. Theantioxidant activities of LTPS were determined by ABTS and FRAP assays. The potentially protective effects of LTPS on human umbilical vascular endothelial cells (HUVEC) were investigated according to the Na2S2O3-induced model. The results showed that there were two main acidic polysaccharides in LTPS-70, LTPS-50 and LTPS-30. The order of molecular weight and total sugar content was LTPS-70<LTPS-50<LTPS-30. While the order of protein, polyphenol contents and antioxidant abilities determined by ABTS and FRAP assays showed the opposite trends. LTPS-70 exhibited the protective effects on HUVEC, indicating it might be applied in medical sciences in the future.
Liubao tea, tea polysaccharides (TPS), antioxidant activity, HUVEC
TS272.5+4;Q539
A
1000-369X(2017)01-025-13
2016-06-24
2016-09-26
应乐,女,博士研究生,主要从事天然产物与人体健康及其机理研究。
zdxp@zju.edu.cn
