急性脑梗死患者外周血单个核细胞中组蛋白H3乙酰化水平的变化
2017-02-14林秀洁黄礼传
林秀洁 黄礼传 张 俊
(福州神经精神病防治院神经科,福建 福州 350008)
急性脑梗死患者外周血单个核细胞中组蛋白H3乙酰化水平的变化
林秀洁 黄礼传 张 俊
(福州神经精神病防治院神经科,福建 福州 350008)
目的 探讨急性脑梗死患者外周血单个核细胞(PBMC)中组蛋白H3乙酰化水平变化与急性脑梗死的临床关系。方法 选取2015年1~12月该院神经内科收治的发病后不同时间段的急性脑梗死患者206例为脑梗死组;选取同期在该院脑卒中筛查门诊就诊的60名健康志愿者为对照组。密度梯度法离心分离PBMC,提取全组蛋白,Western印迹检测组蛋白H3乙酰化水平;根据患者就诊时的症状与体征,进行牛津郡社区脑卒中项目(OCSP)分型,并采用神经功能缺损程度评估(NIHSS)量表评估患者的神经功能缺损程度。结果 急性脑梗死后1 d开始,持续到7 d,PBMC组蛋白H3乙酰化水平均明显低于对照组(P<0.05),其中梗死后第3天蛋白H3值最低。不同OCSP分型患者组蛋白H3乙酰化水平均明显低于对照组(P<0.05);其中完全前循环脑梗死(TACI)组蛋白H3乙酰化水平降低幅度最大,明显低于后循环脑梗死组和部分前循环脑梗死组(P<0.05)。多元直线回归分析显示,PBMC组蛋白H3乙酰化水平是入院急性脑梗死患者NIHSS评分的重要影响因素,两者呈明显直线负相关(β=-0.283,P=0.001)。结论 急性脑梗死患者PBMC中组蛋白H3乙酰化水平低于健康人群,且以TACI型和神经功能缺损严重患者的PBMC中组蛋白H3乙酰化水平下降最为明显。
脑梗死;组蛋白;乙酰化作用
组蛋白乙酰化可通过改变染色体结构来影响基因表达,在中枢神经系统疾病发展过程中发挥重要作用〔1〕。虽然研究显示,在氧糖剥夺(OGD)细胞和大脑中动脉阻断实验(MCAO)大鼠脑组织中组蛋白乙酰化水平均明显降低〔2〕,并且给予中枢神经系统损伤动物乙酰化酶抑制剂可有效提升组蛋白乙酰化水平,通过抗感染、抗氧化应激等作用改善神经系统功能〔3〕。但关于急性脑梗死患者组蛋白水平具体如何仍不清楚。研究已证实,在中枢神经系统疾病中,外周血单个核细胞(PBMC)中表观遗传性变化与脑组织中一致〔4〕。本次研究以PBMC为材料,观察急性脑梗死患者PBMC中组蛋白H3乙酰化水平变化情况,探讨其与急性脑梗死的临床关系。
1 资料与方法
1.1 一般资料 选取2015年1~12月本院神经内科收治的发病后1、3、5、7、14 d的急性脑梗死患者206例为脑梗死组。入选患者均经头颅CT、磁共振成像(MRI)检查证实;签署知情同意书并经本院伦理委员会批准;排除合并脑出血、恶性肿瘤、自身免疫性疾病者。其中男138例,女68例;年龄55~83〔平均(64.31±8.05)〕岁。选取同期在本院脑卒中筛查门诊就诊的60名健康志愿者为对照组,其中男44例,女16例;年龄58~79〔平均(64.12±9.17)〕岁。
1.2 方法
1.2.1 分型与标本采集 脑梗死组根据就诊时的症状与体征,进行牛津郡社区脑卒中项目(OCSP)分型:完全前循环脑梗死(TACI)组36例,部分前循环脑梗死(PACI)组128例,后循环脑梗死(POCI)组42例。此外。对上述患者进行神经功能缺损程度评估(NIHSS评分)。患者入院1 d内取肘静脉血3 ml,对照组入组时取肘静脉血3 ml,收集到的血液标本均在6 h内完成PBMC分离。
1.2.2 组蛋白提取 密度梯度法离心分离PBMC,磷酸盐缓冲液(PBS)充分洗涤,使用总组蛋白提取试剂盒(艾美捷科技有限公司)提取蛋白:每份PBMC标本中加入100 μl裂解缓冲液,冰上裂解10 min,10 000 r/min离心60 s,弃上清后加入50 μl裂解缓冲液,冰上裂解30 min,10 000 r/min离心5 min,取上清,加12 μl硫苏糖醇(1∶500稀释)。二喹啉甲酸法(BCA)蛋白浓度测定试剂盒(北京索莱宝科技有限公司)测定各样本蛋白浓度,-20℃保存。
1.2.3 组蛋白H3乙酰化检测 Western印迹检测组蛋白H3乙酰化水平,2.5 μg蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,转移到聚偏氟乙烯(PVDF)膜(0.22 μm孔径),室温下5%脱脂牛奶封闭60 min,加入兔组蛋白H3(H3)(1∶500稀释),4℃孵育过夜。Tris盐酸缓冲液(TBST)冲洗3次,10 min/次,加辣根过氧化物酶(HRP)标记的山羊抗兔IgG(1∶5 000稀释),室温下孵育60 min,TBST洗膜缓冲液洗3次,10 min/次,化学发光试剂显色。乙酰化蛋白H3(Ac-H3)检测与上述过程相似,Ac-H3抗体亦为1∶500稀释。Image J 软件分析H3、Ac-H3 Western印迹检测图片灰度值,Ac-H3/ H3的比值为组蛋白H3乙酰化水平。
1.3 统计学方法 采用SPSS16.0软件进行t检验、方差分析、Pearson分析、多元回归分析。
2 结 果
2.1 急性脑梗死后不同时间点组蛋白H3乙酰化水平变化 对照组组蛋白H3乙酰化水平为0.23±0.09;急性脑梗死发病后1、3、5、7、14 d分别为:0.12±0.08、0.08±0.03、0.13±0.05、0.14±0.05、0.17±0.03。急性脑梗死后1 d开始,持续到7 d,组蛋白H3乙酰化水平均明显低于对照组(P<0.05)。其中梗死后第3天组蛋白H3水平最低。见图1。

图1 急性脑梗死后组蛋白H3乙酰化水平动态变化
2.2 不同OCSP分型患者组蛋白H3乙酰化水平 不同OCSP分型患者组蛋白H3乙酰化水平均明显低于对照组(0.23±0.09)(P<0.05);TACI组蛋白H3乙酰化水平(0.09±0.05)降低幅度最大,明显低于PACI组(0.13±0.04)和POCI组(0.16±0.07)(P<0.05)。见图2。

图2 不同OCSP分型患者PBMC组蛋白H3乙酰化水平
2.3 神经功能损伤程度与组蛋白H3乙酰化水平的关系 患者年龄、性别、糖尿病、高血压、心血管疾病、组蛋白H3乙酰化水平等与NIHSS评分相关的变量单因素分析见表1。为进一步消除混杂因素干扰,以房颤、组蛋白H3乙酰化水平为自变量,NIHSS评分为因变量进行多元回归分析,结果显示,组蛋白H3乙酰化水平是入院急性脑梗死患者NIHSS评分的重要影响因素(P=0.001),呈明显负相关,见表2。
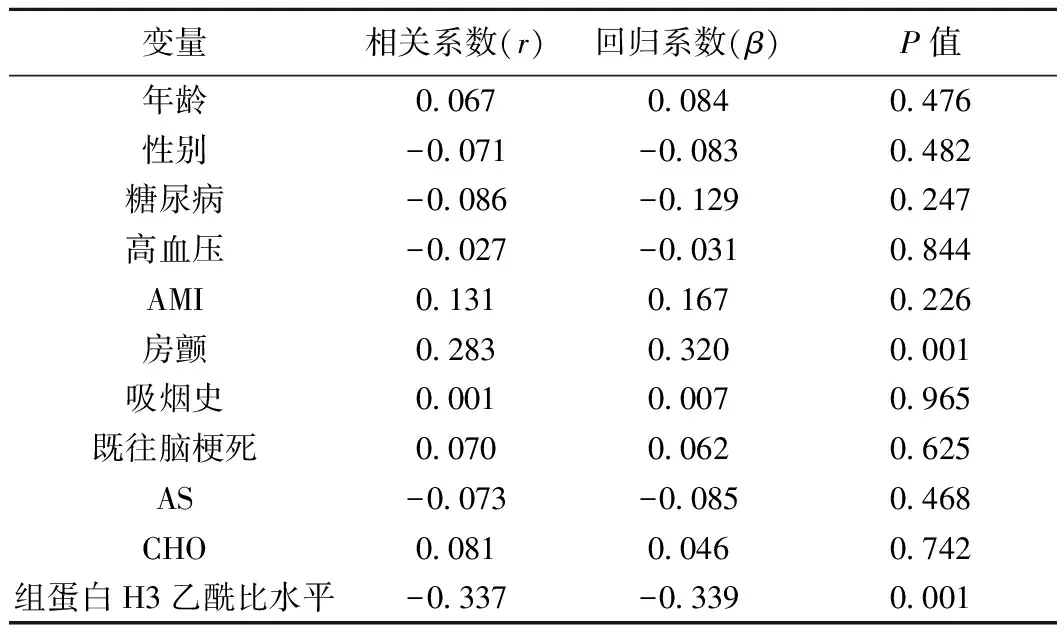
表1 急性脑梗死患者以NIHSS评分为因变量单因素分析
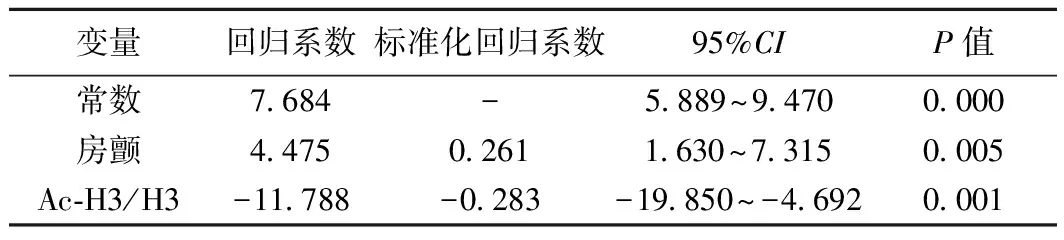
表2 急性脑梗死患者以NIHSS评分为因变量多元回归分析
3 讨 论
目前虽然已逐渐探明急性脑梗死后的病理机制以及氧化应激、炎症反应、钙超载、血脑屏障受损等,但多数有效治疗方案仍受限于时间窗。表观遗传学研究显示,具有遗传性的基因组表观修饰包括组蛋白修饰、DNA甲基化、染色体重排等,任意一种修饰异常均会诱发自身免疫、肿瘤、神经病变等疾病〔5〕。其中组蛋白修饰包括乙酰化、磷酸化、糖基化等,而乙酰化是研究较为系统的表观遗传,其可通过调整组蛋白末端残基上乙酰基数量来改变染色体构型,调整基因表达〔6〕;以组蛋白乙酰化为治疗靶点具有很大的潜在价值。相关研究已证实,组蛋白去乙酰化酶抑制剂在缺血性脑损伤动物模型和OGD细胞模型中具有明显疗效〔7〕。但以上两种模型无法完全模拟脑梗死后患者的病理生理过程,因此需进一步对患者本身组蛋白乙酰化情况进行了解。
尽管本次研究发现了急性脑梗死患者PBMC组蛋白H3乙酰化水平明显低于健康人群,其中以TACI型患者及NIHSS评分高的患者H3乙酰化水平下降最为明显这一现象,但仍有很多工作需要进一步完善。例如由于受目前检测组蛋白乙酰化水平方法的限制,较难开展大样本量的研究分析,而本次研究样本量偏下,结果可能存在偏差。此外,虽然相关研究显示,组织中多数HDACS活性明显提升可能是导致心肌缺血性损伤后组织中组蛋白乙酰化水平下降的原因〔8〕,亦有研究在急性缺血性脑损伤中证实了以上现象〔9〕,但引发急性脑梗死患者PBMC组蛋白H3乙酰化水平降低的原因仍待进一步阐明。
1 Doherty R,O'Farrelly C,Meade KG,etal.Epigenetic regulation of the innate immune response to LPS in bovine peripheral blood mononuclear cells(PBMC)〔J〕.Vet Immunol Immunopathol,2013;154(3/4):102-10.
2 Brown M,Postlethwaite AE,Myers LK,etal.Supernatants from culture of typeⅠ collagen-stimulated PBMC from patients with cutaneous systemic sclerosis versus localized scleroderma demonstrate suppression of MMP-1 by fibroblasts〔J〕.Clin Rheumatol,2012;31(6):973-81.
3 Ghosh S,Zang S,Mitra PS,etal.Global gene expression and Ingenuity biological functions analysis on PCBs 153 and 138 induced human PBMC in vitro reveals differential mode(s)of action in developing toxicities〔J〕.Environ Int,2011;37(5):838-57.
4 Pujari R,Eligar SM,Kumar N,etal.CD45-mediated signaling pathway is involved in Rhizoctonia bataticola lectin(RBL)-induced proliferation and Th1/Th2 cytokine secretion in human PBMC〔J〕.Biochem Biophy Res Commun,2012;419(4):708-14.
5 Ilavarasi K,Kiruthiga PV,Pandian SK,etal.Hydroxytyrosol,the phenolic compound of olive oil protects human PBMC against oxidative stress and DNA damage mediated by 2,3,7,8-TCDD〔J〕.Chemosphere,2011;84(7):888-93.
6 Mihály J,Gericke J,Trocsik D,etal.Reduced lipoxygenase and cyclooxygenase mediated signaling in PBMC of atopic dermatitis patients〔J〕.Prostagland Other Lipid Mediat,2013;107:35-42.
7 Sabo TJ,Dinovic VM,Kaluderovic GN,etal.Syntheses and activity of some platinum(IV)complexes with N-methyl derivate of glycine and halogeno ligands against HeLa,K562 cell lines and human PBMC〔J〕.Inorgan Chim Acta,2005;358(7):2239-45.
8 Wieczorek L,Brown BK,Delsarto-Macedo C,etal.Mitigation of variation observed in a peripheral blood mononuclear cell(PBMC)based HIV-1 neutralization assay by donor cell pooling〔J〕.Virology,2013;447(1/2):240-8.
9 Welker MW,Welsch C,Ochs D,etal.Comparison of envelope 2 CD81 binding regions in PBMC-derived versus serum-derived hepatitis C virus isolates:higher conservation of CD81 region 2 in PBMC isolates〔J〕.J Viral Hepat,2011;18(3):181-92.
〔2016-10-23修回〕
(编辑 袁左鸣)
福建省自然科学基金资助项目(No:2014D013)
林秀洁(1974-),女,主治医师,主要从事精神疾病研究。
R743.33
A
1005-9202(2017)02-0336-03;
10.3969/j.issn.1005-9202.2017.02.031
