CAV1在人肺动脉成纤维细胞增殖调控中的作用
2017-02-11王昌国曾大雄雷伟黄建安
王昌国 曾大雄 雷伟 黄建安
CAV1在人肺动脉成纤维细胞增殖调控中的作用
王昌国 曾大雄 雷伟 黄建安
目的 研究小窝蛋白1(CAV1)在缺氧相关肺动脉成纤维细胞(PAFs)增殖调控中的作用。方法 将体外培养的人PAFs分为:对照组(C:21%O2);10%氧浓度组(10%O2);5%氧浓度组(5%O2)及2%氧浓度组(2%O2)进行细胞增殖实验,选取细胞增殖最明显组为缺氧组(H)进行后续实验。并构建CAV1高表达质粒(pCAV1),然后再将PAFs分为对照组(C:21%O2),缺氧组(H),空白对照组(NC:缺氧+空质粒转染组)和CAV1高表达组(pCAV1:缺氧+ pCAV1转染组),采用Western-blot法检测各组细胞中CAV1、细胞周期蛋白D1(cyclinD1)和细胞凋亡抑制蛋白2(c-IAP2)含量,四甲基偶氮唑蓝(MTT)及增殖细胞核抗原(PCNA)免疫组化法检测细胞增殖情况。结果 缺氧能刺激PAFs增殖,并呈浓度依赖性,于2%氧浓度刺激48小时PAFs增殖达峰值,与对照组相比差异有统计学意义(1.20+0.02vs0.54+0.04,P<0.01);缺氧组PAFs中CAV1表达下调(1.23±0.04vs0.90±0.02,P<0.01),cyclinD1 (0.19±0.03vs1.15±0.06,P<0.01)和c-IAP2(0.63±0.04vs0.78±0.09,P<0.01) 表达上调,细胞增殖增加(MTT:0.78±0.04vs1.20±0.02,P<0.01;PCNA:0.29±0.03vs0.54±0.03,P<0.01);CAV1在PAFs中高表达后(0.55±0.03vs0.90±0.03,P<0.01),cyclinD1 (0.88±0.02vs0.52±0.02,P<0.01)和c-IAP2 (0.87±0.02vs0.72±0.02,P<0.01) 表达下调,PAFs增殖减少(MTT:1.20±0.02vs1.00±0.06,P<0.01;PCNA:0.52±0.03vs0.38±0.03,P<0.01)。结论 缺氧能通过下调CAV-1在PAFs中的表达,促进PAFs的增殖、抑制其凋亡。cyclinD1和c-IAP2可能是CAV1调控PAFs增殖和凋亡的下游靶点。
缺氧;PAH;小窝蛋白1;肺动脉成纤维细胞
缺氧性肺动脉高压(hypoxic pulmonary hypertension, HPH)是临床常见疾病,可导致右心功能衰竭甚至死亡,目前尚缺乏有效治疗手段。肺动脉重构是HPH的特征性改变,也是造成HPH不可逆的主要病理基础。肺动脉重构过程中多种细胞组分参与其中,包括肺动脉内膜内皮细胞、中膜平滑肌细胞以及外膜成纤维细胞等均在细胞增殖、凋亡、分化、基质产生、细胞因子分泌等方面发生明显变化。这些变化导致肺动脉内膜纤维性增厚、中膜增殖肥厚、外膜胶原沉积和纤维组织增多等多种解剖性改变[1-2]。但至今为止,HPH的相关研究主要集中在肺动脉内膜内皮细胞和中膜平滑肌细胞的功能变化方面,而对肺动脉外膜的相关研究甚少[3]。小窝蛋白-1(caveolin1, CAV1)为小窝表面标记蛋白, CAV1可绑定多种信号分子如 Src 家族酪氨酸激酶,G 蛋白,生长因子受体,G蛋白偶联受体和内皮一氧化氮合酶等而产生一系列生物学效应,参与细胞增殖、凋亡、分化、血管生成以及肿瘤发生、发展等过程[4]。近年来研究发现,CAV1在特发性HPH的形成中发挥保护性作用,机制主要与CAV1调控肺动脉内皮细胞功能、平滑肌细胞功能、氧化应激、NO合酶等途径有关[5-7]。但CAV1在低氧性HPH中的作用研究甚少,且存在争议。根据上述研究结果,我们提出如下假设:在HPH形成过程中CAV1能通过调控肺动脉成纤维细胞(pulmonary artery fibroblasts, PAFs)的增殖参与肺动脉外膜的重构。为验证假说,我们分别在缺氧及CAV1高表达质粒转染情况下检测PAFs的增殖以及CAV1、细胞周期蛋白D1(cyclinD1)和细胞凋亡抑制蛋白(cellular inhibitor of apoptosis protein, c-IAP2)在PAFs中的表达,分析两者之间的关系,初步探讨CAV1参与细胞增殖的可能机制,以期为HPH的治疗提供新的潜在靶点。
资料与方法
一、主要材料
人PAFs购自上海生科院细胞库;胰酶、RIPA裂解液、BCA蛋白浓度测定试剂盒均购自上海碧云天生物技术有限公司;胎牛血清购自美国Gibco公司;DAB显色试剂盒购自北京中杉金桥生物技术有限公司;增殖细胞核抗原(proliferation cell nuclear antigen, PCNA)、CAV1、cyclinD1、c-IAP2抗体均购自美国Santa Cruz公司;PAFs培养基购自美国Sciencell公司;CAV1高表达质粒由上海生工生物工程有限公司合成。
二、细胞培养及实验分组
将生长状态良好的3-10代人PAFs置于含10%胎牛血清的成纤维细胞培养基中,于37℃、5%CO2细胞培养箱中培养,3-4天传代一次,每次细胞处理前进行细胞周期同步化,然后进行后续处理。分组设计:首先将人PAFs分为:对照组(C:21%O2);10%氧浓度组(10%O2);5%氧浓度组(5%O2)及2%氧浓度组(2%O2)进行细胞增殖实验,选取细胞增殖最明显组为缺氧组(H),然后再将PAFs分为对照组(C:21%O2),缺氧组(H),空白对照组(NC:缺氧+空质粒转染组)和CAV1高表达组(pCAV1:缺氧+ pCAV1转染组)进行后续实验。
三、细胞转染
细胞转染选用试剂脂质体2000,将PAFs接种至培养板进行培养,待细胞生长至70%左右时更换成纤维细胞培养基(无血清、无双抗),待转染。按照试剂盒说明书,将重组pCAV1质粒与脂质体2000混合后加入PAFs中,培养6 h后更换培养基,后续细胞同步化及分组处理同前述。
四、细胞增殖检测(四甲基偶氮唑蓝,MTT法)
将PAFs接种于96孔板,进行细胞培养及细胞周期同步化。然后按上述实验分组处理后,在每孔中加入MTT孵育4 h弃去培养液,加入二甲基亚砜(DMSO),并于酶标仪上读吸光度值(OD值)。每组增殖实验重复3次。
五、细胞增殖检测(PCNA免疫组化法)
将PAFs接种于预置玻片的24孔板中进行培养及细胞周期同步化,然后按上述实验分组处理后制成细胞爬片进行免疫组化。以鼠PCNA多克隆抗体为一抗(1 ∶200倍稀释),采用SP法,按照试剂盒说明操作,DAB显色液显色。细胞核呈现棕黄色为PCNA阳性表达。用PCNA阳性细胞比例反应细胞增殖。每组实验重复3次。
六、Western-Blot检测
Western-Blot法检测目的蛋白的表达量。将PAFs细胞按上述分组处理后,收集细胞,按照蛋白提取试剂盒说明提取PAFs蛋白。用Bradford 法测定各样品的总蛋白浓度。取各蛋白样品30ug上样,进行电泳、转膜。分别以山羊抗CAV1单克隆抗体(1 ∶200倍稀释),兔抗cyclinD1多克隆抗体(1 ∶500倍稀释),兔抗c-IAP2多克隆抗体(1 ∶500倍稀释)为一抗,以加入辣根过氧化物酶标记的兔抗羊或羊抗兔IgG为二抗(1 ∶5000倍稀释),孵育后按照ECL试剂盒的说明书步骤,加入化学发光底物ECL,于暗室内进行胶片的曝光、显影、定影。采用Quantity One 1.0 软件对各个条带的灰度值进行分析,以目的基因/相应的内参β-actin条带的灰度值来表示该目的基因的相对表达量。每组实验重复3次。
七、数据处理
SPSS16软件计算各组数据的均数和标准差,结果以±s表示,t检验法进行统计学分析,P<0.05说明差异有统计学意义。
结 果
一、缺氧对PAFs增殖的影响
随着氧浓度的下降及缺氧刺激时间的延长,PAFs增殖逐步增加,PAFs增殖峰值出现在2%氧浓度刺激48小时,与对照组相比差异有统计学意义(1.20+0.02vs0.54+0.04,P<0.01),(见图1)。

图1 缺氧对PAFs增殖的影响
A:不同氧浓度及缺氧暴露时间下PAFs的增殖情况;B:常氧情况下PAFs生长情况;C:低氧条件下PAFs生长情况;*表示与对照组相比差异有统计学意义P<0.01
二、缺氧对PAFs中CAV1、cyclinD1、c-IAP2表达及细胞增殖的影响
根据细胞增殖实验结果,选取2%氧浓度组为缺氧组,细胞培养48小时后,分别检测缺氧组及常氧组PAFs中CAV1、cyclinD1及c-IAP2的表达,结果:缺氧组PAFs中CAV1表达下调(1.23±0.04vs0.90±0.02,P<0.01),cyclinD1 (0.19±0.03vs1.15±0.06,P<0.01)和c-IAP2(0.63±0.04vs0.78±0.09,P<0.01) 表达上调,细胞增殖增加(MTT:0.78±0.04vs1.20±0.02,P<0.01;PCNA:0.29±0.03vs0.54±0.03,P<0.01),(见图2)。
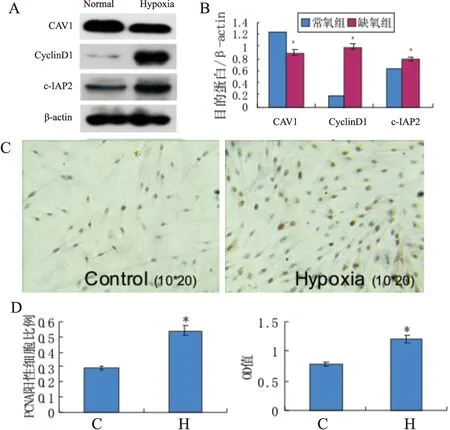
图2 缺氧对PAFs中CAV1、CyclinD1、c-IAP2及细胞增殖的影响
A、B:对照组与缺氧组PAFs中CAV1、CyclinD1、c-IAP2的蛋白表达量;C:对照组及缺氧组PAFs的PCN免疫组化阳性表达情况;D、E:PCNA免疫组化法、MTT法检测对照组及缺氧组细胞增殖情况。*表示与对照组相比,差异有统计学意义,P<0.01
三、高表达CAV1对PAFs中cyclinD1、c-IAP2表达及细胞增殖的影响
采用脂质体2000将CAV1高表达质粒及空质粒分别转入pCAV1及NC组PAFs中,并于2%氧浓度下培养48小时,检测两组PAFs中CAV1、cyclinD1及c-IAP2的表达,以及细胞增殖情况,结果: pCAV1组CAV1表达明显上调(0.55±0.03vs0.90±0.03,P<0.01),而cyclinD1(0.88±0.02vs0.52±0.02,P<0.01)和c-IAP2(0.87±0.02vs0.72±0.02,P<0.01) 表达下调,PAFs增殖减少(MTT:1.20±0.02vs1.00±0.06,P<0.01;PCNA:0.52±0.03vs0.38±0.03,P<0.01),(见图3)。
讨 论
肺动脉重构是HPH的特征性改变,也是HPH不可逆的主要病理基础。研究发现肺动脉外膜的重构是HPH早期而显著的变化,肺动脉外膜的重构主要包括外膜PAFs的异常增殖、迁徙、向肌成纤维细胞的转化以及胶原和细胞外基质的大量沉积[1,3]。因此,本研究中我们选取PAFs作为研究对象。结果发现,缺氧条件下,PAFs的增殖较正常氧浓度下明显增加,并呈浓度依赖性,说明缺氧能够通过调控PAFs的增殖参与肺动脉重构及HPH的形成。
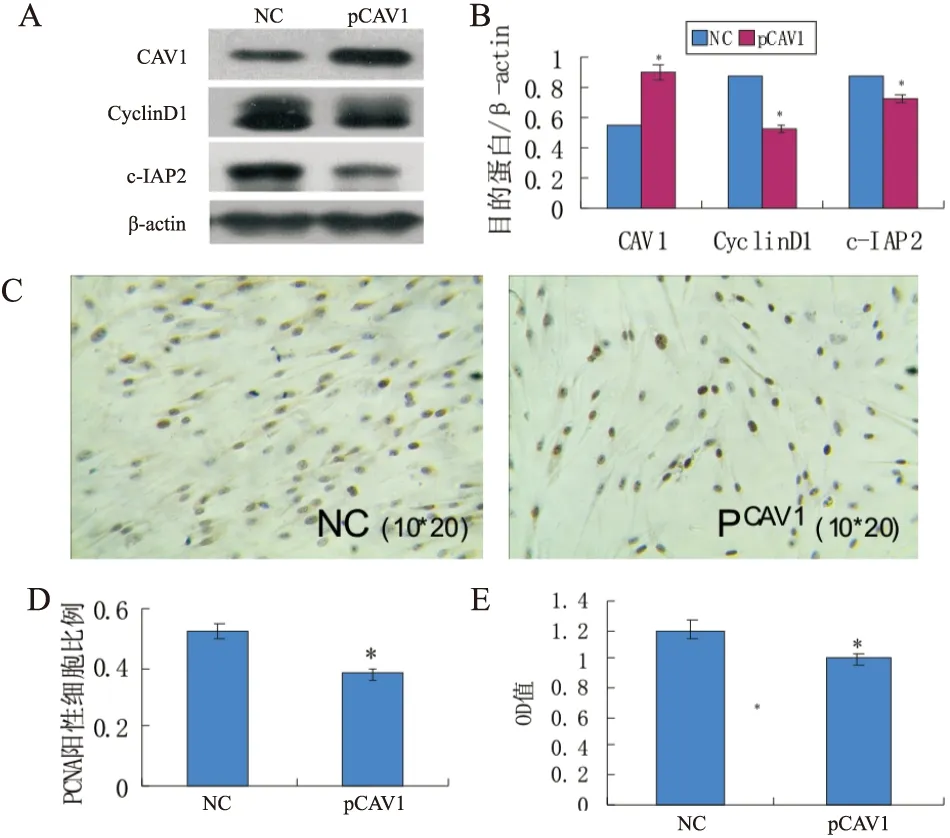
图3 CAV1高表达质粒转染对PAFs中CAV1、CyclinD1、c-IAP2及细胞增殖的影响
A、B:空白对照组与pCAV1组PAFs中CAV1、CyclinD1、c-IAP2的蛋白表达量;C:空白组对照组与pCAV1组PAFs的PCNA免疫组化阳性表达情况;D、E:PCNA免疫组化法、MTT法检测空白对照组与pCAV1组细胞增殖情况。*表示与对照组相比,差异有统计学意义,P<0.01
CAV1为小窝表面标记蛋白,主要参与脂质的形成、胞吞和胞内物质运输、信号通路的转导等过程[8-9]。近来研究发现CAV1在肺组织及肺血管的多种细胞组分中均有表达,并参与多种肺部疾病,比如急性肺损伤、肺间质纤维化、肺癌等的发生发展[10]。但迄今为止, CAV1在HPH中的研究甚少,且存在争议。Wang等研究发现,在特发性肺动脉高压患者外周血中CAV1表达明显下降,而在慢阻肺相关肺动脉高压患者外周血中CAV1表达量较正常对照组有所下降,但未达到统计学差异[11]。提示CAV1可能仅参与了特发性肺动脉高压的形成,而与HPH的相关性不大。而Cruz等研究发现,将CAV1基因敲除小鼠暴露于缺氧环境三周后,小鼠右室压力下降并伴随心输出量下降、右室肥厚、右室间质纤维化以及右心功能的下降,提示CAV1在HPH的形成中同样发挥重要作用[12]。通过本研究我们发现,缺氧能够刺激PAFs的增殖,并伴随CAV1的表达下降。而采用CAV1高表达质粒转染PAFs,使CAV1在PAFs中高表达后,PAFs的增殖减少。说明CAV1能够抑制缺氧引起的PAFs的增殖。因此,我们认为CAV1同样参与HPH的形成,这与Cruz等研究结果相一致[12]。但CAV1调控PAFs增殖的具体机制,目前尚无相关的研究报道。
众所周知,细胞周期蛋白是调控细胞周期,影响细胞增殖的重要因素。细胞周期由G1,S,G2,M四个期组成。G1期进入S期,G2期进入M期是整个细胞周期的2个关键时期,周期蛋白D是细胞G1/S期转化的必需蛋白,其中cyclin D1是细胞周期蛋白D中最主要的一种。当cyclin D1高表达时细胞周期转换加快,引起细胞增殖[13]。在本研究中,我们发现缺氧诱导CAV1在PAFs中低表达后, cyclinD1表达上调,PAFs增殖增加,而高表达CAV1后,cyclinD1在PAFs中的表达随之下调,PAFs增殖减少。提示, cyclinD1可能是CAV1调控PAFs增殖的下游靶点之一。
既往研究发现,在HPH形成过程中,除了细胞增殖外,细胞凋亡也发挥重要作用[14-15]。细胞凋亡抑制蛋白2(c-IAP2)是IAP家族的主要成员之一。 c-IAP2能结合凋亡相关分子Caspases-3 、Caspases-7 和Caspase-9,并抑制其活性,也可通过其他多种途径抑制细胞的凋亡过程[16]。因此,本研究中,我们选取c-IAP2作为细胞凋亡检测的靶点。结果发现,缺氧诱导CAV1在PAFs中低表达后, c-IAP2表达上调,PAFs增加,而高表达CAV1后,c-IAP2表达随之下调,PAFs减少。提示, CAV1同样可以通过对c-IAP2的表达调控,影响PAFs的凋亡,进而参与肺动脉外膜的重构。
综上所述,我们认为,在PAFs中,CAV1能够通过对下游靶点cyclinD1及c-IAP2的调控影响细胞周期进程及凋亡过程,抑制细胞的增殖,进而抑制缺氧性肺动脉外膜重构及HPH的形成。值得注意的是,CAV1对缺氧的反应可能具有细胞特异性,低氧能促进CAV1在人肺腺癌细胞A549中高表达,并促进肿瘤细胞的粘附、迁徙和侵袭[14]。因此,缺氧状态下,CAV1在肺动脉中的总体表达情况,以及其对HPH形成的具体调控,需要进一步体内实验明确。
[1] Chaouat A, Naeije R, Weitzenblum E. Pulmonary hypertension in COPD[J]. Eur Respir,2008,32(5):1371-1385.
[2] Stenmark KR, Fagan KA, Frid MG. Hypoxia-induced pulmonary vascular remodeling cellular and molecular mechanisms[J]. Circulation research,2006,99(7):675-691.
[3] Chen C, Han X, Fan F, et al. Serotonin drives the activation of pulmonary artery adventitial fibroblasts and TGF-β1/Smad3-mediated fibrotic responses through 5-HT2A receptors[J]. Mol Cell Biochem, 2014,397(1-2):267-276.
[4] Goetz JG, Lajoie P, Wiseman SM, et al. Caveolin-1 in tumor progression: the good, the bad and the ugly[J]. Cancer Metastasis Reviews,2008,27(4):715-735.
[5] Patel HH, Zhang S, Murray F, et al. Increased smooth muscle cell expression of caveolin-1 and caveolae contribute to the pathophysiology of idiopathic pulmonary arterial hypertension.[J]. FASEB J,2007, 21(11):2970-2979.
[6] Bakhshi FR, Mao M, Shajahan AN, et al. Nitrosation-dependent caveolin 1 phosphorylation, ubiquitination, and degradation and its association with idiopathic pulmonary arterial hypertension[J]. Pulmonary Circulation, 2013,3(4):816-830.
[7] Sehgal PB, Lee JE. Protein trafficking dysfunctions: Role in the pathogenesis of pulmonary arterial hypertension[J]. Pulmonary Circulation,2011,1(1):17-32.
[8] Cohen AW,Razani B, Schubert W, et al. Role of caveolin-1 in the modulation of lip-olysis and lipid roplet formation[J].Diabetes,2004,53(5):1261-1270.
[9] Wang XM, Kim HP, Song R, et al. Caveolin-1 confers antiinflammatory effects in murine macrophages via the MKK3/p38 MAPK pathway[J]. Am J Respir Cell Mol Biol,2006,34(4):434-442.
[10] 左蓓, 刑敏, 孙珍贵, 等.低氧诱导的小窝蛋白-1 上调参与人肺腺癌细胞A549 迁移和侵袭[J]. 中国病理生理杂志,2014,30(10):1794-1799.
[11] Wang KY, Lee MF, Ho HC, et al. Serum Caveolin-1 as a Novel Biomarker in Idiopathic Pulmonary Artery Hypertension[J]. Biomed Res Int,2015,10:1-7.
[12] Cruz JA, Bauer EM, Rodriguez AI, et al. Chronic hypoxia induces right heart failure in caveolin-1-/- mice[J]. Am J Physiol Heart Circ Physiol,2012,302(12):H2518-H2527.
[13] 王苒, 徐永健, 刘先胜,等. 结缔组织生长因子和周期蛋白D1在烟雾暴露大鼠肺血管重塑中的表达变化[J]. 中华结核和呼吸杂志,2010,33(9):679-683.
[14] Yang DL, Zhang HG, Xu YL, et al.Resveratrol inhibits right ventricular hypertrophy induced by monocrotaline in rats[J].Clin Exp Pharmacol Physiol,2010,37:150-155.
[15] Kolli MB, Manne ND, Para R, et al. Cerium oxide nanoparticles attenuate monocrotaline induced right ventricular hypertrophy following pulmonary arterial hypertension[J]. Biomaterials,2014,35(37): 9951-9962.
[16] Augello C, Caruso L, Maggioni M, et al. Inhibitors of apoptosis proteins (IAPs) expression and their prognostic significance in hepatocellular carcinoma[J]. BMC Cancer,2009,9(1):1-10.
The role of CAV1 in human pulmonary artery fibroblasts proliferation
WANGChang-guo,ZENGDa-xiong,LEIWei,HUANGJian-an
DepartmentofRespiratoryMedicine,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou,Jiangsu215006,China
Objective To study the role of CAV1 in hypoxia associated proliferation of human pulmonary artery fibroblasts (PAFs). Methods The PAFs cultured in vitro were divided into four groups, the control group (C: 21%O2), the 10% oxygen group (10%O2), the 5% oxygen group (5%O2) and the 2% oxygen group (2%O2), and then they were given cells proliferation test and the maximal proliferation group was selected as the hypoxia group (H) for further study. The high expression of CAV1 plasmid (pCAV1) was constructed. After that, the PAFs were divided into the control group (C: 21%O2), the hypoxia group (H), the blank control group (NC: hypoxia+null plasmid group) and the high expression of CAV1 plasmid group (pCAV1), and then the cells proliferation was detected by MTT and PCNA immunohistochemistry, and the expression of CAV1, cyclinD1 and c-IAP2 by western-blot in each group respectively. Results Hypoxia induced the proliferation of PAFs in dose dependent manner, and the maximal PAFs proliferation were observed in the 2%O2group within 48 h while compared with the group C (1.20+0.02vs0.54+0.04,P<0.01). In the hypoxia group, the expression of CAV1 decreased (1.23±0.04vs0.90±0.02,P<0.01), while the expression of cyclinD1 (0.19±0.03vs1.15±0.06,P<0.01) and c-IAP2 (0.63±0.04vs0.78±0.09,P<0.01) increased, and PAFs proliferation increased (MTT: 0.78±0.04vs1.20±0.02,P<0.01; PCNA: 0.29±0.03vs0.54±0.03,P<0.01). When CAV1 was high expressed in PAFs (0.55±0.03vs0.90±0.03,P<0.01), the expression of cyclinD1 (0.88±0.02vs0.52±0.02,P<0.01) and c-IAP2 (0.87±0.02vs0.72±0.02,P<0.01) decreased, and PAFs proliferation decreased, too (MTT: 1.20±0.02vs1.00±0.06,P<0.01; PCNA: 0.52±0.03vs0.38±0.03,P<0.01). Conclusion Hypoxia can down-regulate CAV1 expression in PAFs, promote PAFs proliferation and inhibit PAFs apoptosis, and cyclinD1 and c-IAP2 may be the downstream targets of CAV1 in the regulation of PAFs proliferation and apoptosis.
hypoxia; PAH; CAV1; pulmonary artery fibroblasts
10.3969/j.issn.1009-6663.2017.03.003
苏州市科教兴卫青年科技项目(No KJXW2013006),苏州市产业技术创新专项(应用基础研究)项目(SYS201530)
215006 江苏 苏州, 苏州大学附属第一医院呼吸科及危重症医学科
黄建安,E-mail:huang_jian_an@163.com
2016-10-21]
